- 161.00 KB
- 2023-01-01 08:30:26 发布
- 1、本文档共5页,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报电话:19940600175。
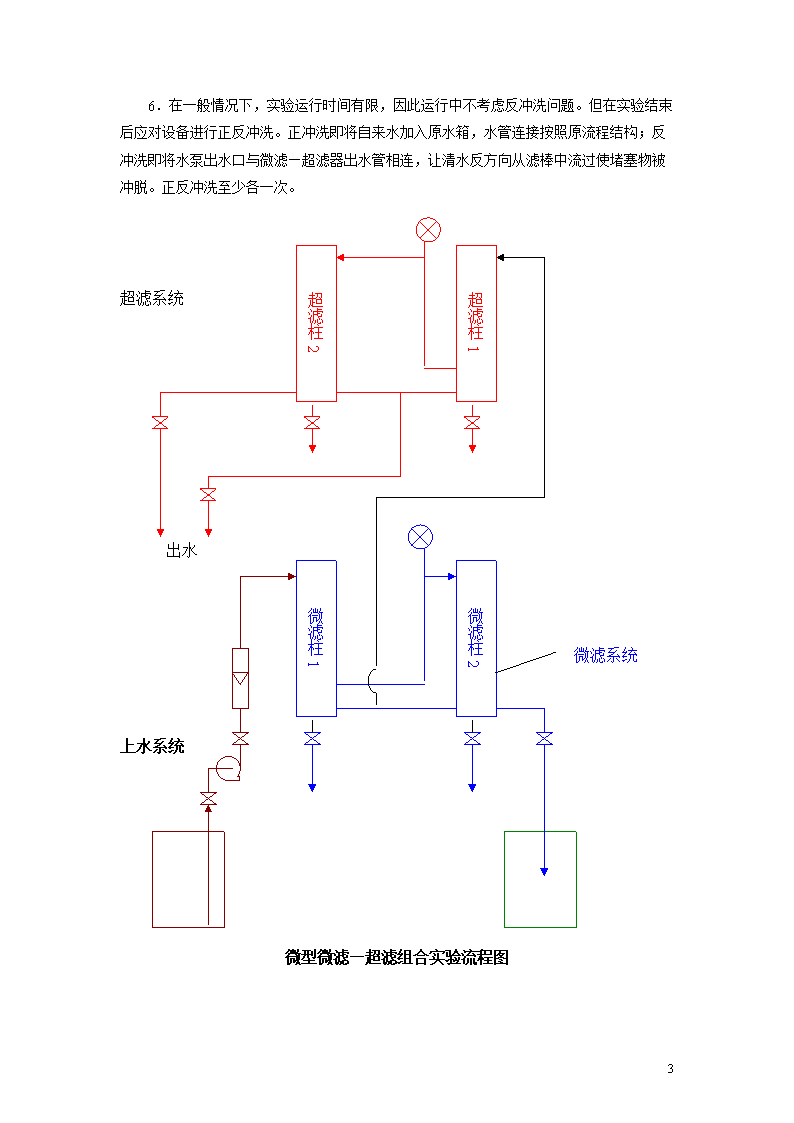
水污染控制工程实验指导书环资学院16\n实验一:微型微滤—超滤组合实验一.原理超滤又称超过滤,属于膜分离方法之一,是一种目前应用日益广泛的废水特别是工业废水处理方法。其原理主要是在加压的情况下通过膜材料的机械隔滤作用,将水中的极细微粒或者水中大分子物质从水中分离出来。因此膜孔隙大小是超滤膜过滤法的主要控制因素。其过滤粒径范围最粗孔可达1um,最细孔可过滤分子量为30Å以上的分子。一般应用的超过滤的孔径为30—500Å。微滤又称微过滤,其原理和超滤相同,一般微滤管过滤范围是0.5um—0.1mm。由于微滤膜孔径的范围正好在超滤孔隙范围之上,故在实际工艺中微滤可作为超滤以及其它更精细的膜分离过程的必不可少的保护性准备作业。本实验装置正是充分的考虑到了这一工艺中实际使用的情况,为了使实验者以最少设备和最简单操作方式完成一个比较完整的工业处理工艺模拟,故将微滤与超滤有机组合在一起,形成一种独特的新实验装置。二.仪器及结构由2根管式微滤器和2根超滤器集成而成,4根管式微滤—超滤组合与水泵由不锈钢支架有机而牢固地集成在一起,形成一个一体化实验设备。微滤、超滤管每根管上下都有三通及取样阀,因此它们之间可以通过软管方便地连接成各种所需工艺形式。所用的施压设备为一种高扬程自吸式单相水泵,由于水泵为自吸式水泵,因此盛原水容器及盛处理后水的容器可放于地上,靠水泵将水自吸而上。三.技术参数微滤器:外管Φ42×280不锈钢管套,微滤膜Φ30×250,孔径0.5-60μm;超滤器:外管Φ32×280不锈钢管套,超滤膜Φ23×260,孔径50-200Å;加压水泵:自吸式;扬程50m,流量2.2t/h,电机电压220V,功率0.75kw;四.实验操作步骤(以间歇式处理为例)1.选定流程方案,进行硬件搭接,搭接中注意软管必须牢固连接于管嘴上,以免被水压撑脱。2.往原水桶中注入定量原水。注意:为了保证微滤—超滤的正常运行,原水入桶之前必须加0.6mm不锈钢筛网加以粗滤,清除浮渣。3.打开水泵灌水孔盖,往里注满清水,然后盖紧。4.启动水泵,同时记时。当水泵吸水管靠近原水桶底时,定量原水几乎可以在一定时间内被抽尽。抽尽后即停泵。从定量水和处理时间即可得处理流量以及可算各管内流速(各管管壳及滤棒直径已知,各管容积已知)。5.取处理后水样进行水质分析,并与原水样对比于评判处理效果。水样分析方法请依据具体废水情况自行设计。16\n6.在一般情况下,实验运行时间有限,因此运行中不考虑反冲洗问题。但在实验结束后应对设备进行正反冲洗。正冲洗即将自来水加入原水箱,水管连接按照原流程结构;反冲洗即将水泵出水口与微滤—超滤器出水管相连,让清水反方向从滤棒中流过使堵塞物被冲脱。正反冲洗至少各一次。超滤柱1超滤柱2超滤系统微滤柱2微滤柱1出水微滤系统上水系统微型微滤—超滤组合实验流程图16\n实验二:离子交换水处理实验一、实验目的利用离子交换树脂对水中有害离子的交换作用,达到净化或浓缩回收的目的。离子交换树脂具有吸附量大、吸附速度快及价格便宜等优点,已广泛应用于废水处理、金属离子的回收以及水软化等领域。二、实验原理水中某些物质溶于水时呈离子化,形成数目相等电荷相反的阴、阳离子,树脂结构中能自由移动的离子与溶液中的同号离子通过离子扩散发生离子交换,从而实现对目标离子的去除。对强酸型阳树脂:R-H++Na+——→R-Na++H+对强碱型阴树脂:R+OH-+Cl-——→R+Cl-+OH-三、实验器材强碱型阴离子交换树脂(201×7)或强酸型阳离子交换树脂(001×7);玻璃交换柱,高40cm,柱身直径3.3cm,出水口直径0.6cm;250ml分液漏斗;250ml锥形瓶;50ml比色管;烧杯若干。四、实验内容:使用阴(阳)离子交换树脂净化含重金属(铬)废水——设计、安装、运行交换柱系统,测试样品铬离子浓度,计算净化系数,评价处理结果。五、主要实验步骤①取实际废液或根据实验要求配制废液,确定废液体积和有害离子浓度(500~2500mg/L),调节pH值。②树脂预处理(预先进行)、装柱、实验系统安装(单柱实验流程)。③完成实验运行,控制废水流量5~10倍床体积/小时(BV/h),记录运行参数(运行时间、累积流量、出水pH值、取样情况等),观察实验现象。④样品测试(水中六价铬的测定采用二苯碳酰二肼比色法),去除率计算、穿透曲线绘制。六、实验结果对实验结果进行理论分析和工程技术评价、得出实验结论,提交实验报告。附录:离子交换树脂处理含铬废水离子交换树脂处理含铬废水的机理是利用交换剂的阴(阳)离子交换基团,与含铬废水中以Cr2O72-及CrO42-或Cr3+形式存在的阴、阳离子交换,达到对废水中铬的净化或回收,反应式为:16\n强碱型阴离子交换树脂交换反应2RCl(OH)+Cr2O72-=R2Cr2O7+2Cl-(OH-)2RCl(OH)+CrO42-=R2CrO4+2Cl-(OH-)强酸性阳离子交换树脂交换反应3RSO3H+Cr3+=(RSO3)3Cr十3H+3RSO3Na+Cr3+=(RSO3)3Cr十3Na+阴离子交换树脂再生反应R2Cr2O7+4NaOH=2ROH+2Na2CrO4+H2O阳离子交换树脂再生反应(RSO3)3Cr+3HCl=3RS03H+CrC13阴离子交换树脂转型反应转为盐型:ROH+HCl=RCl+H2O转为氢氧型:RCl+NaOH=ROH+NaCl阴离子交换树脂转型反应转为盐型:RH+NaOH=RNa+H2O转为氢型:RNa+HCl=RH+NaCl含铬废水在不同pH条件下铬离子的存在状态当pH<4时,废水中六价铬主要以Cr2O72-形式存在;当7>pH>4时,废水中六价铬以Cr2O72-和CrO42-形式存在;当pH>7时,废水中六价铬主要以CrO42-形式存在。16\n实验三:电解凝聚气浮水处理实验一、实验目的使用电解及化学聚凝联合水处理实验装置净化水中胶体物质。二、实验原理电解凝聚是利用电解过程中铁极板或铝极板的腐蚀溶解而成的无机絮凝剂(氯化铁十聚合氧化铁;氯化铝十聚合氯化铝;聚合铝铁等)的凝聚絮凝作用清除水中胶体物质的方法。胶体物质被絮凝剂吸附后,又随电解中阴阳极上所产生O2和H2微泡浮升至水面,再将之刮出得以分离。是一种日益广泛应用的废水处理方法。三、实验装置1.实验器材:电解凝聚气浮实验控制器、循环泵、刮泡电机。2.直流控制器:直流电源控制器是本实验装置的关键设备,可进行电解定时调节、换极周期调节以及输出脉动电源的新型直流电源。这种电源电效率高,而且不存在电极极化钝化现象,大大提高了电解效率,另一方面,它的微脉动性亦有利于电化学过程。其技术参数如下:①电源容量100VA;电压调节范围0-30V;电流调节范围0-3.3A;②倒极周期调节范围0-600S;③实验最佳输出电流25A,实验最佳输出电压:调节电流〈2.5A的电压;④实验最佳换极周期30S-360S(即0.5-6min);⑤实验最佳行时间≤30min;3.其他技术参数:①循环泵:扬程0.5m;流量0.5t/h;电机电压220V;功率10~15W;②刮泡电机:电压12V;功率5~10W;四、操作步骤1.将废水(如印染废水或人工配制废水)装入贮槽的2/3处,并在贮槽内安好微型潜水泵,在贮槽上架好凝聚池,将泵出水口与凝聚池进水口相连,使凝聚池底部出水口可自流入贮槽形成循环系统,并且在凝聚池出渣口下放置一个贮渣容器。2.将电解电源输出线的鲤鱼夹与铝(或铁)极板相接,连接方式一般以双极性接法为佳,即第一极板接正极、而第二、三、四极板并联接负极。检查确认正负极板无碰片现象。3.将220V供电导线与控制器后板220V输入插座相连,暂时不接插在外部电源上。4.检查并调整控制器:①电源总开关(空气开关)应打至OFF位置;②电压调节旋钮应逆时针旋至最小;③将电凝聚定时时间输入定时调节器;④电凝聚工作方式选择开关应打在中部OFF处;16\n①将倒极周期调节旋钮旋至所选择倒极间隔值上;②刮泡电机开关应放在OFF上;⑦循环泵开关应放在OFF上。5.准备工作完毕,插上电源插座:①将总电源开关打至ON,这时电源指示灯应当亮;②将循环泵开关打至ON,这时循环泵应投入工作;③将刮泡电机开关打至ON,这时刮泡电机应投入工作;④调整凝聚浮上池循环水流软管上的节流阀,调节凝聚池中水至适度液面(即液面既不浸入出渣槽,又能刮出浮渣);⑤将电凝聚方式选择开关打向定时〈若无须定时,则打到“不定时”档〉位置,此时倒极调节器开始周期性动作,指示灯有闪烁指示,定时器亦开始计数;⑥沿顺时针方向缓缓调节直流输出电压与电流(调节过猛会使空气开关发生瞬时误动作),保持电流在所需电流上(但一般不要超过2.5A为宜);如电流过小,可以在水中加少量食盐以提高导电率。6.在电解凝聚过程中,由于溶液中物质的电化学作用变化,会使其电解电流发生波动,此时,请注意调整电压,使电流保持在≤2.5A的某值上进行恒流式电解。7.当废水循环电解凝聚处理达到预定时间后实验结束,控制器自行切断电解电源,定时器与倒极器停止工作。澄清后,取水样做水质分析,并与原水样对比以评价处理效果。水样分析方法和指标应依据具体水样选择或设计,如测定BOD5、COD、色度(比色法)以及测定某种离子或离子团的含量。五、注意事项由于水处理实验不可避免要与水接触,且潮湿,实验中要严防师生触电事故。为确保安全,实验指导老师在实验前必须检查直流控制器应可靠接地。六、实验报告1.实验记录序号运行时间输出电流A输出电压V换极周期S处理前C0处理后C2.净化系数:DF=(C0-C/C0)×100%DF——废水经过电解氧化还原水处理的净化系数。C0——废水处理前有害物质含量(或污染程度)。C——废水处理后有害物质含量(或污染程度)。3.结果分析16\n实验四:电解氧化还原水处理实验一、实验目的使用电解氧化还原水处理实验装置浓集和去除工业废水中有毒有害离子。二、实验原理利用水中带电离子发生氧化还原反应,以电解方法来析出有害离子。典型的是水中重金属离子在阴极析出得以清除,是应用于处理含重金属离子工业废水的重要方法。也可处理含氰或含酚废水,应用范围日益广泛。三、实验装置1.实验器材:电还原实验控制器、磁力搅拌器、电极。2.直流控制器:直流电源控制器是本实验装置的关键设备,可进行电解定时调节、换极周期调节以及输出脉动电源的新型直流电源。这种电源电效率高,而且不存在电极极化钝化现象。其技术参数如下:①电源容量100VA;电压调节范围0-30V;电流调节范围0-3.3A;②倒极周期调节范围0-600S;③实验最佳输出电流25A,实验最佳输出电压:调节电流〈2.5A的电压;④实验最佳换极周期30S-360S(即0.5-6min);⑤实验最佳行时间≤30min;3.电极材料的选择①对含重金属离子废水的电还原处理,正负极可用同类材料电极或阳极用石墨等不溶性电板,阴极用于去除离子相同电极(用不同类金属电极亦可)。②对含氰,含酚等废水的氯氧化处理,正负极皆用石墨电极为宜。四、操作步骤1.将250m1废水倒入烧杯中,放入搅拌子。2.将烧杯放在磁力搅拌器托盘上,并在烧杯上固定好电极支架及电极。3.将二极电解导线及220V输入电源线分接控制器后板的直流输出正负极柱上及控制器220V输入插座上。4.将电解导线鲤鱼夹分别夹在正负电极板上。5.检查控制器板面,作如下调整:①电源总开关(空气开关)掷于off(关)位置.。②输出电压调节旋扭逆时针旋至最少。③若要定时处理,则在定时调节器中设定所需时间。16\n④将换极周期调节旋扭至选定的倒极间隔时间上,一般取0.5--6min(即30s-360s)周期为佳。注意:倒极时间设定太小(例如几秒、十几秒),电流效率高,但将减少电源使用寿命。⑤准备工作完毕,首先打开磁力搅拌器(其电源不由控制器控制,而是直接插外部电源接线板上)由磁力搅拌器对杯中水进行搅拌循环。⑥将控制器电源开关开至ON,这时电源指示灯座即亮。⑦顺时针方向缓缓旋动输出电压电流调节旋扭,使电流在2.5A左右。⑧电还原处理过程中,电流会发生变化,应及时调整电压,以保持电流恒定在原值上。如果废水中电导太小影响电流上调,可适当加点食盐。6.当电还原反应进行到预定时间后,控制器自动切断电解直流电源,此时:①关闭控制器开关至OFF,并将输出电压调节旋钮沿逆时针旋至最小。②拔掉与外部220V插座相连的控制器220V输出线。③撤去电解电源线及控制器220V电源输入线。7.取水样分析检验,并与原水样对比以评判处理效果。水样分析方法和指标应依据具体水样选择或设计,如测定BOD5、COD、色度(比色法)以及测定某种离子或离子团的含量。五、注意事项由于水处理实验不可避免要与水接触,且潮湿,实验中要严防师生触电事故。为确保安全,实验指导老师在实验前必须检查直流控制器应可靠接地。六、实验报告1.实验记录序号运行时间(min)输出电流(A)输出电压(V)换极周期(S)处理前C0处理后C2.净化系数DF=(C0-C/C0)×100%DF——废水经过电解氧化还原水处理的净化系数。C0——废水处理前有害物质含量(或污染程度)。C——废水处理后有害物质含量(或污染程度)。3.结果分析16\n附录:电还原处理含铬废水在装有含铬废水的电解槽中放置金属电极(大多为铁板),通入直流电后,铁板阳极溶解产生亚铁离子(强还原剂),可将废水中6价铬(Cr6+)还原为3价铬(Cr3+),反应式为:Fe-2e→Fe2+Cr2O2-7+6Fe2++14H+→2Cr3++6Fe3++7H2OCrO2-4+3Fe2++8H+→Cr3++3Fe3++4H2O由上式可知,还原一个6价铬离子需要3个亚铁离子,即阳极铁板的消耗一般为被处理6价铬离子的3倍左右(重量比)。在铁板阴极,除了氢离子获得电子生成氢气析出外,水中的6价铬直接还原为3价铬:2H++2e→H2↑Cr2O2-7+6Fe2++14H+→2Cr3++6Fe3++7H2OCrO2-4+3e+8H+→Cr3+4H2O由上述反应可知,随着电解的进行,废水中氢离子浓度逐渐降低,结果使其碱性增加,即废水中pH升高。在碱性条件下,可将上述反应所得到的Cr3+和Fe3+以氢氧化铬及氢氧化铁的形式沉淀下来:Cr3++3OH-→Cr(OH)3↓Fe3++3OH-→Fe(OH)3↓当沉淀后的废水达到排放标准时,可直接排放,而沉淀污泥则经脱水后进行处置(如果Fe离子不足可加入辅助反应材料FeSO4)。含铬废水pH值的影响由于六价铬在不同pH条件下其存在状态有所不同,因而pH值直接影响处理效果。当pH<4时,废水中六价铬主要以Cr2O72-形式存在,若假如Na2SO4则有如下反应:Cr2O72-+3SO32-+8H+=2Cr3++3SO42-+4H2O因该反应的标准电势EФ=1.13V,故该反应在瞬间即能自发完成。当7>pH>4时,废水中六价铬以Cr2O72-和CrO42-形式存在,若加入Na2SO3,则有以下两种反应:Cr2O72-+3SO32-+8H+=2Cr3++3SO42-+4H2O2CrO42-+3SO32-+4H++H2O=2Cr(OH)3+3SO42-前一个反应能瞬间完成,而后一个反应由于其标准电势EФ=-1.05V,故该反应不能自发进行,从而使废水中有部分六价铬得不到还原。当pH>7时,废水中六价铬主要以CrO42-形式存在,加入的亚硫酸钠不能使其还原。所以,利用亚硫酸钠法处理含铬废水必须在强酸性条件下进行。在此条件下,亚硫酸钠除与Cr2O72-反应外,还进行如下反应:16\nSO32-+2H+=2SO2+H2O由于这个反应消耗了一定量的亚硫酸钠,因而六价铬与亚硫酸钠反应的投药比远远大于其理论值1:3.64,切反应PH不能太低。化学还原法处理含铬废水显著的特点是:不受废水中六价铬的浓度以及废水量的限制,而且受废水组分的变化影响很小,且有广泛的适用性。亚硫酸盐处理含铬废水操作简便,污泥产量少,易于管理,运行费用较低。在无条件回收铬的情况下,选用化学还原法处理含铬废水比较合适。16\n实验五:多阶完全混合曝气污水处理模拟实验一、实验目的通过操纵多功能多阶完全混合曝气微型污水处理系统,透彻了解活性污泥法水处理的具体工艺及原理,并通过对处理过程中溶解氧的测定,评价曝气设备的充氧能力。二、实验原理普通活性污泥法处理工艺流程:出水进水粗格栅提升泵房细格栅沉砂池初沉池曝气池二沉池进水回流污泥污泥泵房剩余污泥外运栅渣外运栅渣沙水分离污泥处理处置曝气处理过程是普通活性污泥法的核心,是通过空气、活性污泥和污染物三者充分混合,使活性污泥处于悬浮状态,促使氧气从气相转移到液相,从液相转移到活性污泥上,保证微生物有足够的氧进行物质代谢。本实验的曝气过程是通过多阶完全混合曝气微型污水处理系统完成的。三、实验仪器KL-1型微型表曝机(单机共8台)组成的污水处理系统快速DO测定仪移液管烧杯(200ml,4只)四、方法及步骤1、启动微型污水处理系统,调节系统至稳定工作状态。2、系统稳定运行30min后测定各模型曝气池内的溶解氧,此后每隔1min测定一次,共测十次,并记录测定结果。五、注意事项1、因此实验系统电线较多,操作时注意安全。2、溶解氧的测定点(或取样点)应在距池面20cm处。六、实验报告1、绘制普通活性污泥法工艺流程图。2、数据记录16\n曝气池DO值一阶二阶三阶四阶五阶六阶七阶八阶1234567891016\n实验六:混凝剂筛选实验一、实验目的1、观察混凝现象,加深对混凝理论的理解。2、筛选最佳混凝剂,并确定该混凝剂的最佳投加量。二、实验原理就混凝而言有以下四种机理:(1)双电层压缩机理胶粒双电层的构造表明其表面反离子浓度最大,距离胶粒表面越远,反离子浓度越低,最终与溶液浓度相等。当向溶液中投加混凝剂,增加水中反离子,使胶粒扩散层压缩,ξ电位随之降低,斥势能也下降。混凝剂投加量增加,ξ电位降到零,胶粒间斥能消失。此点称为“等电点”,胶体易发生凝聚沉淀。(2)吸附电中和机理吸附电中和作用是指胶粒表面对异号离子有强烈的吸附作用。由于这种作用中和了胶粒部分电荷,降低其静电斥力,ξ电位也隨之减小,因此容易与其它颗粒接近而相互吸附失去稳定性。但与此相反异号离子投加量过大,会使原来带负电荷胶粒变为带正电荷的胶粒,胶粒间会出现斥力和ξ电位增加,此时便发生再稳现象。(3)吸附架桥机理吸附架桥作用是离子物质与胶粒的吸附与桥联,也可说成两个同号胶粒,中间由一个异号小胶粒电性相吸而连接在一起。高分子絮凝剂具有线性结构,它们带有能与胶粒表面某些部位起化学变化的化学基团。当二者相互接触时,基团能与胶粒表面发生特殊反应而吸附;高聚物的其他部分则伸展溶液中,可以和另一个胶粒发生吸附,这样高分子聚合物就起到架桥作用,使絮体长大脱稳。若高分子混凝剂量过大,相应的胶粒少,上述高聚物的伸展部分粘连不上第二个胶粒,则时间过长就会被原胶粒吸附在其他部位上,这个高聚合物失去架桥功能,使胶粒处于稳定状态。此时,胶粒产生了再稳现象。(4)沉析物网捕机理]当金属盐类(铁或铝盐)、金属氢氧化物与石灰作混凝剂时,经水解后形成大量的氢氧化物固体从水中析出、下沉,它们可以网捕卷带水中胶粒形成絮状物。这种作用基本是一种机械作用,混凝剂投加量与被除去的胶体杂质量成反比,即胶粒越少,投加混凝剂越多,反之则少。混凝剂用量太大和太小,絮凝性能均不好。这是因为混凝剂用量太小,起不到电中和和吸附架桥作用,也就不能有效降低ξ电位。隨着用量的增大,胶粒表面对异号离子的吸附作用增强,这种作用中和了胶粒部分电荷,降低其静电斥力,ξ电位也隨之减小,因而容易与其它颗粒接近而相互吸附而脱稳。混凝剂用量太大,会使原来带负电荷的胶粒变为带正电荷,胶粒间会出现斥力和ξ电位增加,发生再稳,致使混凝效果反而变差。16\n三、实验试剂与仪器①六联搅拌器(1台)。②分光光度仪(1台)。③烧杯(500ml,6只)。④移液管(1ml、2ml、5ml、10ml各3只)。⑤硫酸铝Al3(SO4)2·18H2O(10g/L)。⑥三氯化铁FeCl3·6H2O(10g/L)。⑦聚丙烯酰胺(1g/L)。⑧注射针筒(50ml)。四、实验方法及步骤(1)最佳混凝剂的确定①用3只500ml的烧杯,分别取200ml原水,将装有水样的烧杯置于搅拌器上。②分别向3只烧杯中加入硫酸铝、三氯化铁和聚丙烯酰胺,并每次投加量为5ml,同时进行搅拌(转速150r/min),直到其中一个试样出现矾花,这时记录下每个试样中混凝剂的用量。③停止搅拌,静置10min.④用注射针筒取上层清液,用分光光度仪测出透光率并记录数据。⑤根据测得的透光率确定最佳混凝剂。(2)确定混凝剂的最佳用量①用6只500ml烧杯分别取200ml原水,将装有水样的烧杯置于搅拌器上。②采用(1)中选定的混凝剂,按不同的投量(0.5ml、1ml、1.5ml、2ml、2.5ml、3ml)分别加到6只装有原水样的烧杯中。③启动搅拌器,快速搅拌0.5min(300r/min),中速搅拌3min(150r/min),慢速搅拌5min(70r/min)。④停止搅拌,静置10min。用注射针筒公元前50ml上清液,测定透光率,并记录数据。五、实验结果表1三种混凝剂透光率测定数据记录表混凝剂硫酸铝三氯化铁聚丙烯酰胺矾花形成时混凝剂用量/ml11116\n透光率222333平均平均平均表2某种混凝剂用量的最佳选择数据记录表水样编号123456混凝剂用量/ml透光率123平均16