- 181.00 KB
- 2023-01-02 08:30:53 发布
- 1、本文档共5页,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报电话:19940600175。
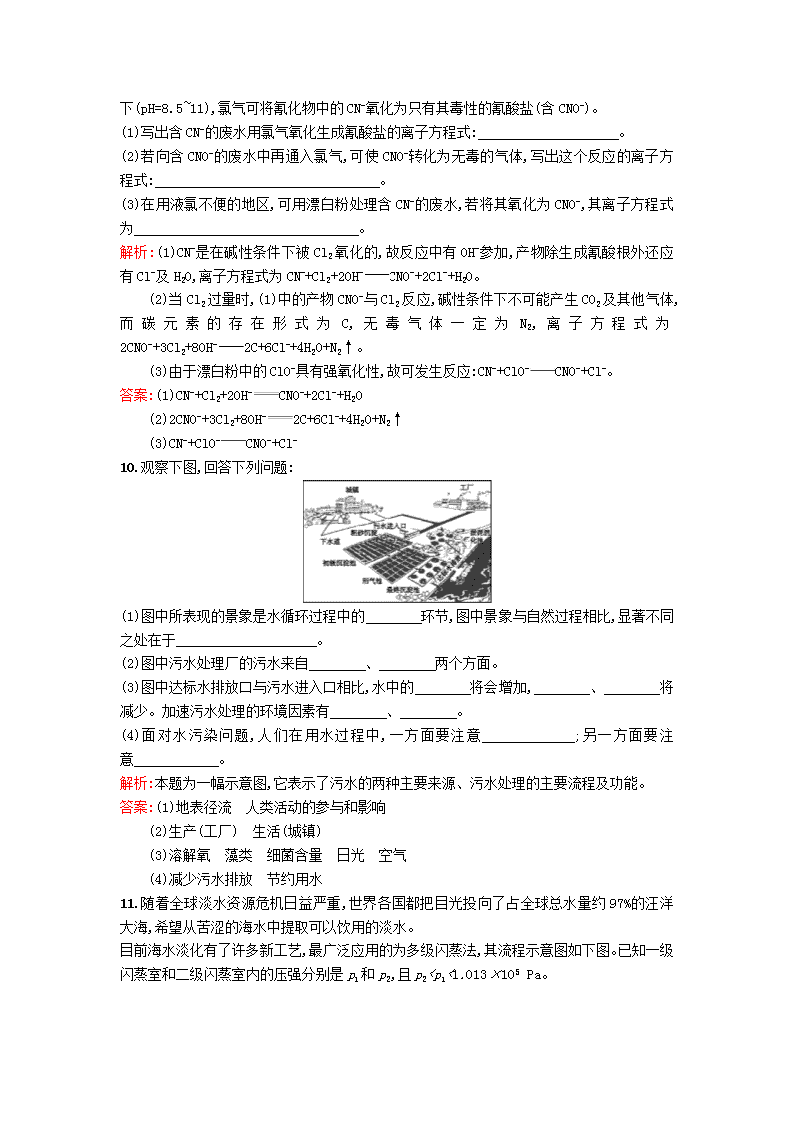
污水处理 海水淡化1.污水处理的主要方法有:①中和法;②化学沉淀法;③氧化还原法;④过滤法。其中属于化学方法的有( ) A.①②③B.①②④C.②③④D.①②③④解析:中和法、化学沉淀法(加入化学试剂形成沉淀)和氧化还原法均属于化学方法,而过滤法是分离难溶性固体和液体的混合物的方法,为物理方法,所以选A。答案:A2.目前下列工艺过程没有直接使用离子交换技术的是( )①硬水的软化 ②电渗析法淡化海水 ③海水蒸馏制淡水A.①B.②C.①②③D.③答案:D3.我国淡水资源非常短缺,所以在生产和生活中应该( )A.减少饮水量,以节约用水B.将生活用水、工厂废水直接排放到湖泊或海洋中C.既要防止和消除水体污染,又要节约用水D.水是取之不尽、用之不竭的天然资源解析:人体需水量不能太少,故不能减少饮水量,A错;B中直接排放污水会造成水污染,B错;水并不是不会枯竭的,故D错。答案:C4.海水约占地球现有总水量的97%,海水淡化问题成为科学家的主要研究方向。下列淡化海水的方法不可行的是( )A.加化学试剂,使海水中的盐分沉淀B.利用太阳能,将海水蒸馏而除去盐分C.将海水通过离子交换树脂而除去盐分D.利用半透膜,采用反渗透法而除去盐分解析:海水中Na+等离子不能通过加化学试剂而沉淀,A项错误;B项为蒸馏法淡化海水;C项为电渗析法淡化海水;D项为反渗透法淡化海水。答案:A5.某地有甲、乙两工厂排放污水,污水中各含有下列8种离子中的四种(两厂不含相同离子):Ag+、Ba2+、Fe3+、Na+、Cl-、S、N、OH-。两厂单独排放废水都会造成严重的水污染,如将两厂的污水按一定比例混合,沉淀后污水变无色澄清且只含NaNO3,污染程度会大大降低。关于污染源的分析,你认为正确的是( )A.S和N可能来自同一工厂B.Cl-和N一定在不同工厂C.Ag+和Na+可能在同一工厂D.Na+和N来自同一工厂解析:\n水污染是当今世界一个普遍问题,根据题意知,两厂各自的废水中必定不存在沉淀,且阴、阳离子同时存在。若Ag+在甲厂,则Cl-、S、OH-必在乙厂;那么Ba2+、Fe3+也得在甲厂中,否则将生成沉淀。由于甲厂废水中不会都为阳离子,所以N必在甲厂废水中,阳离子Na+必在乙厂废水中。故S、N不在同厂废水中,Ag+、Na+不在同厂废水中,Na+、N不在同厂废水中,因而B正确。答案:B6.海水淡化可采用膜分离技术,如右图所示,对淡化膜右侧的海水加压,水分子可以透过淡化膜进入左侧淡水池,而海水中的各种离子不能通过淡化膜,从而得到淡水,对加压后右侧海水成分变化进行分析,正确的是( )A.溶质质量增加B.溶液质量不变C.溶剂质量减少D.溶质质量分数不变解析:右侧海水中水分子能通过淡化膜进入左侧淡水池,而各种离子不能通过淡化膜,故溶质质量不变,溶剂质量减少,溶质质量分数增大。答案:C7.某溶液中含有Fe2+、Al3+、Ag+、Cu2+,为分别得到各含一种金属阳离子的沉淀物,可采取①通入H2S气体,②通入CO2气体,③加入盐酸,④加入氢氧化钠溶液四个步骤,每次通入或加入试剂均过量,且每次都把沉淀物滤出,其操作的正确顺序是( )A.③①④②B.①③④②C.④②①③D.④②③①解析:先除Ag+,再除Cu2+,后除Fe2+和Al3+,故选A。答案:A8.某冶金厂废水的pH为4.5,含超标10倍的Pb2+。该厂处理废水的下列设计中,比较合理的是( )A.用离子交换法除去Pb2+B.在废水中加硫酸,生成PbSO4沉淀C.在废水中加NaOH,调节pH到11.0,使Pb2+转化为氢氧化物沉淀D.在废水中加石灰,调节pH到11.0,使Pb2+转化为氢氧化物沉淀解析:废水量太大,不能用离子交换法;加硫酸虽能除去Pb2+,但增加了溶液酸度,因石灰比NaOH廉价,故选用石灰。答案:D9.含有农药、染料、酚、氰化物以及引起色度、臭味的废水,常用化学氧化法进行处理,所用的氧化剂有氯类(如液氯、次氯酸钙、次氯酸钠等)和氧类(如空气、臭氧、过氧化氢、高锰酸钾等)。一个典型实例是用氯氧化法处理含有剧毒的氰化物(含CN-\n)的废水。在碱性条件下(pH=8.5~11),氯气可将氰化物中的CN-氧化为只有其毒性的氰酸盐(含CNO-)。(1)写出含CN-的废水用氯气氧化生成氰酸盐的离子方程式: 。 (2)若向含CNO-的废水中再通入氯气,可使CNO-转化为无毒的气体,写出这个反应的离子方程式: 。 (3)在用液氯不便的地区,可用漂白粉处理含CN-的废水,若将其氧化为CNO-,其离子方程式为 。 解析:(1)CN-是在碱性条件下被Cl2氧化的,故反应中有OH-参加,产物除生成氰酸根外还应有Cl-及H2O,离子方程式为CN-+Cl2+2OH-CNO-+2Cl-+H2O。(2)当Cl2过量时,(1)中的产物CNO-与Cl2反应,碱性条件下不可能产生CO2及其他气体,而碳元素的存在形式为C,无毒气体一定为N2,离子方程式为2CNO-+3Cl2+8OH-2C+6Cl-+4H2O+N2↑。(3)由于漂白粉中的ClO-具有强氧化性,故可发生反应:CN-+ClO-CNO-+Cl-。答案:(1)CN-+Cl2+2OH-CNO-+2Cl-+H2O(2)2CNO-+3Cl2+8OH-2C+6Cl-+4H2O+N2↑(3)CN-+ClO-CNO-+Cl-10.观察下图,回答下列问题:(1)图中所表现的景象是水循环过程中的 环节,图中景象与自然过程相比,显著不同之处在于 。 (2)图中污水处理厂的污水来自 、 两个方面。 (3)图中达标水排放口与污水进入口相比,水中的 将会增加, 、 将减少。加速污水处理的环境因素有 、 。 (4)面对水污染问题,人们在用水过程中,一方面要注意 ;另一方面要注意 。 解析:本题为一幅示意图,它表示了污水的两种主要来源、污水处理的主要流程及功能。答案:(1)地表径流 人类活动的参与和影响(2)生产(工厂) 生活(城镇)(3)溶解氧 藻类 细菌含量 日光 空气(4)减少污水排放 节约用水11.随着全球淡水资源危机日益严重,世界各国都把目光投向了占全球总水量约97%的汪洋大海,希望从苦涩的海水中提取可以饮用的淡水。目前海水淡化有了许多新工艺,最广泛应用的为多级闪蒸法,其流程示意图如下图。已知一级闪蒸室和二级闪蒸室内的压强分别是p1和p2,且p2