- 1.06 MB
- 2023-01-02 08:31:21 发布
- 1、本文档共5页,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报电话:19940600175。
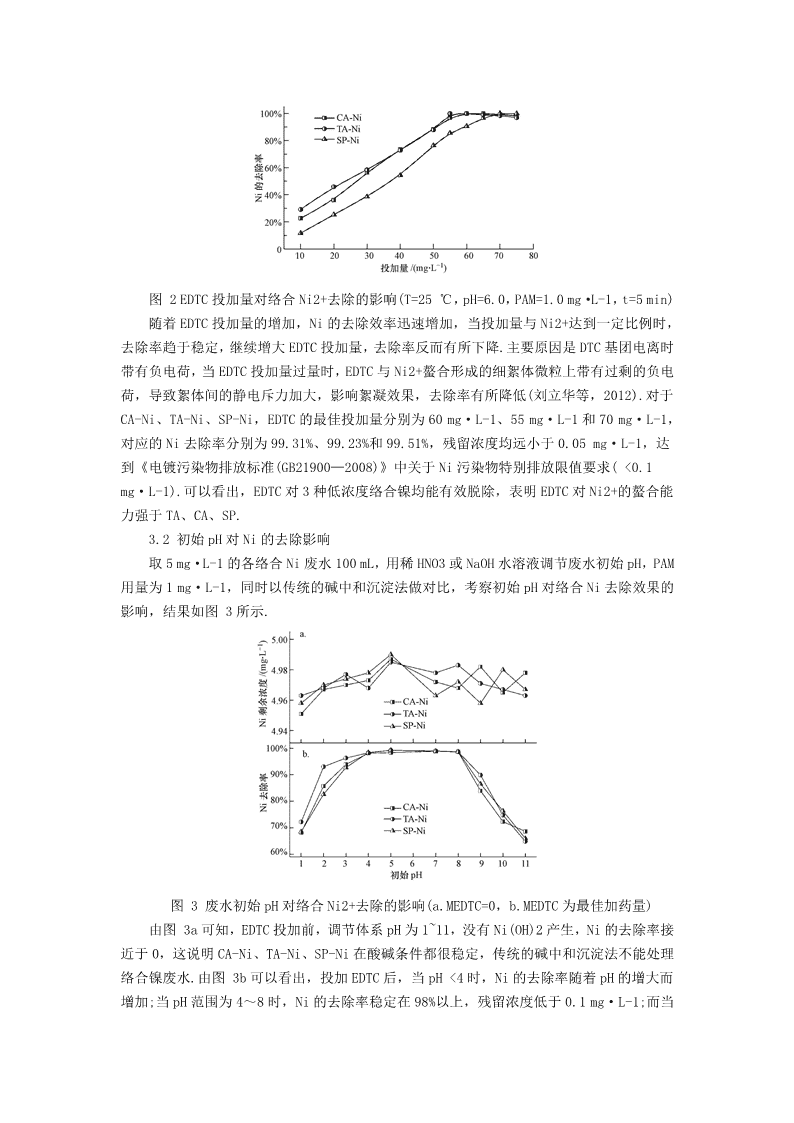
含镍废水方法研究1引言(Introduction)镀镍作为金属表面修饰的主要方式,其过程会产生大量的含镍废水,其中除了有以硫酸镍和氯化镍为主的游离态镍,还有因生产工艺需要添加各种络合剂,如酒石酸钾钠(TA)、柠檬酸(CA)、焦磷酸钠(SP)等,它们会与废水中的Ni2+形成更稳定的TA-Ni、CA-Ni、SP-Ni等酸性络合镍,使得含镍废水难以有效处理,而镍是国际上公认的致癌物,在GB8978—1996《污水综合排放标准》中被归为第一类污染物,其超标排放会对环境造成严重污染.目前,处理含镍废水最常用的方法是以氢氧化物和硫化物为主的传统化学沉淀法,其主要适用于游离态镍处理,但对低浓度络合Ni很难有效脱除,其他方法如电解法、离子交换法、吸附法、高级氧化还原法,虽能保证出水总镍达标,但普遍存在处理成本较高,反应时间长,易引起二次污染等,限制了其实际应用.随着废水排放标准日益严格,特别是广东省环保厅要求处理后的含Ni电镀废水中残留Ni2+浓度低于《电镀污染物排放标准(GB21900-2008)》特别排放限值0.1mg·L-1,因此需要开发一种更稳定有效深度脱除低浓度络合Ni的方法.以二硫代氨基甲酸类(DTC)为代表重金属捕集剂因其强大的螯合能力,可直接与络合态重金属离子形成强稳定性的螯合沉淀物,从而有效脱除废水中的重金属污染物,受到广泛关注.近些年来,学者已经开始利用DTC类重金属捕集剂来处理含镍废水,并取得较好的效果.合成四乙烯五胺多(二硫代甲酸钠,TEPAMDT)来处理含游离和络合Cu2+及Ni2+废水,去除率均在99.8%以上.Fu等(2007)利用合成的重金属捕集剂BDP和DDTC处理Ni2+和CA-Ni废水,其对Ni的沉淀效率达到98%以上,出水Ni2+浓度低于1.0mg·L-1.然而,绝大多数学者研究的都是较高浓度的含镍废水(>50mg·L-1),尤其对于低浓度络合Ni废水的研究较少.本研究结合实际需要,选用自主合成的多硫代巯基类重金属捕集剂N,N-双(二硫代羧基)乙二胺,以CA-Ni、TA-Ni、SP-Ni3种低浓度模拟络合镍废水为研究对象,系统研究了EDTC投加量、初始pH、反应时间、沉淀时间等因素对Ni去除效果的影响,同时探讨了螯合沉淀物的浸出特性及EDTC深度脱除络合Ni的机理,为实际低浓度含镍废水的高效深度处理提供理论依据.2材料与方法(Materialsandmethods)2.1实验材料氯化镍(NiCl2·6H2O),分析纯,天津市百世化工有限公司;柠檬酸(CA),分析纯,成都市科龙化工试剂厂分析;氢氧化钠(NaOH)分析纯,天津市科密欧化学试剂有限公司;酒石酸钾钠(TA)分析纯,成都市科龙化工试剂厂;焦磷酸钠(SP)分析纯,天津市科密欧化学试剂有限公司;浓硝酸,分析纯,天津市百世化工有限公司;阴离子型聚丙烯酰胺(PAM),分子量300万,分析纯,天津市科密欧化学试剂有限公司;自制重金属捕集剂N,N-双(二硫代羧基)乙二胺(EDTC)2.2实验方法2.2.1重金属捕集剂EDTC的制备往配有搅拌和冷凝的三口烧瓶中加入40mL的混合溶剂(V乙醇/VH2O=1∶2),后在搅拌过程中加入乙二胺0.1mol(6.68mL),在冰水浴中缓慢滴加CS20.25mol(15.08mL),滴\n加完成后升温至室温,稳定反应2h,抽滤,分别用去离子水和无水乙醇洗涤产物2次,40℃真空干燥至恒重,得白色粉末固体,即为重金属捕集剂EDTC.2.2.2低浓度络合镍的捕集实验在室温条件下,在烧杯中加入100mL5mg·L-1模拟络合镍废水(由六水氯化镍与TA、CA、SP按物质量比1∶1配制,后稀释至5mg·L-1),调节初始pH,投加一定量重金属捕集剂EDTC,置于六联搅拌器中快速(250r·min-1)搅拌2min,投加絮凝剂PAM1.0mg·L-1,并缓慢搅拌(50r·min-1)5min,静置10min后取液面以下2cm处清液,用原子吸收分光光度计测定上清液中残留的Ni浓度,计算去除率.具体流程如图1所示.图1重金属捕集剂EDTC处理含镍废水实验流程图2.2.3螯合沉淀物浸出实验将EDTC与络合Ni按最佳条件反应生成的螯合产物经去离子水和乙醇各洗涤两次、过滤,于40℃真空干燥后备用,参照Chang等(2002)的方法对沉淀物进行半自动溶出实验(SDLT),测定螯合沉淀物的稳定性.SDLT实验步骤如下:将螯合沉淀物加入4个具塞锥形瓶内,按100∶1(mL·g-1)的固液比分别加入pH为3.0和5.0的醋酸溶液、pH为7.0的水溶液及pH为9.0的NaOH溶液.进行静置溶出实验.每隔一段时间测定溶出的Ni2+浓度.2.3分析方法pH指标:采用雷磁pHS-25酸度计测定;Ni2+浓度:采用火焰原子吸收分光光度计测定(日立Z2000型,检出限0.02mg·L-1,日本日立仪器有限公司);重金属捕集剂EDTC反应前后表征:(1)采用KBr压片法,Nicolet380傅里叶变换红外光谱仪(Nicolet380,美国THERMOFisherScientific)在波数4000-400cm-1范围内测定透光率,仪器分辨率为0.4cm-1.(2)采用有机元素分析仪(2400Ⅱ,美国PerkinElmer)测定捕集剂和螯合产物碳氢氮硫含量.3结果与讨论(Resultsanddiscussion)3.1EDTC投加量对Ni去除效果的影响取浓度为5mg·L-1各络合Ni废水100mL,调节初始pH为6.0,投加不同剂量的重金属捕集剂EDTC,反应2min,PAM为1.0mg·L-1,慢搅5min,静置10min,考察EDTC投加量对Ni去除效果的影响,结果如图2所示.\n图2EDTC投加量对络合Ni2+去除的影响(T=25℃,pH=6.0,PAM=1.0mg·L-1,t=5min)随着EDTC投加量的增加,Ni的去除效率迅速增加,当投加量与Ni2+达到一定比例时,去除率趋于稳定,继续增大EDTC投加量,去除率反而有所下降.主要原因是DTC基团电离时带有负电荷,当EDTC投加量过量时,EDTC与Ni2+螯合形成的细絮体微粒上带有过剩的负电荷,导致絮体间的静电斥力加大,影响絮凝效果,去除率有所降低(刘立华等,2012).对于CA-Ni、TA-Ni、SP-Ni,EDTC的最佳投加量分别为60mg·L-1、55mg·L-1和70mg·L-1,对应的Ni去除率分别为99.31%、99.23%和99.51%,残留浓度均远小于0.05mg·L-1,达到《电镀污染物排放标准(GB21900—2008)》中关于Ni污染物特别排放限值要求(<0.1mg·L-1).可以看出,EDTC对3种低浓度络合镍均能有效脱除,表明EDTC对Ni2+的螯合能力强于TA、CA、SP.3.2初始pH对Ni的去除影响取5mg·L-1的各络合Ni废水100mL,用稀HNO3或NaOH水溶液调节废水初始pH,PAM用量为1mg·L-1,同时以传统的碱中和沉淀法做对比,考察初始pH对络合Ni去除效果的影响,结果如图3所示.图3废水初始pH对络合Ni2+去除的影响(a.MEDTC=0,b.MEDTC为最佳加药量)由图3a可知,EDTC投加前,调节体系pH为1~11,没有Ni(OH)2产生,Ni的去除率接近于0,这说明CA-Ni、TA-Ni、SP-Ni在酸碱条件都很稳定,传统的碱中和沉淀法不能处理络合镍废水.由图3b可以看出,投加EDTC后,当pH<4时,Ni的去除率随着pH的增大而增加;当pH范围为4~8时,Ni的去除率稳定在98%以上,残留浓度低于0.1mg·L-1;而当\npH>8时,Ni的去除率迅速下降,反应先后反应体系pH变化不大.废水pH对络合Ni去除影响较大的原因如下:EDTC与Ni2+反应的实质是DTC(二硫代氨基甲酸基)基团与Ni2+的螯合作用,DTC基团在反应体系中存在式(1)电离平衡(郝学奎等,2008),随着pH值的上升,H+浓度不断减小,电离平衡向右移动,解离出更多的DTC基团与Ni2+进行螯合,去除率逐渐上升;当体系在碱性条件下(pH>8),络合离子如柠檬酸、焦磷酸等酸效应较弱,其与Ni2+形成的螯合物稳定性较强,抑制了EDTC对络合Ni的捕集,Ni的去除率迅速下降,特别是当pH=11时,Ni的去除率下降至65%左右;当在强酸条件下,大量的H+一方面会抑制—CSSH的电离,即式(1)中的平衡向左移动,同时EDTC还可能分解为CS2和质子化胺(Saegnsaetal.,1978),如式(2)所示,使得反应体系中DTC基团减少;另一方面体系中H+浓度过高,可能会与Ni2+竞争DTC基团上的螯合活性位点(Baietal.,2011),导致Ni的去除率迅速降低.因实际电镀含镍废水多为酸性废水(pH为6.0左右),传统的化学沉淀法一般需要在反应前后消耗大量的酸碱调节pH,甚至需要提前经过破络,而EDTC可以直接用于酸性含镍废水的处理,克服了传统化学沉淀法的不足(王贞等,2010).(1)(2)3.3反应时间对Ni的去除影响反应时间对于废水处理工艺设计尤为重要,直接关系到反应池的池容,进而影响所需反应设备的选型等(胡运俊等,2013).取5mg·L-1的各络合Ni废水100mL,调节初始pH=6.0,EDTC投加量为各最佳投加量,PAM用量为1.0mg·L-1,调整慢搅时间0~12min,考察反应时间对Ni去除效果的影响,结果如图4所示.\n图4反应时间对络合Ni2+去除的影响(T=25℃,pH=6.0,PAM=1.0mg·L-1)可以看出,在前2min,EDTC对络合Ni的去除率随着反应时间的增加而迅速增大,在2min后,反应达到稳定,Ni的去除率稳定在99%以上,出水浓度<0.05mg·L-1,远低于国家排放标准,这表明EDTC与Ni2+能迅速发生反应,而当反应时间超过8min后,Ni的去除率却有所下降,但仍在98%以上.分析原因:反应完成后,过量延长搅拌时间会导致沉淀絮体颗粒破碎,沉降不完全,影响出水水质.总体来说,反应时间对含镍废水处理有一定影响,但不如EDTC投加量和初始pH大.考虑的经济成本,故选择最佳反应时间2min.3.4螯合沉淀物的沉降性取5mg·L-1的各络合Ni废水100mL,调节pH值为6.0,投加对应最佳EDTC用量,分别沉淀1~20min,考察螯合沉淀物的沉降性能,如图5所示.图5沉淀时间对络合Ni2+去除的影响(T=25℃,pH=6.0)螯合沉淀物的沉降性能较好,EDTC对Ni2+的去除效率随着沉降时间的延长而增加.当沉淀时间为8min时,Ni的去除率可达到98%以上,残留Ni2+浓度低于0.1mg·L-1,之后去除率逐渐趋于稳定.与传统的化学沉淀法相比,其沉降性能大大提高,同时减少了絮凝剂的使用.如硫化物沉淀法处理低浓度重金属废水时,生成的沉淀颗粒较小,沉淀周期较长,同时需要添加一定量的混凝剂和絮凝剂(Kelly-Vargasetal.,2012).因此,选用EDTC处理低浓度重金属废水,具有沉降周期短,固液易分离、所需设备体积小、效率高等优点.3.5EDTC与Ni2+的螯合机理按上述最佳反应条件(PAM除外)得到EDTC与3种络合Ni废水的螯合沉淀物,沉淀物经过滤、洗涤、真空干燥后进行红外光谱分析,沉淀物和EDTC的红外光谱图如图6所示.\n图6EDTC与3种螯合沉淀物的红外光谱图(4000~400cm-1)(a.EDTC,b.EDTC和SP-Ni的反应沉淀物,c.EDTC和CA-Ni反应沉淀物,d.EDTC和TA-Ni反应沉淀物)由图6a可知:3231cm-1处的强吸收峰为N—H的伸缩振动峰;2952cm-1为C—H伸缩振动峰,且低于3000cm-1,该峰为C—H的饱和吸收峰;2576cm-1为—SH的弱的特征吸收峰峰;1508cm-1为N—CS2的伸缩振动峰,此峰介于C—N单建(1300cm-1)和CN双键(1600cm-1)之间,具有部分双键性质;在1480~1510cm-1处的ν(C—N)伸缩振动及在940~990cm-1处的ν(C—S)伸缩振动表明二硫代甲酸盐是双齿配体,即S—CS(Oktavecetal.,1980);1007cm-1为C—S的红外特征吸收峰,低于CS双键的特征吸收(1501~1200cm-1),而且是一个较强的吸收峰.对比沉淀物和EDTC的红外光谱图可知,EDTC与Ni发生反应后,2576cm-1处的—SH的特征吸收峰消失,1508cm-1处的N-CS2的伸缩振动峰和1007cm-1处的C—S红外特征吸收峰出峰强度有所减弱,这几个吸收峰为螯合反应的关键基团,分析原因是EDTC分子上的S与Ni发生作用,降低了S的电负性,引起了峰的变化(Liuetal.,2013).由此推断EDTC捕集Ni的主要官能团是—SH,其余基团未参与反应.进一步,对3种螯合沉淀物进行元素分析,结果如表1所示.由表1可知,3种螯合沉淀物的各元素百分含量与EDTC-Ni(EDTC与Ni摩尔比为1∶1)的理论含量基本一致,由此推断EDTC与络合Ni废水的产物化学式为EDTC-Ni.表13种螯合沉淀物(b、c、d)和EDTC-Ni理论元素含量对比由上述推论可知,EDTC与Ni的作用机理为脱络-螯合,即反应时,由于EDTC对Ni2+的螯合能力更强,使Ni2+先与CA等络合剂分离,后EDTC与Ni2+生成更稳定的螯合沉淀物\nEDTC-Ni,进而可以深度脱除低浓度络合Ni,其本质是由于EDTC分子为左右对称结构,含有二硫代羧基基团—CSSH,二硫代羧基基团上的S原子半径较大,电负性强,具有3对孤立的电子对,其中2对可以占用镍离子的空d轨道,形成配位键.根据配位场理论,在d轨道全空的情况下,容易形成正四面体型的结构,这样各电子对之间的相互排斥力小,而S原子外层4对电子也形成互斥力小的正四面体构型,形成稳定的交联网状螯合物(Zhenetal.,2012),其反应方程式如式(3)所示.此外,EDTC分子中N-C键有很强的电负性,通过电子传递作用,使得二硫代羧基上的S原子电负性增强,促进S原子更易失去电子而极化变形形成电场,从而与废水中Ni2+趋向形成强稳定的疏水性螯合沉淀物(严苹方等,2015;李清峰等,2014).由于螯合产物中不含有CA等络合剂,使得三螯合沉淀物的红外图谱基本一致,如图6b、c、d所示,三者的出峰强度的差异体现了EDTC与3种络合Ni反应的差异:3种络合剂结构不同,对Ni2+的螯合能力大小不同,当EDTC对络合Ni脱络时,所需能量不同,引起键能发生变化,导致了3种螯合沉淀物红外图谱的差异.其中,M代表3种络合剂(CA、TA、SP).(3)3.6螯合沉淀物的溶出特性图7为螯合产物EDTC-Ni在不同pH值下溶出Ni2+的累积分数.由SDLT实验结果可知:在pH=3.0时,30d的溶出Ni2+累积分数达到0.575%;而在pH=5.0和7.0时,Ni2+溶出积分数仅有0.005%和0.008%;pH=9.0时的30d累积分数为0.105%.这说明螯合沉淀物EDTC-Ni在酸性和弱碱性环境下能稳定存在,可以长期稳定安全放置.图7SDLT中EDTC-Ni沉淀溶出Ni的累积分数随时间变化曲线4结论(Conclusions)1)自主合成的重金属捕集剂EDTC能快速高效脱除低浓度络合态Ni,处理初始浓度5mg·L-1的CA-Ni、TA-Ni、SP-Ni,EDTC的最佳投加量分别为60mg·L-1、55mg·L-1和\n70mg·L-1,对应去除率分别为99.31%、99.23%和99.51%,残留Ni2+浓度达到《电镀污染物排放标准(GB21900-2008)》中关于Ni污染物特别排放限值要求(<0.1mg·L-1).2)EDTC具有较宽的pH的适用范围,在pH值为4~8时,EDTC对络合Ni2+的去除率均在98%以上,可以直接用于酸洗含镍废水处理,而反应时间对含镍废水处理有一定影响,但不如EDTC投加量和初始pH大.3)EDTC与络合Ni反应时,与络合剂(CA、TA、SP)竞争Ni2+,并与Ni2+生成更稳定螯合沉淀物EDTC-Ni.沉降性实验和SDLT实验表明螯合沉淀物EDTC-Ni沉降性能好,稳定性强,自然堆积条件下不易返溶而引起二次污染.