- 469.32 KB
- 2023-01-02 08:31:21 发布
- 1、本文档共5页,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报电话:19940600175。
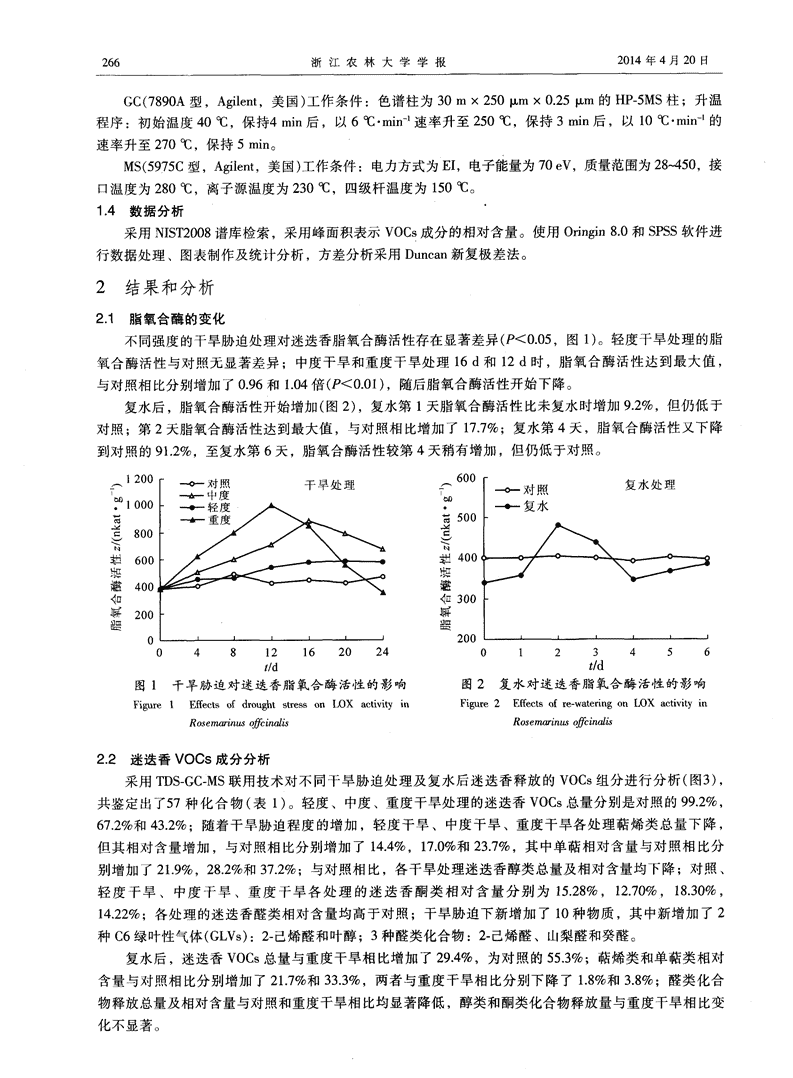
浙江农林大学学报,2014,31(2):264—271JournalofZhejiangA&FUniversitydoi:10.11833,j.issn.2095—0756.2014.02.015干旱一复水处理对迷迭香挥发性有机化合物释放规律的影响刘芳,许改平,吴兴波,丁倩倩,郑洁,张汝民,高岩(浙江农林大学林业与生物技术学院,浙江临安311300)摘要:为了探讨干旱胁迫对迷迭香Rosmarinusofficinalis挥发性有机化合物(volatileorganiccompounds,简称VOCs)释放规律的影响,采用称量控水法对迷迭香进行干旱胁迫试验,设置轻度、中度、重度干旱水平、复水和对照。结果表明:干旱胁迫下迷迭香VOCs释放总量减少,但种类增加;轻度、中度、重度处理VOCs总量分别是对照的99.6%,69.4%,43.2%。迷迭香VOCs主要是萜烯类化合物,占总量的46.0%以上;各干旱处理萜烯类化舍物相对含量与对照比分别增加了14.4%,17.01%,23.7%,其中单萜类相对含量呈增加显著;干旱胁迫明显诱导C6绿叶性挥发物和醛类化合物的释放。复水处理萜烯类百分含量和单萜类百分含量比重度处理稍有下降,仍显著高于对照、轻度和中度处理。图3表l参30关键词:植物学;干旱胁迫;复水;迷迭香;脂氧合酶;挥发性有机化合物;绿叶性气体;单萜中图分类号:S718.43文献标志码:A文章编号:2095—0756(2014)02—0264—08Effectofdroughtstressandre—wateringonemissionsofvolatileorganiccompoundsfromRos.magnusofficinalisLIUFang,XUGaiping,WUXingbo,DINGQianqian,ZHENGJie,ZHANGRumin,GAOYan(SchoolofForestryandBiotechnology,ZhejiangA&FUniversity,Lin’an311300,Zhejiang,China)Abstract:Tobetterunderstandtheeffectsofwaterlimitationsontheemissionofvolatileorganiccompounds(VOCs),VOCemissionsfromRosmarinusofficincdisweredeterminedunderdroughtstressandafterre—watering.ResultsshowedthatwithdroughtstressR.officinalisVOCemissionsandlipoxidaseactivitywerestronglyaffectedwiththedegreeofinfluencedependentonthestresslevelandtime.Atthebeginningofthedroughtstressperiod,lipoxidaseactivityincreasedslightly;midwaythrough,theactivityreachedapeak;thenitdeclined.DroughtstressreducedR.officinalisVOCemissions,butinducednewVOCsincluding2-hexenal,leafalcoholsorbaldehydc,andn—decana1.Also,R.officinalisincreasedterpeneemissions,especiallymonoterpenes,toreducedroughtstressdamage.[Ch,3fig.1tab.30ref.]Keywords:botany;droughtstress;re-water;Rosmarinusofficinalis;lipoxidase;volatileorganiccompounds(VOCs);greenlearvolatiles(GLVs);monoterpenes园林植物是维系城市生态平衡的重要因素,自然环境的干旱胁迫会使植物体内细胞脱水,造成水分亏缺而导致植物受害。干旱胁迫是众多环境胁迫因子中最常见的一种汜,对植物的生长发育会产生不同程度的影响。在现代化的城市绿化中,选择观赏性好、抗性强的观赏植物,对节约水资源改善土壤干旱、半干旱的现状具有重要意义。植物挥发性有机化合物(volatileorganiccompounds,简称VOCs)~常指分子质量小于250,沸点小于340℃,从植物地上部分(如叶、花和芽等)表面散发的多种微浓度的挥收稿13期:2013.01.16;修回日期:2013.05.18基金项目:国家自然科学基金资助项目(30972397,31270756);浙江农林大学科研发展基金资助项目(2010FR058)作者简介:刘芳,从事植物生理生态研究。E—mail:sijiali1987lu@126.con。通信作者:高岩,教授,博士,从事植物生理生态等研究。E—mail:ga0yan1960@s0hu.com\n第31卷第2期刘芳等:干旱一复水处理对迷迭香挥发性有机化合物释放规律的影响265发性次生代谢物质口]。植物VOCs在生态系统中占有重要地位,它是重要的化学信息传递物质],在调节植物的生长、发育和繁衍,抵御环境胁迫及预防动物和昆虫的危害等。。方面具有重要作用。非生物胁迫会明显影响植物VOCs的合成与释放,Ibrahim等¨和Hartikainen等均研究发现,高温胁迫会诱导欧洲白桦Betulapendula和欧洲山杨Populustremula释放大量的异戊二烯、萜类和C6绿叶性气体(greenleafvolatiles,GLVs);光照一黑暗转换处理会诱导欧洲黑杨Populusdeltoides叶片大量释放己烯醛和乙醛等¨。干旱对VOCs释放规律的影响呈现多样性,Staudt等¨在对栓皮栎Quercussuber的研究中发现,适度干旱胁迫导致单萜类化合物的释放量增加30%,而Lavoir等¨发现,干旱胁迫下冬青栎Quercusilex。释放的单萜是对照处理的55%。Blanch等H研究发现干旱导致冬青栎萜烯类释放量增加33%,而相同干旱条件下地中海白松Pinushalepensis萜烯类释放量降低了38%。迷迭香Rosemarinusofcinalis,又名情人草,原产地为欧洲、北非及地中海沿岸,主要分布在法国、突尼斯、摩洛哥和保加利亚。迷迭香枝叶气味浓烈,抗旱性极强,是一种被广泛应用的园林芳香植物,可用于花坛绿地片植、丛植、孤植或作为配材,用于镶边,亦可用作小绿篱或花篱,国外多用于花境配材。近几年,迷迭香的研究多集中在其有效成分提取工艺、抗氧化物功能和精油组分分析等方面。关于干旱胁迫下迷迭香VOCs释放规律与抗旱机制之间的关系未见报道。因此,本研究采用称量控水法模拟干旱胁迫,利用动态顶空气体循环法和热脱附.气相色谱.质谱联用技术(TDC—GC.MS)测定了干旱胁迫及复水后迷迭香VOCs成分的变化;同时,测定了迷迭香叶片脂氧合酶(LOX)活性的变化,以期从迷迭香释放VOCs角度揭示它对干旱胁迫的适应机制,为进一步研究植物释放VOCs对非生物胁迫的响应机制提供理论依据1材料与方法1.1供试材料及处理、供试材料为迷迭香2年生实生苗(江苏省宿迁谊园花卉盆景苗木公司提供),苗高约为20cm。2012年4月栽置于盛有培养土[m(泥炭):m(沙土):m(蛭石)=1:2:1,干质量1.8kg]的花盆中(盆径为l8am,盆高为20am),l株·盆~,盆栽苗置于温室中,在充足的水分条件下培养恢复1个月后实施控水处理。选取长势一致、枝条数相同的盆栽苗24盆,分别进行干旱胁迫处理,设正常浇水(对照,75%田问持水量)、轻度干旱(60%田问持水量)、中度干旱(40%田间持水量)和重度干旱(20%田间持水量)等4种处理,6盆·处理~。采用称量法控制土壤水分含量,每天傍晚进行称量并补充各处理消耗的水分。4d测定1次脂氧合酶活性,重复3次。干旱胁迫处理24d后,对重度干旱进行复水处理,每天测定脂氧合酶活性,复水共6d。‘1-2实验方法’酶液提取:称取迷迭香枝条第5~8片叶片0.5g,加入适量预冷的0.05mol·L的pH7.8磷酸缓冲溶液,充分冰浴研磨后,定容至25.0mL。4℃下1万r·min离心20min,回收上清液用于脂氧合酶活性测定,重复3次。脂氧合酶活性的测定参照Hatanaka等。加的方法。底物配制:将0.1mL吐温20加入到2.0mL0.2mol·L的硼酸缓冲液(pH9.0)中并混匀,滴加0.1mL亚油酸后充分混匀,再加入0.2mL1.0mol·L氢氧化钠溶液并保证此时的溶液澄清,然后加入上述硼酸缓冲液18.0mL,再加水定容至50.0mL,一20oC保存备用。3.0mL反应体系中含有0.1mL底物2.8mL磷酸缓冲液(0.1mol·L~,pH7.0)和0.1mL酶液,测定反应体系3min内在234nm波长处吸光度的变化。酶活性定义:234nm波长处,以亚油酸为底物,3.0mL反应体系吸光度1min增加0.1为1个酶活单位。1.3VOCs采集及分析方法VOCs的采集:干旱胁迫处理24d及复水第6天,选取株型相似、枝条数相同的迷迭香,3盆·处理,采用Qc.2型大气采样仪通过动态顶空气体循环采集法收集VOCs,气体流量0.1m3·min~,采样时间20min。采用TDS.GC—MS分析迷迭香VOCs成分。仪器及参数设置条件参照Gao等¨的方法。TDS(TD3型,GERSTEL,德国)工作条件:载气压力20kPa;进样口温度250oC;热脱附温度250oC,10min;冷阱温度一100℃,3min;进样时冷阱骤然升至260℃。\n浙江农林大学学报2014年4月20日GC(7890A型,Agilent,美国)工作条件:色谱柱为30mX250m×0.25m的HP一5MS柱;升温程序:初始温度40cc,保持4min后,以6℃·min速率升至250oC,保持3min后,以10oC·min的速率升至270℃,保持5min。MS(5975C型,Agilent,美国)工作条件:电力方式为EI,电子能量为70eV,质量范围为28--450,接口温度为280℃,离子源温度为230,四级杆温度为150℃。1.4数据分析。采用NIST2008谱库检索,采用峰面积表示VOCs成分的相对含量。使用Oringin8.0和SPSS软件进行数据处理、图表制作及统计分析,方差分析采用Duncan新复极差法。2结果和分析2.1脂氧合酶的变化不同强度的干旱胁迫处理对迷迭香脂氧合酶活性存在显著差异(P<0.05,图1)。轻度干旱处理的脂氧合酶活性与对照无显著差异;中度干旱和重度干旱处理16d和12d时,脂氧合酶活性达到最大值,与对照相比分别增加了0.96和1.04倍(P<0.01),随后脂氧合酶活性开始下降。复水后,脂氧合酶活性开始增加(图2),复水第1天脂氧合酶活性比未复水时增加9.2%,但仍低于对照;第2天脂氧合酶活性达到最大值,与对照相比增加了17.7%;复水第4天,脂氧合酶活性又下降到对照的91.2%,至复水第6天,脂氧合酶活性较第4天稍有增加,但仍低于对照。∞●.S烬髓Ⅱ口皿t/dt/d图l干旱胁迫对迷迭香脂氧合酶活性的影响图2复水对迷迭香脂氧合酶活性的影响Figure1Effects0fdroughtstressonLOXactivivinFigure2Effec~0fre—watenngohLOXaetivivinR∞e『rmofcind~Rosemarin~ofcind~2.2迷迭香VOCs成分分析采用TDS—GC.MS联用技术对不同干旱胁迫处理及复水后迷迭香释放的VOCs组分进行分析(图3),共鉴定出了57种化合物(表1)。轻度、中度、重度干旱处理的迷迭香VOCs总量分别是对照的99.2%,67.2%和43.2%:随着干旱胁迫程度的增加,轻度干旱、中度干旱、重度干旱各处理萜烯类总量下降,但其相对含量增加,与对照相比分别增加了14.4%,17.0%和23.7%,其中单萜相对含量与对照相比分别增加了21.9%,28.2%和37.2%;与对照相比,各干旱处理迷迭香醇类总量及相对含量均下降;对照、轻度干旱、中度干旱、重度干旱各处理的迷迭香酮类相对含量分别为15.28%,12.70%,18.30%,14.22%;各处理的迷迭香醛类相对含量均高于对照;干旱胁迫下新增加了10种物质,其中新增加了2种C6绿叶性气体(GLVs):2.己烯醛和叶醇;3种醛类化合物:2.己烯醛、山梨醛和癸醛。复水后,迷迭香VOCs总量与重度干旱相比增加了29.4%,为对照的55.3%;萜烯类和单萜类相对含量与对照相比分别增加了21.7%和33.3%,两者与重度干旱相比分别下降了1.8%和3.8%;醛类化合物释放总量及相对含量与对照和重度干旱相比均显著降低,醇类和酮类化合物释放量与重度干旱相比变化不显著。\n第31卷第2期刘芳等:干旱一复水处理对迷迭香挥发性有机化合物释放规律的影响2673讨论和结论脂氧合酶通过催化具有顺,顺一1,4一戊二烯结构的不饱和脂肪酸的加氧反应,生成含氧挥发性有机化合物(oxy—genatedvolatilehydrocarbons,OVOCs),其中包括绿叶性气体(GLVs)J。动物取食、病原菌侵害和机械损伤均能诱导植物大量释放GLVsl22剖,这些化合物都具有提高植物受损伤器官抵御细菌侵害的功能,可以作为植物体内的信号物质来增加防御,提高植物体的抗逆性~]。干旱胁迫诱导产生大量活性氧(reactiveoxygenspecies,ROS),活性氧破坏细胞膜结构,使得细胞内游离不饱和脂肪酸增加,进而促使脂氧合酶活性升高,催化产生大量的12OVOCs。本研究发现,随着干旱胁迫的进行,各处理的10呈8脂氧合酶活性均增加。在对挥发性有机化合物(VOCs)6各组分进行分析时发现,干旱诱导产生了3种醛类物质往4*2和2种C6一GLVs,这些物质的相对含量增加,这与脂氧[.L上O合酶活性增加呈现相关性;并且轻度干旱和中度干旱处理的3一2己0烯8一2_6酮4含量2明O显2高0于8对6照4,此2O时这2个处理的m8642O8642O脂氧合酶活性也高于对照,两者存在相关性;复水后,脂氧合酶活性降低,干旱胁迫诱导产生的2一己烯醛、山梨醛和癸醛也同时消失。轻度干旱处理酯类相对含量是对照的1.66倍,而中度干旱和重度干旱处理的酯类相对含量均下降,可能是因为轻度干旱下脂氧合酶活性最高,催化生成大量酯类,另一种可能的原因是,迷迭香体内具有储存VOCs的结构],轻度干旱下酯类物质储存结构中释放出来,而中度干旱和重度干旱处理储存的VOCs在干旱早期或已经释放,具体原因有待于进一步研究。萜烯类化合物是植物次生代谢产生的种类最多、释468l0I2l315l7l92l2325262830放量最大的VOCs,对植物体起到重要的保护作用,27]otimiI1本研究发现各干旱处理的迷迭香萜烯类百分含量均有较图3不同处理的迷迭香挥发性有机化合物大增加,一方面是因为萜类化合物沸点较低,干旱诱导总离子流图气孔关闭时,它们可以通过非气孔途径向外界排放副;另Figure3Totalioncurrentofvolatileorganiccompounds一方面,当非生物胁迫发生时,植物体内会通过增加萜(vOCs)ofRosemarinusoffcinalisunderdrought烯类化合物的释放来缓解胁迫压力,瑚]。Simpraga等stresses表1迷迭香挥发性有机化合物的主要成Table1Maincomponentsofthevolatileorganiccompounds(VOCs)fromRosemarinusoffcindis\n268浙江农林大学学报2014年4月2013\n第31卷第2期刘芳等:干旱一复水处理对迷迭香挥发性有机化合物释放规律的影响269说明:“一”表不未检测到化合物。在对欧洲山毛榉Fagussylvatica的研究中发现,停止浇水10d后,山毛榉净光合速率下降,几天之后单萜类的释放总量减少,但分配到单萜合成途径中碳的比例却是增加的,说明植物体能够通过增加单萜类的释放来降低光合氧化伤害;Lavoir等发现:干旱胁迫下冬青栎释放的单萜是对照处理的55%。本研究同样表明:各干旱处理单萜类释放总量均减少,但单萜类相对含量却随着干旱程度的加深呈现明显的增加趋势,说明迷迭香能够通过增加单萜类的释放来抵御干旱胁迫。综上所述:干旱能够诱导脂氧合酶酶活性增加,催化合成更多的GLVs及醛类VOCs;干旱导致迷迭香VOCs释放总量下降,却诱导迷迭香合成新的VOCs成分,且萜烯类的释放比例呈增加的趋势。研究表明:迷迭香能够通过增加GLVs、醛类和萜烯类化合物的释放来有效缓解干旱胁迫造成的伤害,提高迷迭香的抗旱性。园林植物在生长发育的过程中,不可避免的会受到环境的胁迫,而干旱胁迫是最常见的一种,研究园林植物的抗旱性机理对于园林植物的养护管理意义重大,并且,迷迭香VOCs的释放规律研究可以为迷迭香的园林配置,尤其是芳香植物园配置提供科学依据。参考文献:[1]NIINEMETSU.Responsesofforesttreestosingleandmultipleenvironmentalstressesfromseedlingstomatureplants:paststresshistory,stressinteractions,toleranceandacclimation[J].ForEcolManage,2010,260:1623—1639.[2]CRAMERGR,URANOK,DELROTS,eta1.Effectsofabioticstressonplants:asystemsbiologyperspective.BMCPlantBiol,2011,11:163.doi:10.1186/1471—2229—11-163.[3]LORETOF,SCHNITZLERJP.AbioticstressesandinducedBVOCs[J].TrendsPlantSci,2010,15(3):154—166.[4]BALDWINIT,HALITSCHKER,PASCHOLDA,eta1.Volatilesignalinginplant—plantinteractions:talkingtreesinthegenomicsera[J].Science,2006,311:812—815.[5]左照江,张汝民,高岩.植物间挥发物信号的研究进展[J].植物学报,2009,44(2):245—252.ZUOZha@ang.ZHANGRumin,GAOYan.Researchadvancesinvolatilesignalsamongplants[J].ChinBullBot,2009,44(2):245—252.,[6]林富平,周帅,马楠,等.4个桂花品种叶片挥发物成分及其对空气微生物的影响[J].浙江农林大学学报,2013,30(1):15—21.LINFuping,ZHOUShuai,MANan,et.VolatileorganiccompoundsinleavesofOsmanthus舸删andtheiref-\n270浙江农林大学学报2014年4月2O日fectonairbornemicroorganisms[J].JZhejiangA&FUniv,2013,30(1):15—21.[7]孑L垂华,徐涛,胡飞,等.环境胁迫下植物化感作用及其诱导机制[J1.生态学报,2000,20(5):849—854.KONGChuihua,XUTao,HUFei,eta1.Allelopathyunderenvironmentalstressanditsinducedmechanism[J].ActaEcolSin,2000,20(5):849—854.[8]THEISN,LERDAUM.Theevolutionoffunctioninplantsecondarymetabolites[J].IntJPlantSci,2003,164:93—102.[9]ARIMURAG,OZAWAR,KUGIMIYAS,eta1.Herbivore—induceddefenseresponseinamodellegume:two—spotedspidermites,tetranychusurticae,induceemissionof(E)一p·ocimeneandtranscriptaccumulationof(E)·p—ocimenesynthasinLotusjaponicus[J1.Plantsiol,2004,135:1976—1983.[10]TUMLINSONJH,LAIRCG.Biosynthesisoffattyacidamideelicitorsofplantvolatilesbyinsectherbivores[J].ArchInsectBiochemPhysiol,2005,58(2):54—68.[11]IBRAHIMMA,MAENPAAM,HASSINENV,eta1.Elevationofnight—timetemperatureincreasesterpenoidemis—sionsfromBetulapendulaandPopulustremula[J].JExpBot,2010,61:1583—1595.[12]HARTIKANINENK,NERGA,KIVIMAENPAAM,eta1.EmissionsofvolatileorganiccompoundsandleafstructuralcharacteristicsofEuropeanaspen(Populustremula)grownunderelevatedozoneandtemperature[J].TreePhysiol,2009,29:1163—1173.[13]KARIT,CURTISAJ,ROSENSTIELTN,eta1.Transientreleasesofacetaldehydefromtreeleaves—productsofapyruvateoverflowmechanism[J].PlantCellEnviron,2002,25:1121—1131.[14]STAUDTM,ENNAJAHA,MOUILLOTF,eta1.DovolatileorganiccompoundemissionsofTunisiancorkoakpopu—lationsoriginatingfromcontrastingclimaticconditionsdifferintheirresponsestosummerdrought[J].CanJForRes,2008,38:2965—2975.[15]LAVOIRAV,STAUDTM,SCHNITZLERJP,eta1.DroughtreducedmonoterpeneemissionsfromQuereusilextrees:resultsfromathroughfalldisplacementexperimentwithinaforestecosystem[J].BiogeosciDiscuss,2009,6:863—893[16]BLANCHJS,PENUELASJ,LLUSIAJ.Sensitivityofterpeneemissionstodroughtandfertilizationinterpene—storingP/nushdepensisandnon—storingQuereusilex[J1.PhysiolPlant,2007,131(2):211—225.[17]王珲,高慧媛,张振秋,等.中药迷迭香化学成分的分离与鉴定[J].中国现代中药,201l,13(1):23—25.WANGHui,GAOHuiyuan,ZHANGZhenqiu,eto1.IsolationandidentificationofchemicalconstituentsfromRos—marinusofficinalisLJ].ModernChinMed,2011,13(1):23—25.[18]袁干军,李沛波,杨慧.迷迭香中鼠尾草酸的抗MRSA活性研究[J].中国现代应用药学,2012,29(7):571—574.YUANGa~un,LIPeibo,YANGHui.Anti-MRSAactivityofcarnosicacidinrosemary.ChinJModApplm,2011,29(7):571—574.[19]黄宏妙,郭占京,卢汝梅,等.迷迭香挥发油提取工艺优化及其化学成分分析_J].湖北农业科学,2012,51(11):2321—2324HUANGHongmiao,GUOZhanjing,LURumei,eta1.Optimizationofextractiontechnologyofvolatileoilfromrose—maryandanalysisonthechemicalconstituentsofvolatileoil[J].HubeiAgricSci,2012,51(11):2321—2324.[20]HATANAKAA.Thebiogenerationofgreenodourbygreenleaves[J].Phytochemistry,1993,34(5):1201—1218.[21]GAOYan,JINyouju,LIHaidong,et.Volatileorganiccompoundsandtheirrolesinbacteriostasisinfiveconiferspecies[J1.JIntegratPlantBiol,2005,47(4):499—507.[22]LA0THAW0RNKITKULJ。PAULND,VICKERSCE,eta1.Isopreneemissionsinfluenceherbivorefeedingdeci—sions[J1.PlantCellEnviron,2008,31:1410—1415.[23]周帅,林富平,王玉魁,等.樟树幼苗机械损伤叶片对挥发性有机化合物及叶绿素荧光参数的影响[J].植物生态学报,2012,36(7):671—680.ZHOUShuai,LINFuping,WANGYukui,eta1.Effectsofmechanicaldamageofleavesonvolatileorganiccom—poundsandchlorophyllfluorescenceparametersinseedlingsofCinnarnomumcamphora[J].ChinJPlantEcol,2012,36(7):671—680.[24]VAAHTERAL,BROSCHEM.Morethanthesumofitsparts—howtoachieveaspecifictranscriptionalresponseto\n第31卷第2期刘芳等:干旱一复水处理对迷迭香挥发性有机化合物释放规律的影响]J]j]J]J1●J1如Jabioticstress[J].PlantSci,201l,180(3):421—430.BRUCETJA,WADHAMSLJ,WO0DC0CKCM.Insecthostlocation:avolatilesituation[J].TrendsHamSci,2005,lO(6):269—274.左照江,张汝民,王勇,等.冷蒿挥发性有机化合物主要成分分析及其地上部分结构研究[J].植物生态学报,2010,34(4):462—468.ZUOZhaojiang,ZHANGRumin,WANGYong,eta1.AnalysisofmainvolatileorganiccompoundsandstudyofabovegroundstructuresinArtemisiafrigida[J3.ChinJPlantEcol,2010,34(4):462—468.NIINEMETSU,LORETOF,REICHSTEINM.Physiologicalandphysicochemicalcontrolsonfoliarvolatileorganiccompoundemissions[J].TrendsHamSci,2004,9(4):180—186.BRILLIF.BARTAC.FORTUNATIA,eta1.Responseofisopreneemissionandcarbonmetabolismtodroughtinwhitepoplar(Populusalba)saplings[J].Newol,2007,175:244—254.SIMPRAGAM.VERBEECKH,DEMARCKEM。eta1.Clearlinkbetweendroughtstress,photosynthesisandbio—genicvolatileorganiccompoundsinFagussylvaticaL.[J].AtmosphericEnviron,2011,45:5254—5259.DELFINES,LORETOF,PINELLIP,eta1.Isoprenoidscontentandphotosyntheticlimitationsinrosemaryandspearmintplantsunderwaterstress[J].AgricEcosystEnviron,2005,106:243—252.浙江农林大学在加纳合作共建竹加工企业2013年l2月8日,浙江农林大学非洲农林研究院、浙江德清莫干山竹胶板有限公司和加纳GWIRA地区传统管理委员会三方在德清签署“关于在加纳共和国共建竹加工示范企业的合作框架协议”。这项协议的签署,标志着中国首家竹产业合作示范工厂落户西非加纳共和国的工作迈出了坚实的一步。。框架协议的主要目标是通过三方联合,在技术研究、政策、与当地土著居民合作以及中国境外企业绿色发展的研究和示范方面形成优势互补、相互支持和互利互惠的合作格局,实现该示范企业的正常生产和运转,实现企业赢利,带动当地就业和居民增收,同时提高企业履行社会责任的意识,树立中国在非企业负责任和绿色发展的形象。根据这一协议,三方将着重在推动加纳竹产业政策制定和改革、提高竹子企业社会责任和环境保护意识、开展人员培训和能力建设、开展竹子加工和培育技术的适应性研究等4个方面开展工作。据介绍,该竹加工企业将建设成为中国境外企业由消耗木材等自然资源到绿色可持续发展的转变、中国绿色竹产业在非洲落地和发展的示范工厂。非洲农林研究院新闻中心