- 1.58 MB
- 2023-01-02 08:31:22 发布
- 1、本文档共5页,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
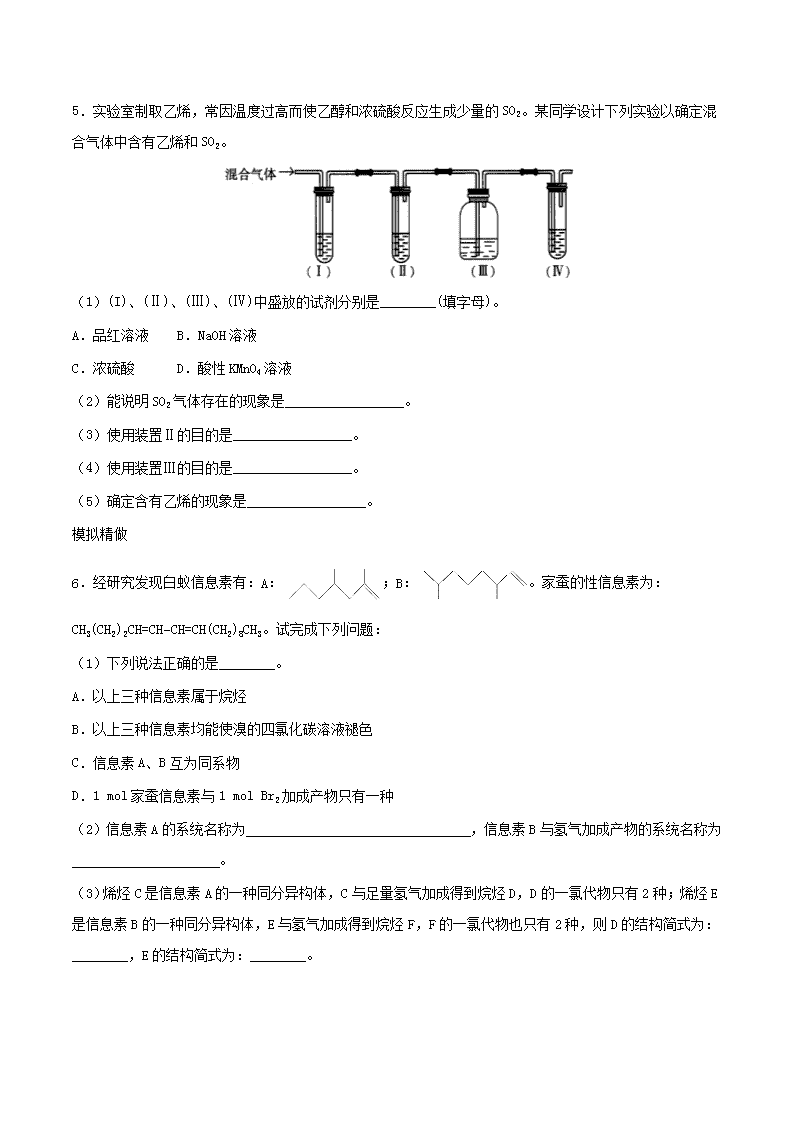
- 文档侵权举报电话:19940600175。
第二章烃和卤代烃第一节脂肪烃第1课时烷烃和烯烃经典精做1.汽车使用的燃料主要是汽油,汽油是多种烃类的混合物,其中一种烃的蒸气密度为相同状况下氢气密度的57倍,其分子中碳元素的质量分数为84.2%。(1)则该烃的分子式是 。(2)该烃的某种同分异构体的一氯代物只有一种,它的结构简式为 ,用系统命名法命名为 。2.(1)相对分子质量为70的烯烃的分子式为 ;若该烯烃与足量的H2加成后能生成含3个甲基的烷烃,则该烯烃可能的结构简式为 。(2)有机物A的结构简式为,若A是单烯烃与氢气加成后的产物,则该单烯烃可能有 种结构;若A是炔烃与氢气加成后的产物,则此炔烃可能有 种结构。3.2-丁烯是石油裂解的产物之一,回答下列问题:(1)在催化剂作用下,2-丁烯与氢气反应的化学方程式为 ,反应类型为 。(2)烯烃A是2-丁烯的一种同分异构体,它在催化剂作用下与氢气反应的产物不是正丁烷,则A的结构简式为 ;A分子中能够共平面的碳原子个数为 ,A与溴的四氯化碳溶液反应的化学方程式为 。4.0.1mol某种烯烃或两种烯烃的混合物(碳原子数均不超过5)充分燃烧后,生成的二氧化碳完全被300mL2mol/L的NaOH溶液吸收,所得溶液中含有两种物质的量相等的溶质。(1)若为纯净物,试推断可能的烯烃分子式:①________;②________;③________(可以不填满,也可以补充)。(2)若为两种烯烃的混合物,试推断可能的组成及体积比(可以不填满,也可以补充)。序号组成(填分子式)体积比123\n5.实验室制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的SO2。某同学设计下列实验以确定混合气体中含有乙烯和SO2。(1)(I)、(Ⅱ)、(Ⅲ)、(Ⅳ)中盛放的试剂分别是________(填字母)。A.品红溶液B.NaOH溶液C.浓硫酸D.酸性KMnO4溶液(2)能说明SO2气体存在的现象是_________________。(3)使用装置Ⅱ的目的是_________________。(4)使用装置Ⅲ的目的是_________________。(5)确定含有乙烯的现象是_________________。模拟精做6.经研究发现白蚁信息素有:A:;B:。家蚕的性信息素为:CH3(CH2)2CH=CH−CH=CH(CH2)8CH3。试完成下列问题:(1)下列说法正确的是________。A.以上三种信息素属于烷烃B.以上三种信息素均能使溴的四氯化碳溶液褪色C.信息素A、B互为同系物D.1mol家蚕信息素与1molBr2加成产物只有一种(2)信息素A的系统名称为 ,信息素B与氢气加成产物的系统名称为 。(3)烯烃C是信息素A的一种同分异构体,C与足量氢气加成得到烷烃D,D的一氯代物只有2种;烯烃E是信息素B的一种同分异构体,E与氢气加成得到烷烃F,F的一氯代物也只有2种,则D的结构简式为:________,E的结构简式为:________。\n7.下面是某课外活动小组在实验室模拟沼气池发酵制取沼气,收集较纯净的甲烷并测定产生甲烷体积的实验。如图,甲瓶是产生沼气的发酵瓶,将牛、马粪按比例均匀拌入沼气菌种,放进发酵瓶甲内并加满水;乙瓶中充满水;丙瓶内盛有X溶液;丁为量筒。(1)按实验要求,将四个装置a〜f各个导管口连接起来,其正确的顺序是a→__________→__________→__________→___________→(填接口序号)。(2)丙瓶内盛有的X溶液为____________(填序号)。A.浓氨水 B.NaOH溶液 C.CuSO4溶液 D.盐酸(3)若要验证CH4中含有H2S气体,要在甲装置后增加一个洗气瓶装置,该装置中的试剂可能是____________(填序号)。A.浓氨水B.NaOH溶液C.CuSO4溶液D.盐酸8.实验室用浓硫酸与乙醇混合加热至170℃制取乙烯。(1)实验中反应液变黑,产生SO2、CO2等气体,写出产生此气体的化学反应方程式: 。(2)为避免上述问题,现改用P2O5(一种固体粉末,实验室常用作干燥剂和脱水剂)与无水乙醇共热制备乙烯,并探究乙烯与溴反应的实质,实验装置如图所示。P2O5在此实验中的作用是作 ,装置B中装有蒸馏水,该装置的作用有两个,一是吸收装置A中可能产生的乙醇蒸气,二是 。(3)利用装置D和E对乙烯与溴的反应进行定性探究,请完成相关实验设计。可供选择的试剂有:0.1mol·L-1溴水、0.1mol·L-1溴的四氯化碳溶液、0.01mol·L-1KMnO4溶液、AgNO3溶液。\n实验方案:在试管D中加入适量 ,试管E中加入适量 ,持续通入乙烯一段时间后,若观察到D中溶液 ,E中溶液 ,说明该反应为加成反应。(4)有人设计了另一探究方案,在如图所示的装置中,烧瓶内已事先收集好一瓶乙烯气体,滴管中预先装有浓溴水,实验时 (填写有关操作方法),然后打开止水夹a,可观察到烧杯中的蒸馏水进入烧瓶中,说明该反应是加成反应。答案与解析1.【答案】(1)C8H18(2)2,2,3,3-四甲基丁烷【解析】本题的关键是通过理论数据计算烃的分子式;通过实验事实、现象推断烃的同分异构体的结构简式,一氯代物只有一种的烃分子应是分子结构高度对称的分子。该烃的相对分子质量为57×2=114。故分子中的碳原子数为≈8,分子中的氢原子数为=18,所以该烃的分子式为C8H18。烷烃的一氯代物只有一种,那么其分子结构中连有氢原子的碳一定是—CH3,所以可得一氯代物只有一种的烃的结构简式为,其名称为2,2,3,3-四甲基丁烷。2.【答案】(1)C5H10、、(2)51【解析】(1)由M(CnH2n)=70,14n=70,n=5,得该烯烃的分子式为C5H10;该烯烃加成后所得的产物(烷烃)中含有3个甲基,表明在烯烃分子中只含有一个支链。当主链为4个碳原子时,支链为1个—CH3,此时烯烃的碳骨架结构为,其双键可在①、②、③三个位置,有3种可能的结构。\n(2)有机物A的碳骨架结构为,其双键可处于①、②、③、④、⑤五个位置,而三键只能处于①一个位置。3.【答案】(1)CH3CH=CHCH3+H2CH3CH2CH2CH3加成反应(2)4+Br2【解析】本题主要考查烯烃的化学性质、烯烃的同分异构体、有机反应类型及有机分子中原子间的位置关系。2-丁烯与氢气反应得到正丁烷,属于加成反应。2-丁烯的同分异构体有1-丁烯、2-甲基丙烯,加氢后前者得到正丁烷,后者得到2-甲基丙烷,根据题给条件,A应是2-甲基丙烯(),4个碳原子都在同一平面内。4.【答案】(1)①C2H4②C4H8(2)序号组成(填分子式)体积比1C2H4、C5H101:22C3H6、C5H101:13C4H8、C4H8(互为同分异构体)任意比【解析】(1)n(NaOH)=0.3L×2mol/L=0.6mol,所得到的溶液中的成分有如下两种情况:①Na2CO3和NaOH的混合物,假设生成的Na2CO3和剩余的NaOH的物质的量都是x,则根据钠元素守恒,有:2x+x=0.6mol,解得x=0.2mol,所以n(C)=0.2mol,n(烯烃):n(C)=0.1mol:0.2mol=l:2,所以该烯烃为C2H4。②Na2CO3和NaHCO3的混合物,假设生成的Na2CO3和NaHCO3的物质的量都是x,则根据钠元素守恒,有:2x+x=0.6mol,解得x=0.2mol,所以n(C)=0.2mol+0.2mol=0.4mol,n(烯烃):n(C)=0.1mol:0.4mol=l:4,所以该烯烃为C4H8。\n(2)若为两种烯烃的混合物,则烃分子中的平均碳原子数为2或4,因为乙烯是最简单的烯烃而且只有一种结构,所以烃分子中的平均碳原子数只能为4。根据平均值的特点可以判断,混合物有如下三种可能的组成:①C5H10和C2H4,②C5H10和C3H6,③C4H8和C4H8(互为同分异构体),此情况下两种烃以任意比混合。判断前两种情况下气体的体积比,可以用十字交叉法:所以V(C2H4):V(C5H10)=l:2,V(C3H6):V(C5H10)=l:1。5.【答案】(1)ABAD(2)装置I中品红溶液颜色变浅或褪去(3)除去SO2气体(4)检验SO2是否除尽(5)装置(Ⅲ)中品红溶液不褪色,装置(Ⅳ)中酸性KMnO4溶液褪色【解析】(1)检验SO2要用品红溶液,检验CH2=CH2要用酸性KMnO4溶液,若先检验CH2=CH2,因为SO2也能使酸性KMnO4溶液褪色,会干扰CH2=CH2的检验,所以先检验SO2,再把其除去,再检验SO2是否除尽,最后检验CH2=CH2的存在,故(I)、(Ⅱ)、(Ⅲ)、(Ⅳ)中所放试剂顺序为A、B、A、D。(2)装置(I)中的品红溶液颜色变浅或褪去,可说明SO2的存在。(3)装置(Ⅱ)中的NaOH溶液是为了除去SO2,避免后面干扰CH2=CH2的检验。(4)装置(Ⅲ)是为了检验SO2是否除尽。(5)装置(Ⅲ)中品红溶液不褪色,装置(Ⅳ)中酸性KMnO4溶液褪色,可证明CH2=CH2的存在。6.【答案】(1)BC(2)2,4-二甲基-1-庚烯2,6-二甲基辛烷(3)【解析】(1)三种信息素都含有碳碳双键,属于烯烃;烯烃能使溴的四氯化碳溶液褪色;A、B结构相似且分子组成上相差一个―CH2原子团,二者属于同系物;家蚕信息素含有类似1,3-丁二烯的结构,与1molBr2加成产物有2种。故选项B、C正确。(2)根据烯烃命名原则,A的名称为2,4-二甲基-1-庚烯。与H2发生加成反应生成烷烃,其名称为2,6-二甲基辛烷。\n(3)根据题设条件,D的一氯代物只有2种,说明D分子含有对称的―CH2CH3,故D的结构简式为。F的一氯代物也只有2种,F为,反推可得E为。7.【答案】(1)decb(2)B(3)C【解析】从题目所给试验装置看:应用甲装置产生甲烷,考虑到CH4中混有CO2、H2S等酸性气体杂质,可先用碱液除杂,然后排水、量水,利用量筒中水的体积计算CH4的体积。要验证CH4中混有H2S气体,要求选取的试剂与CH4不反应,但能和H2S反应,并有明显的实验现象,通常选用CuSO4溶液。8.【答案】(1)C+2H2SO4(浓) CO2↑+2SO2↑+2H2O (2)脱水剂和干燥剂将可能产生的乙醚冷凝为液体 (3)溴的四氯化碳溶液 AgNO3溶液 褪色 无沉淀生成 (4)将滴管内的浓溴水挤入烧瓶并振荡【解析】(1)发生的反应为C+2H2SO4(浓) CO2↑+2SO2↑+2H2O。(2)乙醇制乙烯是脱水反应,题干中也说到P2O5在实验室的作用是作干燥剂和脱水剂,所以在此实验中P2O5的作用应为脱水剂和干燥剂(吸水有利于平衡右移)。装置B中的蒸馏水可以溶解蒸发出来的乙醇蒸气,也可将可能产生的乙醚冷凝为液体。(3)乙烯与溴发生的反应是取代反应还是加成反应,可从产物中有无溴化氢进行判断。由于溴化氢易溶于水,应选用溴的四氯化碳溶液,并在E中用AgNO3溶液检验是否有HBr产生。(4)该实验的原理是若发生加成反应,则气体体积缩小;若发生取代反应,则气体体积不变。将滴管中的浓溴水挤入烧瓶中后打开止水夹,若烧杯中的水倒流进入烧瓶中,则说明气体体积减小,发生的是加成反应。贵金属“制造厂”宇宙中比铁更重的元素,即超铁元素,如金、银等,无法在恒星内部产生。有科学家提出,中子星碰撞产生一类新的爆发现象——巨新星,它意味着发现了超铁元素的起源地。以中国科学家为首的一个研究团队最近重新系统分析了伽玛暴GRB060614的观测数据,第二次在宇宙范围内发现巨新星信号,GRB060614也成为宇宙中又一处黄金、白银等贵重金属“制造厂”。第一节脂肪烃\n第2课时炔烃脂肪烃的来源及其应用经典精做1.某有机化合物的结构简式如下,分析其结构并回答下列问题。(1)写出其分子式: 。(2)分子中含有 个不饱和碳原子,分子中有 种双键。(3)分子中的极性键有 。(4)分子中的饱和碳原子有 个;一定与苯环处于同一平面的碳原子(包括苯环上的碳原子)有 个。(5)分子中的键角为 。2.以乙炔为主要原料可以合成聚氯乙烯、聚丙烯腈和氯丁橡胶,下图所示是有关合成路线图。已知反应:nCH2=CH−CH=CH2请完成下列各题:(1)写出物质的结构简式A________,C________。(2)写出反应的化学方程式反应②________________________________;反应③________________________________;反应⑥_________________________________。\n3.某烃A,相对分子质量为140,其中碳的质量分数为0.857。A分子中有两个碳原子不与氢直接相连。A在一定条件下氧化只生成G,G能使石蕊试液变红。已知:+R3COOH试写出:(1)A的分子式________。(2)化合物A和G的结构简式:A________________、G________________。(3)与G同类的同分异构体(含G)可能有________种。4.如图中的实验装置可用于制取乙炔。请填空:(1)图中,A管的作用是_____________________,制取乙炔的化学方程式是_____________________,为避免反应太迅速,可采取的措施为___________。(2)乙炔通入酸性KMnO4溶液中观察到的现象是___________,乙炔发生了___________反应。(3)乙炔通入溴的CCl4溶液中可观察到的现象是___________,乙炔发生了___________反应。(4)为了安全,点燃乙炔前应___________,乙炔燃烧时的实验现象是___________。模拟精做5.用电石制备的乙炔气体中常混有少量H2S气体。请用图中仪器和药品组成一套制备并净化乙炔的装置,并可通过测定乙炔的量,从而计算电石纯度。\n(1)进行实验时,所制气体的流向为从左向右,仪器的正确连接顺序是 (填接口字母)。(2)为了使实验装置中气流平稳,甲中分液漏斗里的液体通常为 。(3)若在标准状况下溴水与乙炔完全反应生成C2H2Br4,已知称取的电石为mg,测得量筒内液体的体积为VmL(气体状态为标准状况),则电石的纯度可表示为 (列式即可)。(4)若没有除去H2S的装置,则测定结果将会 (填“偏高”“偏低”或“不变”),理由是 (用化学方程式表示)。6.如图是实验室中乙炔的制取和性质检验实验装置的一部分。(1)写出反应生成乙炔的化学方程式: 。(2)实验中用饱和食盐水代替水(实际上还可以用乙醇水溶液代替水),这样做的目的是 。(3)CuSO4溶液可以除去乙炔中混有的H2S、PH3等杂质气体,高锰酸钾酸性溶液也可以除去这些杂质,但不能用高锰酸钾酸性溶液代替CuSO4溶液,原因是 。(4)点燃不纯的乙炔气体可能会发生爆炸,点燃乙炔前应先进行的操作是 。也可在点燃前连接一个安全装置以防止意外。如图所示装置中能起到此作用的是 。\n答案与解析1.【答案】(1)C16H16O5(2)122(3)H—C、H—O、O—C、C=O(4)410(5)180°【解析】(1)分析该有机物的结构简式,可知其分子式为C16H16O5。(2)苯环上的6个碳原子,碳碳双键上的2个碳原子,碳碳三键上的2个碳原子,酯基中的1个碳原子以及羧基中的1个碳原子,均为不饱和碳原子,共12个。该分子中有C=C、C=O两种双键。(3)分子中的极性键有H—C、H—O、O—C、C=O。(4)1个—CH3、2个―CH2―和1个中的碳原子为饱和碳原子,共4个。结合乙炔的直线形结构和苯的平面结构可知该有机物中一定与苯环处于同一平面的碳原子(包括苯环上的碳原子)有10个。(5)的键角为180°。【备注】在判断有机物中的原子共线、共面等问题时,需要牢牢掌握饱和碳原子的四面体结构、碳碳双键的平面结构、碳碳三键的直线形结构及苯环的平面结构,然后结合单键可以绕键轴旋转而碳碳双键和碳碳三键不能旋转进行分析。2.【答案】(1)CH2=CHCl CH≡C−CH=CH2(2)nCH2=CHClCH≡CH+HCNCH2=CH−CNCH≡CH−CH=CH2+HCl\n【解析】由合成路线图进行正推(由反应物→产物)和反推(由产物→反应物)。如由A,可推A为CH2=CHCl(氯乙烯),由A可推反应①为CH≡CH+HClCH2=CHCl。再如根据加成原理,可写出反应③为:CH≡CH+HCNCH2=CHCN。3.【答案】(1)C10H20(2)(3)4【解析】(1)计算C原子数:=10,计算H原子数:=20,分子式为C10H20。(2)A分子中有两个碳原子不与氢直接相连,又由A氧化只生成G,便可确定A的结构简式。(3)G的分子结构中含有一个羧基(—COOH),因此丁基有几种,则G有几种同分异构体。4.【答案】(1)调节水面高度以控制反应的发生和停止CaC2+2H2OCa(OH)2+C2H2↑把水换成饱和食盐水(2)酸性KMnO4溶液褪色 氧化(3)溴的CCl4溶液褪色 加成(4)检验乙炔的纯度 火焰明亮并伴有浓烈的黑烟【解析】由图可以看出A管通过橡胶软管与右侧相连,A管的高低可调节右管中的水是否与电石接触,从而控制反应发生。若反应太快,可把水换成饱和食盐水。乙炔易被酸性高锰酸钾氧化,而使高锰酸钾酸性溶液褪色。乙炔还可与溴发生加成反应,生成无色的溴代烃,使溴的CCl4溶液褪色。可燃性气体点燃前都应检验纯度。由于乙炔的含碳量较髙,所以燃烧时火焰明亮并伴有浓烈的黑烟。5.【答案】(1)AHGEFDCB(2)饱和食盐水(3)×100%(4)偏高H2S+Br2S↓+2HBr【解析】由题意可知,电石与足量水反应生成乙炔,其中混有的H2S可用NaOH溶液吸收,乙炔气体被溴水吸收后余下的部分通过排水法测量其体积。设CaC2的物质的量为x,电石纯度计算过程如下:\n则x=(+0.001)mol,w(CaC2)=×100%。6.【答案】(1)CaC2+2H2OCa(OH)2+C2H2↑(2)减缓反应速率 (3)高锰酸钾酸性溶液也能氧化乙炔 (4)验纯 b【解析】(2)碳化钙与水反应的速率极快,为了减缓反应速率,可用饱和食盐水代替水。(3)高锰酸钾酸性溶液能将硫化氢、乙炔等氧化,也能氧化乙炔。(4)气体应“长进短出”,排除c、d。但a装置中进气管和出气管均在液面上方,一旦发生爆炸,会将发生装置中的气体引燃,b装置则可以避免这种情况出现。二氧化碳变身碳纤维美国乔治·华盛顿大学的一个研究团队开发出一种将温室气体二氧化碳直接转化成在工业和消费领域都十分紧俏的碳纤维技术。这种技术高效、低能耗,有充足的阳光和大量的二氧化碳即可,通过电解合成纳米纤维:在750℃装有熔融碳酸盐的高温电解槽中,通过镍和钢电极的热及直流电使二氧化碳溶解,碳纳米纤维可以在钢电极形成。第二章烃和卤代烃第二节芳香烃经典精做1.有4种无色液态物质:己烯、己烷、苯和甲苯,符合下列各题要求的分别是:(1)不能与溴水或酸性KMnO4溶液反应,但在铁屑作用下能与液溴反应的是________,生成的有机物名称是__________,反应的化学方程式为:______________________,此反应属于________反应。(2)不能与溴水和酸性KMnO4溶液反应的是________。(3)能与溴水和酸性KMnO4溶液反应的是________。\n(4)不与溴水反应但能与酸性KMnO4溶液反应的是________。2.乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物。完成下列各题:(1)正四面体烷的分子式为_________,其二氯取代产物有_________种。(2)关于乙烯基乙炔分子的说法错误的是_________。a.能使酸性KMnO4溶液褪色b.1mol乙烯基乙炔能与3molBr2发生加成反应c.乙烯基乙炔分子内含有两种官能团d.等质量的乙炔与乙烯基乙炔完全燃烧时的耗氧量不相同(3)写出与苯互为同系物且一氯代物只有两种的物质的结构简式(举两例):_________、_________。3.如图所示A~G是几种烃分子的球棍模型,据此回答下列问题:(1)常温下含碳量最高的气态烃是 (填字母)。(2)能够发生加成反应的烃有 种。(3)一卤代物种类最多的是 (填字母)。(4)写出F发生硝化反应的化学方程式: 。(5)写出由D生成聚合物的反应方程式: 。4.现有A、B、C三种烃,其比例模型如图:\n(1)B所含官能团的名称为________。(2)等质量的以上三种物质完全燃烧时耗氧的量最多的是________(填对应字母,下同);生成二氧化碳最多的是________,生成水最多的是________。(3)1molA、B混合物完全燃烧生成H2O的物质的量为________________。(4)在120℃、1.01×105Pa下,有两种气态烃和足量的氧气混合点燃,相同条件下测得反应前后气体体积没有发生变化,这两种气体是________。5.实验室用苯和浓硝酸、浓硫酸发生反应制取硝基苯的装置图如图所示。回答下列问题:(1)反应需在50~60℃的温度下进行,图中给反应物加热方法是___________________,它的优点是_____________和___________________。(2)在配制混合酸时应将____________加入________中。(3)该反应的化学方程式是________________________。(4)由于装置的缺陷,该实验可能导致的不良后果是_________________。(5)反应完毕后,除去混合酸,所得粗产品用如下操作精制:①蒸馏 ②水洗 ③用干燥剂干燥 ④10%NaOH溶液洗 ⑤水洗,其中正确的操作顺序是______。A.①②③④⑤B.②④⑤③①C.④②③①⑤ D.②④①⑤③6.某化学课外小组用如图所示装置制取溴苯。先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中。\n(1)写出A中反应的化学方程式 。(2)观察到A中的现象是 。(3)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是 。写出有关反应的化学方程式 。(4)要证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入AgNO3溶液,若产生淡黄色沉淀,则能证明。另一种验证的方法是向试管D中加入 ,现象是 。模拟精做7.苯的同系物中,有的侧链能被酸性高锰酸钾溶液氧化生成芳香酸,反应如下:(R、R'表示烃基或氢原子)(1)现有苯的同系物甲、乙,分子式都是C10H14。甲不能被酸性高锰酸钾溶液氧化生成芳香酸,则甲的结构简式是 ;乙能被酸性高锰酸钾溶液氧化生成分子式为C8H6O4的芳香酸,则乙可能的结构有 种。(2)有机物丙也是苯的同系物,分子式也是C10H14,它的苯环上的一溴代物只有一种。试写出丙所有可能的结构简式: 。8.已知某有机化合物只由碳、氢两种元素组成,其摩尔质量为128g·mol-1。回答下列问题:(1)若该有机化合物分子中无碳碳不饱和键,则该有机化合物的分子式为 ,其同系物中摩尔质量最小的有机化合物的名称为 。(2)若该有机化合物分子中含有的碳碳不饱和键只有碳碳双键和碳碳三键,且该链烃分子中碳碳三键的数目已确定,请在下表中填写对应分子中所含碳碳双键的数目。碳碳三键数目123碳碳双键数目\n(3)若该有机化合物分子中含有碳碳不饱和键,则其分子式为 ,分子结构中含有一个苯环、一个碳碳双键和一个碳碳三键,且苯环上有两个取代基,取代基处于邻位的有机化合物的结构简式为 ;若分子结构中含有两个苯环,则该有机化合物的结构简式为 。9.自20世纪90年代以来,芳炔类大环化合物的研究发展十分迅速,具有不同分子结构和几何形状的这一类物质在高科技领域有着十分广泛的应用前景。合成芳炔类大环化合物的一种方法是以苯乙炔()为基本原料,经过反应得到一系列的芳炔类大环化合物,其结构为:(1)上述系列中第1种物质的分子式为__________。(2)以苯乙炔为基本原料,经过一定反应而得到最终产物。假设反应过程中原料无损失,理论上消耗苯乙炔与所得芳炔类大环化合物的质量比为__________。10.蒽()与苯炔()反应生成化合物X(立体对称图形),如下图所示:(1)蒽与X都属于________。a.环烃 b.烃 c.不饱和烃(2)苯炔的分子式为____________,苯炔不具有的性质是____________。a.能溶于水 b.能发生氧化反应c.能发生加成反应 d.常温常压下为气体(3)下列属于苯的同系物的是________(填字母)。\n(4)下列物质中,能发生加成反应,也能发生取代反应,同时能使溴水因加成反应而褪色,还能使酸性高锰酸钾溶液褪色的是__________。11.请写出如图中②④⑤三步反应的化学方程式。已知,在苯环上,—Br是邻、对位定位基,—NO2为间位定位基。②________________________________;④________________________________;⑤________________________________。12.已知:①R—NO2R—NH2;②苯环上的取代基对新导入的取代基进入苯环的位置有显著的影响。如图表示以苯为原料制备一系列有机物的转化过程:(1)A是一种密度比水 (填“大”或“小”)的无色液体,苯转化为A的化学方程式是 。\n(2)在“苯CD”的转化过程中,属于取代反应的是 (填序号,下同),属于加成反应的是 。(3)图中“苯→E→F”的转化过程省略了反应条件,请写出E的结构简式: 。(4)有机物B苯环上的二氯代物有 种结构;的所有原子 (填“在”或“不在”)同一平面上。13.有机热载体具有较好的热稳定性、不易腐蚀管道设备、传送阻力小等优点,但温度超过80℃时,需隔绝空气,温度过高易出现结焦现象。有机热载体可分为石蜡基碳氢化合物(饱和烷烃)、环烷烃碳氢化合物、芳香烃碳氢化合物三类。根据以上信息和相关知识回答下列问题:(1)下列说法正确的是 。A.有机热载体在传递热量过程中自身发生了变化从而提高了热效率B.石蜡基碳氢化合物能使酸性KMnO4溶液褪色C.有机热载体工作温度越高越好D.有机热载体在传递热量过程中需隔离空气(2)工业上将苯蒸气通过赤热的铁合成一种新型有机热载体,其分子中苯环上的一氯代物有3种,1mol该化合物催化加氢时最多消耗6molH2。①该有机热载体是 。A. B.C. D.②下列关于该有机热载体的说法正确的是 。A.苯蒸气合成该有机热载体的反应属于加成反应B.该有机热载体与苯互为同系物C.该有机热载体能与溴水发生取代反应D.该有机热载体所有原子可能在同一平面内\n③有机物与溴的四氯化碳溶液反应的化学反应方程式为 。(3)某有机热载体为苯的同系物,取一定质量的该有机物完全燃烧,生成的气体依次通过浓硫酸和碱石灰,经测定,前者质量增加10.8g,后者质量增加39.6g(设均为完全吸收)。又知经氯化处理后,该苯的同系物苯环上的一氯代物、二氯代物、三氯代物都只有一种。①推断该苯的同系物的分子式为____________。②写出该有机物在催化剂作用下与液溴反应生成一溴代物的化学方程式 。答案与解析1.【答案】(1)苯溴苯+Br2+HBr取代(2)苯、己烷(3)己烯(4)甲苯【解析】己烯、己烷、苯、甲苯四种物质中,既能和溴水反应,又能和酸性KMnO4溶液反应的只有己烯。均不反应的为己烷和苯。不能与溴水反应但能被酸性KMnO4溶液氧化的是甲苯。苯在铁的催化作用下与液溴发生取代反应生成溴苯。2.【答案】(1)C4H41(2)d(3)【解析】此题是一道考查烃性质的有机题。根据碳可形成4对共用电子对,可知正四面体烷的分子式为C4H4,根据其对称性可知,二氯代物只有1种。每个乙烯基乙炔分子中含有一个碳碳双键、一个碳碳三键,因此a、b、c正确。乙烯基乙炔和乙炔含碳量和含氢量相同,等质量的两种物质完全燃烧耗氧量相等。一氯代物只有两种的苯的同系物,在结构上应具有较好的对称性,一氯取代时,可以取代苯环上的氢,也可以取代侧链上的氢。3.【答案】(1)D (2)4 (3)G (4)+HO—NO2+H2O (5)\n【解析】根据球棍模型可知A为甲烷;B为乙烷;C为乙烯;D为乙炔;E为丙烷;F为苯;G为甲苯。(1)除苯和甲苯外,其他都是气态烃。将各烃的化学式都设为CHx,得:A.CH4;B.CH3;C.CH2;D.CH;E.CH8/3。x的值越小,含碳量越高。显然乙炔含碳量最高。(2)能够发生加成反应的烃是乙烯、乙炔、苯和甲苯。(3)一卤代物数目:A、B、C、D、F的一卤代物均只有1种,G的一卤代物有4种,丙烷的一卤代物有2种。4.【答案】(1)碳碳双键 (2)A C A (3)2mol (4)A、B【解析】(1)(2)A、B、C三种物质分别为甲烷、乙烯、苯,根据它们燃烧的方程式便可确定相关量的关系。(3)可以根据质量守恒进行求解,A(CH4)、B(C2H4)分子中所含氢原子数均为4,1molA、B混合物中氢原子物质的量为4mol,完全燃烧生成水的物质的量为2mol。(4)分子中氢原子个数为4的气态烃完全燃烧,在1.01×105Pa下,若温度高于100℃,则气体的体积在燃烧前后不变。5.【答案】(1)水浴加热 便于控制温度 受热均匀(2)浓硫酸 浓硝酸(3)+HNO3(浓)+H2O(4)苯、硝酸等挥发到空气中,造成污染(5)B【解析】本题以苯的硝化反应为载体,考查了一些基本实验知识。水浴加热法的优点应是考生熟知的;配制混合酸时应将密度大的浓硫酸加入密度小的浓硝酸中;由于苯和硝酸都是易挥发且有毒的物质,设计实验装置时应该考虑它们可能产生的污染和由挥发导致利用率降低的问题;所得粗产品中可能还混有少量酸,若直接用NaOH溶液洗则太浪费药品,因此应用在NaOH溶液洗之前用水洗。6.【答案】(1)2Fe+3Br22FeBr3 C6H6+Br2C6H5Br+HBr(2)反应液微沸,有红棕色气体充满A容器(3)除去溶于溴苯中的溴 Br2+2NaOHNaBr+NaBrO+H2O(4)紫色石蕊溶液 溶液变红色(其他合理答案也可)【解析】(1)A中的反应包括Br2与Fe反应生成FeBr3,苯与溴在FeBr3催化作用下的取代(溴代)反应。(2)由于苯与溴在催化剂作用下的反应是放热反应,而苯、溴的沸点较低,所以混合液呈沸腾状态,A中充满苯蒸气和溴蒸气,溴蒸气呈红棕色。(3)\n反应后,生成的溴苯中因溶解有未反应完的溴而呈褐色,可以用NaOH溶液除去溴苯中的溴。(4)生成的HBr溶于水后呈酸性,所以检验时,可以检验Br-,也可以检验H+。7.【答案】(1) 9 (2)、、、【解析】能被氧化为芳香酸的苯的同系物必须具备一个条件:与苯环直接相连的碳原子上要有氢原子。由此可推出甲的结构简式。产物中羧基数目等于苯的同系物分子中能被氧化的侧链数目,若苯的同系物能被氧化生成分子式为C8H6O4的芳香酸(二元酸),说明苯环上有两个侧链,可能是两个乙基,也可能是一个甲基和一个正丙基,或一个甲基和一个异丙基,两个侧链在苯环上的相对位置又有邻、间、对三种,故乙共有3×3=9种结构。8.【答案】(1)C9H20 甲烷 (2)5 3 1 (3)C10H8 【解析】分析该有机化合物的摩尔质量可知其化学式可能为C9H20或C10H8。(1)C9H20为烷烃,其同系物中摩尔质量最小的是甲烷。(2)该链烃中含有碳碳不饱和键,其分子式为C10H8,不饱和度为7,故当其所含碳碳三键的数目分别为1、2、3时,则对应所含碳碳双键的数目为5、3、1。(3)由(2)可知,其分子式为C10H8,分子结构中含有一个苯环,一个碳碳双键和一个碳碳三键,且苯环上两个取代基处于邻位的有机化合物为。分子结构中含有两个苯环,且分子式为C10H8的有机物的结构简式为。9.【答案】(1)C24H12(2)51:50【解析】(1)注意苯环间以碳碳三键相连,碳原子数为3×6+2×3=24,H原子数为3×6-2×3=12。(2)仔细观察可知,苯乙炔在接入大环时去掉两个氢(一个是苯环上的,一个是碳碳三键的C上的),所以理论上消耗苯乙炔与所得芳炔类大环化合物的质量比为102:100=51:50。10.【答案】(1)abc(2)C6H4ad(3)D(4)D【解析】(1)蒽和X都只含C、H两种元素,有环状结构,且含有不饱和碳原子。故a、b、c均正确。(2)由苯炔的结构简式,结合碳的四价结构,可确定其分子式为C6H4,烃都不溶于水,常温常压下是气体的烃其碳原子数不超过4,因苯炔分子内含有C=C键、C≡C键,可以发生氧化反应、加成反应。(3)苯的同系物分子中只有一个苯环,且侧链均为烷基,满足条件的只有D项。(4)同时满足三个条件的只有D项。\n11.【答案】②+Br2+HBr①2+2HO—NO2+2H2O⑤2+2Br2 ++2HBr【解析】根据苯的化学性质可推知A为,因为—NO2为间位定位基,可推知②反应中—Br取代在苯环上并与—NO2处在间位的位置。同理可推知④反应中—NO2在苯环上并与—Br处在邻位或对位位置,即C为。在⑤反应中,因中只有两个位置既属于—Br的邻、对位又属于—NO2的间位,因此可得D、E的结构简式:、。12.【答案】(1)大 +HNO3+H2O (2)①② ③ (3)(X是卤素原子) (4)6 不在【解析】(1)苯与浓硫酸和浓硝酸的混合液在加热条件下反应生成硝基苯,硝基苯的密度大于水。(2)由苯生成溴苯的反应为取代反应,由溴苯生成的反应也为取代反应,由生成的反应是加成反应。(3)由可推知F是(X是卤素原子),分析题图中的隐含信息,结合—NO2是苯环上的间位定位基,卤素原子是苯环上的对位定位基,可得E应是(X是卤素原子)。(4)由并结合题给信息可推知B为,苯环上的二氯代物有、、、、\n、,共6种。由CH4的正四面体结构和NH3的三角锥形结构可知,的所有原子不可能都在同一平面上。13.【答案】(1)D(2)①B②D③+3Br2→(3)①C9H12②+Br2+HBr【解析】(1)选项A,有机热载体的功能是传递热量自身不发生变化。选项B,石蜡基碳氢化合物属于饱和烷烃,不能使酸性KMnO4溶液褪色。选项C,有机热载体属于有机物,由题给信息知工作温度不可过高。选项D,有机物在空气中受热易燃烧,所以有机热载体需隔绝空气。(2)①1mol最多与3molH2加成;苯环上的一氯代物只有2种;苯环上的一氯代物只有1种;符合题设条件。②选项A,根据题目信息,可知2分子合成1分子,相当于苯上的1个―H原子被苯基取代,反应类型应该是取代反应。选项B,该有机载热体含有两个苯环,不是苯的同系物。选项C,芳香烃不能与溴水发生取代反应。选项D,根据苯的结构推知,该有机物所有原子有可能在同一平面内。③1mol该有机物于3molBr2发生加成反应,模仿乙烯的性质即可写出相应反应方程式。(3)①设苯的同系物的分子式为CnH2n-6,则CnH2n-6+(n-1)O2nCO2+(n-3)H2O,根据相应数据可得:,解得n=9,该有机物分子式为C9H12。\n②C9H12的苯环上一氯代物、二氯代物、三氯代物都只有一种,故其结构简式为,与溴反应时苯环上只有一个位置的―H原子被取代生成。难扑灭的火焰某工厂仓库中堆放的镁粉正在燃烧,放出耀眼的白光。隔壁就是化学药品仓库,如果不及时扑灭,势必要发生更大的火灾事故。保管员小张用二氧化碳灭火器去灭火,不但火没有被扑灭,反而烧得更旺;后来用水浇,也无济于事。最后,还是有经验的消防队员用大量的黄沙去扑盖,避免了一场重大的火灾发生。为什么只能用黄沙呢?这是因为镁可以在二氧化碳中燃烧生成氧化镁和单质碳,而在高温下镁也可以和水反应生成氧化镁和氢气。