- 851.00 KB
- 2023-01-02 08:31:27 发布
- 1、本文档共5页,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报电话:19940600175。
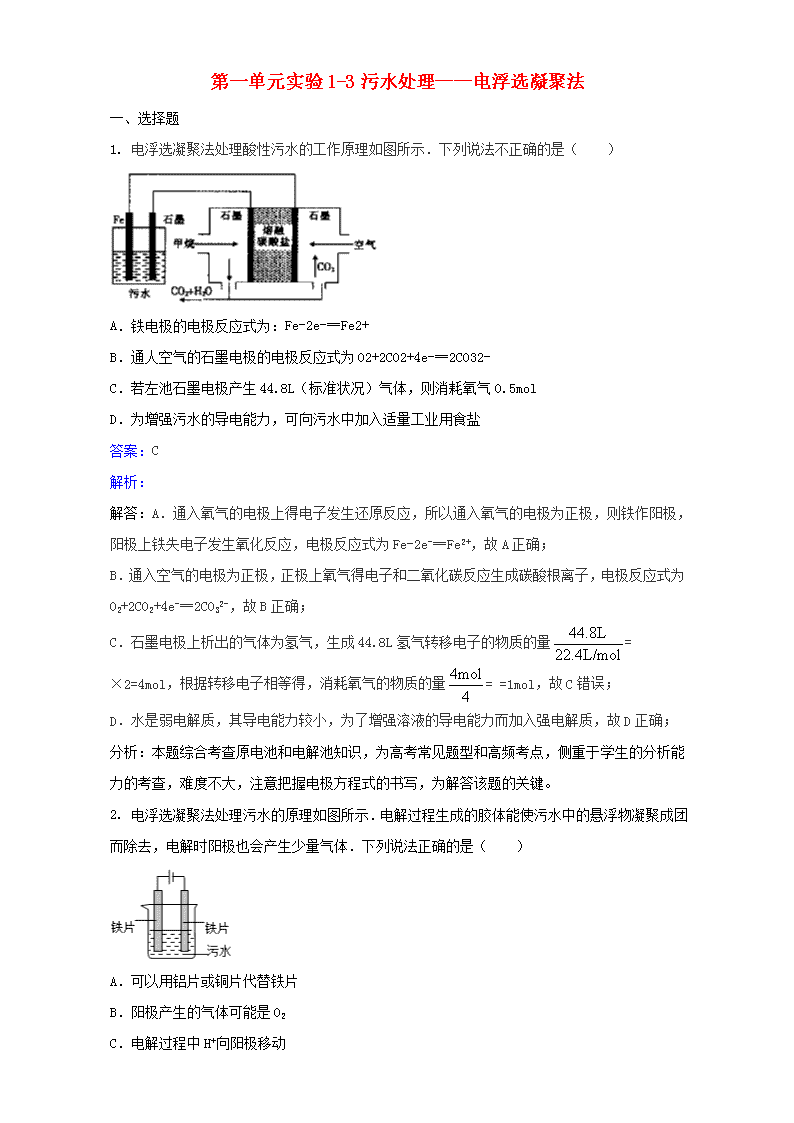
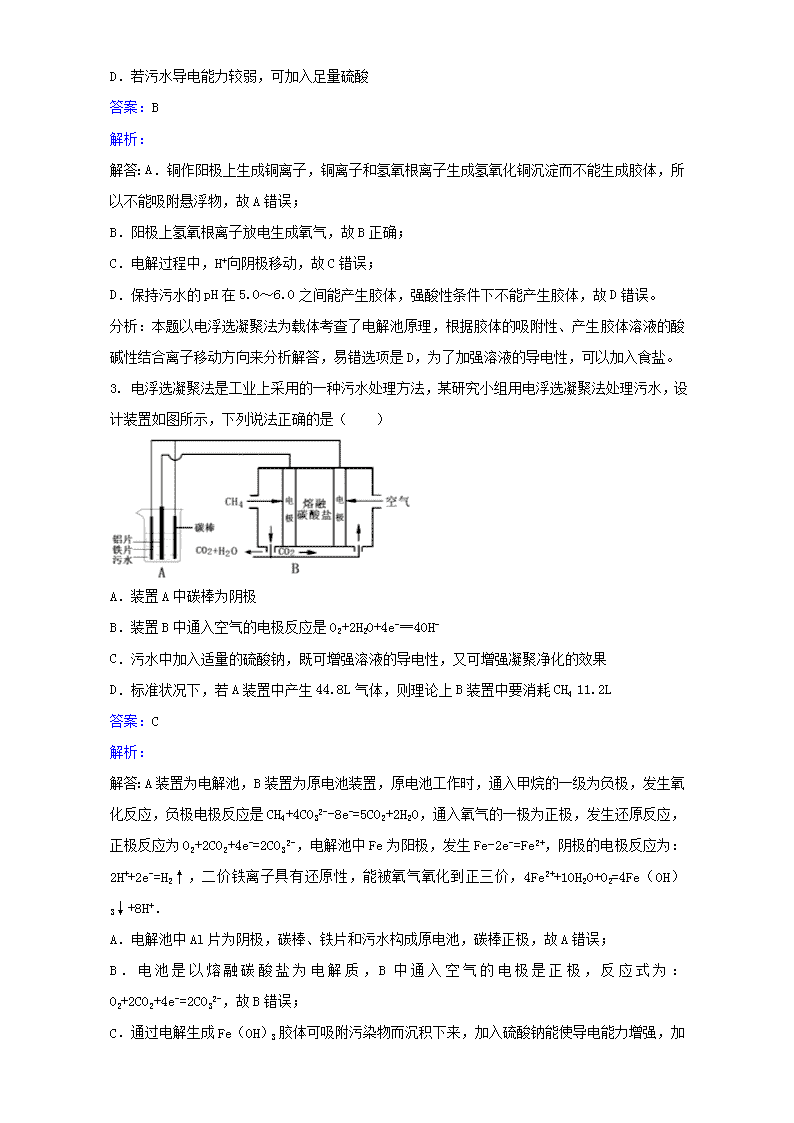
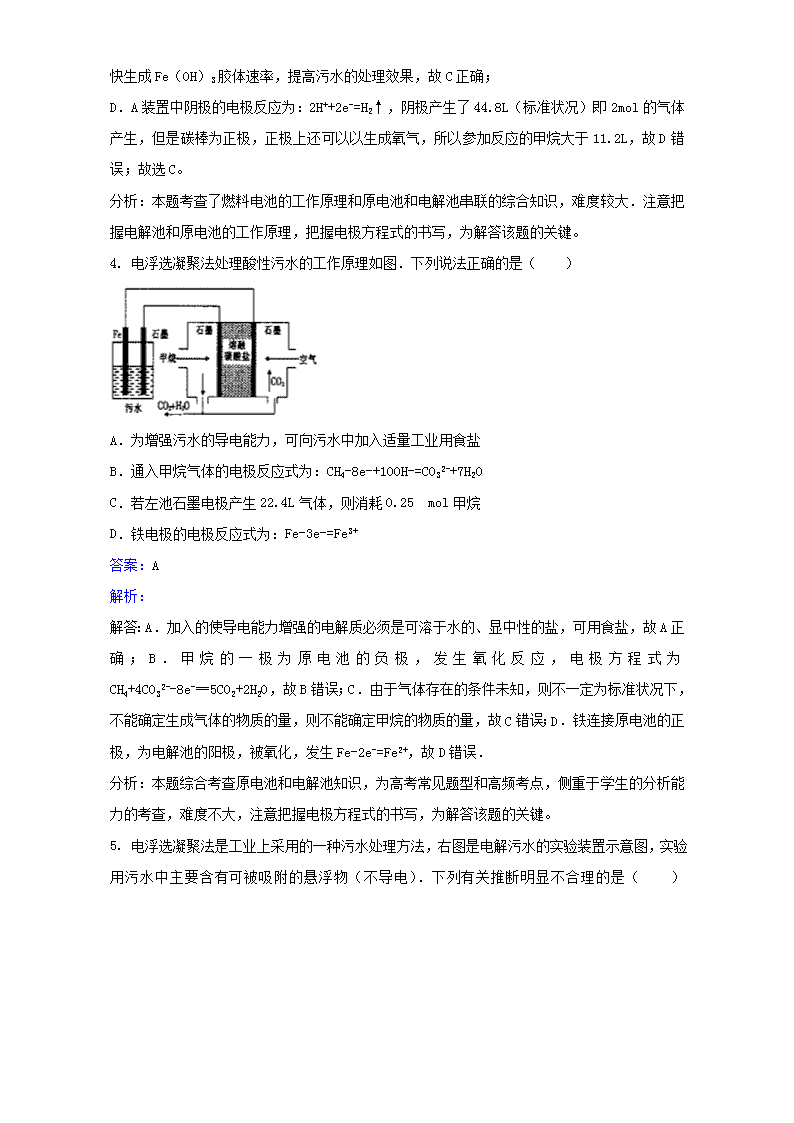
第一单元实验1-3污水处理——电浮选凝聚法一、选择题1.电浮选凝聚法处理酸性污水的工作原理如图所示.下列说法不正确的是( )A.铁电极的电极反应式为:Fe-2e-═Fe2+B.通人空气的石墨电极的电极反应式为O2+2CO2+4e-═2CO32-C.若左池石墨电极产生44.8L(标准状况)气体,则消耗氧气0.5molD.为增强污水的导电能力,可向污水中加入适量工业用食盐答案:C解析:解答:A.通入氧气的电极上得电子发生还原反应,所以通入氧气的电极为正极,则铁作阳极,阳极上铁失电子发生氧化反应,电极反应式为Fe-2e-═Fe2+,故A正确;B.通入空气的电极为正极,正极上氧气得电子和二氧化碳反应生成碳酸根离子,电极反应式为O2+2CO2+4e-═2CO32-,故B正确;C.石墨电极上析出的气体为氢气,生成44.8L氢气转移电子的物质的量=×2=4mol,根据转移电子相等得,消耗氧气的物质的量==1mol,故C错误;D.水是弱电解质,其导电能力较小,为了增强溶液的导电能力而加入强电解质,故D正确;分析:本题综合考查原电池和电解池知识,为高考常见题型和高频考点,侧重于学生的分析能力的考查,难度不大,注意把握电极方程式的书写,为解答该题的关键。2.电浮选凝聚法处理污水的原理如图所示.电解过程生成的胶体能使污水中的悬浮物凝聚成团而除去,电解时阳极也会产生少量气体.下列说法正确的是( )A.可以用铝片或铜片代替铁片B.阳极产生的气体可能是O2C.电解过程中H+向阳极移动\nD.若污水导电能力较弱,可加入足量硫酸答案:B解析:解答:A.铜作阳极上生成铜离子,铜离子和氢氧根离子生成氢氧化铜沉淀而不能生成胶体,所以不能吸附悬浮物,故A错误;B.阳极上氢氧根离子放电生成氧气,故B正确;C.电解过程中,H+向阴极移动,故C错误;D.保持污水的pH在5.0~6.0之间能产生胶体,强酸性条件下不能产生胶体,故D错误。分析:本题以电浮选凝聚法为载体考查了电解池原理,根据胶体的吸附性、产生胶体溶液的酸碱性结合离子移动方向来分析解答,易错选项是D,为了加强溶液的导电性,可以加入食盐。3.电浮选凝聚法是工业上采用的一种污水处理方法,某研究小组用电浮选凝聚法处理污水,设计装置如图所示,下列说法正确的是( )A.装置A中碳棒为阴极B.装置B中通入空气的电极反应是O2+2H2O+4e-═4OH-C.污水中加入适量的硫酸钠,既可增强溶液的导电性,又可增强凝聚净化的效果D.标准状况下,若A装置中产生44.8L气体,则理论上B装置中要消耗CH411.2L答案:C解析:解答:A装置为电解池,B装置为原电池装置,原电池工作时,通入甲烷的一级为负极,发生氧化反应,负极电极反应是CH4+4CO32--8e-=5CO2+2H2O,通入氧气的一极为正极,发生还原反应,正极反应为O2+2CO2+4e-=2CO32-,电解池中Fe为阳极,发生Fe-2e-=Fe2+,阴极的电极反应为:2H++2e-=H2↑,二价铁离子具有还原性,能被氧气氧化到正三价,4Fe2++10H2O+O2=4Fe(OH)3↓+8H+.A.电解池中Al片为阴极,碳棒、铁片和污水构成原电池,碳棒正极,故A错误;B.电池是以熔融碳酸盐为电解质,B中通入空气的电极是正极,反应式为:O2+2CO2+4e-=2CO32-,故B错误;C.通过电解生成Fe(OH)3\n胶体可吸附污染物而沉积下来,加入硫酸钠能使导电能力增强,加快生成Fe(OH)3胶体速率,提高污水的处理效果,故C正确;D.A装置中阴极的电极反应为:2H++2e-=H2↑,阴极产生了44.8L(标准状况)即2mol的气体产生,但是碳棒为正极,正极上还可以以生成氧气,所以参加反应的甲烷大于11.2L,故D错误;故选C。分析:本题考查了燃料电池的工作原理和原电池和电解池串联的综合知识,难度较大.注意把握电解池和原电池的工作原理,把握电极方程式的书写,为解答该题的关键。4.电浮选凝聚法处理酸性污水的工作原理如图.下列说法正确的是( )A.为增强污水的导电能力,可向污水中加入适量工业用食盐B.通入甲烷气体的电极反应式为:CH4-8e-+10OH-=CO32-+7H2OC.若左池石墨电极产生22.4L气体,则消耗0.25 mol甲烷D.铁电极的电极反应式为:Fe-3e-=Fe3+答案:A解析:解答:A.加入的使导电能力增强的电解质必须是可溶于水的、显中性的盐,可用食盐,故A正确;B.甲烷的一极为原电池的负极,发生氧化反应,电极方程式为CH4+4CO32--8e-═5CO2+2H2O,故B错误;C.由于气体存在的条件未知,则不一定为标准状况下,不能确定生成气体的物质的量,则不能确定甲烷的物质的量,故C错误;D.铁连接原电池的正极,为电解池的阳极,被氧化,发生Fe-2e-=Fe2+,故D错误.分析:本题综合考查原电池和电解池知识,为高考常见题型和高频考点,侧重于学生的分析能力的考查,难度不大,注意把握电极方程式的书写,为解答该题的关键。5.电浮选凝聚法是工业上采用的一种污水处理方法,右图是电解污水的实验装置示意图,实验用污水中主要含有可被吸附的悬浮物(不导电).下列有关推断明显不合理的是( )\nA.阴极的电极反应式为:O2+4e-+2H2O=4OH-B.通电过程中烧杯内产生可以吸附悬浮物的Fe(OH)3C.通电过程中会产生气泡,把悬浮物带到水面形成浮渣弃去D.如果实验用污水导电性不良,可加入少量Na2SO4固体以增强导电性答案:A解析:解答:A、阴极发生还原反应,应为:2H++2e-=H2↑,故A错误;B、Fe作为阳极,电解时生成Fe2+,Fe2+再被氧化生成Fe3+,Fe3+水解生成Fe(OH)3,Fe(OH)3具有吸附性,可将污染物吸附而沉淀下来,故B正确;C、阴极上H+离子放电生成氢气,产生H2气泡,气泡把污水中悬浮物带到水面形成浮渣层,故C正确;D、Na2SO4固体不参与电极反应,对电解产物没有影响,加入少量Na2SO4固体,溶液离子浓度增大,溶液导电性增强,故D正确.分析:本题考查电解原理及其应用,本题注意阳极材料为铁,为活性电极,易被氧化,本题难度不大,注意基础知识的积累。6.电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用.模拟处理装置如图所示,下列说法错误的是( )A.X电极是负极,电极反应式为:CH4-8e-+4CO32-═5CO2+2H2OB.铁是阳极,失去电子生成Fe2+C.工作时熔融盐中的碳酸根移向Y电极D.污水中存在反应:4Fe2++10H2O+O2═4Fe(OH)3↓+8H+答案:C\n解析:解答:A.X电极是负极,电极反应式为:CH4-8e-+4CO32-═5CO2+2H2O,故A正确;B.电解池中Fe为阳极,发生Fe-2e-=Fe2+,故B正确;C.工作时熔融盐中的碳酸根移向负极移动,即X电极,故C错误;D.二价铁离子具有还原性,能被氧气氧化到正三价,而水呈酸性,方程式为:4Fe2++10H2O+O2=4Fe(OH)3↓+8H+,故D正确分析:本题考查了燃料电池的工作原理和原电池和电解池串联的综合知识,难度较大.注意把握电解池和原电池的工作原理,把握电极方程式的书写,为解答该题的关键7.关于电解NaCl水溶液,下列叙述正确的是( )A.电解时在阳极得到氯气,在阴极得到金属钠B.若在阳极附近的溶液中滴入KI溶液,溶液呈棕色C.若在阴极附近的溶液中滴入酚酞试液,溶液呈无色D.电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈中性答案:B解析:解答:电解NaCl溶液时,其化学方程式为:2NaCl+2H2O2NaOH+H2↑+Cl2↑阳极上产生Cl2,在阳极附近滴入KI溶液,溶液呈棕色,B正确;阴极上产生H2,在阴极附近滴入酚酞,溶液呈红色,最终溶液呈碱性,C、D两项均不正确。分析:本题考查电解原理和电极反应产物的判断,题目难度不大,熟练掌握电解原理是解题的关键。8.用石墨电极电解含有相同物质的量的Na2SO4和CuSO4的溶液。一段时间后,溶液颜色变浅。此时若要使溶液中的Na2SO4和CuSO4都恢复到电解前的浓度,应向电解后的溶液中加入适量的( )A.Na2SO4和CuSO4B.CuOC.Na2O和CuOD.H2O和CuSO4答案:B解析:解答:电解此溶液的本质是:2Cu2++2H2O===2Cu↓+4H++O2↑,所以要使电解液复原,应加CuO。分析:本题考查电解原理的应用、电解质溶液的浓度恢复方法,题目难度不大,熟练掌握电解原理和电解质溶液的变化是解题的关键。\n9.某学习小组做电浮选凝聚法净化污水的实验时,同学们发表了如下看法,其中错误的是()A.两个电极都可选用Fe片B.电源电极接反时仍能产生一定净水效果C.反应中产生的H2会将Fe3+还原成Fe2+D.电浮选凝聚法用于工业污水处理时要注意通风,防止爆炸答案:C解析:解答:电解池中阴极受到保护,主要起导电作用,可选Fe片;电极接反时,Al作阳极失去电子生成Al3+,再生成Al(OH)3,也有一定净水作用;在水溶液中,H2不能将Fe3+还原成Fe2+;阴极产生H2,易燃易爆,要注意通风,故选C。分析:本题考查电解池的电极的判断和电极反应产物的分析,题目难度中等,熟练掌握电解反应是解题的关键。10.用石墨作电极,电解1mol/L下列物质的溶液,溶液的pH保持不变的是( )A.HCl B.NaOHC.Na2SO4D.NaCl答案:C解析:解答:选项A,电解1mol/LHCl溶液,阴极2H++2e-===H2↑,阳极2Cl--2e-===Cl2↑,H+得电子,c(H+)浓度降低,pH增大。选项B,电解1mol/LNaOH溶液,阴极4H++4e-===2H2↑,阳极4OH--4e-===2H2O+O2↑,实质上电解水,NaOH浓缩,溶液的pH增大。选项C,电解1mol/LNa2SO4溶液,阴极4H++4e-===2H2↑,阳极4OH--4e-===2H2O+O2↑,实质上电解水,溶液的pH保持不变。选项D,电解1mol/LNaCl溶液,阴极2H++2e-===H2↑,阳极2Cl--2e-===Cl2↑,破坏了水的电离平衡,c(OH-)增大,pH增大。分析:本题考查电解原理和溶液pH的计算,题目难度中等,熟练掌握电解原理的应用是解题的关键。11.用石墨作电极电解1mol/LCuSO4溶液,当c(Cu2+)为0.5mol/L时,停止电解,向剩余溶液中加入下列何种物质可使电解质溶液恢复至原来状态( )A.CuSO4 B.CuOC.Cu(OH)2D.CuSO4·5H2O答案:B解析:解答:电解过程中的反应为:\n阳极:4OH--4e-===2H2O+O2↑阴极:2Cu2++4e-===2Cu总反应为:2CuSO4+2H2O2H2SO4+2Cu+O2↑由以上反应可知,电解使2molCuSO4和2molH2O变成了2molH2SO4,同时析出铜,放出O2,溶液中每生成2molCu则放出1molO2,故需补充CuO。分析:本题考查电解原理的应用、电解质溶液的浓度恢复方法,题目难度不大,熟练掌握电解原理和电解质溶液的变化是解题的关键。12.下列描述中,不符合生产实际的是( )A.电解熔融的氧化铝制取金属铝,用铁做阳极B.电解法精炼粗铜,用纯铜做阴极C.电解饱和食盐水制烧碱,用涂镍碳钢网做阴极D.在镀件上电镀锌,用锌做阳极答案:A解析:解答:电解冶炼金属铝时,若铁做阳极,则铁将失电子而溶解,不符合生产实际。分析:本题考查电解原理和电极判断,题目难度不大,熟练掌握电解原理的应用是解题的关键。13.下列有关用惰性电极电解AgNO3溶液的说法不正确的是( )A.电解过程中阴极质量不断增大B.电解过程中阳极附近的pH不断降低C.电解一段时间后,向溶液中加入适量的Ag2O固体可使溶液恢复到电解前的状况D.电解过程中,溶液中电子由阴极迁向阳极答案:D解析:解答:电解过程中Ag在阴极析出,故阴极质量不断增大,A正确;电解过程中阳极附近的OH-不断放电生成氧气,使pH不断降低,B正确;电解一段时间后,溶液产生HNO3,故向溶液中加入适量的Ag2O固体可使溶液恢复到电解前的状况,C正确;电解过程中,溶液中没有电子移动,D错;答案为D。分析:本题考查电解原理的应用,题目难度不大,熟练掌握电解过程中的电极反应和产物是解题的关键。14.Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如图所示,电解总反应为:2Cu+H2OCu2O+H2↑。下列说法正确的是( )\nA.石墨电极上产生氢气B.铜电极发生还原反应C.铜电极接直流电源的负极D.当有0.1mol电子转移时,有0.1molCu2O生成答案:A解析:解答:绿色化学倡导无污染过程,本题结合电化学中电解原理涉及这一理念。从反应中得知Cu在通电时失电子在阳极放电,发生氧化反应,另一电极(石墨)做阴极,发生还原反应:2H++2e-===H2↑,相应的CuCuO2,转移0.1mol电子生成0.05molCu2O,故B、C、D项错。分析:本题考查利用电解原理制取氧化亚铜的电解池设计,题目难度不大,熟练掌握电解原理是解题的关键。15.金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:氧化性Fe2+Fe>Ni>Cu>Pt,阴极的放电顺序为:Zn2+