- 1.11 MB
- 2023-01-02 08:31:30 发布
- 1、本文档共5页,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报电话:19940600175。
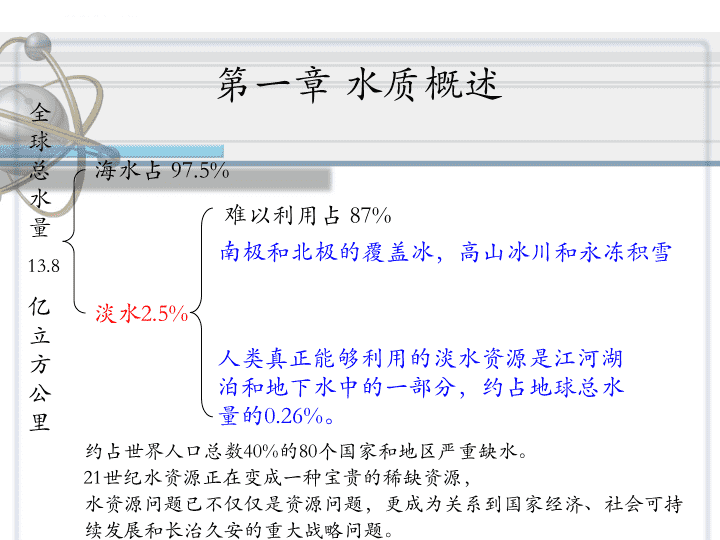
第一章水质概述约占世界人口总数40%的80个国家和地区严重缺水。21世纪水资源正在变成一种宝贵的稀缺资源,水资源问题已不仅仅是资源问题,更成为关系到国家经济、社会可持续发展和长治久安的重大战略问题。全球总水量13.8亿立方公里海水占97.5%淡水2.5%难以利用占87%人类真正能够利用的淡水资源是江河湖泊和地下水中的一部分,约占地球总水量的0.26%。南极和北极的覆盖冰,高山冰川和永冻积雪\n\n主要内容第一节电厂用水水源及水质特征第二节天然水中的杂质及特征第三节电厂用水的水质指标第四节天然水的分类第五节水质校核\n一、电厂用水的水源1.地表水地表水是指流动或静止在陆地表面的水,主要是指江河、湖泊和水库水、海水等。2.地下水存在于地球表面以下土壤和岩层中的水称为地下水。由雨水和地表水经过地层的渗流而形成的。新水源:城市中水逐渐成为电厂用水的另一种水源。第一节电厂用水水源及水质特点\n二、各种水的水质特点1、地表水:江河水:化学组分具有多样性和易变性;悬浮物和胶体杂质含量较多,浊度高于地下水;含盐量及硬度较低。(注:大气水:自然界的雨水和雪水,江河水的主要来源,不是电厂水的来源。)湖泊及水库水:浊度较低,藻类含量较多,含盐量比江河水高。海水:含盐量高,35g/L,NaCl约占89%。\n2、地下水:浊度较低,含盐量高于地表水,富含游离CO2,溶解氧含量少。3、中水:用于工业冷却水的补充水,以及消防、绿化、道路清洁、冲厕等。中水水质:(1)卫生要求:细菌总数、大肠杆菌群数、余氯量、悬浮物、生活需氧量、化学需氧量;(2)感官要求:色度、浊度和臭味;(3)防止严重腐蚀和结垢的指标:pH值、浊度、溶解性物质和蒸发残渣。\n第二节天然水中的杂质及特征杂质来源:水在循环运动过程中,接触大气、尘埃、土壤、岩石、矿物以及各种污染物,还会滋生一些细菌及各种水生生物,这样给水中带入很多杂质。大自然中很纯的水是没有的。天然水中杂质分类:状态:固态、液态、气态(分子态、离子态或胶体颗粒)性质:有机物、无机物、微生物分散体系(粒径大小):悬浮物、胶体、溶解物质\n1悬浮物(suspendedsolids,SS)2胶体(colloid)3溶解物质(dissolvedmatter)3.1溶解气体3.2溶解无机离子3.3溶解有机物质对于天然水中的杂质,由水处理方法需要与杂质颗粒的大小有关,粗略地可以按其颗粒大小分为三类:\n1悬浮物悬浮物:大于100nm(10-4mm)以上的颗粒。它属于肉眼可见或光学显微镜下的可见物。包括泥沙、黏土、藻类、细菌、动植物的肢体及其腐败产物。它是导致水发生浑浊的原因。流动时:悬游于水流中,所以称为悬浮物静止时:密度小的上浮漂浮物(动植物生存过程产生的腐殖质)密度大的下沉下沉物可以自然沉降由于水中悬浮物的这种不稳定性,使得湖水、水库水中悬浮物含量少,而河流水中悬浮物含量多,且受气候影响波动较大。水中悬浮物的存在,使水体变浑浊。\n2胶体胶体:水中尺寸约为1-100nm(10-6-10-4mm)的颗粒。不能自然沉降,主要有两方面原因:①颗粒小,沉降速度慢;②胶体颗粒带有电荷,斥力使胶体在水中非常稳定。分类:无机胶体:硅、铝、铁的化合物、复合物及其聚合物有机胶体:大分子有机物,腐殖质、蛋白质类混合胶体:无机胶体吸附大分子有机物水中胶体物质的存在,使水在光照下显得浑浊。\n3溶解物质溶解物质:粒径小于1nm(10-6mm)的颗粒溶解气体:地表水:与空气接触,空气中会溶入O2、N2(惰性不考虑)及CO2(地壳运动,水生生物作用等也可放出CO2气体),排入地表水中的污水中还带入H2S、NH3等气体。\n地下水:溶氧较少,但地壳运动产生的CO2大量溶入水中,地下水经过硫铁矿,还会带有H2S等气体。天然水中常见的溶解气体:O2和CO2,有时有H2S、NH3等。其中最为关注的溶解气体为O2(5~10mg/L)和CO2(地表水几到几十mg/L;地下水几十到几百mg/L),它们的存在是金属腐蚀的主要原因。\n溶解有机物目前,通常采用水通过0.45或0.15μm孔径滤膜后的水中有机物当作溶解态的有机物。溶解的无机离子天然水中溶解的无机离子主要有:阳离子:K+、Na+、Ca2+、Mg2+等;阴离子:HCO3-、Cl-、SO42-等它们的含量占水中总的无机离子95%以上。是水流经地层过程中被溶解的一些矿物盐类。某些地区的地下水中含有较多的Fe2+和Mn2+。在盐碱地带,F-、NO3-、CO32-的含量较高。\n第三节水质指标天然水中总是含有许多杂质,这样就产生了水质有好有坏的问题。在不同的工业部门中,由于水的用途不一样,对水质要求也不同,故各种工业部门中所采用的水质指标常有所不同。热力发电厂用水的各种指标、符号及常用单位\n指标名称常用符号单位指标名称常用符号单位pH值pH---硬度YD或Hmmol/L全固体QGmg/L碳酸盐硬度HT悬浮固体XG非碳酸钙硬度HF浊度ZDFTU、NTU碱度JD或B透明度TDcm酸度SD或A溶解固体RGmg/L化学需氧量(以O2计)CODmg/L灼烧减少固体SG生化需氧量BOD含盐量YL或S总有机碳TOCcmmol/L氨氮电导率DDμs/cm细菌含量个/mL表1-6火力发电厂用水的技术指标\n水质指标可以分为两种类型:成分指标:明确表示水中某些具体物质含量的指标为成分指标。技术指标:用来表示水中某一类物质总的含量或者是某一类物质的某种性质。\n一、表示水中悬浮物及胶体的指标1、悬浮固体含义:反映水中悬浮物含量的一项指标。测定方法:悬浮固体测定实际是采用孔径3-4μm玻璃过滤器对水进行过滤,滤出物在105-110℃烘干称重而得,单位mg/L。评价:仅能表征水中颗粒较大的悬浮物,而且操作复杂,不宜现场操作,有较大局限性。悬浮物和胶体可以使水发生浑浊,所以可以采用浊度和透明度这些光学性质来表征悬浮物含量。\n2、浊度含义:浊度是利用悬浮物和胶体等粗分散颗粒对水清晰透明的影响程度。利用水中悬浮物和胶体颗粒对光的透射或散射作用来表征其含量的一种指标。浊度越大,水透明程度差,水中颗粒状物也多;相反,浊度越小,颗粒状物也少。浊度的测定:用一束光通过含有粗分散颗粒的水,光除了受到阻碍,透射光强度减弱外,光线遇到水中颗粒物,还要发生散射。\n利用测量透射光强度的浊度仪称为透射光浊度仪——透射光浊度利用测量散射光强度的称散射光浊度仪——散射光浊度均测量的为积分球式浊度仪。——积分球浊度浊度的测定:用一束光通过含有粗分散颗粒的水,光除了受到阻碍,透射光强度减弱外,光线遇到水中颗粒物,还要发生散射。\n浊度单位依据:标准水样浊度的配制方法不同,使用单位不同;福马肼单位:目前通用,以福马肼聚合物(它是利用硫酸肼和六次甲基四胺配制成的浑浊液。)作为浊度标准对照液。散射光福马肼浊度单位NTU透射光福马肼浊度单位FTU积分球式福马肼浊度单位FNU以前常采用经特殊精致的漂白土或硅藻土的悬浮液(SiO2)为标准,用杰克逊烛光浊度仪测定,此种浊度单位称为杰克逊浊度单位(JTU)。\n3、透明度反应水中悬浮物和胶体含量的指标透明度:是利用水中悬浮物和胶体物质的透光性来表征其含量的指标。即表示水的透明程度,单位为cm。特点:为了适应快速监测的需要,早期还使用过透明度指标,表示水的透明程度。误差较大,现已不常采用。\n二、表示水中溶解物质的指标1、含盐量含盐量:水中所含溶解盐类的总和,可以通过水质的全分析测得。表示方法:1)物质的量浓度表示法(mmol/L),即将水中全部阳离子(或全部阴离子),均按带一个电荷的粒子为基本单元,全部相加计算其浓度;2)质量表示法(mg/L),即将水中各种阴、阳离子的以质量含量为单位,全部相加。注:不包括H+OH-由于水质全分析比较麻烦,所以常用溶解固体近似表示,或者用电导率衡量。\n2、溶解固体概念:在规定条件下,单位水样经过滤除去悬浮固体后,经蒸发、干燥所得的残渣质量。单位用mg/L表示。测定方法:取一定体积的过滤水样蒸干,最后将残渣在105-110℃下干燥至恒重。这种方法实际测得的是在蒸发时水中不挥发物质(在上述温度下)的量,主要是水中各种溶解性盐类。\n但它只能近似表示水中溶解盐类的含量。有几方面原因:过滤时水中胶体(硅酸、铁、铝的氧化物)及部分有机物与溶解盐类一样能穿过滤层;蒸干时某些物质的湿分和结晶水不能除尽。特别是在锅炉水中,常常会有许多难以在此温度下将湿分除尽的盐类,如Na2SO4、NaOH、Na3PO4等;有些有机物分解;水中原有碳酸氢盐在蒸干过程中全部转换为碳酸盐。\n3、电导率电导率是测定水中溶解盐类多少的一种指标,其测定方法比测定含盐量简便的多。由于火力发电厂制水纯度很高,并且溶于水中的盐类都能电离出具有导电能力的离子,因此测定水的电导率是间接表示水中溶解物质的最简便的方法。表示电导率的单位为西/厘米(S/cm),它是电阻率单位欧·厘米(Ω·cm)的倒数。实用上,由于水的电导率常常很小,所以经常用μS/cm单位,它是S/cm的1/106。氢电导:火电厂水汽质量标准中采用,指水样经过氢型强酸阳离子交换树脂彻底交换后测得的电导率。(可消除其中氨的影响)\n三、表示水中易结垢物的指标1、硬度硬度是表征水中易结水垢物质的指标。对于天然水来说,这些物质主要是钙、镁离子,所以通常把硬度看作是这两种离子。水中钙离子含量称为钙硬(Hca),镁离子含量称为镁硬(HMg)。因此,总硬度(或简称硬度)就表示钙、镁离于含量之和,即硬度常用的单位是mmol/L。\n但目前还在使用一些其他单位,比如:1)mgCaCO3/L是将水中硬度离子全部换算成CaCO3,计算以mg/L为单位的浓度。2)美国:ppmCaCO3(百万分之一),它与mg/L大致相当3)德国:德国度(°G)是指水中硬度离子全部换算成CaO,计算以mg/L为单位的浓度,1°G相当于10mg/LCaO。因为CaCO3的相对分子质量为100,CaO的相对分子质量为56,故上列三种表示法的关系如下:1mmol/L()=50mgCaCO3/L=2.8°G\n根据钙镁离子与酸根离子结合形式的不同,划分为碳酸盐硬度和非碳酸盐硬度两类,现分述于下:2、碳酸盐硬度(HT)碳酸盐硬度是指水中钙、镁的碳酸盐及碳酸氢盐含量。因为天然水中碳酸根的含量常很小,所以一般将碳酸盐硬度看作与碳酸氢盐结合的钙、镁的量。所谓结合是一种假设的说法,由于水受热的时候,会析出CaCO3、Mg(OH)2,所以假设水中钙镁是首先与碳酸氢根结合,多余的才与其他阴离子结合。碳酸盐硬度又叫暂时硬度。\n水的总硬度和碳酸盐硬度之差就是非碳酸盐硬度,它们是指水中钙、镁的氯化物和硫酸盐的含量。水沸腾时不能除去又称为永久硬度。3、非碳酸盐硬度(HF)\n四、表示水中酸、碱物质的指标1、碱度(mmol/L(H+))表征:水中碱性物质的指标。定义:水中能接受H+,与强酸进行中和反应的物质的含量。形成碱度的物质(1)强碱:在水中完全电离,以OH-形式构成的碱度,如NaOH、Ca(OH)(2)弱碱:在水中部分电离出OH-,如NH4OH(3)强碱弱酸盐:水解时产生的OH-,Na2CO3一般天然水中的碱度成分:主要是碳酸氢盐,少数pH值(>8.3)较高的天然水中:主要为碳酸氢盐,少量碳酸盐。天然水中有时还有少量的腐植酸盐。\n通常表示水中OH-、CO32-、HCO3-量及其他一些弱酸盐类量的总和。因为这些盐类在水溶液中都呈碱性,可以用酸中和,所以归纳为碱度。水中碱度可能存在五种形式:(1)只有OH-碱度(2)只有CO32-碱度(3)只有HCO3-(4)同时存在OH-和CO32-碱度(5)同时存在CO32-和HCO3-碱度\n碱度的测定(1)方法:碱度是用中和滴定法来测定。(标准HCl、H2SO4)(2)指示剂:甲基橙:滴定终点pH为4.2,HCO3-和CO32-均中和成H2CO3,OH-中和成H2O。所测得碱度为全碱度(甲基橙碱度),即碱度。碱度的单位为mmol/L(H+),这里H+表示中和用酸的基本单元。酚酞:滴定终点pH为8.3,OH-中和成H2O,CO32-中和为HCO3-所测得碱度为酚酞碱度。\n2、酸度(mmol/L(OH-))酸度是指水中能与强碱(如NaOH、KOH等)中氢氧根离子反应的物质的量。可能形成酸度的物质有强酸、强酸弱碱盐、酸式盐和弱酸。酸度不表示水中H+的浓度(pH),它表示在中和滴定过程中可以和强碱进行反应的全部H+的数量。在天然水中,酸度有H2CO3和HCO3―的盐类。在水净化过程中,有时还可能出现强酸。水中既存在酸度又可同时存在碱度。酸度的测定:用强碱标准溶液来滴定。甲基橙:pH4.2,测出的为强酸酸度,简称酸度酚酞:pH8.3,测出的为总酸度。\n五、表示水中有机物的指标天然水中有机物的种类繁多,不论是对某些有机物的量,还是对有机物的总量,都难以准确测定,为此,人们基于有机物具有可氧化的共性,拟订了许多以大致估量有机物总量的方法。化学氧化量、生物氧化量和燃烧等方法\n1、化学耗氧量概念:在规定条件下,用氧化剂处理水样时,氧化水样中有机物所消耗该氧化剂的量,即为化学需氧量(COD)。常用单位为mg/LO2氧化剂:重铬酸钾(K2Cr2O7),CODCr,条件:强酸加热沸腾回流,银离子为催化剂有机物氧化率:85~95%高锰酸钾(KMnO4),CODMn_高锰酸盐指数条件:反应时间短,操作简单有机物氧化率:70%\n氧化剂KMnO4不能使水中所有有机物充分氧化,所以也有采用K2Cr2O7作为氧化剂的,则测得的耗氧量称为重铬酸钾耗氧量。K2Cr2O7在一定的条件下可以将有机物氧化得较完全,用它测得的耗氧量要比用KMnO4的大2—3倍。通常将重铬酸钾法测得的耗氧量称为化学需氧量(CODCr),其理由是此法测得的数据比较接近于有机物完全氧化的耗氧量。在国内,有人将符号COD笼统地代表耗氧量,此时必须标明所用氧化剂,否则,意义含糊。在要求较高的场合,还应标明耗氧量的测试条件。高锰酸钾耗氧量法为:在一定条件下,用氧化剂(KMnO4)处理水样,测定其反应过样中消耗的氧化剂量,其单位用mg/LO2表示,即将消耗的氧化剂量换算成O2来表示。耗氧量所表示的实际上是水中全部易氧化的物质,其中虽然主要是有机物,但有时免不掉有一些无机物参与反应,如Fe2+等。\n2、生化需氧量定义:生化需氧量表示用微生物氧化(降解)水中有机物所消耗的氧量,通常用符号“BOD”表示,单位为mg/LO2。生物氧化的整个过程一般可分成两个阶段。在第一阶段中,主要是有机物转化成CO2、H2O和NH3;第二阶段主要是NH3转化成NO2―和NO3―。微生物的活动与环境有关,所以试验规定在温度为20℃和在黑暗的条件下进行。在这样的环境中,用微生物来完全氧化有机物需要21一28d。21d的时间太长,在实用上有困难,日常以5d作为测定生化需氧量的时间,此时测得的量可用符号“BOD5”来表示。\n3、灼烧减少固体(SG)将已烘干至恒重的溶解固体残渣放入800℃的高温炉中,灼烧到一定时间残渣变白后,所失去的质量即为灼烧减少固体。在灼烧残渣的过程中,主要进行的是将有机物全部烧掉。所以,它可以近似表示有机物的含量。但用此法算得的有机物只是近似的,其原因为:第一,部分有机物在测定溶解固体时,要蒸发和分解;第二,灼烧时,溶解固体残渣中残存的结晶水完全被除去了;第三,灼烧时有一部分碳酸盐和氯化物会分解。实践证明,当水中含盐量大时,灼烧减量当作有机物的含量,误差就很大,不用于水分析核算中。\n4、总有机碳(TOC)概念:总有机碳是指水中有机物的总含碳量.测定方法:将水样中的有机物在900℃高温和加催化剂的条件下气化、燃烧,这时水样中的有机碳和无机碳全部氧化成CO2,然后利用红外线气体分析仪分别测定总的CO2和无机碳产生的CO2量,两者之差即为总有机碳量。5、总需氧量(TOD)概念:用仪器测定有机物完全燃烧所消耗氧的量。\n六、活性硅和非活性硅硅酸是一种比较复杂的化合物,它的形态很多,其通式为xSiO2·yH2O。例如当x和y等于l时,分子式可写成H2SiO3,称为偏硅酸;当x=1,y=2时,分子式为H4SiO4,称为正硅酸;当x>1时,硅酸呈聚合态,称为多硅酸。硅酸化合物各种形态可以相互转化,提高温度或者增大水的pH值,都有利于胶体硅向溶解态硅的转变。\n在水质分析中,常把硅酸化合物分为两类。活性二氧化硅(简称活性硅)凡是能够直接用比色方法测得的硅酸化合物称为活性二氧化硅,这类硅酸化合物通常都是溶于水的单分子(或离子态)化合物,它能与钼酸反应而显色,所以又称为可溶性硅。非活性二氧化硅(简称非活性硅)不能直接用比色方法测得的硅酸化合物大都是硅酸的多聚物,是以胶体形态存在于水中的,所以有时称为胶硅。活性硅与非活性硅之和称为全硅,通常用SiO2来表示。由于水中非活性硅无法测定,常用测得的全硅与活性硅之差求的。\n七、氨氮1、定义:以氨或铵离子形式存在的化合氨2、来源:人和动物的排泄物,雨水径流和农业化肥的流失、企业废水。3、分类:离子氨(基本无毒);非离子氨(水合氨):对水生生物有毒害作用,0.02mg/L。4、氨氮对工业循环冷却水的危害:(1)氨氮浓度较高、滋生微生物、甚至生成黏泥和泥垢。(2)氨氮在硝化菌的作用下,会部分转化为硝酸盐和亚硝酸盐,导致水的pH值下降和设备腐蚀。\n八、细菌总数概念:指水样在一定条件下(培养基成分、培养温度和时间、pH值等)下培养后,所得1mL水样中所含细菌菌落的总数。浓度单位:cfu/mL,菌落数/mL\n第四节天然水的分类一、按主要水质指标分类1、按含盐量来分低含盐量水——含盐量在200mg/L以下;中等含盐量水——含盐量为200~500mg/L;较高含盐量水——含盐量为500~1000mg/L;高含盐量水一—含盐量在1000mg/L以上;我国江河水属于低含盐量的约占一半,其他都是中等含盐量水,地下水大部分是中等食盐量水。\n2、按硬度来分极软水——硬度在1.0mmol/L以下;软水——硬度为1.0~3.0mmol/L;中等硬度水——硬度为3.0~6.0mmol/L;硬水——硬度为6.0~9.0mmol/L;极硬水——硬度在9.0mmol/L以上。我国江河水的硬度情况是:在东南沿海一带最低,大都小于0.5mmol/L,为极软水区,愈向西北硬度愈大,最大可达3~6mmol/L;东北地区,硬度由北向南增大,松花江和东北沿海又低达0.5~1.0mmol/L。\n二、按水中盐类的组成分类假设:天然水中得硬度(Ca2+、Mg2+)先与水中碱度(HCO3-)结合,剩余的才与SO42-、Cl-。这种表示法的原则为:阳离子按Ca2+、Mg2+、Na++K+的次序排列,阴离于按HCO3-、SO42-、Cl-的次序排列,根据它们的含量,作图解如下图所示。在此图上ab段代表Ca(HCO3)2,bc段代表Mg(HCO3)2,cd段代表MgSO4,其余是Na++K+的盐类。水中溶有的盐类都是呈离子状态存在的,所以水分析结果用离子来表示比较合适。\n这种表示法的理由是:Ca2+和Mg2+的碳酸氢盐最易转化成沉淀物,其次是它们的硫酸盐;阳离子Na+和K+,阴离子Cl-都不易生成沉淀物。在这种设想基础上,根据碱度和硬度比值不同,又可以将天然水分成碱性水和非碱性水两类。\n(1)碱性水(碱度值大于硬度值,仅有碳酸盐硬度,没有非碳酸盐硬度,有过剩碱度)碱性水的特征是碱度大于硬度(B>H),即[HCO3-]>[1/2Ca2+]+[1/2Mg2+]。如用图解表示,可参见图l-4所示。在碱性水中,Ca2+都Mg2+都形成碳酸氢盐,没有非碳酸盐硬度(HF),水中还有Na+和K+的碳酸氢盐。在这种情况下,B和H的差值,相当于Na+和K+的碳酸氢盐量。这个碳酸氢盐量称为过剩碱度(BG),有时称为“负硬”,即BG=B-H\n(2)非碱性水(碱度值小于硬度值,既有碳酸盐硬度又有非碳酸盐硬度,没有过剩碱度)非碱性水的特征为硬度大于碱度(H>B),即[1/2Ca2+]+[1/2Mg2+]>[HCO3-]。此时,水中有非碳酸盐硬度(HF)存在。非碱性水又可按钙、镁的分配情况,分为两种:一种为钙硬水,其特征为[1/2Ca2+]>[HCO3-],如图1-5(a)所示,水中有钙的非碳酸盐硬度(即图中的CaSO4),因而没有镁的碳酸盐硬度,即图中没有Mg(HCO3)2;\n另一种为镁硬水,其特征为[1/2Ca2+]<[HCO3-],如图1-5(b)所示,水中有镁的碳酸盐硬度,因而没有钙的非碳酸盐硬度。\n根据天然水中阴离子的相对量,可将水分作碳酸盐型和非碳酸盐型,碳酸盐型:[HCO3-]>[1/2SO42-]十[Cl-]。我国的水多数为碳酸盐型。非碳酸盐型:[HCO3-]﹤[1/2SO42-]十[Cl-]\n第五节水质校核一、水中阳离子与阴离子根据物质电中性的原则:正负电荷的总和相等。因此,水中各种阳离子和各种阴离子的物质的量总数必然相等。即:(1-1)在水质分析测定时,由于各种原因会导致分析结果产生误差,使得各种阳离子浓度总和和各种阴离子浓度总和往往不相等,但是差值应在一定的允许范围(δ)内,一般认为δ小于2%是允许的。δ可由下式计算:(1-2)\n二、含盐量和溶解固体校正依据已在溶解固体处讲过:溶解固体(测量方法导致)和含盐量的差异:过滤时水中胶体(硅酸、铁、铝的氧化物)及部分有机物与溶解盐类一样能穿过滤层;有些有机物分解;水中原有碳酸氢盐在蒸干过程中全部转换为碳酸盐。RGJ=RG-[SiO2]-[R2O3]-有机物+0.51[HCO3-]含盐量大于100mg/L含盐量小于100mg/L\n三、硬度与碱度硬度:H=HCa+HMg=HT+HF碱性水中:有过剩碱度BGH=HT,HF=0非碱性水中:B=HT,BG=0\n四、pH值与碳酸化合物水中碳酸化合物有几种不同的存在形态:溶于水中的气体二氧化碳(CO2);碳酸氢根(HCO3-)和碳酸根(CO32-)。它们与pH值的关系如图:\n从图中可以看出,当pH≤4.2时,水中只有CO2;pH=8.3时,98%以上都是HCO3-。所以水中各种碳酸化合物、在一定的pH值和温度下,它们的相对量是一定的。pH=8.3是个限值;4.28.3时,水中只有HCO3-、CO32-,所以可根据两者间平衡关系计算pH=10.33-lg[HCO3-]+lg[CO32-]实测pH值和上述计算的pH误差绝对值不应大于0.2\n习题1、根据下面的水质资料,指出该水的总硬度、碳酸盐硬度、非碳酸盐硬度、全碱度、过剩碱度各为多少mmol/L?Ca2+=50mg/L、Mg2+=9.6mg/L、Na+=16.1mg/L、HCO3-=170.8mg/L、SO42-=43.2mg/L、Cl-=10.65mg/L2、某天然水水质分析结果如下(单位:mg/L)Ca2+=36、Mg2+=6、K++Na+=35(=1.4mmol/L,按Na+:K+=7:1计算)、HCO3-=152.5其余为强酸阴离子(1)求该天然水中强酸阴离子的量为多少mmol/L?(2)指出该天然水的碱度、过剩碱度、碳酸盐硬度、非碳酸盐硬度各位多少mmol/L?(3)若该天然水的pH为7.2,求其CO2的含量为多少mg/L?\n3、含盐量的计算,溶解固体计算?4、硬度表示方法?5、碳酸化合物在水中存在形式?6、什么是碱性水和非碱性水?过剩碱度的计算方法?7、电厂用水的分类?8、汽水损失分类及原因?9、电厂给水处理主要内容?10、水中悬浮物、胶体、溶解物质的颗粒粒径范围?11、水中溶解物质主要包括?溶解无机离子主要有?12、浊度单位表示方法?13、硬度表示方法?