- 4.22 MB
- 2023-01-02 08:31:45 发布
- 1、本文档共5页,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报电话:19940600175。
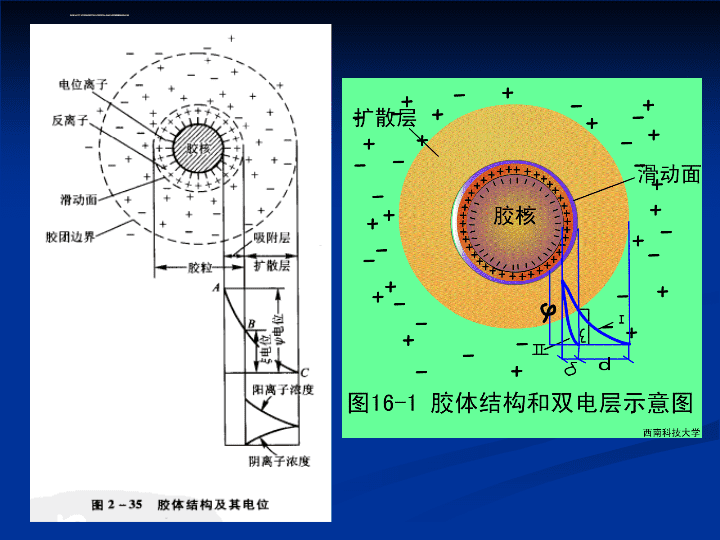
第三章污水的化学处理3.1化学混凝法3.2中和法3.3化学沉淀法3.4氧化还原法3.5电化学法3.6消毒\n§31化学混凝法(Cogulation)去除对象:水中细小的悬浮物和胶体污染物质混凝目的:投加混凝剂使胶体脱稳,相互凝聚生长成大矾花;水处理中主要杂质:粘土(50nm-4m)细菌(0.2m-80m)病毒(10nm-300nm)蛋白质(1nm-50nm)腐殖酸\n\n§31.1混凝原理(1)胶体结构(双电层结构)A、电位离子层:胶核表面,吸附了一层带同号电荷的离子;B、反离子层:电位离子层外吸附了电量与电位离子层总电量相同,而电性相反的离子;吸附层扩散层\nC、滑动面:吸附层与扩散层的交界面;D、胶体的电动电位:指胶粒与扩散层之间的电位差;电动电位胶体脱稳凝聚E、总电位:胶核表面的电位离子与溶液主体之间电位差;\nF、胶体粒子的结构式Fe(OH)3胶体分散系胶团结构:\n(AgI)mI-I-I-I-I-I-I-I-K+K+K+K+K+K+K+K+K+K+AgNO3+KI→AgI+KNO3KI过量[(AgI)mnI-,(n-x)K+]x-xK+胶核胶粒胶团吸附层扩散层\n(2)胶体的稳定性A定义:胶体粒子在水中长期保持分散悬浮状态的特性;B分类:动力学稳定性:颗粒布朗运动对抗重力影响的能力;——粒子越小,动力学稳定性越强;\n聚集稳定性:胶体粒子之间不能相互聚集的特性;—静电作用和水化膜的作用阻碍胶体粒子的聚合,—胶体的稳定性关键在于聚集稳定性;—胶体的电动电位越高,胶体的稳定性越高;\n(3)DLVO理论德加根(Derjaguin)、兰道(Landon)伏维(Verwey)、奥贝克(Overbeek)胶体的稳定性和凝聚:可由两胶粒间的相互作用和距离来评价距离>OA(稳定)静电斥力占优势距离Ksp:溶液为不饱和溶液,沉淀从溶液中析出;\n§3.3.2化学沉淀法类型(1)氢氧化物沉淀法I、基本原理水在25℃的离子积:Kw=[H+][OH-]=1×10-14\n124365798111012-7-6-5-4-3-2-1Fe3+Al3+Cr3+Cu2+Zn2+Ni2+Fe2+Cd2+Mn2+Lg[Mn+]pHKspFe(OH)33.2×10-38Al(OH)31.3×10-33Cr(OH)36.3×10-31Cu(OH)25.0×10-20金属离子溶解度与pH的关系\n[Mn+]相同时,Ksp,析出氢氧化物沉淀的pH;同一金属离子,[Mn+],析出氢氧化物沉淀的pH;\nII、氢氧化物沉淀法处理铅锌冶炼厂废水第一沉淀池反应池第三沉淀池出水水废图铅锌冶炼厂废水处理工艺流程第二沉淀池石灰、漂白粉沉渣9.9-11.0<0.022<0.1<0.091.79<0.6处理后(mg/L)6.4-7.80.73-2.200.551.68-10.2383.48-2.021.06-19.68处理前(mg/L)pHCNAsCdZnpb水质取样pH=9.5-10.5\n(2)硫化物沉淀法I、基本原理金属硫化物的溶解平衡式为:以硫化氢为沉淀剂时,硫化氢分两步电离,其电离方程式如下:\n【例题分析】\n例:向含镉废水中通入硫化氢气体并达到饱和,调整pH值达8.0,求水中剩余Cd2+浓度。已知:K1=9.1×10-8,K2=1.2×10-15,Ksp=7.9×10-27\nII、硫化物沉淀法在含汞废水处理中的应用碱性条件下,投加硫化钠及聚凝剂硫酸亚铁\n(3)钡盐沉淀法A、用途:主要用于处理含六价铬的废水;B、沉淀剂:碳酸钡、氯化钡、硝酸钡、氢氧化钡等C、主要反应:(KBaCO3=8.0×10-9,KBaCrO4=2.3×10-10)\n(4)铁氧体法(FerriteMethod)I、铁氧体:具有高的导磁率和高的电阻率;具有一定晶体结构;复合氧化物;是一种重要的磁性介质;组成可表示:BO·A2O3,(B代表2价,A代表三价金属)如磁铁矿(FeO·Fe2O3)就是一种天然的尖晶石型铁氧体。\nII、铁氧体沉淀法指向废水中投加亚铁盐,通过工艺条件控制,使废水中多种重金属离子与铁盐形成稳定铁氧体共沉淀。采用固液分离手段,达到去除重金属离子的目的。\nIII、工艺过程A、投加亚铁盐:为了形成铁氧体,需要有足量的Fe2+和Fe3+。投加亚铁盐(FeSO4)的作用:①补充Fe2+;②通过氧化,补充Fe3+;③如水中含Cr6+,则将其还原为Cr3+,作为形成铁氧体的原料之一。B、加碱沉淀:pH值控制在8-9时,各种难溶金属氢氧化物可同时沉淀析出。\nΔFe(OH)3FeOOH+H2OFeOOH+Fe(OH)2FeOOH·Fe(OH)2ΔFeOOH·Fe(OH)2+FeOOHFeO·Fe2O3+2H2OD、固液分离分离铁氧体沉渣的方法有3种:①沉淀过滤;②离心分离;③磁分离;E、沉渣处理C、充氧加热,转化坏淀;\nIV、工艺特点:A、优点:①能一次脱除废水中的多种金属离子;②设备简操作方便;③硫酸亚铁的投量范围大,对水质的适应性强;④沉渣易分离、易处置(回收利用或贮存);\nB、缺点是:①不能单独回收有用金属;②需要消耗相当多的硫酸亚铁、一定数量的氢氧化钠及热能,处理成本较高;③出水硫酸盐浓度高;\n§3.4氧化还原法(OxidationReduction)§3.4.1氧化法I、药剂氧化法(1)氧化剂:a、活泼非金属中性分子,如O2、O3、Cl2b、含氧酸根阴离子及高价金属离子,ClO-、Fe3+、MnO4-(2)处理对象:a、无机物:CN-、S2-、Fe2+、Mn2+等离子;b、有机物:酚、醇、醛、油类等;\n(3)空气氧化法定义:就是把空气鼓入废水中,利用空气中的氧气氧化废水中的污染物;特点:A、降低pH值,有利于空气氧化;强碱性(pH=14)溶液中的半反应为:O2+2H2O+4e=4OH-E0=0.401v中性和强酸性溶液中半反应为:O2+4H++4e=2H2O中性(pH=7)E0=0.815v强酸性(pH=0)E0=1.229v\nB、提高温度和氧分压,可以增大电极电位;C、添加催化剂,反应活化能降低,有利于氧化反应进行;\n应用A、地下水除铁、锰:\nB、工业废水脱硫:\n(4)碱性氯化法(用于CN-的去除)A、氧化剂(ClO-):次氯酸钠、漂白粉、液氯;B、氧化类型:局部氧化(pH=12-13)CN-+ClO-+H2OCNCl+2OH-(slow)CNCl+2OH-CNO-+Cl-+H2O(fast)完全氧化(pH=6-7)2NaCNO+3HOCl=2CO2+N2+2NaCl+HCl+H2O2CNCl+2HOCl+H2O=2CO2+N2+4HCl\nExample.HowmuchCl2mustbesuppliedtooxidize130mg/lcyanide(CN-)givenaflowof10,000l/d?(a)ConsideroxidationtoCNO-.(b)ConsidercompleteoxidationtoCO2andN2SolutionRecation1:CN-+ClO-+H2OCNCl+2OH-Recation2:CNCl+2OH-CNO-+Cl-+H2OCombineReactions1and2togiveanoverallreactionofCN-toCNO-:(Reaction1+Reaction2)CN-+ClO-CNO-+Cl-(Cl2+H2OHOCl+HCl)[Cl2]=(130/1000)/26=5.010-3mol/l\nFinally,fora10,000l/dflow:Cl2=(5.010-3mol/l10,000l/d71)/1000=3.55kg/d(b)ConsiderRecation3:2CNO-+3HOCl=2CO2+N2+3Cl-+H2O+H+(5.010-33/2)(10,000l/d)(71/1000)=5.33kgCl2/dandtotalrequirementis:Cl2=3.55+5.33=8.88kg/d\n(5)臭氧氧化法(Ozone)臭氧的性质A、氧化能力(如表)B、溶解性:水中溶解度比纯氧高10倍,比空气高25倍C、毒性:对眼及呼吸器官有强烈的刺激作用;D、稳定性:易分解E、腐蚀性:用耐腐材料\n氧化剂方程式氧化电极电位•OH臭氧过氧化氢高锰酸根二氧化氯氯气OH+H++e=H2OO3+2H++2e=H2O+O3H2O2+2H++2e=2H2OMnO4-+8H++5e=Mn2++4H2OClO2+e=Cl-+O2Cl2+2e=2Cl-2.802.071.771.521.501.30各种氧化剂的电极电位\n臭氧的制备:无声放电制法其原理为:O2+e-→2O+e-3O→O3O2+O=O3O3+O→2O2特点:①可达到降低COD,无二次污染;②杀菌、增加溶解氧;③脱色除臭;④处理成本高;\n废水处理中的应用印染废水处理:用于脱色发色基团:不饱和的原子团;如:偶氮基、羧基、硝基、亚硝基等;脱色机理:不饱和键的断裂;含氰废水处理:2KCN+3O32KCNO+2O22KCNO+H2O+3O32KHCO3+N2+3O2含酚废水的处理\n\n(6)湿式氧化(WAO-WetAirOxidation)A、定义:在高温(150-350C)和高压(5-20MPa)下,用空气中的氧来氧化废水中溶解和悬浮有机物和还原性无机物的一种方法。\nB、作用机理:氧溶解度和传质系数的提高;自由基反应诱导期、增殖期、退化期、结束期C、应用:①各类难生物降解的高浓度有机废水;②还原性无机物(CN-、SCN-、S2-)\n自由基反应:(1)诱导期:RH+O2→R•+HOO•2RH+O2→2R•+H2O2(2)增殖期:R•+O2→ROO•ROO•+RH→ROOH+R•(3)退化期:ROOH→RO•+HO•ROOH→RO•+R•+H2O(4)结束期:R•+R•→R—RROO•+R•→ROORROO•+ROO•→ROH+R1COR2+O2\nD、发展方向:催化湿式氧化(CatalyticWetAirOxidation)贵金属、稀土等作催化剂;超临界湿式氧化(SupercriticalWetOxidation);Tc=400-600CPc=25-40MPa(超临界状态)\n固体液体气体三相点647.3K373K273.16K10MPa0.6MPa25MPa超临界流体水的存在状态图\n溶质普通水超临界水无机物有机物气体大部分易溶大部分微溶或不溶大部分微溶或不溶不溶或微溶易溶易溶化合物名称分解结果%化合物名称分解结果%二噁英氯代甲苯DDT>99.9999>99.998>99.997CCl多氯联苯(PCB)1,1,1-三氯代乙烷>99.53>99.99999>99.9999氯化有机物在超临界水氧化后的分解结果超临界水与普通水溶解度的对比\nE、优点:①适用范围广;②处理效率高;③二次污染低;④氧化速度快;⑤装置小;⑥可回收能量和有用物料;\nII、光化学氧化(1)光氧化的基本原理光氧化:水溶液中有机物通过直接吸收光而变为激发态分子或直接与O2作用或裂解成自由基再与O2作用;AY+hυ→AY*AY*→A·+Y·,A·+Y·+O2→产物AY*+O2→产物(若干步)\n光化学氧化系统A、UV/H2O2反应机理:脱氢反应:亲电加成电子转移RH+•OH→H2O+•R→进一步氧化+•OH→→+HCl•OH+RX→•RX++OH-\nB、UV/O3反应机理:C、UV/O3/H2O2反应机理:H2O2+H2O2→H3O++HO-2O3+H2O2→•OH+HO2•+O2O3+HO-2→•OH+O-2•+O2O3+O-2→O-3+O2O-3+H2O→•OH+HO-+O2\nD、UV/Fenton氧化法Fenton试剂:亚铁离子和过氧化氢H2O2+hv→2•OHFe2++hv→Fe3+→Fe(OH)2+(pH=5.5)Fe(OH)2+→Fe2++•OHFe2++H2O2→Fe3++OH-+•OHFe3++H2O2→Fe2++HO2•+H+Organ+•OH→CO2+H2O+其他产物\n(2)二氧化钛光催化氧化(非均相体系)AkiraFujishima\n作用机理光催化氧化是在水中加入一定量的半导体催化剂(TiO2或CdS),催化剂在紫外光辐射下产生自由基,氧化有机污染物和无机污染物。\n光催化氧化的影响因素催化剂:N型半导体(TiO2、ZnO、CdS、WO3等)TiO2:金红石型、锐钛型(催化活性高);颗粒尺寸:粒径比表面积活性\n锐钛型:四方晶系,每个八面体与周围8个八面体相连接;连接方式:4个共边,4个共顶角,4个TiO2分子组成一个晶胞。金红石型:四方晶系,每个八面体与周围10个八面体相联连接方式:2个共边,8个共顶角,2个TiO2分子组成一个晶胞。\n光源和光强:光源:只有波长小于390nm的光子才能激发它;光强:低光强:有机物降解速率与光强呈线性关系;高光强:降解速率与光强平方根呈线性关系;pH值:影响有机物的降解;酸性:TiO2表面带正电;碱性:TiO2表面带负电;\n外加氧化剂:H2O2、K2S2O8(电子浮获剂)H2O2+e-HO+OH-S2O82-+e-SO42-+SO4-盐Cl-、HCO3-、CO32-\n光催化活性的提高贵金属的表面沉积:电子从TiO2向金属上扩散,电子在金属上的富集,从而抑制了电子和空穴的复合;\n\n半导体中掺杂影响对TiO2进行Cr6+、Cu2+、Fe3+、V4+、Ru3+、Mn2+、Pb2+、W6+等离子的掺杂,将激发光的波长范围扩大到可见光区促进TiO2微粒光生电子-空穴对的有效分离;\nTiO2光敏化有机染料,叶绿素,腐殖酸,富里酸等都可吸收可见光作敏化剂,吸附于光催化剂表面,从而扩大激发波长范围,增加光催化反应的效率;\n\nTiO2与其它半导体复合能使电荷与空穴有效分离,形成更有效的光催化剂。CdS/TiO2、SnO2/TiO2、WO3/TiO2、TiO2/Fe2O3、TiO2/PbS、CdS/ZnO、SiO2/TiO2导体Eg≥5eV空带禁带满带价带Eg≤3eV半导体绝缘体导带\n\n⑤光电催化\n废水处理中的应用有机物降解:卤代芳烃、多环芳烃、硝基芳烃等;无机物:CN-、Cr2O72-、Hg2+、Pb2+、Ag+;饮用水的深度处理:微量难降解有机物的去除;\n(3)光敏化氧化:SS*hvS*+ASA*++氧化剂产物A*B·C·A*+氧化剂产物\n光氧化特点(1)氧化能力强,可有效分解难生物降解的有毒有机物(2)利用光照射可以加强某些氧化剂的氧化能力;(3)通常不产生二次污染;(4)工艺简单,操作方便;(5)投资大,适于小规模深度处理;\n§3.4.2药剂还原法(1)常用的还原剂:SO2、硫化钠、硫化氢、硫代硫、铁粉、硫代硫酸钠、亚硫酸钠、硫酸亚铁、NaBH4或甲醛等。(2)还原法除铬A、来源:电镀、冶炼、制革、化工等工业废水B、形式:CrO42-(pH>7.6)、Cr2O72-(pH<4.2)\nC、方法:亚硫酸钠还原H2Cr2O7+3Na2SO3+3H2SO4=2Cr2(SO4)3+3Na2SO4+8H2OCr2(SO4)3+6NaOH=2Cr(OH)3↓+3Na2SO4硫酸亚铁还原H2Cr2O7+6FeSO4+6H2SO4=Cr2(SO4)3+3Fe2(SO4)3+7H2OCr2(SO4)3+3Ca(OH)2=2Cr(OH)3↓+3CaSO4↓水合肼还原4CrO3+3N2H4=4Cr(OH)3↓+3N2\n(3)还原法除汞金属还原法Hg2++Zn=Hg+Zn2+硼氢化钠还原法(pH=9-12)Hg2++BH4-+2OH-=Hg↓+3H2+BO2-\n§3.5电化学法(电解-Electrolysis)§3.5.1概述电解:电解质溶液在电流作用下,进行电化学反应的过程;阳极:得电子,使阴离子失去电子而被氧化;阴极:失电子,使阳离子得电子而被还原;作用类型:电化学氧化电化学还原电解上浮电解凝聚\n(1)法拉第电解定律【例题分析】\n例3-1一台600mm180mm38mm石墨板为阳极,有10组双电极串联的电解食盐水发生NaOCl装置。阳极的电流密度i为50mA/cm2,如以40%的电流效率计算,则电解装置每昼夜可处理含氰10mg/L的废水多少吨。解:(1)依据法拉第定律,理论上电解产生的Cl2为:\n(2)实际Cl2的产量为:17141.740%=6856.68gCl2+2OH-=OCl-+Cl-+H2O(3)实际产生的OCl-的量为:6856.6851.45/(235.45)=4975.69g(4)处理含氰废水的量:2CN-+5OCl-=CO2+N2+5Cl-+CO32-(2/5)(4975.69/51.45)26=1005.77g废水含氰为10g/m3,则一昼夜可处理废水1005.77/10=100.6m3\n(2)分解电压使电解正常进行时所需的最小外加电压;电解槽本身就是某种原电池;原电池的电动势同外加电压的方向相反;分解电压必须大于原电池的电动势(极化);极化浓差极化化学极化\n(3)电解槽的结构形式和极板电路A、电解槽的结构形式回流式:翻腾式:B、极板电路单极性板电路双极性板电路\n§3.5.2电化学氧化法(处理含氰废水)◆直接氧化:阳极接受电子、相当于氧化剂,氧化水中污染物;A、CN-+2OH--2e=CNO-+H2OB、CNO-+2H2O=NH4++CO32-(副反应)C、2CNO-+4OH--6e=N2+2CO2+2H2O◆间接氧化:阳极反应产生氧化剂来氧化水中污染物;A、2CI--2e=Cl2B、CN-+Cl2+2OH-=CNO-+2CI-+H2OC、2CNO-+3Cl2+4OH-=2CO2+N2+6CI-+2H2O\n§3.5.2电化学还原法◆作用过程:电解槽阴极可以给出电子,相当于还原剂,可使废水中的重金属离子还原出来,沉积于阴极,加以回收利用。◆电化学还原法处理含铬(VI)废水(1)电极材料:Fe(2)处理对象:CrO42-、Cr2O72-(3)有关反应:\n电化学还原除铬有关反应:(a)阳极氧化:FeFe2++2e(b)间接还原:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2OCrO42-+3Fe2++8H+=Cr3++3Fe3++4H2O(c)阴极直接还原:Cr2O72-+14H++6e=2Cr3++7H2OCrO42-+8H++3e=Cr3++4H2O(d)沉淀去除:Cr3++3OH-=Cr(OH)3Fe3++3OH-=Fe(OH)3\n§3.5.3电解上浮和电解凝聚(1)电解上浮法:A、定义:废水电解时,由于水的电解氧化,在电极上会有气体析出。借助于电极上析出的微小气泡而浮上分离疏水杂质微粒的技术;阳极4OH--4e=O2↑+2H2O阴极2H++2e=H2↑\nB、作用:去除细小悬浮固体物和油状物;阳极还具有降低BOD和COD、脱色、脱臭、消毒的能力,阴极还具有沉积重金属离子的能力。C、优点:去除污染物范围广;泥渣量少、工艺简单;设备小等;D、缺点:电耗大;\n(2)电解凝聚:A.电极材料:Fe、Al作阳极B.电极反应:FeFe2++2eFe3+(阳极溶出)AlAl3++3e(阳极溶出)Fe3++3OH-Fe(OH)3↓Al3++3OH-Al(OH)3↓C.作用原理:凝聚和吸附D.去除对象:胶态杂质及悬浮杂质、重金属废水\n§3.6消毒§3.6.1概述病原体:病原性细菌:伤寒杆菌、痢疾杆菌、霍乱弧菌、结核杆菌;肠道病毒:脊髓灰质炎病毒、肝炎病毒、口蹄疫病毒等;蠕虫卵:蛔虫卵、钩虫卵、蛲虫卵;我国《生活饮用水卫生标准》要求:细菌总数不超过100个/mL;大肠茵群数不超过3个/L;\n消毒:杀灭水中病原细菌和其它对人体健康有害微生物;灭菌:杀灭水中的一切微生物;方法氯及氯化物消毒(液氯/次氯酸钠/漂白粉/二氧化氯);臭氧消毒;重金属消毒;物理消毒(紫外线、加热);\n§3.6.2氯消毒(1)氯消毒原理Cl2+H2OHOCl+HClHOClH++OCl-(分布图)消毒机制:HOCl穿透到细菌内部破坏细菌酶系统;消毒效果:pH越低,消毒越好(细菌带负电);消毒副反应(水中有氨氮)NH3+HOClNH2Cl+H2ONH2Cl+HOClNHCl2+H2ONHCl2+HOClNCl3+H2O\n(2)加氯量加氯量=需氯量+余氯(实验确定)I、需氯量:用于灭活水中微生物;氧化有机物和还原性物质;II、余氯:抑制病原微生物的再度繁殖,确保持续的杀菌能力;余氯在接触30min后不低于0.3mg/L;管网末梢不应低于0.05mg/L;\nIII、加氯曲线无微生物、有机物、还原性无机物时,加氯量=余氯第1区OA段:余氯为零,消毒效果不可靠;第2区AH段:氯与氨反应,有余氯存在,余氯为化合性余氯(NH2Cl)有一定消毒效果;第3区HB段:仍然是化合性余氯,加氯量增加,氯氨被氧化成不起消毒作用的化合物,余氯减少;第4区BC段:没有氯消耗,出现游离性余氯,消毒最好;折点加氯:加氯量超过折点需要量;\nb1b2b4a2a3a4AHB余氯量(mg/L)加氯量(mg/L)游离性余氯(C12、HClO、ClO-1)化合性余氯需氯量曲线b——需氯量a___余氯量1234(NH2Cl、NHCl2)加氯量=余氯+需氯量b3Ob1b2b4a2a3a4AHB余氯量(mg/L)加氯量(mg/L)游离性余氯(C12、HClO、ClO-1)化合性余氯需氯量曲线b——需氯量a___余氯量1234(NH2Cl、NHCl2)加氯量=余氯+需氯量b3OC\n(3)余氯脱除目的:降低处理水对后续处理系统的危害;降低对受纳水体生物的毒性;方法:二氧化硫脱余氯SO2+HOCl+H2O=HCl+H2SO4活性炭脱除余氯;C+Cl2+2H2O=4HCl+CO2\n(4)氯消毒优缺点优点:具持续的消毒作用;成本低;操作简单,不需要庞大的设备;缺点:有机物含量高会产生有机氯化物;处理出水有氯和氯酚味;\n§3.6.3二氧化氯消毒(1)二氧化氯的性质常温下为一种具刺激性气味的黄氯色气体;极不稳定;气态和液态均易爆炸;易溶于水;(2)二氧化氯的制备亚氯酸钠和氯制取:Cl2+2NaClO22ClO2+2NaCl用酸与亚氯酸钠制取:5NaClO2+4HCl4ClO2+5NaCl+2H2O\n(3)二氧化氯在水中与某些物质的反应与无机物反应2ClO2+5Mn2++6H2O5MnO2+2Cl-+12H+2ClO2+5Fe(HCO3)2+6H2O5Fe(OH)3+10CO2+HCl与有机物反应有效氧化苯酚,而不形成氯酚;\n(4)二氧化氯消毒的特点对细菌的细胞具有较强的吸附和穿透能力;消毒能力比氯强;不会与水中有机物作用生成有机氯化物:ClO2余量能在管网中保持很长的停留时间;ClO2不水解,消毒受pH影响较小;操作管理要求高,成本较高;ClO2对人体血红细胞、神经系统及生殖系统有害;\n§3.6.4漂白粉消毒Ca(OCl)2+2H2O2HOCl+Ca(OH)2+CaCl2§3.6.5次氯酸钠消毒NaOCl+H2OHOCl+NaOH\n§3.6.6臭氧消毒消毒机制仍是氧化作用;不会产生三卤甲烷,杀菌和氧化能力比氯强;出水中增加溶解氧;不能在配水管网中继续保持杀菌能力;设备复杂,投资大,耗电较高;\n§3.6.8其它消毒法(1)紫外线消毒:A、作用机理:细菌核酸对紫外线的吸收后发生突变,其复制、转录受阻碍,从而引起体内蛋白质和酶的合成障碍;B、消毒效果:260nm的紫外线杀菌能力最强;C、优点:消毒速度快,效率高;不影响水的物理性质和化学成分;操作简单,便于管理,易于实现自动化;\nD、缺点:不能解决消毒后在管网中的再污染问题;电耗高;水中悬浮物妨碍光线透射;(2)加热消毒:细菌蛋白质变性;(3)微电解消毒:氧化剂、电场效应;(4)高锰酸钾消毒:氧化剂(5)重金属离子:凝固细菌蛋白质\n§3.7水的软化处理目的:降低水中Ca2+、Mg2+的含量,防止在管道和设备中结垢。方法:加热软化:借助加热把碳酸盐硬度转化为溶解度很小的CaCO3和Mg(OH)2沉淀出来;\n药剂软化法:借助药剂把水中Ca2+、Mg2+的盐类转化为CaCO3和Mg(OH)2沉淀出来a、石灰软化法\nb、石灰—苏打软化法离子交换法(如图)\n\n第三章总结混凝:胶体的结构胶体脱稳和凝聚机理混凝过程、影响因素及动力学中和:方法、药剂及量的确定;沉淀:氢氧化物、硫化物、钡酸盐、铁氧体(概念及工艺)氧化还原:化学氧化:空气、臭氧、碱性氯化、湿式氧化光化学、光催化(机理、影响因素)、光敏化化学还原(汞、铬):电化学法:电化学氧化、还原、电解上浮和电解凝聚消毒:氯及氯化物、臭氧、高锰酸钾重金属、紫外线等软化:加热、药剂法\n1、何谓胶体稳定性,简述胶体脱稳和凝聚的作用机理。2、何谓同向絮凝和异向絮凝?两者的碰撞速率与哪些因素有关。3、影响混凝效果的主要因素有哪几种?这些因素是如何影响混凝效果的。4、用氯气处理某工业含氰废水,已知水量为10m3/d,含[CN-]浓度为500mg/L,为将水中全部氰转为氮气,需用多少氯气?\n5、一个城市小型水处理厂以MgO为药剂处理水量为1.56×107L/d的生活污水,使污水中所含磷、氮化合物通过化学沉淀反应一并去除,若按污水中含30mg/LH2PO43-作化学计量计算,则每天产渣量多少?沉淀反应方程为:H2PO43-+NH4++MgO+5H2O=Mg(NH4)2PO46H2O6、 什么叫光氧化作用,光氧化与化学氧化的主要区别是什么?7、简述光催化氧化的主要作用机理及影响因素。8、试用反应式表述光敏化氧化的基本过程。\n9、 简述电解上浮法和电解凝聚法的作用原理。10、电解上浮法在废水处理中的主要作用有哪些?11、试分别举例说明电化学氧化和电化学还原作用原理。12、简述加氯消毒的原理,pH对消毒效果有何影响?13、什么叫游离(自由)性氯、化合性氯?消毒效果有何区别?