- 2.12 MB
- 2023-01-03 08:30:25 发布
- 1、本文档共5页,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报电话:19940600175。
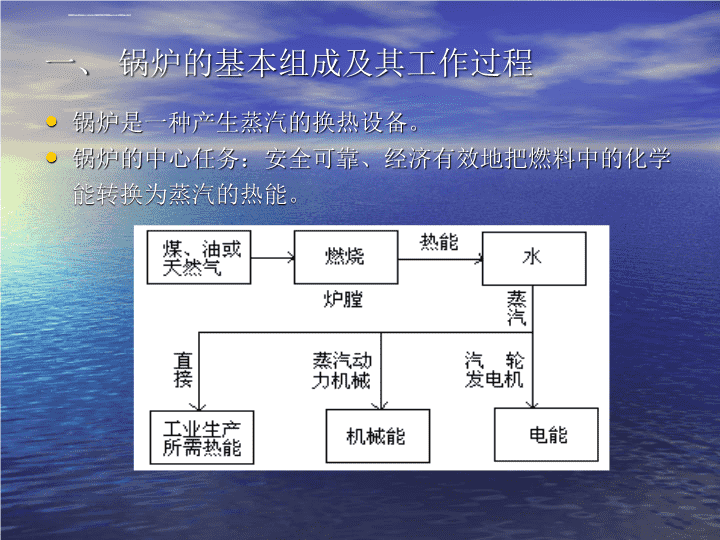
第五章锅炉水处理第一节锅炉及其水汽质量标准第二节锅炉水处理第三节锅炉的腐蚀与防护第四节锅炉的化学清洗\n第一节锅炉及其水汽质量标准一、锅炉的基本组成及其工作过程二、锅炉水汽质量标准三、低压锅炉水质标准四、中、高压锅炉的水汽质量标准\n一、锅炉的基本组成及其工作过程锅炉是一种产生蒸汽的换热设备。锅炉的中心任务:安全可靠、经济有效地把燃料中的化学能转换为蒸汽的热能。\n锅炉的分类:按用途:工业锅炉、船舶锅炉、电站锅炉等;按蒸汽压力:低压、中压、高压、亚临界压力、超临界压力锅炉;按燃料:燃煤、燃油、燃气锅炉;按燃烧方式:火床炉、煤粉炉、沸腾炉等;按水汽流动情况:自然循环锅炉、强制循环锅炉和直流锅炉。\n1.锅炉的基本组成一般分两部分:锅炉本体:保证燃料(煤、气、油)充分燃烧,同时产生合格的蒸汽。辅助装置:保证连续可靠地供给锅炉合格的燃料、空气和水,并将燃料燃烧后所产生的灰渣和烟气排出。\n\n\n\n(2)锅炉的燃烧系统室燃炉/煤粉炉\nA.炉膛:燃料与可燃气体燃烧的空间,又称燃烧室。炉膛或烟道用炉墙密封,以隔绝火焰和烟气与外界大气,起保温作用。B.燃烧器:保证燃料进入炉膛后能迅速着火和完全燃烧,并使火焰很好地充满整个炉膛容积.C.空气预热器:在锅炉出口,对空气进行预热,既利用了排出烟气的热量,又可改善燃烧。\n(3)锅炉的辅助组成磨煤装置:将原煤磨制成合格的煤粉,并用热风将煤粉经一次风管送至燃烧器供炉膛燃烧。送风装置:将冷空气送至预热器加热,供给燃料燃烧和输送煤粉所用的空气。引风装置:将炉子中排出的烟气排到大气中去。给水装置:包括给水泵、给水管道及水处理设备。\n燃料供应装置:将燃料由储煤场送到锅炉房,包括装卸和运输机械等。除灰装置:从锅炉中除去灰渣并送出电厂。除尘装置:除去锅炉烟气中的飞灰,改善环境卫生。布置在锅炉与引风机之间,有布袋式、机械式、水膜式及电除尘器。自动控制与仪表:包括热工仪表及自动控制设备。\n2锅炉的工作过程包括三个同时进行的过程:A.燃料的燃烧过程B.烟气向水、汽的传热过程C.水的汽化过程\nA.燃料的燃烧过程煤粉在高温下释放出挥发分,挥发分燃烧完后,焦炭才开始点燃。焦炭和氧接触后首先在表面气化产生CO和CO2,CO2和介质中的水汽使焦炭气化,从而使固体焦炭转变为气体状态加速燃烧过程。燃烧反应由缓慢的表面反应转变为迅速的空间反应。燃烧反应主要是反应物和中间活性物起反应。燃料完全燃烧的三个条件:温度、空气、混合和时间。\nB.烟气向水、汽的传热过程
生成的高温火焰和烟气通过辐射传递热量给四周的水冷壁,水冷壁以对流的方式将热量传给管内的水。烟气还流经过热器、再热器、省煤器及空气预热器等,温度逐渐降低。
水冷壁管内水温上升,逐渐吸热、汽化,产生水蒸气,经汽水分离器后进入过热器。\nC.水的汽化过程给水经水泵、除氧、加热后进入省煤器。在省煤器中被加热进入汽锅。水沿下降管、下联箱进入水冷壁吸热汽化形成汽水混合物进入汽锅。蒸汽经分离器进入过热器加热。\n3锅炉的水循环在自然循环锅炉的蒸发部分中,工质的流动是借于自然推力—水和汽水混合物的密度差。\n水循环系统的要求:选用合适的水冷壁和下降管合理布置水冷壁下降管布置在炉壁外完全不受热\n4锅炉的基本参数锅炉的作用是产生一定数量和参数的蒸汽,在锅炉的规范中,以单位时间内产生的蒸汽量和所产生的蒸汽的参数来表示锅炉的基本参数。\n蒸发量((t/h):每小时所产生蒸汽的吨数。额定蒸发量:在规定的出口压力、温度和保证效率下长时期内能维持正常工作的最大蒸发量,也称最大长期蒸发量;经济蒸发量:锅炉机组具有最高效率时的蒸发量,一般为额定蒸发量的75~80%。蒸汽锅炉容量D:每小时所产生的额定蒸汽量,t/h。采暖锅炉容量Q:每小时产生的额定产热量,MW。蒸汽的参数:指锅炉出口处(即过热器出口)蒸汽的额定压力(MPa)和温度(℃)。\n低压锅炉蒸汽压力≤2.5MPa,蒸汽温度≤400℃;中压锅炉蒸汽压力2.6~6.0MPa,蒸汽温度400~450℃;高压锅炉蒸汽压力6~14MPa,蒸汽温度460~540℃;超高压锅炉蒸汽压力≥14MPa,蒸汽温度540~570℃;亚临界压力锅炉蒸汽压力17~18MPa,蒸汽温度540~570℃返回\n二、锅炉水、汽质量标准使用合格要求的水质,是锅炉能够安全、经济、可靠而稳定运行以及产出合格蒸汽或热水的前提。水质不良会导致锅炉损坏。\n1锅炉用水名称原水:生水,未经任何处理的天然水或城市自来水,作为锅炉补给水的水源。锅炉补给水:经处理后用来补充锅炉汽水损失的水。根据处理工艺有:澄清水:去除了原水中悬浮杂质的水;软化水:去除了原水中钙镁离子的水;除盐水:去除了原水中盐类离子的水;凝结水:锅炉产生的蒸汽用于汽轮机作功后,经冷却水冷凝成的水,以及石化生产过程中经分离后蒸汽冷凝的水。\n给水:送进锅炉的水。有汽轮机的凝结水、补给水、生产返回水和各种热力设备的疏水等。锅水:在锅炉本体的蒸发系统中流动的受热沸腾而产生蒸汽的水。排污水:为了保证锅水在一定浓度范围内运行,从而防止锅炉结垢和改善蒸汽品质,需从汽锅中排放掉一部分锅水,以排走由给水带入的盐分和锅内的沉渣,这部分排出的锅水称为排污水。疏水:各种蒸汽管道和各种热力设备中的蒸汽凝结水。减温水:调节过热器出口蒸汽在允许范围内,以保证过热器管壁温度不超过允许的工作温度,而采用混合减温时引入的水。\n2用水水质不良对锅炉的危害形成水垢导致锅炉受热面金属的损坏,降低锅炉使用寿命;减少受热管内流通截面,增加管内水循环的流动阻力;降低热效率,增加煤耗量或降低锅炉出力;增加化学清洗次数,多消耗化学清洗药剂;导致金属腐蚀。\n导致锅炉金属腐蚀锅水中游离氢氧化钠过高或pH低,又含有较多中性盐的情况下会导致金属腐蚀。易使蒸汽品质恶化锅水含盐量高会发生汽水工腾现象,污染蒸汽。在压力较高的锅炉中,硅等会选择性地溶解在蒸汽中。\n3锅炉水汽质量标准《低压锅炉水质质量标准》《水力发电机组及蒸汽动力设备水气质量标准》废热锅炉的水质标准\n第二节锅炉水处理锅炉用水——外界水,杂质:a.肉眼可见:泥沙、粘土等悬浮物,d>10-4mm,可过滤分离。b.肉眼不可见:胶体物质(分子离子的集合体),d=10-6~10-4mm不能过滤分离。溶解物质(离子)及气体,d<10-6mm\n\n一、主要水质指标1硬度H溶于水且能形成水垢的物质,即Ca2+、Mg2+离子的含量,mmol/L.暂时硬度HT:加热后形成沉淀析出的离子的含量,=碳酸盐硬度永久硬度HFT:受热后不会分解,当在水中浓度>饱和极限时析出的离子的含量,=非碳酸盐硬度H=HT+HFT\n2.碱度A:水中能接受H+物质的量,eg.OH-、HCO3-、CO32-等若酸盐,mmol/l;什么是相对碱度?HT属于可见碱度Na+盐碱度与HFT不能共存eg.Na2CO3(NaOH)+CaSO43.pH值:酸碱性指标自然水:6~8.5;给水:>7;锅水:10~124.溶解氧:控制溶解气体对受热面的腐蚀,mg/l控制亚硫酸根的浓度5.锅水含盐量:水中各种盐类含量的总和,影响蒸汽带水的指标,mg/L\n二、给水的软化处理Na+离子交换软化(用比Ca2+、Mg2+离子更活泼的离子将其置换,使水软化)离子交换剂——阳离子+阴离子R-有Na+、H+、NH4+等阳离子,复合阴离子根,为不溶置换水中的结垢离子于水的高分子化合物,eg.合成树脂\n\n(2)特点可除硬度==>可软化不能除碱软水的含盐量略有上升(3)交换剂再生用NaCl溶液(5~8%)流经失效的交换剂层,还原实际用量=(1.2~1.7)理论用量\n2.Na+交换设备(固定床)交换剂层固定不动,原水由上而下流经交换剂层筒体交换剂(1)顺流式再生——再生液由上向下流经交换剂层\n运行步骤:软化:原水由上而下(2)反洗:原水由下而上,松动交换剂层,带出层内杂质(3)再生(还原):盐液由上而下,恢复交换剂软化能力(4)正洗:原水由上而下,消除残余再生液和再生生成物\n特点:运行具有周期性,间断性出水,至少2个交换罐切换使用,或1个交换器:软水箱容量足够维持交换器“反洗…再生…正洗”时间内的锅炉用水量,传统系统图2)下层交换剂层再生程度低(为什么?)\n(2)逆流式再生——再生液由下向上流经交换剂层(下层交换剂再生效果好,出水品质好)防止交换剂层乱层:a中间排水装置b压实层(失效树脂)c加顶压(压缩空气)运行步骤:a软化b小反洗c排水d顶压f再生g逆流冲洗h小反洗i正洗\n3H-Na离子交换除碱\n\n\n三、水的除气原理——气体溶解定律:亨利定律(气体在水中的溶解度与该气体在汽水界面上的分压成正比)除气设备热力除氧器运行原理:通过加热使水沸腾,使溶于水中的气体解析出来。结构:除氧头(脱气塔)+除氧水箱(贮水箱)\n淋水盘式喷雾填料式\n\n\n四排污1目的:排出锅水中沉积物和过多的碱量、盐量,避免化学腐蚀2方式:定期排污-排出沉淀物,布置于锅筒、集箱底部。连续排污-排出盐分、碱分,布置于锅筒最低水位下方(一般可利用排污水热量后再排污)\n第三节锅炉的腐蚀与防护一给水系统的腐蚀及防止二汽包锅炉水汽系统的腐蚀、结垢及防止三锅炉化学清洗\n一给水系统的腐蚀及防止(一)给水系统的腐蚀(二)给水系统腐蚀的防止\n(一)给水系统的腐蚀给水系统中流动的水虽然较纯净,但其中含有O2和CO2,这两种气体是引起给水系统中金属腐蚀的主要因素。\n1溶解氧(DO)腐蚀腐蚀特征给水系统发生氧腐蚀时,表面形成许多小型鼓包,直径不一,称之为溃疡腐蚀,鼓包颜色由黄褐色至砖红色不等,次层则是黑色粉末状物,这些均为腐蚀产物,主要是铁的氧化物。腐蚀部位如果除氧工作不善,在给水管道和省煤器中常能看到这种腐蚀形态。凝结水系统不易发生氧腐蚀。虽然凝汽器汽侧是在负压运行,总有少量空气漏入,使凝结水中含有微量氧,但凝结水的含氧量一般小于50μg/L,而且温度低,含盐量小,微量氧不致引起严重的腐蚀。\n2游离CO2的腐蚀腐蚀特征钢材受游离CO2腐蚀而生成的腐蚀产物都是可溶的,所以其特征是金属均匀地变薄,这种腐蚀虽不致很快引起金属的严重损伤,但大量腐蚀产物进入锅内会引起锅内结垢和腐蚀等问题\n腐蚀部位热力设备汽水系统中的二氧化碳来源于补给水和漏入汽轮机凝结水中的冷却水带入的碳酸化合物,碳酸化合物进入锅内会全部发生分解,生成CO2:2HCO3-→CO2↑+H2O+CO32-CO32-+H2O→CO2↑+2OH-在热力系统中,最易发生CO2腐蚀的部位是凝结水系统,由于凝结水较纯,只要含少量CO2,其pH值就会显著降低。\n3同时有溶解氧和游离CO2的腐蚀在给水系统中,若同时含有O2和CO2,钢的腐蚀会更严重,这是由于O2的电极电位高,易形成阴极,侵蚀性强;CO2具有酸性,破坏保护膜。这种腐蚀的特征是金属表面往往没有腐蚀产物,但腐蚀速度很快。在凝结水和疏水系统都可能发生O2和CO2同时存在的腐蚀。而对于给水泵,因其是除氧器后第一个设备,所以当除氧不彻底时更易发生这类腐蚀。\n(二)给水系统腐蚀的防止为了防止给水系统的腐蚀,通常采用的方法是除去给水中溶解氧并提高pH,这种方法称之为“给水碱性水规范”。\n1热力除氧除氧原理由亨利定律可知,气体在水中的溶解度与此气体在气水界面上的分压成正比,所以,水温升至沸点,气水界面上水蒸气分压增大而其他气体减小甚至为0,这时水中原有的各种溶解气体都分离出来。热力除氧器不仅能除去水中溶解氧,而且可除去其他溶解气体如游离CO2,而且还会使水中HCO3-发生分解,这是因为除去了游离CO2,下述平衡被打破:2HCO3-≒CO2↑+H2O+CO32-\n运行注意事项水应加热至沸点解吸出来的气体应能通畅地排走送入的补给水量应稳定并列运行的各台除氧器负荷应均匀\n2化学除氧热力除氧后,给水中DO可降至7μg/L以下,仍能引起相当严重的腐蚀,因此要用化学法消除水中的残氧。\n(1)联胺除氧原理联胺是一种还原剂,可将水中DO还原N2H4+O2→N2+2H2O反应产物N2和H2O对热力系统没有任何害处。除了与O2反应外,联胺在高温(200℃以上)水中可将Fe2O3、CuO等还原,6Fe2O3+N2H4→4Fe3O4+N2+2H2O2Fe3O4+N2H4→6FeO+N2+2H2O2FeO+N2H4→2Fe+N2+2H2O4CuO+N2H4→2Cu2O+N2+2H2O2Cu2O+N2H4→4Cu+N2+2H2O联胺的这些性质可以用来防止锅内结铁垢和铜垢\n除氧条件必须使水有足够的温度温度越高,反应越快,温度低于50℃,联胺与O2反应速度很慢;温度高于100℃时,反应已明显加快;温度大于150℃,反应速度很快。必须使水维持一定的pH联胺必须在碱性水中才能是强还原剂,它与O2的反应速度与水的pH密切相关,pH在9~11时,反应速度最大。\n必须使水中N2H4有足够的剩余量在pH和温度相同时,N2H4过剩量越大,反应速度越快,除氧所需时间越少,但不宜过多,否则可能使未反应N2H4进入蒸气。综上所述,联胺除氧的合理条件为:150℃以上的温度,pH为9~11的碱性介质和适当的N2H4过剩量。\n加药药品通常使用的联胺是40%的N2H4·H2O溶液加药量N2H4的加药量通常按从省煤器入口所采得的给水水样中剩余N2H4含量来控制。一般地,给水中过剩N2H4含量可控制在20~50μg/L。加药点N2H4大都加在给水泵的低压侧,即除氧器出口处,以有利于药液和水的混合。\n(2)亚硫酸钠除氧原理Na2SO3也是一种还原剂,能与水中DO反应:2Na2SO3+O2→2Na2SO4由上式可见,Na2SO3除氧会增加水中含盐量。\n除氧的技术问题影响反应速度的因素Na2SO3与氧的反应速度不仅受温度、Na2SO3过剩量的影响,而且与水中其他物质的催化或阻化作用有关。温度越高,反应速度越快,Na2SO3过剩量越大,反应速度越快。Ca2+、Mg2+、Mn2+、Cu2+等对除氧反应有催化作用,而有机物和SO42-会减慢其反应速度。\nNa2SO3的分解溶液在高温时可能发生分解,4Na2SO3→3Na2SO4+Na2S(a)Na2S+2H2O→2NaOH+H2S(b)Na2SO3+H2O→2NaOH+SO2(c)如,当锅内压力为10.78MPa时,Na2SO3会发生(c)式的分解反应,产生SO2等气体进入蒸气。当SO2和H2S等气体进入汽轮机后就会腐蚀汽轮机叶片、凝汽器等。因此,Na2SO3除氧只能用在中低压锅炉,高压锅炉不能使用Na2SO3除氧,可用N2H4。\n(3)催化联胺催化联胺就是在联胺中添加了催化剂,大大提高了N2H4和O2的反应速度,尤其是在水温较低时。催化联胺中的催化剂大都是有机化合物,主要是以下几类:醌的化合物、芳胺和醌的混合物、1-苯基-3-吡唑烷酮、对氨基苯酚等,一般添加量极其微小。催化联胺在国外应用较为普遍。\n(4)有机除氧剂碳酰肼碳酰肼是联胺和CO2的衍生物,除氧反应与N2H4相似,但反应分两步,(N2H3)2CO+H2O→2N2H4+CO2N2H4+O2→N2+2H2O\n肟类除氧剂如甲基乙基酮肟、丙酮肟、乙醛肟等。其除氧反应,\n除此之外,肟类除氧剂还是金属钝化剂,他们与Fe2O3、CuO反应生成保护性氧化物,防止金属腐蚀,2R1R2CNOH+6Fe2O3→2R1R2CO+4Fe3O4+N2O+H2O2R1R2CNOH+4CuO→2R1R2CO+2Cu2O+N2O+H2O\n异抗坏血酸也是一种强还原剂,有除氧作用及钝化作用羟胺类化合物如二乙基羟胺,是一种强还原剂,与O2反应速度比N2H4更快。\n3调节给水的pH值随着水的pH值增大,钢铁的腐蚀明显减少。若单从钢铁考虑,给水的pH值应高于9,但在pH>9时,铜的腐蚀增大,所以全面考虑一般把给水的pH值调节在8.9~9.3的范围,调节方法是加氨或胺。\n(1)给水氨处理氨处理原理NH3具有不会受热分解和易挥发的性能。NH3调节pH的原理是NH3可与水中CO2反应,NH4OH+H2CO3→NH4HCO3+H2ONH4OH+NH4HCO3→(NH4)2CO3+H2O\n氨处理带来的问题NH3是一种挥发性物质,在热力系统中,NH3的流程与CO2相似,但NH3和CO2的分配系数有差别,即在汽水两相共存时,NH3在汽相、水相中的比值与CO2的不同,所以用NH3处理时,会出现某些地方NH3过多,另一些地方NH3过少。因此,不能用NH3作为解决给水因有利CO2而pH过低问题的唯一措施,而应首先尽可能降低给水中碳酸化合物含量,再进行加氨处理。\n加NH3处理常使人担心会不会引起黄铜的腐蚀,因为水中有NH3存在时,它会与Cu2+、Zn2+形成Cu(NH3)42+、Zn(NH3)42+,这样使原来不溶于水的Cu(OH)2保护膜溶解,破坏其保护作用而使黄铜遭受腐蚀。实践证明,水中含有NH3并含有氧化性物质如DO时,确有可能发生这种腐蚀。所以再用NH3处理时,首先应保证汽水系统中含氧量非常低,且加氨量不宜过多。为了保持给水的pH在8.8~9.3的范围内,给水中含氨量通常在0.5~1.0mg/L以下。\n(2)给水有机胺处理胺是氨的衍生物,用于给水处理的胺,按其用途不同分为中和胺和膜胺两类。中和胺这类胺用来中和给水中的酸性物质,应具有碱性、挥发性以及不与Cu2+、Zn2+形成络离子的性能。\n常用的中和胺吗啉又称对氧氮己烷、莫福林\n环己胺缺点:价格高,温度高于510℃条件下,中和胺在蒸气中可能发生分解,不适于高参数锅炉。\n膜胺是一类大分子量的烷胺,CnH2n+1NH2,常用的膜胺:十八烷胺、十六烷胺和癸胺。防腐原理膜胺能在金属表面吸附形成单分子层的保护膜,使水和金属表面完全隔离,因而防止了O2和CO2对金属的腐蚀。此外膜胺有较强的渗透性,能透过金属表面上的铁锈而在金属表面形成保护膜,所以膜胺可用在已发生腐蚀的水汽系统中。\n投加量膜胺投加量与水汽系统CO2含量无关,只要加入量足以使金属表面生成完整的保护膜即可。缺点不能用于高参数锅炉,膜胺在高温下分解。\n4给水氧化性水化学工况对于超临界压力机组和亚临界压力直流机组,前述的水质调节处理方法(亦称为给水还原性水化学工况)的防腐蚀效果不能完全满足机组的安全、长期运行。为此,开发了给水氧化性水化学工况。\n原理通常,DO是一种对金属有腐蚀性的物质,但当水中含盐量非常小,以至电导率小于0.15μS/cm时,DO就不再对钢铁有腐蚀性,相反,DO能促使钢铁表面形成保护膜,从而抑制腐蚀。比如,若电导率为0.1μS/cm,DO越大,腐蚀速度越小基于此原理,在水质极纯且呈中性或弱碱性条件下,向水中加入适量O2或H2O2,使钢铁表面生成保护膜,可防止给水系统的腐蚀。\n水质条件电导率<0.15μS/cmpH:7.0~7.5DO:50~250μg/L\n二、汽包锅炉水汽系统的腐蚀、结垢及防止
(一)水汽系统的腐蚀及防止
(二)水垢的形成及锅炉水磷酸盐处理\n(一)水汽系统的腐蚀及防止锅炉水汽系统如果发生较严重的腐蚀,那么由于锅内高温高压的作用,极易导致爆管事故,所以防止水汽系统的腐蚀是一个很重要的问题。水汽系统可能发生的腐蚀类型如下。\n1氧腐蚀在正常情况下不会有大气侵入锅内,而即使给水中带有微量的氧也往往在省煤器中就消耗完了,所以锅内不会发生氧腐蚀。但如果除氧器运行不正常或锅炉停用期间无防护,就有可能发生氧腐蚀。\n2沉积物下腐蚀腐蚀原理当锅内金属表面附着有水垢或水渣时,在其下面会发生严重的腐蚀,称之为沉积物下腐蚀,这是高压锅炉内常见的一类腐蚀。其可分为酸性腐蚀、碱性腐蚀两种类型。\n(1)酸性腐蚀若炉管的向火侧已沉积了一层沉积物,而炉水中有MgCl2和CaCl2等物质,当沉积物下的炉水蒸发浓缩时,MgCl2、CaCl2等发生以下反应,MgCl2+2H2O→Mg(OH)2↓+2HClCaCl2+2H2O→Ca(OH)2↓+2HClMg(OH)2、Ca(OH)2形成了新的沉积物,而沉积物下浓缩的炉水中积累了很多的H+,这样沉积物下会发生酸性水对金属的腐蚀,阳极反应Fe→Fe2++2e阴极反应2H++2e→2H→H2\n由于阴极反应发生在沉积物下,产生的H2不能很快扩散到汽水混合区域,因此在管壁和沉积物之间积累了多余的氢,一部分氢可能扩散到金属内部,与碳钢中的碳化铁(渗碳体)发生反应:Fe3C+2H2→3Fe+CH4因而造成碳钢脱碳,金相组织受到破坏,并且CH4会在金属内部产生应力,使金相组织产生裂纹。\n(2)碱腐蚀如果锅水中有游离NaOH,那么沉积物下会因炉水浓缩而形成高浓度的OH-。在高pH下,钢铁表面的Fe3O4保护膜被溶解而破坏Fe3O4+4NaOH→2NaFeO2+Na2FeO2+2H2O另一方面,高pH下,Fe与NaOH直接反应Fe+2NaOH→Na2FeO2+H2这就是碱腐蚀\n防止措施锅炉要定期清洗以除去管壁上的沉积物提高给水水质,防止给水系统腐蚀而使给水中铜铁含量增大\n尽量防止凝汽器泄漏。酸性腐蚀中MgCl2、CaCl2的主要来源就是凝汽器泄漏而导致冷却水进入。碱性腐蚀中的NaOH也是由于冷却水泄漏把碳酸盐带入给水中,在锅内高温下,碳酸盐发生下列反应:2HCO3-→CO2↑+H2O+CO32-CO32-+H2O→CO2↑+OH-HCO3-→CO2↑+OH-\n调节锅炉水质,消除或减少炉水中的侵蚀性杂质,如实行锅水的协调pH-磷酸盐处理,消除炉水中的游离NaOH做好锅炉的停用保护工作,防止停用腐蚀\n3水蒸气腐蚀腐蚀原理当过热蒸汽温度达到450℃时,蒸汽即与碳钢发生反应,在450~570℃之间,他们反应的产物是Fe3O4,3Fe+4H2O→Fe3O4+4H2当温度到570℃以上,反应产物是Fe2O3,Fe+H2O→FeO+H22FeO+H2O→Fe2O3+H2\n腐蚀部位在锅炉内,发生汽水腐蚀的部位一般在汽水停滞部分和蒸汽过热器中。防止方法消除锅炉中倾斜度较小的管段,保证汽水的正常循环;对于过热器,如温度过高,应采用特种钢材制造,如耐热的奥氏体不锈钢。\n4应力腐蚀当金属除了受某些侵蚀性介质的作用外,同时还受机械应力的作用时,会发生裂纹损坏,称为应力腐蚀。锅炉金属的应力腐蚀有以下几种:疲劳腐蚀、应力腐蚀开裂、苛性脆化。\n腐蚀疲劳定义金属在交变应力作用下发生的一种应力腐蚀。在锅炉汽包的管道结合处,因金属局部受到交变冷热应力的作用,会发生腐蚀疲劳。防止方法防止发生腐蚀疲劳可以从消除应力方面着手,例如在汽包的给水管接头处加装特殊的保护套管,使汽包壁上管孔处的金属不与给水进水管直接接触,而在其间隔着一层蒸汽或炉水,消除温度的剧变。\n应力腐蚀开裂定义应力腐蚀开裂是奥氏体钢在应力和侵蚀性介质作用下发生的腐蚀损坏。所谓侵蚀性介质主要是指氯化物、氢氧化钠和硫化物等。应力腐蚀开裂主要发生在高参数锅炉的过热器和再热器等奥氏体钢部件上。\n防止措施制造、安装和检修时应尽可能消除钢材内应力,在锅炉化学清洗或部件水压试验时,要小心避免含有氯化物、硫化物、氢氧化物的水溶液进入或残留在过热器、再热器管子中,对于U型弯头处应特别留意。\n苛性脆化定义由于水中的苛性钠使受腐蚀的金属发生脆化,称之为苛性脆化。锅炉苛性脆化不易察觉,当观察到裂纹时,金属的损伤已达到严重的程度,轻者使锅炉不能使用,重者发生锅炉爆炸。\n防止措施维持一定的相对碱度。相对碱度指锅水重游离NaOH量和总含盐量之比,对于中低压锅炉,控制炉水相对碱度小于0.2不会发生苛性脆化。实施锅炉水协调pH-磷酸盐处理。锅炉水协调pH-磷酸盐处理可以消除锅炉水中的游离NaOH,因而可防止苛性脆化的发生,此法适用于高压和超高压锅炉。\n(二)水垢的形成及锅炉水磷酸盐处理锅炉水中形成的水垢种类主要有钙镁水垢、硅酸盐水垢、氧化铁垢、铜垢等。为了防止水垢的形成,必须对锅炉给水进行严格处理,尽量减少成垢离子的量,另外就是采用锅内加药的方法进行水质调节以防止水垢的形成,最常用的锅内水质调节方法是磷酸盐处理。\n1磷酸盐防垢处理原理在锅炉水中经常维持一定量的磷酸根,由于锅炉水处在沸腾条件下,而且碱性较强(pH一般在9~11范围内),因此,炉水中的钙离子与PO43-会发生下列反应,10Ca2++6PO43-+2OH-→Ca10(OH)2(PO4)6生成的Ca10(OH)2(PO4)6是一种松软的水渣,易随锅炉排污排除,不会黏附在锅内变成水垢。\n常用药品采用磷酸盐对锅炉水进行处理时,常用的药品是Na3PO4·12H2O。有时由于锅炉水碱度太高,为降低锅炉水的碱度,可采用Na2HPO4处理,可消除部分游离NaOH:Na2HPO4+NaOH→Na3PO4+H2O\n锅炉水中的PO43-为了防止在锅炉中产生钙垢,锅炉水中必须维持足够的PO43-量,而PO43-量究竟该维持多少,目前还估算不出,主要凭实践经验来定。锅炉水中的PO43-不应太多,否则会引起诸多不良后果:增加锅炉水的含盐量,影响蒸汽品质有生成Mg3(PO4)2的可能容易在高压和超高压锅炉中发生Na3PO4的“隐藏”现象\nMg3(PO4)2的生成随给水进入锅内的Mg2+量是很少的,在沸腾的碱性锅炉水中,Mg2+会和SiO32-发生下列反应:3Mg2++2SiO32-+2OH-+H2O→3MgO·2SiO2·2H2O↓蛇纹生成的蛇纹石呈水渣形态,易随排污而排除。但当锅炉水中PO43-过多时,有可能生成Mg3(PO4)2。由于Mg3(PO4)2在高温水中的溶解度非常小,能黏附在炉管内形成二次水垢\n磷酸盐隐藏的实质在锅炉负荷增加时,锅炉水中的磷酸盐一部分从水中析出,沉积在炉管管壁上,结果炉水中的磷酸盐浓度降低,而在负荷减小时,沉积在炉管管壁上的磷酸盐又被溶解下来,使炉水中的磷酸盐浓度重新增高。由此可见,出现磷酸盐隐藏现象时,在炉管管壁上必有磷酸盐的附着物形成,其危害性与水垢相似。\n2协调pH-磷酸盐处理协调pH-磷酸盐处理不仅能防止钙垢的析出,而且能防止炉管的腐蚀。原理协调pH-磷酸盐处理就是除了向汽包中添加Na3PO4外,再添加其他适当的药品,使锅炉水既有足够的pH和维持一定的PO43-含量,又不含有游离NaOH,怎样保证不含有游离NaOH呢?\n如果向锅炉水中加入Na2HPO4,使之与NaOH发生反应:Na2HPO4+NaOH→Na3PO4+H2O只要Na2HPO4足量,NaOH均可以变成Na3PO4而消除。但当发生磷酸盐暂时消失时,锅炉水中又会出现游离NaOH:Na3PO4+0.15H2O→Na2.85H0.15PO4↓+0.15NaOH因此Na2HPO4的添加量不能简单地由锅炉水中游离NaOH量决定,而必须考虑出现磷酸盐暂时消失时的情况。\n为了描述水中不同组分的磷酸盐,人们给出了一个比值Na/PO4(R),它代表磷酸盐溶液中Na+、PO43-的摩尔比。例如Na3PO4溶液中R为3,Na2HPO4溶液中R为2,Na3PO4+Na2HPO4混合液中R为2~3。研究表明,当磷酸盐溶液中Na/PO4小于2.85大于2.13时,即使发生磷酸盐暂时消失现象,炉管管壁边界层也不会产生游离NaOH,这样可避免炉管管壁发生碱性腐蚀。\n为了防止炉管有发生酸性腐蚀的可能性,必须保证锅炉水的pH较高。此外,考虑到高压和超高压锅炉炉水中含有少量NH3,为了减小NH3所产生的影响,R的下限定位2.3较合适,即炉水的R在2.3~2.8的范围内。此外,还要保证炉水的pH值在合适的范围内。\n水质控制在进行锅炉水协调pH-磷酸盐处理时,要精确测定炉水的pH(25℃)和PO43-,要求测试结果有效数字为两位,并严格控制在所谓的“安全区”内,安全区可由pH-PO43-浓度图获得。高压锅炉实施协调pH-磷酸盐处理时,炉水水质控制如下:pH(25℃)>9.10,PO43-为4~10mg/L,Na/PO4:2.3~2.8。\n锅内加药配方配方应由炉水水质条件决定。例如如下两种情况:炉水中有游离NaOH,即炉水中Na/PO4大于3.0。此时锅内处理应由原来的Na3PO4单一配方,改为Na3PO4+Na2HPO4配方,调节Na/PO4在2.3~2.8之间。炉水中PO43-已达到10mg/L,但炉水pH仍低于9,锅内处理应由原来的Na3PO4单一配方,改为Na3PO4+NaOH配方。\n第四节锅炉化学清洗一、碱洗二、酸洗三、漂洗与钝化\n清洗目的化学清洗的目的在于除去锅炉金属受热面上积聚的氧化铁垢、钙镁水垢、铜垢、硅酸盐垢和油垢等,以免锅内沉积物过多而影响锅炉的安全运行。\n怎样确定锅炉需要进行化学清洗在大修前的最后一个小修中,割开水冷壁管测垢量,当水冷壁管内沉积物达到或超过下表的极限时,应进行化学清洗。上述并非硬指标,而应根据实际情况合理调整。炉型汽包炉直流炉主蒸汽压力MPa<5.885.88~12.64>12.64沉积物量g/m2600~900400~600300~400200~300\n锅炉化学清洗的一般工艺步骤水冲洗→碱洗→水冲洗→酸洗→水冲洗→漂洗→钝化\n一、碱洗目的碱洗又称为碱煮,主要是除去油污和一些碱溶性沉积物,同时可改善被清洗设备表面的润湿性,松动某些致密的垢层。\n原理使硅化合物变为可溶性物质利用碱液中的OH-或磷酸盐水解生成的OH-与硅化合物反应,使之转化为可溶性物质。Na3PO4+H2O→Na2HPO4+NaOHNa2HPO4+H2O→NaH2PO4+NaOH2NaOH+SiO2→Na2SiO3+H2O皂化除油润湿表面NaOH能与动植物油脂反应,生成甘油和肥皂:(C17H35COO)3C3H5+3NaOH→3C17H35COOH+C3H5(OH)皂可进一步改善水溶液对垢层的润湿性能。\n转化溶解硫酸盐垢CaSO4属强酸强碱沉淀盐,不能用强酸溶解。磷酸盐、NaOH可使CaSO4转型并呈孔隙状,提高酸洗效果。3CaSO4+2Na3PO4→2Ca3(PO4)2+3Na2SO4CaSO4+2NaOH→Ca(OH)2+Na2SO4此外,碱煮若用Na2CO3,则Na2CO3可与CaSO4、CaSiO3等难溶于酸的物质在较高温度下反应,使之转化为CaCO3,再用酸洗。CaSO4+Na2CO3→CaCO3+Na2SO4CaSiO3+Na2CO3→CaCO3+Na2SiO3\n碱煮药剂一般选用Na3PO4和Na2HPO4,为增加除油效果,可适当添加润湿剂,如0.8%Na3PO4·12H2O+0.4%Na2HPO4+0.05~0.1除油剂。NaOH和Na2CO3也可作为清洗剂,但对于大型发电锅炉一般不用NaOH和Na2CO3,主要是为了减少清洗时的游离OH-,因此NaOH和Na2CO3的清洗多用于中小型锅炉。\n清洗工艺将清洗剂通过清洗泵注入锅炉和省煤器至锅筒最高水位,开启炉水循环泵进行清洗。建筑时间应根据锅炉内的污脏程度而定,一般在压力为1.0~2.0MPa下持续碱煮12~14小时。煮炉液应定期取样,分析碱度、磷酸盐和溶解硅酸,同时也应检查是否存在油脂。若炉水碱度降低至它的初始值的1/2时,应添加煮炉化学药品以恢复初始浓度。\n当煮炉溶液分析结果显示碱度、磷酸盐已已达平衡状态,且取样中不存在油脂时,锅炉细活,当锅筒压力降至0.21MPa时,打开锅筒排气阀和过热器疏水阀,并保持水循环,待锅筒壁温度降至93℃以下时,停泵排水。\n二、酸洗1盐酸原理用盐酸溶液清洗锅炉水垢和氧化铁垢,约占锅炉酸洗量的75%,不锈钢出外,大多数金属设备均可用HCl清洗。盐酸不仅可将沉积物或垢溶解,还可使附着物从金属表面脱落下来。大多数钙镁垢溶于盐酸中,盐酸与垢和氧化铁皮接触时,首先与基底金属交界处垢层中的某些物质反应,使垢层和氧化铁皮成碎片脱落。\nCaCO3+2HCl→CaCl2+H2O+CO2↑MgCO3·Mg(OH)2+4HCl→2MgCl2+3H2O+CO2↑FeO+2HCl→FeCl2+H2OFe2O3+6HCl→2FeCl3+3H2OFe3O4+8HCl→FeCl2+2FeCl3+4H2O\n工艺特点优点:速度快价格低废液易处理\n缺点盐酸对低合金钢的汽包钢等敏感酸洗后至锅炉点火吹管时间长,易产生二次锈蚀过热器及炉前给水系统不能用盐酸清洗Cu2+较多时,Cu会在金属表面析出,使钢铁表面镀铜\n2氢氟酸原理HF是弱酸,但HF比HCl、H2SO4、H3Cit等有更强的溶解氧化铁的能力,主要是因为F-的络合作用。HF与磁性氧化铁接触时首先发生F-O交换,继而进行F-的络合作用,使氧化铁皮得以溶解。当HF与具有络合能力的有机酸混合使用时,HF中的F-不再具有络合能力,HF只起催化剂作用,本身并不参加反应,例如HF在H3Cit中的反应,\nFe3O4+8HF→2Fe3++Fe2++8F-+4H2O2Fe3++Fe2++3H3Cit→2[FeCit]+H[FeCit]+8H+总反应:Fe3O4+8HF+3H3Cit→2[FeCit]+H[FeCit]+8HF+4H2O实际酸洗中,HF起双重作用,以催化作用为主,次之是络合作用,所以也要少量消耗HF。HF是硅垢的唯一酸洗剂,SiO2+4HF→SiF4+2H2OSiO2+8H++6F-→SiF62-+2H2O\n工艺特点锅炉经HF酸洗后,受热面洁净,并能获得暂时的钝化膜。酸洗后锅炉启动后蒸汽品质较好,特别是蒸汽中SiO2含量在一天内即可下降到合格。酸洗时间短,效率高,溶解氧化铁皮的起始速度高。HF对钢材均具有良好的适应性,但对钛材腐蚀严重。\n3柠檬酸机理柠檬酸清洗时易产生柠檬酸铁沉淀,为此一般采用柠檬酸单氨清洗,即将3%的柠檬酸溶液用氨水调节pH至3.0~3.5,柠檬酸单氨铁的溶解度较大,清洗分三步进行:1)离解H3Cit+NH3·H2O→C3H4OH(COOH)2·COONH4+H+2)溶解反应Fe+2H+→Fe2++H2Fe2O3+6H+→2Fe3++3H2OFe3O4+6H+→2Fe3++3H2O\n3)综合络合反应Fe+NH4H2C6H5O7→FeNH4C6H5O7+H2Fe2O3+2NH4H2C6H5O7→2FeC6H5O7+H2O+2NH3·H2OFe3O4+3NH4H2C6H5O7→FeNH4C6H5O7+2FeC6H5O7+2H2O+2NH3·H2O\n工艺特点工艺控制要求严格,系统连接复杂柠檬酸清洗以络合作用为主,适用于奥氏体钢和蛇形管清洗清洗时流速应大于0.5m/s,温度应大于90℃柠檬酸没有溶硅垢能力,机组启动时应有洗硅措施\n4络合剂(ACR)ACR清洗法是近年来发展起来的新型清洗方法。ACR清洗剂是一种碱性的对氧化铁、氧化铜具有良好络合能力的有机混合物,其组成以EDTA钠盐为主,并加有顺丁烯二酸酐、羟胺、多乙基醇胺等,此外还有缓蚀剂。将其配成0.5~1%清洗液,pH9~9.2使用。\nACR清洗特点能在短时间内完成清洗,如除铁一般只需6小时,除铜在80℃下进行并加入氧化剂只需2~6小时,所以可利用周末或假日进行,又称周末清洗法能使用一种清洗剂同时清洗铁垢和铜垢清洗pH在9.0~9.2,不会腐蚀锅炉材质,避免氢脆清洗后即生成钝化膜,可省去漂洗、钝化操作废液可回收,向其中加HCl或H2SO4,调节pH至1.0,EDTA即析出\n4蒸汽加氧吹洗原理在高温汽流和O2的共同作用下,使管道及设备在机组安装过程中产生的污脏物和大气腐蚀产物从管中排出,并在设备内表面生成致密的钝化膜。炉内腐蚀产物主要由热力学不稳定的低价氧化铁组成,在温度较高及O2作用下,可转变为高价铁氧化物,相组成发生变化,\n4FeO+O2→2Fe2O36FeO+O2→2Fe3O46Fe(OH)2+O2→Fe3O4+6H2O4Fe+3O2→2Fe2O33Fe+2O2→2Fe3O4当沉积物的相组成发生变化时,其结构坚固性被破坏,在一定压力、温度的过热蒸汽以较高流速通过时,便能将沉积物机械地除去。清洗后的金属表面在高温O2的氧化作用下,形成高强度的保护膜,无需另行钝化。\n适用的部位再热器和过热器通常含有一部分奥氏体钢材,为防止奥氏体钢材发生晶间腐蚀,一般不采用化学清洗的方法,此时可采用蒸汽加氧吹洗工艺。\n5其他除以上介绍的清洗方法外,还有许多其他清洗剂,如HCl+H3Cit,NH2SO3H,HOCH2COOH,EDTA,HEDP,PAA,HNO3等。\n三、漂洗与钝化漂洗钝化钝化膜耐蚀性的检验\n1漂洗酸洗后,随着冲洗的进行,pH升高,Fe3+转化为难溶的氧化物附着于设备表面,这对钝化极为不利,是引起二次锈蚀的主要原因。为减少表面附着的氧化物量,可用稀柠檬酸漂洗,漂洗一段时间后,可加NH3·H2O中和,待pH升高后再钝化。因为残余Fe3+在pH较高的柠檬酸铵溶液中仍被很好地络合溶解,所以不会沉积在金属表面而影响钝化效果。\n2钝化酸洗钝化剂一般有Na3PO4、N2H4、NaNO2、多聚磷酸钠、H2O2、DMKO、乙醛肟、EDTA充氧钝化及EDTA清洗钝化等。\n钝化剂N2H4NaNO2Na3PO4Na3PO4+NaOH钝化剂浓度,%0.0050.010.030.10.51.02.03.020.6+0.5pH9.79.69.19.31010101011.612.7钝化时间,h2424242444441212湿热箱试验发生腐蚀的时间,h242727271401681681682731\n钝化膜耐蚀性的检验湿热箱法将钝化后的试样悬挂在湿热箱中,保持其相对湿度95%±2%,每昼夜温度为:16h保持在(40±2)℃,其余8h保持在(30±2)℃,共进行7昼夜试验。定期观察试样表面状态、锈蚀程度,并以试样表面最初出现锈点的时间作为金属试片在湿热箱中的耐蚀时间。\n恒电位仪法利用恒电位仪,测定钝化后的试片在电解质溶液中的腐蚀电位,画出φ~t曲线,根据曲线评定膜的耐蚀性。电解质溶液为0.025g/LNaCl+0.057g/LNa2SO4+0.164g/LNa2CO3混合液。\n硫酸铜溶液点滴试验法在钝化后的试样表面,选择若干点(其他处用石蜡封盖),然后逐渐点滴上CuSO4溶液,根据滴入试片表面Cu2+颜色的变化(由蓝变红)时间快慢来评定膜的质量,而且通过同一试片上各点变色时间的长短可看出膜的均匀性。CuSO4点滴溶液:0.4mol/LCuSO4溶液40mL+10%NaCl溶液20mL+0.1mol/LHCl溶液1.5mL,混合后用除盐水稀释至100mL。耐蚀性标准:变色时间大于10s为优良,5~10s为合格,≤5s为不合格。