- 2.51 MB
- 2022-04-22 13:33:15 发布
- 1、本文档共5页,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报电话:19940600175。
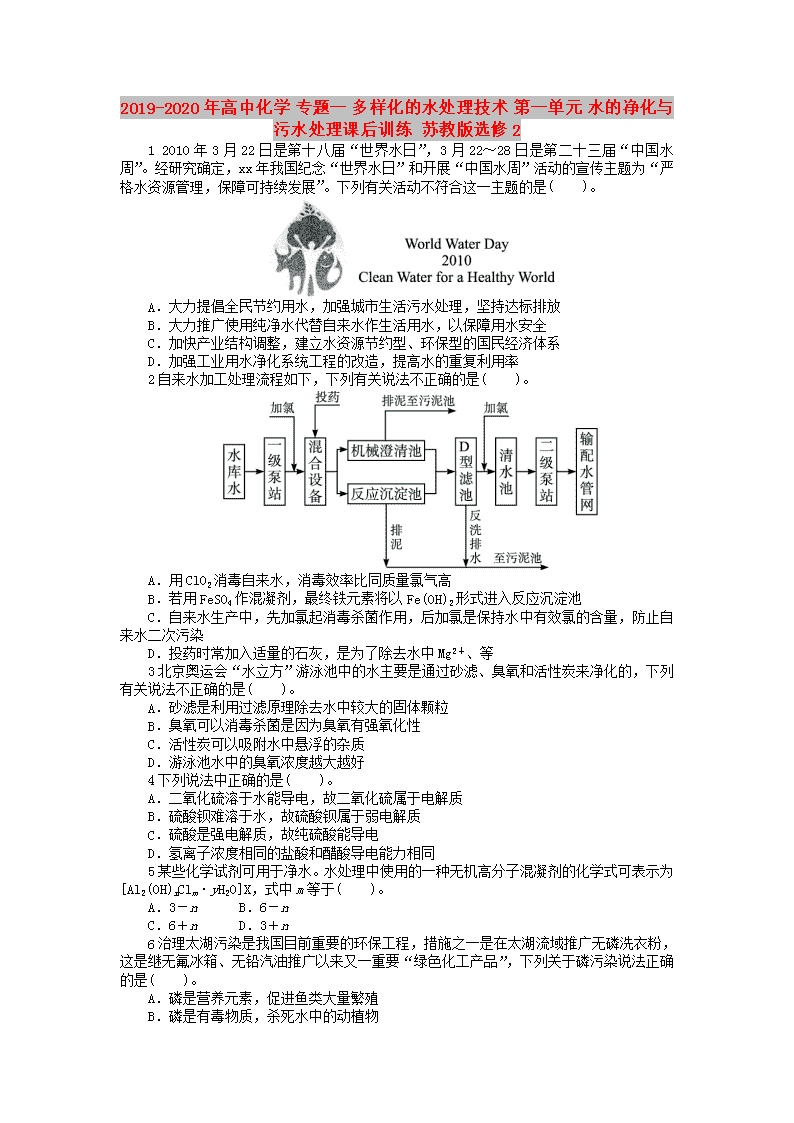
'2019-2020年高中化学专题一多样化的水处理技术第一单元水的净化与污水处理课后训练苏教版选修212010年3月22日是第十八届“世界水日”,3月22~28日是第二十三届“中国水周”。经研究确定,xx年我国纪念“世界水日”和开展“中国水周”活动的宣传主题为“严格水资源管理,保障可持续发展”。下列有关活动不符合这一主题的是( )。A.大力提倡全民节约用水,加强城市生活污水处理,坚持达标排放B.大力推广使用纯净水代替自来水作生活用水,以保障用水安全C.加快产业结构调整,建立水资源节约型、环保型的国民经济体系D.加强工业用水净化系统工程的改造,提高水的重复利用率2自来水加工处理流程如下,下列有关说法不正确的是( )。A.用ClO2消毒自来水,消毒效率比同质量氯气高B.若用FeSO4作混凝剂,最终铁元素将以Fe(OH)2形式进入反应沉淀池C.自来水生产中,先加氯起消毒杀菌作用,后加氯是保持水中有效氯的含量,防止自来水二次污染D.投药时常加入适量的石灰,是为了除去水中Mg2+、等3北京奥运会“水立方”游泳池中的水主要是通过砂滤、臭氧和活性炭来净化的,下列有关说法不正确的是( )。A.砂滤是利用过滤原理除去水中较大的固体颗粒B.臭氧可以消毒杀菌是因为臭氧有强氧化性C.活性炭可以吸附水中悬浮的杂质D.游泳池水中的臭氧浓度越大越好4下列说法中正确的是( )。A.二氧化硫溶于水能导电,故二氧化硫属于电解质B.硫酸钡难溶于水,故硫酸钡属于弱电解质C.硫酸是强电解质,故纯硫酸能导电D.氢离子浓度相同的盐酸和醋酸导电能力相同5某些化学试剂可用于净水。水处理中使用的一种无机高分子混凝剂的化学式可表示为[Al2(OH)nClm·yH2O]X,式中m等于( )。A.3-nB.6-nC.6+nD.3+n6治理太湖污染是我国目前重要的环保工程,措施之一是在太湖流域推广无磷洗衣粉,这是继无氟冰箱、无铅汽油推广以来又一重要“绿色化工产品”,下列关于磷污染说法正确的是( )。A.磷是营养元素,促进鱼类大量繁殖B.磷是有毒物质,杀死水中的动植物
C.磷导致藻类疯长,鱼类因缺氧而无法生存D.磷促进水中动植物尸体的分解7某工厂废水中含5.00×10-3mol·L-1的,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料Cr0.5Fe1.5FeO4的流程图示意如下:下列有关判断错误的是( )。A.操作①中反应的离子方程式为+6Fe2++14H+===2Cr3++6Fe3++7H2OB.操作②所得的滤渣成分主要为Fe(OH)3、Fe(OH)2、Cr(OH)3C.磁性材料Cr0.5Fe1.5FeO4中,显+3价铁与显+2价铁的质量之比为2∶3D.若废水中杂质不与绿矾反应,将该1L废水中的完全转化为Cr0.5Fe1.5FeO4,理论上需加入绿矾13.9g8含有农药、染料、酚、氰化物,以及引起色度、臭味的废水,常用化学氧化法进行处理,所用的氧化剂有氯类(如液氯、次氯酸钙、次氯酸钠等)和氧类(如空气、臭氧、过氧化氢、高锰酸钾等)。一个典型实例是用氯氧化法处理含有剧毒的氰化物(含CN-)的废水。在碱性条件下(pH=8.5~11),氯气可将氰化物中CN-氧化为只有它毒性1/1000的氰酸盐(含CNO-)。(1)写出含CN-废水用氯气氧化生成氰酸盐的离子方程式:______________________。(2)若向含CNO-的废水中再通入氯气,可使CNO-转化为无毒的气体,写出这个反应的离子方程式:______________________________。(3)在用液氯不便的地区,可用漂白粉处理含CN-的废水,若将其氧化为CNO-,其离子方程式为______________________________。9废水中的氮常以含氮有机物、氨、硝酸盐及亚硝酸盐等形式存在。生物处理的方法是先将大多数有机态氮转化为铵态氮,然后通过进一步转化成N2而消除污染。生物除氮工艺有以下几种方法:【方法一】在有氧条件下,通过好氧硝化菌的作用,将废水中的铵态氮转化为中间过渡形态的硝酸态氮和亚硝酸态氮,然后在缺氧条件下,利用反硝化菌,硝酸态氮和亚硝酸态氮被水中的有机物还原为氮气。见图中之①。反应过程如下:(注:有机物以甲醇表示;当废水中有机物不足时,需另外投加有机碳源)2+3O2===2HNO2+2H2O+2H+2HNO2+O2===2HNO36+2CH3OH―→6+2CO2↑+4H2O6+3CH3OH―→3N2↑+3CO2↑+3H2O+6OH-【方法二】与方法一相比,差异仅为硝化过程的中间过渡形态只有亚硝酸态氮。见图中之②。请回答下列问题:(1)大气中的氮氧化物的危害有________和________等。(2)方法一中铵态氮元素1g转化为硝酸态氮时需氧的质量为________g。(3)从原料消耗的角度说明方法二比方法一有优势的原因:__________________。
(4)自然界中也存在反硝化作用,使硝酸盐还原成氮气,从而降低了土壤中氮素营养的含量,对农业生产不利,农业上可通过松土作业,以防止反硝化作用。其原因是________________________________________________________________________。(5)荷兰Delft大学Kluyver生物技术实验室试验确认了一种新途径。在厌氧条件下,以亚硝酸盐作为氧化剂,在自养菌作用下将铵态氮(铵态氮以NH表示)氧化为氮气(见图中过程③)。其反应的离子方程式为______________________________________________。
参考答案1.解析:B选项和节约用水的主题相违背。答案:B2.解析:A对,因为ClO2比同质量氯气得电子多。B错,因为混凝剂要经过水解变为胶体,最终聚沉为Fe(OH)3。答案:B3.解析:游泳池水中的臭氧浓度不是越大越好。答案:D4.解析:不能仅仅根据溶液是否导电判断电解质和非电解质,也不能根据化合物的溶解性及溶液的导电能力判断电解质的强弱。对于A项,SO2的水溶液导电,电解质是H2SO3,不是SO2;BaSO4难溶于水,只是溶解度小,但溶解的部分完全电离,BaSO4是强电解质,故B项错误;对于C项,尽管硫酸是强电解质,由于没有水存在,H2SO4未电离,因此不能导电;对于D项,不能因为醋酸是弱电解质其溶液的导电能力就一定弱,因为溶液的导电能力主要决定于溶液中自由移动的离子的浓度。答案:D5.解析:由电荷守恒可知:6=m+n。答案:B6.解析:磷对水体的污染主要是因为它是水生植物生长的营养元素,水体中含磷量增加,水生植物疯长,将水面完全覆盖后,鱼类及其他水生动物、浮游生物都会因缺氧而窒息死亡。答案:C7.解析:①步骤,在酸性溶液中与Fe2+反应生成Cr3+、Fe3+、H2O,离子方程式为+6Fe2++14H+===2Cr3++6Fe3++7H2O,A选项正确;向含Fe2+、Fe3+、Cr3+的溶液中加入氢氧化钠溶液后,得到三种沉淀:Fe(OH)2、Fe(OH)3、Cr(OH)3,B选项正确;这三种氢氧化物焙烧失水得到磁性材料Cr0.5Fe1.5FeO4,元素化合价没有变化,该化学式中Cr显+3价,若+2价铁为1.5mol,+3价铁为1mol,则正化合价代数和为3×0.5+2×1.5+3×1=7.5,负化合价代数和为(-2)×4=8,化学式中总的化合价代数和不等于0,由此说明,+2价铁为1mol,+3价铁为1.5mol,故说明该材料中,n(Fe2+)∶n(Fe3+)=1mol∶1.5mol=2∶3,C选项不正确;D选项,理论上,1L废液中含有的物质的量:n()=5.00×10-3mol·L-1×1L=5.00×10-3mol,根据关系式:~4Cr0.5Fe1.5FeO4~10FeSO4·7H2O得出,理论上需要绿矾:m(FeSO4·7H2O)=5.00×10-3mol×10×278g·mol-1=13.9g,D选项正确。答案:C8.解析:(1)CN-是在碱性条件下被Cl2氧化的,故反应物应有OH-参加,产物除生成氰酸盐外还应有Cl-及H2O,离子方程式为CN-+Cl2+2OH-===CNO-+2Cl-+H2O。(2)当Cl2过量时(1)中的产物CNO-与Cl2反应,碱性条件下不可能产生CO2及其他气体,而碳元素的存在形式为,无毒气体一定为N2,离子方程式:2CNO-+3Cl2+8OH-===2+6Cl-+4H2O+N2。(3)由于漂白粉中的ClO-具有强氧化性,故可发生反应:CN-+ClO-===CNO-+Cl-。答案:(1)CN-+Cl2+2OH-===CNO-+2Cl-+H2O(2)2CNO-+3Cl2+8OH-===2+6Cl-+4H2O+N2(3)CN-+ClO-===CNO-+Cl-9.解析:本题是与生活相联系的信息情景题。(1)氮的氧化物常见危害是破坏臭氧层、形成光化学烟雾、形成酸雨等;(2)从方程式可以看出,2mol完全转化为HNO3时消耗4molO2,则1g铵态氮元素需要的氧气的质量为×2×32g=4.57g;(3)注意要从原料消耗的角度去解释;(4)通过松土作业,增加与氧气的接触,防止反硝化作用;(5)依据题中所给的信息,可以写出方程式:+===N2↑+2H2O。答案:(1)破坏臭氧层 光化学污染 形成酸雨(任选2项)(2)4.57(4.6也可)(3)节省铵态氮氧化到硝酸态氮所需的氧,还可节省还原硝酸态氮到氮气的有机碳源
(4)增加与氧气的接触,防止反硝化作用(5)+===N2↑+2H2O'
您可能关注的文档
- 对虾养殖业污水处理技术研究
- 油田污水处理技术与设备汇总(整理搜集的)
- 生活污水处理技术规范
- 医疗污水处理技术指南
- 污水处理技术综述与方案设计比选
- 涂料废水处理技术实用工艺
- 农村饮水工程中的水处理技术及净化工艺
- 水处理技术讲课材料
- 生活污水处理技术要求规范
- 2019-2020年高中化学专题一多样化的水处理技术第三单元海水淡化课后训练苏教版选修2
- 2019-2020年高中化学专题一多样化的水处理技术第三单元海水淡化学案苏教版选修
- 2019-2020年高中化学专题一多样化的水处理技术第一单元水的净化与污水处理学案苏教版选修
- 2019-2020年高中化学专题一多样化的水处理技术第二单元硬水软化学案苏教版选修
- 2019-2020年高中化学专题一多样化的水处理技术1.2硬水软化与海水淡化教案苏教版选修
- 2019-2020年高中化学专题一多样化的水处理技术第二单元硬水软化课后训练苏教版选修
- 2019-2020年高中化学专题一多样化的水处理技术第二单元硬水软化第三单元海水淡化教案苏教版选修
- 2019-2020年高中化学专题一多样化的水处理技术1.1水的净化与污水处理教案苏教版选修
- 工厂化养殖废水处理技术