- 694.22 KB
- 2022-04-22 11:21:53 发布
- 1、本文档共5页,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报电话:19940600175。
'课后答案网,用心为你服务!大学答案---中学答案---考研答案---考试答案最全最多的课后习题参考答案,尽在课后答案网(www.khdaw.com)!Khdaw团队一直秉承用心为大家服务的宗旨,以关注学生的学习生活为出发点,旨在为广大学生朋友的自主学习提供一个分享和交流的平台。爱校园(www.aixiaoyuan.com)课后答案网(www.khdaw.com)淘答案(www.taodaan.com)
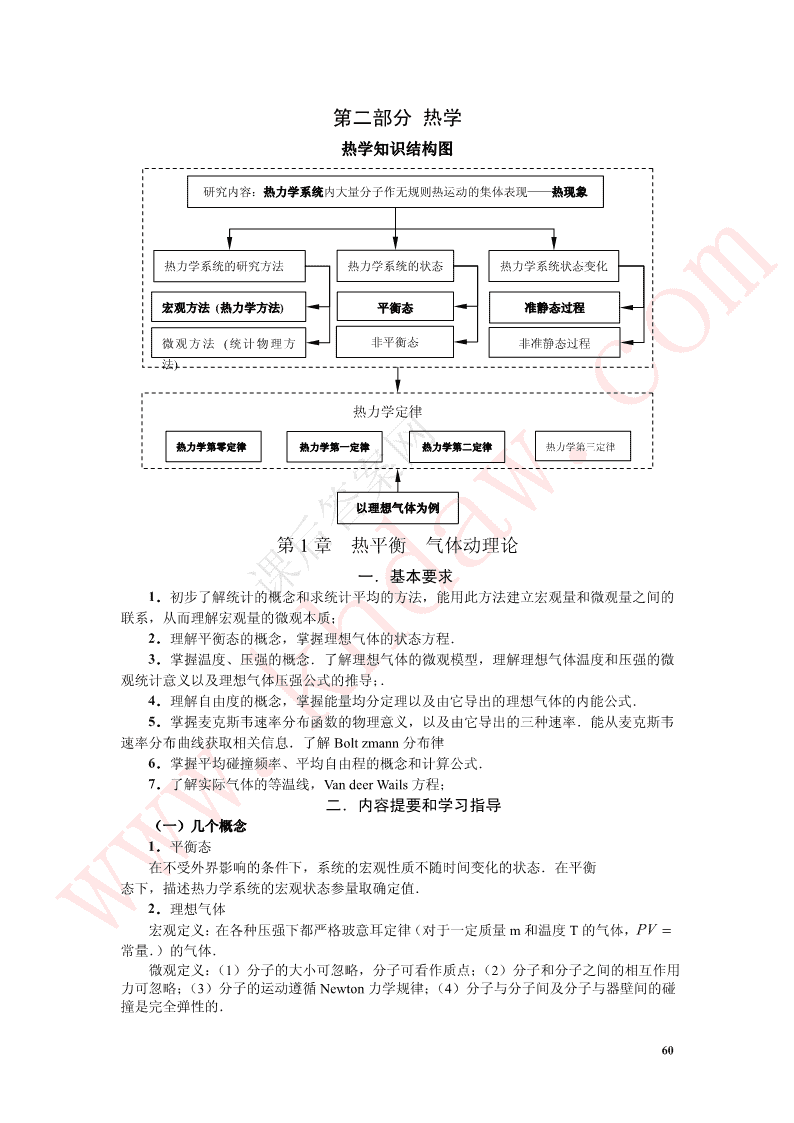
第二部分热学热学知识结构图研究内容:热力学系统内大量分子作无规则热运动的集体表现——热现象热力学系统的研究方法热力学系统的状态热力学系统状态变化宏观方法(热力学方法)平衡态准静态过程微观方法(统计物理方非平衡态非准静态过程法)热力学定律热力学第零定律热力学第一定律热力学第二定律热力学第三定律以理想气体为例第1章热平衡气体动理论一.基本要求1.初步了解统计的概念和求统计平均的方法,能用此方法建立宏观量和微观量之间的联系,从而理解宏观量的微观本质;2.理解平衡态的概念,掌握理想气体的状态方程.3.掌握温度、压强的概念.了解理想气体的微观模型,理解理想气体温度和压强的微观统计意义以及理想气体压强公式的推导;.4.理解自由度的概念,掌握能量均分定理以及由它导出的理想气体的内能公式.5.掌握麦克斯韦速率分布函数的物理意义,以及由它导出的三种速率.能从麦克斯韦速率分布曲线获取相关信息.了解Boltzmann分布律6.掌握平均碰撞频率、平均自由程的概念和计算公式.7.了解实际气体的等温线,VandeerWails方程;二.内容提要和学习指导(一)几个概念1.平衡态在不受外界影响的条件下,系统的宏观性质不随时间变化的状态.在平衡态下,描述热力学系统的宏观状态参量取确定值.2.理想气体宏观定义:在各种压强下都严格玻意耳定律(对于一定质量m和温度T的气体,PV常量.)的气体.微观定义:(1)分子的大小可忽略,分子可看作质点;(2)分子和分子之间的相互作用力可忽略;(3)分子的运动遵循Newton力学规律;(4)分子与分子间及分子与器壁间的碰撞是完全弹性的.60
3.温度宏观定义:处于热平衡的各热力学系统所具有的共同的宏观性质.微观解释:温度反映分子无规则运动的激烈程度,是分子平均平动动能的量度.4.压强微观解释:大量分子碰撞器壁的平均效果.pn2/3t(二)几个规律pVmN1.理想气体的状态方程:C,pVRTRT,pnkT;TMNmolmol2.分子热运动能量的统计规律——能量均分定理在温度为T的平衡态下,平均每个分子每个自由度所分得的能量都等于kT2/。3imi分子平均平动动能kT;分子平均动能kT;理想气体内能ERT。tk22M2mol(单原子分子i3,双原子刚性分子i5,三原子以上刚性分子i6)3.分子数按速率分布的统计规律——麦克斯韦速率分布律2mvdNm2/322麦克斯韦速率分布函数f(v)4()ekTvNdv2kT物理意义:表示速率在v附近单位速率区间的分子数占总分子数的百分比.22由f()v计算平均值:vvf()vdv,vvf()vdv。002RT8RT23RT三种速率:vp,v,v。MMMmolmolmoldN/kT4.能量分布的统计规律——玻耳兹曼分布律CedxdydzdvdvdvxyzNp特例:重力场中粒子数密度按高度的分布nnekT05.理想气体分子碰撞的统计规律——平均碰撞频率、平均自由程2平均碰撞频率Z2nv2dvn11kT平均自由程222n2dn2dP三.习题解答和分析1.1.试述以下定义:理想气体,平衡态,热动平衡,温度。【答】理想气体:①严格遵守三条气体实验定律的气体;②分子平均间距较大,除碰撞瞬间外,分子间无相互作用力的气体;③内能只是温度的单值函数的气体。平衡态:①不受外界影响的系统,经过足够长时间后,最终将处于宏观性质不随时间改变的状态;②描述系统状态的宏观参量均匀、唯一确定且不随时间改变的状态。热动平衡:系统处于平衡态时,内部大量粒子仍在不停地作无规热运动,但是其统计平均效果不变。温度:①处于共同热平衡状态的所有热力学系统具有的共同的宏观性质称为温度;②温度是气体分子61
2t平均平动动能的度量,即T。3k1.2.试述热力学系统的宏观描述和微观描述之间的不同与联系。【答】宏观描述:以观察和实验事实为依据,从能量的观点出发,经归纳和总结,推理出关于宏观量(P、V、T…)的定律。微观描述:从单个分子的微观量(m、v、…)出发,按照一定的统计假设,对大量分子的无规则热运动进行统计平均,从而推导出关于宏观量的定律。两种描述的相互联系:宏观描述得到的结论要通过微观描述得到合理的解释;微观描述推出的结论要通过宏观方法在实验上得到检验。111.3.目前实验室获得的极限真空度约为1.3310Pa,求在0C时单位体积内的分子数,并与标准状态下单位体积内的分子数比较。11p1.331093p0【解】nm3.5310(1/),n230kT1.3810273.15kT0011np1.331016→1.313105np1.013100031.4.把定容气体温度计的测温泡放入水的三相点管的槽内时,气体压强为5.78×10Pa。当气体压强为33.35×10Pa时,待测温度是多少?P【解】对于一定质量的气体而言,当V一定时,c,所以有T3PT3.3510273.161TK158.3()3P5.7810141.5.柴油机汽缸压缩前空气的温度为47℃,压强为8.61×10Pa。当活塞急剧上升,汽缸内空气被压缩6到原来体积的1/17时,压强增大到4.25×10Pa,求此时汽缸内空气的温度。PVPVPV221122【解】对于一定质量的气体而言,→TT929.59()K21TTPV2111761.6.一氧气瓶容积为V32L,压强为p1.310P,按规定压强降到p1.010P时要00a1a5重新充气,以免洗瓶。若每天用掉的氧气为:VL400,p1.0110P。问:一瓶氧气能用多少天22a(设使用过程中温度不变)。【解】设压强为p的氧气使用n天后压强变为p,由总质量守恒可得01pVpVpV()ppV00102201.0n→pVpVnpV→n9.5(天)001022RTRTRTpV000221.7.地球的大气在2km范围内是等温的,设为10℃。海平面气压为750mmHg,如测得一山顶气压为630mmHg,求山的高度。mghMmolgh【解】由等温气压公式ppekTpeRT可得0062
RTp08.31283.157503hmlnln1.4410()3Mgp29109.8630mol1.8.一定质量的气体,当温度保持不变时,压强随体积的减小而增大;当体积保持不变时,压强随温度的升高而增大。从微观上说明这两种使压强增大过程的区别。【答】当温度不变体积减小时,气体分子的平均速率不变,平均每次碰撞作用给器壁的冲量不变,但是单位体积的分子数增多,使得碰撞频率增加,因此压强增大;当体积不变温度升高时,单位体积的分子数不变,气体分子的平均速率增加,使得碰撞频率增加,同时,平均每次碰撞作用给器壁的冲量增加,因此压强增大。1.9.什么是气体分子的平均平动动能,平均动能,平均能量?【答】1.10.什么是内能?理想气体内能的特征是什么?【答】1.11.如果氧气(O2)和氦气(He)的温度相同,摩尔数也相同,那么这两种气体分子的平均动能是否相等?平均平动动能是否相等?内能是否相等?i【答】(1)由气体分子的平均动能公式kT可知,两种气体的温度T相同,但自由度i不同,k2其中i5,i3,所以两种气体分子的平均动能不相等。o2He3(2)由气体分子的平均平动动能公式kT可知,两种气体的温度T相同,故两种气体分子的平t2均平动动能相等。imm(3)由理想气体的内能公式ERT可知,两种气体的、T相同,但自由度i不同,2MMmolmol所以两种气体的内能不相等。1.12.求氧分子在温度17℃时的平均平动动能、平均动能和64g氧气的内能。332321【解】tkT1.3810290.156.010()J22520kkT1.010()J2im5644ERT8.31290.151.2110()J22M32mol1.13.盛有氧气的容器以100m/s的速度运动。若该容器突然停止运动,问容器中氧气的温度将上升多少?温度的增量与初始温度有关吗?【解】气体分子有序运动的动能通过碰撞转化为无序运动的动能,故有22312imvMmol1003210mvRT→TK7.7()(与初始温度无关)。22MiR58.31mol1.14.一容器中间用隔板隔开,装有压强相等、温度分别为263K的氦气和323K的氧气各一半。问抽去隔板后,混合气体的温度是多少?53mm5m3moHeoHe【解】混合前后总能量应不变→RTRT()RToHe22MM2M2MoHeoHe63
53mm53mmoHeoHe→TT()ToHe22MM22MMoHeoHemmm8ToHeo由pVRT及题设条件可知TT→TK298oHeMMM53/TTmoloHeoHe1.15.说明以下各表达式的物理意义:v2v2(1)f()vdv;(2)Nfvdv();(3)f()vdv;(4)Nfvdv()v1v1dN【答】由速率分布函数的定义fv()可知:NdvdN(1)fvdv()表示速率在vvdv区间的分子数占总分子数的百分比.N(2)Nfvdv()dN表示速率在vvdv区间的分子数.v2N(3)fvdv()表示速率在vv区间的分子数占总分子数的百分比.v121Nv2(4)Nf()vdvN表示速率在vv区间的分子数.v1211.16.最概然速率和平均速率的物理意义是什么?【答】v:在速率v处,速率分布函数取极大值。即v附近单位速率区间内的分子数占分子总数ppp的百分比最大。在讨论速率分布时要用最概然速率。v:分子速率的统计平均值。在讨论分子的平均自由程、平均碰撞频率时要用到平均速率v。1.17.容器中储有27℃、1atm的氧气,求分子的平均速率、方均根速率、最概然速率。8RT88.31300.15【解】vm446(/)s3M3.14321023RT38.31300.15vm484(/)s3M32102RT28.31300.15vm395(/)sP3M32101.18.在一个封闭的容器中,理想气体的平均速率升高为原来的两倍,则其温度和压强各升高为原来的多少倍?【答】理想气体的平均速率vT,所以当理想气体的平均速率升高为原来的两倍时,其温度将升高为原来的四倍,又根据温度和压强和温度的关系式pnkT,封闭容器中的分子数密度n不变,所以压强也将升高为原来的四倍.1.19.某气体被压缩后,压强增大3倍,体积减小一半。问温度变化多少?分子平均平动动能变化多少?分子方均根速率变化多少?64
2PV11PV22TP22V23t2T23vT223【解】→→→。TT12TP11V12t11T2v2T2111.20.有N个粒子,其速率分布函数为:f()vC(0vv);fv()0()vv。00(1)作速率分布曲线并求常数C;(2)求粒子的平均速率和方均根速率。v0【解】(1)归一化条件f(v)dv1→Cdv100f()v11/vv000v1/v0→C→fv()v0vv00v0v10v0v(2)vvfvdv()dvv000v2题1.20图02211v0222v0vvf()vdvvdvv→v000v3301.21.有N个粒子,其速率分布函数为:vf()va(0vv);f()va(2vvv);fv()0(2vv)。0000v0(1)作速率分布曲线并求常数a;(2)分别求速率大于v0和小于v0的粒子数;(3)求粒子的平均速率。【解】(1)归一化条件f(v)dv1→0f()vv0av2v022/(3)vdvadv1→a→00vv03v0022/(3)(0vvvv)000v02vv0fv()2/(3)(vvvv2)000题1.21图0(vv2)02v022(2)vv的粒子数NdNNf()vdvNdvN,0vvv00033v0vv00v021vvv的粒子数NdNNf()vdvNdvN;0000233v02vv0022vv2211(3)vvfvdv()dvdvvvv002v00033vv000991.22.试说明:最概然速率相同的两种不同气体,其速率分布曲线一定相同。2kT1m1m【答】v→→P2mvk2Tvk2TPP65
2mv2vm412→f()4(ve)3/22kTv2evPv232kTvP可以看出:当两种不同的气体的最概然速率相同时,速率分布函数相同,因此速率分布曲线相同。1.23.求速率在v到1.01v之间和2v到2.01v之间的气体分子数占总分子数的百分比。以PPPPdv0.01v计算。P【解】设uvv,根据上题结果,麦克斯韦速率分布函数写为Pv2Nv4()v42u22vpfvv()()eueuNvvpp当速率在v~.101v之间时,u1,u.001,所以PPN411e0.010.83%N3.14当速率在2v~.201v之间时,u2,u.001,所以PPN444e0.010.17%N3.141.24.氢气的温度为300℃,求①最概然速率;②速率在3000m/s~3010m/s之间的分子数占总分子数的百分比;③速率在2170m/s~2180m/s之间的分子数占总分子数的百分比;④速率在1500m/s~1510m/s之间的分子数占总分子数的百分比。对上述所得结果进行分析。2RT28.31573.15【解】①最概然速率vm2171(/)s;p3M2.0210v2()Nv42vpv由fvv()()e,可得NvvPp②当vm3000/s,vm10/s时23000N14300023217110()e2.94100.294%N21712171③当vm2170/s,vm10/s时22170N24217023217110.().e.3.83100.383%N21712171④当vm1500/s,vm10/s时66
21500N34150023217110.().e.3.08100.308%N21712171N:N:N.294.3:83.3:08123分布在2170ms~2180ms区间分子数最多,这表明:每个分子,速率越靠近最可几速率,概率越大。1.25.容器内储有某种气体,若体积不变温度升高,其分子的碰撞频率和平均自由程怎样变化?若保持压强不变使气体温度升高,其分子的碰撞频率和平均自由程又怎样变化?2281kT【解】由公式Zd22nvdp,可知:22mkT2dn2dp若体积不变(n不变)温度升高,则Z变大而不变;若压强不变温度升高,则Z减小而变大。-2-3-101.26.真空管线度为10m,真空度为1.33×10Pa,设分子有效直径为3×10m,求27℃时单位体积内的空气分子数、分子平均自由程和平均碰撞频率。3P1.3310173【解】分子数密度:nm3.2110(1/)23kT1.3810300112平均自由程:7.82()mm10()21021722dn(310)3.210此时分子的平均自由程已大于容器的线度,分子几乎不发生碰撞,所以上面给出的平均自由程的公式不再2适用,实际的平均自由程"10()m.vR18T188.313004平均碰撞频率:zs4.6810(1/)23M1029101.27.试比较真实气体与理想气体的区别。P【答】理想气体在各种压强下都严格遵守Boyle定律,其等温线是一条双曲线。真实气体差别于理想气体48.1ºC气的是:①在高温下,真实气体接近理想气体。温度越低,真实气体偏离理想气体越远。②存在临界温度Tc,当温液31.1ºC度Tc时,气体不可液化。21ºC③当温度0,系统放热则Q<0;系统对外界做功则A>0,外界对系统做功则A<0;内能增加则E>0,内能减少则E<0)注意:热力学第一定律实质上是能量守恒和转换定律在热现象中的具体形式,它适用于任何系统的任何热力学过程.69
(三)热力学第一定律对理想气体热力学过程的应用过程特征过程方程QAEP-V图备注等温过程pVCmV2mV20pQARTlnRTlnMVMV(T不变)mol1mol1或或OVVVpVln2pVln21111VV11等容过程pm0mQECCTVm,CTVm,pMM(V不变)TmolmolOV等压过程VmP()VV21或mQAECCTPm,CTVm,pMM(P不变)TmolmmolR()TT21MmolOV准静态的PVC101mAE(p1V1p2V2)CTVm,p11M绝热过程VTC2mol绝热线比1PTC3或mRTTO等温线陡12M1Vmoln多方过程pVCnmRT()21TmCVm,过程曲线略QAEQAETn1Mmol(1n)MmolmCVm,TMmol绝热自由无000无过程曲线初末态温膨胀过程过程方程.度相同.(非准静态)(四)循环过程:系统由初态出发,经一系列变化后回到初态。特征是E0。准静态循环过程:用状态图中的闭合曲线来表示。循环种类原理过程曲线循环效率正循环热机效率从高温热源吸热Q1PA0(热机循环)A1Q2向低温热源放热Q2Q1Q1To2对外做功A卡诺热机1VT1逆循环致冷系数P(致冷机循环)向高温热源放热Q1A0QQ22AQQ从低温热源吸热Q122oT外界做功AV卡诺致冷机2TT1270
三.习题解答和分析2.1.以下说法是否正确?(1)物体温度越高则热量越多;(2)物体温度越高则内能越大。【答】(1)不正确。因为温度是状态量,热量是过程量。(2)正确。因为温度越高,分子平均动能越大,从而物体内能越大。2.2.以下过程是否可能?如可能,举例说明。(1)系统与外界没有热量传递而温度升高;(2)系统吸收了热量而温度并未升高。【答】(1)可能。如:绝热压缩。(2)可能。如:等温膨胀。p2.3.讨论理想气体在下述过程中,、、、Q的正负:3(1)图(a)所示过程123;等温线(2)图(b)所示过程123和123.【解题分析】在P—V状态图中,过程曲线下的面积表示系统对21外所做的功,面积越大,系统对外做的功越多,如果系统体积膨胀,o此功为正,否则为负.V题2.3图(a)【解】(1)由于1、3状态在同一等温线上,故有T=0、=0;p从123过程中,体积缩小,外界对系统做功,故有A0;由热力1学第一定律可得在这一过程中系统从外界吸收的热量Q0.绝热线(2)对123、123和绝热过程而言,它们具有相同的始2末状态,因而具有相同的T和.拿绝热膨胀过程来说23QAE0,而A0,所以E,0T0.oV题2.3图(b)在123和123中,系统体积都增大,都对外做功,所以A,0A0.由图中可以看出在123过程中,系统对外做功比绝热过程少,所以2"2QAEAE022由图中可以看出12′3过程中,系统对外做功比绝热过程多,所以QAEAE0"2"2p()atm2.4.理想气体由a到d发生的过程如图所示,包括一个等温过程、一个等体过程和一个等压过程,已知在状态a时气体的温度为4a600K,求:(1)气体在b,c,d各态的温度,并作V—T图;(2)2b计算整个过程气体对外所做的功。1dcVL()【解】(1)ab为等温过程,所以TT600K;o1020ba题2.4图PcTb1600bc为等容过程,所以Tc300K;TK()P2b600abVdTc300ccd为等压过程,所以T150K;dV150dcVL()o1020作V—T图如右图。bd(2)整个过程中,只有ab、cd过程做功:ApdVpdVac71
VVbdpVV3aabdVpdVcapValnpVcdVc1.810()JVVacVVa2.5.一热力学系统由图示状态a沿abc到达状态c时,吸收了502J的热p量,同时对外做了324J的功.(1)如果系统沿adc到达状态c时,对外做了bc202J的功,求系统吸收的热量;(2)当系统由状态c沿ca返回状态a时,外界对系统做了265J的功,求系统传导的热量,是吸热还是放热?ad【解】(1)由热力学第一定律可得:EEQA178()JcaabcabcoV题2.5图→QEEA380()Jadccaadc(2)QEEA443Jcaacca“—”表示系统向外界放热.【评注】热量和功是过程量,即经过不同的过程,系统从外界吸收的热量和对外做功不同。内能是状态量,即一定的状态对应一定的内能,内能的增量只决定于始末状态,与过程无关。2.6.1mol氧气温度由10℃升到60℃,试问在以下过程中,氧气各吸收多少热量?增加多少内能?对外做多少功?(1)保持体积不变;(2)保持压强不变。im53[解](1)V常量→A0→QERT18.31501.0410()J22Mmolmmi73(2)p常量→QCT(1)RT18.31501.4510()J,PMM22molmol33理想气体的内能只是温度的单值函数→EJ1.0410(),→AQE0.4110()J2.7.有1mol的双原子分子理想气体,压强为1atm、温度为27℃、体积为V0,试计算在下述两种过程中气体内能的增p()atmb量、气体对外所做的功和气体吸收的热量,并作出p-V图。1.2(1)等体加热升温到87℃,再等温膨胀到原体积的2倍;1.0a(2)等温膨胀至原体积的2倍,再等体加热升温到87℃。0.6c【解】(1)将过程记为abc,由题意可得:VL()TVbbpbapa1.2(tm),pcbpa0.6(tm)。oV02V0TVac题2.7图(1)据此绘出p-V图如右上图。p()atmmmiECTRTVm,MM2molmol1.0a530.6c18.31601.2510()J20.5bccm1VL()ApdVRTdVbbMVboV2V0mol0题2.7图(2)72
mVc3RTJln18.31360ln22.0710()bMVmolb3QEA3.3210()JJ(2)将过程记为abc,由题意可得:VaTcpbapa0.5(tm),pcbpa0.6(tm)。VbTb据此绘出p-V图如右下图。3EJ1.2510();mVb33ARTln18.31300ln21.7310()JQEA2.9810()JaMVmola2.8.如同所示,理想气体分别经历了ba和da两个过程,pa绝热线试分析在这两个过程中E、T、A和Q的正负。等温线【解】ba过程:T0→E0;V0→A0;babaT2QEAEA→Q0。bcdT1babacabao题2.8图Vda过程:T0→E0;V0→A0;dadaQEAEA→Q0。dadacada2.9.温度300K、压强1atm的氮气经绝热压缩后体积变为原来的1/5,求压缩后氮气的压强和温度。V1r57/55【解】由绝热过程方程可得:PP()1.0131059.6410()P21aV2V110.45TT21()3005571()Kp(10Pa)V210a2.10.某双原子分子理想气体,摩尔数为2mol,在温度27℃绝热线时体积为5L。经过(1)绝热膨胀;(2)等温膨胀;其末态体积等温线都为50L。试分别计算在每一过程中气体所做的功,画出P—V5图,并说明其差别。b2RTb【解】pa9.97210()5Po2550VL()aaVa题2.10图Va7/55(1)绝热膨胀:ppP()0.39710()。baaVb据此绘出P—V图如右图。73
mAEC()TTabVabMmolmiVar1RT[1()]aMV2molb50.4328.31300(10.1)7.510()J2pVaa5(2)等温过程:pb0.997210(Pa)。据此绘出P—V图如上图。VbmVb4AabRTaln28.31300ln101.1510()JMVmola【评注】等温过程与绝热过程的比较:从同一状态出发,膨胀相同的体积,等温过程中系统所做的功大于绝热过程中系统所做的功。系统的绝热线比等温线陡。2.11.如图所示,总容积为40L的绝热容器,中间隔有一质量可忽略、能无摩擦自由升降的绝热隔板.A、B两部分各装有1mol的氮气,最初压强都是1atm,隔板在中间.现让微小电流通过B中电阻缓慢加热,直到A中气体的体积减小到A原来的一半。求:(1)B中气体的过程方程;(2)两部分气体各自的最后温度;(3)这一过程中B中气体吸收的热量。【解题分析】因为是缓慢加热,所以,可以认为A和B中的气体所经历的过B程是准静态过程。B中的气体从外界吸热,且温度和体积都在发生变化,所以它经历的不是我们所熟悉的绝热过程或等值过程.但是A中的气体经历的是绝热过程,因此可根据A中的气体的过程方程,以及A、B两部分气体状态参量的联系,I间接导出B中气体的过程方程.题2.11图r【解】(1)由题意可知,对A中气体,有PVPV;AAAA0051.4又:PP、V.004V,→PV(0.04)PV1.013100.02423.7BAABBBAA007/5即,B中气体的过程方程为:PV(0.04)423.7BBmPV1pV1423.7AAAA00(2)PVRT→TV321.7()KAA0.4MRRV8.310.01molAPV1423.71423.7BB→TV0.03965.1()KBB1.4RR(0.04V)8.310.01B(3)以整体为研究对象,B中气体吸收的热量应等于A、B两部分气体内能的增加量.5PV51.013100.02BB00ECT()8.31(965.1)14985()JBVBR28.315PV51.013100.02AA00ECT()8.31(321.7)1618()JAVAR28.3174
QEE16603()JBABTpabdc2.12.理想气体分别作如图所示的两个循环过程,问:各个分过程是什么过程?各个分过程b是吸热还是放热?每一循环中系统所做的净功是正功还是负功?作出相应的p—V图。ca【答】(1)ab是等温膨胀降压吸热过oVoT题2.12图(a)题2.12图(b)程;bc是等压压缩降温放热过程;ca是等容升温升压吸热过程;一个循环中系统所做pp的净功为正功。acd(2)ab是等容升温升压吸热过程;bc是等温压缩升压放热过程;cd是等b压降温压缩放热过程;da是等温膨胀降压cb吸热过程;一个循环中系统所做的净功为负功。aoo绘出上述两循环过程对应的p—V图如右图。VV题2.12图(a")题2.12图(b")【评注】在T—V图和p—T图中研究内能、热量、功、净功和净热等问题时,简捷的方法就是绘出相对应的p—V图。p2.13.如图,理想气体所经历的循环过程包括两个等压过程和两个绝热ab过程。已知b点和c点的温度分别为Tb和Tc,求循环效率。【解题分析】由热机效率公式1/QQ可知,解题关键是计算21dc一个循环过程中系统的吸热和放热,而绝热过程中系统不吸热也不放热,因oV此不予考虑.但是可以根据绝热过程得到描述状态a、b、c、d的状态参量题2.13图之间的关系.mm【解】ab过程吸热QC(TT);cd过程放热QC()TT;1Pba2PcdMMmolmolQTTTTT(1/)2cdcdc→111。QTTTT(1/T)1bababr1rr1rr1rr1r由于b和c状态,a和d状态都由绝热过程连接,故有:PTPT,PTPT;bbccaaddTTadTaTdTc并且PP,PP;→()()→→1。bacdTTTTTbcbcb2.14.设有ν摩尔的理想气体,其循环过程如T—V图所示,已知状T态a(T1,V1),状态b(T1,V2),ca为绝热过程。求(1)c点温度;(2)abT1循环效率。【解】(1)ca为绝热过程,根据绝热过程方程有Vcrr111r1TVTV→TT()。11c2c1VV2oV1V2题2.14图75
V2(2)ab过程等温膨胀,吸热为:QRTln11V1V1r1bc过程等容降温,放热量为:QC()[TTCT1()]→21VcV1V2r1r1QVCV[1(/V)]1[1(/V)]21V122111QRVVln(/)1ln(VV/)p12121bc2.15.如图,理想狄赛尔内燃机循环由两个绝热过程、一个等压过程和一个等体过程组成,试证明此热机效率为da(/)1VV1321(/)[(/)1VVVV)]1232oV2V3V1V【证明】bc过程吸热为:QCTT(),题2.15图1pcbda过程放热为:QC()TT,2VdaQCTT()1T(1/TT)2Vdadad→111。QC()TTTT(1/T)1pcbcbcr1r1r1r1由于cd、ab过程为绝热过程,故TVTV,TVTVa1b2d1c3TTabVV2211VV3211(/)V3→()()→1()→TTVVVV1(/)Vdc33123(/)1VV3211(/)[(/)1VVVV]12322.16.一卡诺热机低温热源温度为7.0℃,效率为40%。欲提高效率到50%,问高温热源的温度需提高几度?【解】根据卡诺热机效率公式1/TT,可得21TT1122TT280.15()93.4()K11110.50.62.17.1mol的理想气体在T1=400K的高温热源与T2=300K的低温热源间作卡诺循环,在400K的等温线33上初态体积为V1=0.001m,末态体积为V2=0.005m,试求此气体在每一循环中(1)从高温热源吸收的热量;(2)气体所做的净功;(3)气体传给低温热源的热量.【解】(1)系统与高温热源接触,等温膨胀吸热,并且吸收的热量全部用来对外做功,所以有:VV22dVV2QApdVRTRTln8.31400ln55349.8()J111VV11VV176
AT2T2300(2)卡诺循环的效率1→AQJ1(1)5349.8(1)1337.5()QTT400111(3)根据热力学第一定律,气体传给低温热源的热量为QQA4012.4()J21【评注】关于热机效率,一般公式为A/1/QQQ,此式对于任意热机循环都成立。对121于卡诺热机,其循环效率除遵守一般公式外,也遵守特定公式1/TT,此式只能用于卡诺循环。在21计算卡诺循环问题时,有时用一般公式,有时用特定公式,有时将两者综合运用。2.18.效率分别为η1和η2的两台卡诺热机串联运行,以第一台热p机的低温热源作为第二台热机的高温热源。试证明联合热机的效率Q1为:η=η1+(1-η1)η2。【证明】在p—V图中作卡诺循环曲线如右图。T11/TT,1/TT,1/TT;→Q2T212123231TQ33TT/1,TT/1,TT/1;→o21132231V题2.18图TT/(1)(1)1;→31121(1)(1)→(1)(1)12121211222142.19.使用空调器保持室内温度为22℃,设室外温度为32℃,漏入室内热量的速率为3.8×10kJ/h,若空调器致冷系数为理想卡诺循环致冷系数的60%,计算空调器一天的耗电量。T295.152【解】理想卡诺循环的致冷系数为:w29.5。TT305.15295.1512设空调致冷器的系数为w,则:4QQ3.8102422ww"0.6→Ak51525(J)14.3(kwh)A0.6w0.629.52.20.逆向斯特林回热式制冷机循环如图所示,它由等温压缩、等p体降温、等温膨胀、等体升温四个准静态过程组成。求此循环致冷系数。b(因da过程所吸收的热量与bc过程所放出的热量相等,故不计入循环T1Q1效率计算)cVTa12【解】ab过程放热为:QRTln;11V2Q2doV2V1VVQRTln1题2.20图cd过程吸热为:;22V2QQT222致冷系数为:w。AQQTT121277
第3章热力学第二定律熵一.基本要求1.理解实际宏观过程的不可逆性及其相互沟通,掌握热力学第二定律及其统计意义;2.理解可逆过程的概念,了解Carnot定理;3.理解Clausius熵公式、Boltzmann熵公式和熵增加原理;4.掌握Clausius熵增的计算方法;5.了解能量退化,熵和信息,信息的负熵原理。二.内容提要和学习指导(一)几个概念1.可逆过程和不可逆过程可逆过程:系统从初态a出发经中间过程到达末态b,若存在一个过程,使系统从b回到a,系统和外界同时复原,则称a到b的过程是可逆过程。例:无摩擦的准静态过程、温差无限小的热传导过程。不可逆过程:系统从初态a出发经中间过程到达末态b,若使系统从b回到a,无论如何外界都不能复原,则称a到b的过程是不可逆过程。自然界一切宏观的自发过程都是不可逆过程。例:功热转换过程、有限温差热传导过程、气体绝热自由膨胀过程。自然界宏观自发过程的不可逆性是相互沟通的,即:一种自发过程的不可逆性存在,必将导致另一种自发过程的不可逆性也存在;一种自发过程的不可逆性消失,必将导致另一种自发过程的不可逆性也消失。2.熵的定义式波尔兹曼熵(微观定义)Skln。其中:k—波尔兹曼常数;—热力学概率,即微观状态数;S—系统无序性的量度。BdQ克劳修斯熵增(宏观定义)SSS。其中:T—系统温度;dQ—系BAA()RT统吸热;R—连结A和B的可逆过程;S—只取决于系统的始末状态。玻耳兹曼熵和克劳修斯熵在本质上是统一的。熵概念的推广:自然界发生的不可逆过程,会导致与熵增成正比的能量的退化;自然界熵增加的方向,从物理上定义了时间进行的方向;生命与熵;信息与熵。(二)几条定理、定律及其应用1.热力学第二定律①两种典型表述。克劳修斯表述:热量不能自动地从低温物体传向高温物体。(热传导的不可逆性)开尔文表述:唯一效果是热转换为功的过程是不可能的。(热功转换的不可逆性)两种表述相互沟通。也可以用其它宏观自发过程的不可逆性作为热力学第二定律的表述。②熵增加原理(热力学第二定律的数学表述):在孤立系中所进行的自发过程总是沿着熵增大的方向进行,即SSS0。21对热力学第二定律和熵增加原理的微观统计解释:自然界的自发宏观过程总是向着使分子运动更加无序(热力学几率增大)的宏观状态进行。③卡诺定理(应用热力学第二定律的例子):对于工作在相同的高温和低温热源之间的热机,一切可逆机的效率1/TT,一切不可逆机的效率1/TT。可逆卡21不可逆2178
2.热力学第三定律:在绝对温度趋于零时,所有等温过程的熵不变。它的一个直接推论是绝对零度可以无限接近,但是不能达到。3.利用克劳修斯熵计算熵增的步骤:①选定系统;②确定不可逆过程及其始、末状态参量;③在始、末状态间拟定一个可逆过程;④沿可逆过程计算熵增(热温比的积分:dQSS)。21可逆T典型结果:系统的可逆循环过程:S=0;孤立系统的可逆过程一定是可逆绝热过程:S=0;孤立系统达到平衡态时:S=0;mT2理想气体的始末态等压:SCln;PMTmol1mT2理想气体的始末态等容:SCln;VMTmol1T2用温度为T2的恒温热源把物体由T1加热到T2:Sm物cln,T1TT21Sm源c;T2mV2理想气体绝热自由膨胀:SCVln;MVmol1三.习题解答和分析3.1.可逆过程是否一定是准静态过程?准静态过程是否一定可逆?【答】可逆过程一定是准静态过程,而准静态过程不一定是可逆过程。例如,有摩擦的准静态过程是不可逆过程。3.2.下列说法是否违反了热力学第二定律?(1)理想气体等温膨胀时所吸收的热量完全转化为功;(2)致冷机使热量从低温热源传到高温热源。【答】上述两种说法都不违反热力学第二定律。在(1)中热量全部变为功的同时产生了其他变化,即理想气体的体积变大。在(2)中热量从低温物体传到高温物体的同时,外界做了功,所以不是自动的。3.3.下列说法是否正确?(1)功可以全部转化为热,但热不能全部转化为功;(2)热量可以从高温物体传到低温物体,但不能从低温物体传到高温物体。【答】上述两种说法都是错误的。(1)热量可以全部转化为功,只不过产生了其他变化。例如,等温膨胀过程。(2)热量可以从低温物体传到高温物体,只不过不是自动的。例如,制冷机的制冷循环。3.4.两条绝热线与一条等温线可否构成一个循环?p绝热线【答】不可能。因为如果存在这种可能,就意味着存在一种循环,只等温线从单一热源吸热,使之完全转化为功,其他的一切都没有发生任何变化。这违反了热力学第二定律的开尔文表述。3.5.由热力学第一定律能证明任何可逆循环的效率都等于1T/To21V题3.4图吗?为什么?79
【答】不能证明。根据第二章所学知识,由热力学第一定律仅能证明理想气体的卡诺循环效率为1T/T。根据第三章中卡诺定理的证明过程可知,由热力学第二定律才能证明任何可逆循环的效率都21等于1T/T。.21AT23.6.由1可知,T0时,有100%,说明这能实现吗?为什么?2QT11【答】不可能实现。这是因为①绝对零度不可能达到;②违反了热力学第二定律的开尔文表述。3.7.试简要阐述热力学第二定律的内容和宏观、微观意义。【答】热力学第二定律的两种典型表述:①Clausius表述:热量不可能自动地从低温物体传向高温物体;②Kelvin表述:唯一效果是热量转变为功的过程是不可能的;或:不可能制成循环动作的热机,它只从单一热源吸收热量,使之完全转化为有用的功,而其它的一切都没有发生任何变化。这两种表述是相互沟通的,是等价的。宏观意义:自然界的一切自发过程都是不可逆过程,并且它们的不可逆性是相互沟通的,即由一种自发过程的不可逆性必定导致另一种自发过程的不可逆性。微观意义:对于自然界的自发过程,从分子运动的观点来看,每个分子的运动是可逆的,但是,对大量分子运动统计而言,可逆的概率微乎其微。3.8.自然宏观热力学过程既遵循热力学第一定律又遵循热力学第二定律。自然微观过程是否也如此?【答】否。热力学第二定律所描述的不可逆性是一个统计规律,适用于大量分子的集体运动。对于单个分子或少数分子,其运动是可逆的,不遵循热力学第二定律。3.9.试阐述玻尔兹曼熵和克劳修斯熵的物理意义。dQ【答】玻尔兹曼熵Skln是系统无序度的量度;克劳修斯熵SS是系统热温21可逆T比的积分,是系统处于平衡态时的状态函数。对于系统的平衡态而言,两种熵的定义是等价的。3.10.试阐述怎样利用克劳修斯熵计算一个不可逆过程始、末两态的熵增?并举例说明。【答】利用克劳修斯熵计算熵增的步骤:(1)选定系统;(2)确定不可逆过程及其始、末状态参量;(3)在始、末状态间拟定一个可逆过程;(4)沿可逆过程计算熵增(热温比的积分:dQSS).。21可逆TT例:设A和B两个物体的质量和比热相同,初始温度分别为T和T,AA0B0(TT)。两物体接触并最终达到热平衡。计算此过程中系统的熵増。QTBA0B0解:①选择两接触物体为孤立系统;②不可逆过程:有限温差热传导过程;由两物体的初态推导系统末态:mcdTdQ,AAmcdTdQ,dQdQ→dTdT→TTTT→TT()T/2;BBABABAB00AB00③拟定可逆过程:对A物体,拟定温差无限小的热传导过程,使其由TT;A0对B物体,拟定温差无限小的热传导过程,使其由TT;B0④沿温差无限小的热传导过程计算系统熵增:80
TTdQmcdTTTTAAAB00A物体的熵增Smclnmcln(0);ATTAA00TTT2TAAA00ATTdQmcdTTTTABAB00B物体的熵增Smclnmcln(0);BTTBB00TTT2TABB00B22T()TTAB00系统的总熵增SSSmclnmcln(0)ABTT4TTAB00AB003.11.下列说法是否正确?(1)任一绝热过程dS0;(2)任一可逆过程dS0;(3)孤立系统任意过程dS0。dQ【解题分析】对于任意无穷小的热力学过程有dS,其中等号对于可逆过程成立。T【解】(1)错误。仅对可逆绝热过程才有dS0。对不可逆绝热过程有dS0。(2)错误。仅对可逆绝热过程才有dS0。对可逆非绝热过程有dS0。(3)正确。对于孤立系统,可逆过程有dS0,不可逆过程有dS0。3.12.一定量的气体经过绝热自由膨胀过程.由于绝热过程dQ0,所以dS0。这一说法是否正确,为什么?dQ【答】错误。绝热自由膨胀过程为不可逆过程,而不可逆过程中的熵增dS,所以在绝热自由T膨胀过程中dS0。3.13.一摩尔理想气体经过绝热自由膨胀,体积从V1增大到V2,求此过程中的熵增。【解】按上面3.10题所述的解题步骤解题。(1)选择绝热容器内的理想气体为孤立系统;paVT(,)10c(2)不可逆过程:绝热自由膨胀;其始、末状态为(,)(,)VTVT;1020(3)在始、末状态间拟定可逆过程;cbVT(,)20方法一:拟定准静态等温膨胀过程ab,沿此可逆过oVVVbVdQ1122程求熵增SpdVaVTT1题3.13图01V2dVV2RTRln(0)0TVVV101cbdQdQ方法二:拟定准静态过程acb,沿此可逆过程求熵增SacTTcbCdTVcCdTpiiT2T00TV2RlnRRRlnlnln(0)acTTT22TTV01cccbdQdQ方法三:拟定准静态过程acb,沿此可逆过程求熵增SacTT81
cbCdTpCdTVcii2TTTcV02RRRRlnlnlnln(0)acTT22TTTV00c1【评注】此例进一步说明:系统的熵增只取决于系统的始末两个平衡态,与系统所经历的具体过程无关。熵是系统的态函数。3.14.一杯开水放在空气中冷却后熵减少了,这是否与熵增加原理矛盾?【答】不矛盾。熵增加原理指出孤立系统的熵永不减少,而放在空气中的开水为开放系统,其熵是可能减少的。若把这杯水和周围吸热的空气包含在一个孤立系统内,则此系统的总熵是增加的。3.15.有100g的冰,温度为-40℃,在1atm大气压下将其变为100℃的蒸汽,求此过程中的熵增。(冰的比热为2.1Jg/(K),熔解热为334/Jg,水的比热为4.2/(JgK),汽化热为2260/Jg。T2dQT2c1mdTT2【解】–40℃的冰升温至0℃的冰的过程中的熵增:Scmln1TT11T1TT1dQQ2m0℃的冰等温等压地融化为0℃的水的过程中的熵增:S2TTT222T3dQT3c2mdTT30℃的水等压升温至100℃的水的过程中的熵增:Scmln3TT22T2TT2dQQ4Lm100℃的水等压汽化为100℃的水蒸气过程中的熵增:S4TTT333TLT23总的熵增为:SSSSSmc(lncln)123412TTTT12232733343732260100(2.1ln4.2ln)892.6(/JK)2332732733733.16.把质量为1kg、温度为0℃的水放到100℃的恒温热源上,最终达到平衡。求这一过程中水和恒温热源所组成的系统的熵增.如果把这罐水先放到50℃的恒温热源上加热,达到平衡后,再放到100℃的恒温热源上加热,最终达到平衡。再求这一过程中系统的熵增。【解】在第一种情况下系统的熵增T2cmdTQT2cm(T2T1)SSScmln1水源T1TTTT21233731004.210(ln)184.8(/JK)273373在第二种情况下系统的熵增TcmT()TTcmT(T)122SSSSScmlncmln2水1源1水2源2TTTT12Tc21m()(TTcmT2T)33735050JKcmln4.210(ln)97.7(/)TTT2733233731282
【评注】要把一个物体由初态温度加热到一定的末态温度,选择的中间热库越多,S越小。若中间热库“无限多”,过程变为“温差无限小的热传导”过程,这是可逆过程,系统的熵增S0。3.17.如图,ac为等温线,ad为绝热线.试求摩尔理想气体p经历下列过程的熵增:(1)abc;(2)ac;(3)adc。ab【解题分析】本题涉及到的过程均为可逆过程,可逆过程的熵增2dQ可用公式S计算。由于熵是状态的函数,下面将看到从1T状态a经过三个不同的过程到达状态c,熵增是相同的。cd【解】(1)abc过程为先等压,后等容过程,其熵增为obcdQdQTTbbCdTCdT2060V(L)pVSabTTTTabTT题3.17图TTTTbcbcCClnln()CRlnClnpVVVTTTTababTTTVcbbbCRRlnlnlnRlnRln3VTTTVaaaa(2)ac过程为等温过程,其熵增为cVdQ11ccVdVVcSpdVRTRlnRln3aVaVTTaaaaTaVVa(3)adc过程为先绝热,后等压过程TcCdTpTTcaSSClnClndcppTdTTTdd1ppVdcc1RCCCln()ln()(ln)Rln3pppppCVaapa3.18.一绝热容器被隔板隔成等体积的两部分,分别盛有v1摩尔和v2摩尔的两种理想气体,其温度和压强都相同。抽去隔板后两种气体相互扩散并最终达到平衡。试证明:全过程中系统的熵增为2Rln2。1【证明】由题设可知,且扩散后系统的温度不变,因此可以设计这样一个可逆过程,即两种12气体分别等温膨胀到原来体积的两倍.由此可得系统的熵增为dQV2pdVV2SSRlnRln212V11T1TV1总的熵增为S2S2Rln2113.19.绝热容器中有一无摩擦可移动的导热隔板,容器隔开的两部HeO2分分别装有1mol温度为300K的He气和1mol温度为600K的O2气,其压强都等于1atm。求:(1)平衡时的温度和压强;(2)系统的熵增。题3.19图【解】(1)平衡前后系统的能量不变,即E0,设系统热平83
衡时的温度为T,则有()(CTTCT)()(T)0VHeHeVO22O()CT()CT(3/2RT)(5/2RT)35TTVHeHeVOO22HeO2HeO2TK487.5()()CC()(3/2RR)(5/2)8VHeVO2平衡前后系统的总体积不变,即VVVV。设系统热平衡时的压强为p,则HeOH22eORTHeRTORTRT2T2487.5211.08()→ppatm0ppppTT30060000HeO2(2)由题设可知系统发生的过程为不可逆过程,但可设计可逆过程来计算系统的熵变。如右图所示,对于He气,设计的可p()atm300K487.5K逆过程为:abc;对于O2气,设计的可逆过程为:600Kabc;系统的熵增为1.08c1.00abaS(S)(S)HeO2VoTpTp(CR)lnln(CR)lnln题3.19图pHePO2TpTpHe00O21TTp8.31487.5487.51.08R(5ln7ln4ln)(5ln7ln4ln)2.77(/)(0)JK。2TTp23006001HeO203.20.温度为T1体积为V1的ν摩尔的理想气体,经绝热自由膨胀,体积变为V2,然后再压缩回V1。分别求下列两种情况下整个过程的熵增:(1)无限缓慢地压缩到(V1,T);(2)快速地压缩到(V1,T)。11【解题分析】求解本题时,一定要注意,在绝热容器内将理想气体p压缩回V1时,其温度不可能回到T1。如果是无限缓慢压缩,即沿准静d绝热线态绝热线压缩,回到V1时的温度TT。原因是压缩时外界对气体做11c功,使得气体内能增加,从而温度升高。如果是快速压缩,回到V1时的等温线温度T11T。并且压缩越快,T1越大。原因是压缩越快,贴近活塞的aT1T1压强越高,外界对气体所做的功越多。不同过程的始末状态点如右图所bT1示。oVV1V2【解】绝热自由膨胀过程(V1,T)→(V2,T)是不可逆过程,11题3.20图拟定的可逆过程是准静态等温膨胀过程a→b(如图),沿此可逆过程计算熵增dQVV22pdVdVV2SRRln1TTVV11VV11(1)无限缓慢的压缩过程(V2,T1)→(V1,T1)是可逆的绝热过程b→c(如图)。显然,S20。V2整个过程的熵增为SSSRln12V184
(2)快速的压缩过程(V2,T)→(V1,T)是不可逆过程。当然,可以设计一个准静态的可逆过11程b→d来计算S。但是,因为我们要求解的是a→b→d过程中的总熵增,因此,最简单的方法就3是在a→d间拟定一个最简单的可逆过程,这个可逆过程就是准静态的等容过程,沿此过程计算总熵增dTdQ1CdTTV1SSS13CVln(与压缩的快慢程度有关)。aTTT1T13.21.1mol的理想气体初始温度为T1,初始体积为V1,经过下列三个可逆过程:先绝热膨胀到2V1,再等体升压恢复到T1,最后等温压缩到原体积.求(1)每一过程中的熵增;(2)等温过程中系统和外界环境的总熵增;(3)一个循环过程中系统的总熵增。已知CV、γ。paT1CdTV【解】(1)①绝热:S0;②等体:S12TbT绝热线等温线TV12r1cCClnln()(1)Cln2;VVVTVb1T1VpdVV1dVVo1V2V③等温:SRRlnRln2。113TVVV2题3.21图2(2)等温过程系统与外界构成绝热系统,总熵不变,S0,即S理想气体S外界。大系统(3)SSSS0。123【评注】因为熵是态函数,所以系统沿任意可逆循环一周,熵增必定为零。3.22.证明一条等温线和一条绝热线不能有两个交点。p【证明】如图所示,如果一条等温线和一条绝热线有两个交点,这将意绝热线味着存在一种循环系统,它只从单一热源吸热,使之完全转变为有用的功,等温线而其它的一切都未发生任何变化。这违背了热力学第二定律的开尔文表述,所以一条等温线和一条绝热线不可能有两个交点。T3.23.把1mol温度为0℃的冰全部化为同温度的水需吸热6000J,求:oV题3.22图(1)这一过程中水的熵增;(2)0℃时水的微观状态数与冰的微观状态数之比。dQM6000mol【解】(1)SJ22.97(/K);TT273.15水(2)SSSklnklnkln→水冰水冰冰S21.97水k1.38102315.9210236.9141023eee10。冰85
第4章非平衡态热力学简介一.基本要求1.了解三种输运过程,会计算输运过程的简单问题;2.了解自组织现象和耗散结构。二.内容提要和学习指导(一)输运过程(平衡态附近的非平衡过程):过程名称输运的物理量宏观规律系数的微观表示(以不太稀薄的理想气体为例)内摩擦分子定向动量du114kmT1/2df()zSbvb(或粘滞)dz033热传导分子无规能量dT1C14CkmT1/2dQ()Svm,vm,zbvbdz03M3M热扩散分子质量d114kT33/2dMtD()zSDbvbdz033mp注:①CiR/2;②nm,vk8/Tm(),1/(2n),pnkTvm,0.70.71.752③实验结果:T,T,DTT;④在简单理论中:bbb1;⑤在严格理论中:b.147,b.368,b.177。(二)自组织现象和耗散结构1.自组织现象:在一定条件下,系统内部自发地由无序变为有序的现象。如:贝纳德对流图像,化学振荡和化学波,激光。这种现象可以用耗散结构理论解释。2.耗散结构:在远离平衡态处形成的稳定有序结构。耗散结构的形成条件:①系统是开放的。这样,系统才能从外界吸收能量和负熵以形成和维持有序结构。②系统必须处于远离平衡的非线性不稳定态。系统若处于近平衡态(线性非平衡态),即使与外界有物质、能量交换,其自发趋势还是要向平衡态发展,不能形成耗散结构。③必须存在非线性相互作用。正是这种非线性相互作用,引起反常涨落,再通过正反馈放大,才使系统演变为有序的耗散结构。三.习题解答和分析4.1.什么是气体内的输运现象?气体内产生输运现象的原因是什么?是如何实现的?【答】气体内的输运现象有:粘滞现象、热传导现象和热扩散现象。产生输运现象的原因是气体内各部分的物理性质不均匀。如密度不均匀产生了热扩散现象;流速不均匀产生了粘滞现象;温度不均匀产生了热传导现象。输运现象之所以能够实现,从宏观上看是系统由非平衡态自动趋向平衡态,即热力学第二定律中所指的自发过程;从微观上看是气体分子相互碰撞和搀和而交换动量和能量。4.2.试说明:当容器内气体温度不变而压强降低时,气体热传导系数保持不变;当压强降低到分子运动的平均自由程与容器线度可比时,气体热传导系数将随压强降低而减小。1CV【答】理想气体的热传导系数为nv,其中C是摩尔热容量,N是阿伏加德罗常Vmol3Nmolp数,n是分子数密度,v是气体分子平均速率,是气体分子平均自由程,b是比例常数。将n、kT8kTkT2CkTVv和代入得,由此可知,当容器内气体温度不变而压223m2dp3Ndmolm86
强降低时,气体热传导系数保持不变。当压强降低到分子运动的平均自由程与容器线度可比时,实际的自22ClpV由程就是容器的线度l,此时,显然,若温度不变而压强降低,则减小。3NmkTmol-54.3.标准状态下氦气的粘滞系数为1.89×10Pa·s,求氦原子平均自由程和氦原子的有效直径。11M1MR8Tmolmol【解】理想气体的粘滞系数为vv33VV3molmol533Vmol31.891022.4107→2.6410()m8MRT841038.31273.15mol2311kT1.3810273.1510→dm1.7810()2572dn2np221.013102.64104.4.1mm厚的空气可以保持20K的温差,在单位时间单位面积通过相同热量的情况下,如果用玻璃维-2持相同的温差,玻璃的厚度为多少?设空气和玻璃温度的梯度均匀。=2.38×10W/(m·K),空气=0.72W/(m·K)玻璃QTQTQQ玻璃空气玻璃空气【解】()s,()s,,TT玻璃空气tZtZstst玻璃空气玻璃0.72→→zz130.3(mm)2zz2.3810空气4.5.热水瓶胆两壁间距为0.4cm,在27℃时充满氮气,问两壁间压强降低到多大以下时,氮气的热传-10导系数才会比它在常压下的数值小?氮分子有效直径为3.7×10m。kT【解】由上面的4.2题可知,理想气体的热传导系数随压强减小而降低的条件是l22dp23kT1.3810300.15→PP1.704(a)。210222dl2(3.710)0.410-524.6.标准状态下氧的扩散系数为1.9×10m/s,求氧分子的平均自由程和分子的有效直径。18RT【解】理想气体的扩散系数为Dv33Mmol3Mmol573210→3D31.9101.3410()m;8RT88.31273.152311kT1.3810273.1510→d2.5010(m)。2572dn22np21.013101.341087'
您可能关注的文档
- EDA技术实用教程 第三版 (潘松 黄继业 著) 科学出版社 部分习题参考答案
- 基础会计 第三版 (陈国辉 陈文铭 孙光国 著) 清华大学出版社 课后答案
- 大学物理学 第四版 下册 (上海交通大学物理教研室 著) 上海交通大学出版社 课后答案
- 信号与系统 第三版 (曾禹村 著) 北京理工大学 课后答案
- 大学物理学 第四版 下册 (上海交通大学物理教研室 著) 上海交通大学出版社 课后答案_
- EDA技术与VHDL 第三版 (黄继业 著) 清华大学出版社 课后答案
- 基础会计学 (刘尚林 杨明海 著) 对外经济贸易大学出版社 课后答案
- 信号与系统 第三版 (陈生潭 著) 西安电子科技大学出版社 课后答案 第5章 陈生潭
- EDA技术与VHDL 第三版 (潘松 黄继业 著) 清华大学出版社 课后答案
- 基础会计学 (罗新运 著) 经济管理出版社 课后答案
- 大学物理学 上册 (李承祖 杨丽佳 著) 科学出版社 课后答案 第三部分 电磁学 课后答案
- 基础会计学 (王来群 著) 清华大学出版社 课后答案
- 信号与系统 第三版 (段哲民 著) 西北工业大学出版社 课后答案
- 基础会计学原理 (骆静 王莹 著) 南开大学出版社 课后答案
- 大学物理学 上册 (李承祖 杨丽佳 著) 科学出版社 课后答案 第一部分 力学 课后答案
- Essential Mathematical Methods (K. F. RILEY, M. P. HOBSON 著) cambridge university press 课后答案
- 基础物理实验 修订版 (李朝荣 著) 北京航空航天大学出版社 课后答案
- 信号与系统 第一版 (王明泉 著) 科学出版社 课后答案
相关文档
- 施工规范CECS140-2002给水排水工程埋地管芯缠丝预应力混凝土管和预应力钢筒混凝土管管道结构设计规程
- 施工规范CECS141-2002给水排水工程埋地钢管管道结构设计规程
- 施工规范CECS142-2002给水排水工程埋地铸铁管管道结构设计规程
- 施工规范CECS143-2002给水排水工程埋地预制混凝土圆形管管道结构设计规程
- 施工规范CECS145-2002给水排水工程埋地矩形管管道结构设计规程
- 施工规范CECS190-2005给水排水工程埋地玻璃纤维增强塑料夹砂管管道结构设计规程
- cecs 140:2002 给水排水工程埋地管芯缠丝预应力混凝土管和预应力钢筒混凝土管管道结构设计规程(含条文说明)
- cecs 141:2002 给水排水工程埋地钢管管道结构设计规程 条文说明
- cecs 140:2002 给水排水工程埋地管芯缠丝预应力混凝土管和预应力钢筒混凝土管管道结构设计规程 条文说明
- cecs 142:2002 给水排水工程埋地铸铁管管道结构设计规程 条文说明