- 1.04 MB
- 2023-01-01 08:31:56 发布
- 1、本文档共5页,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报电话:19940600175。
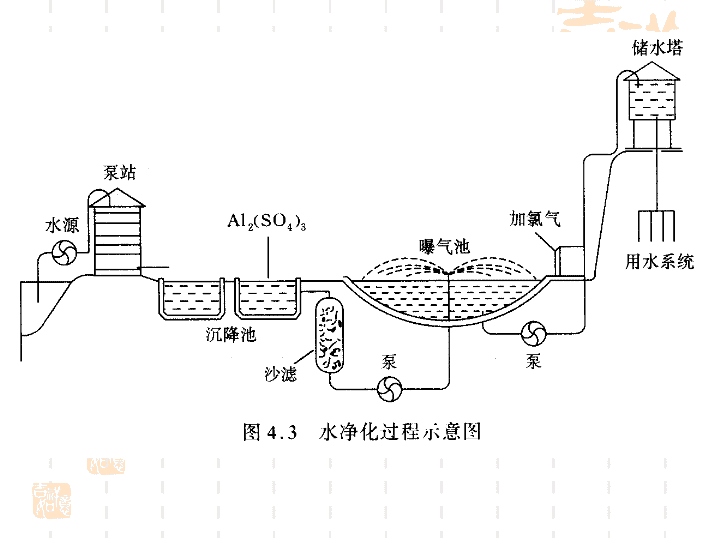
第一单元 水的净化与污水处理\n___________________________;_____________________________.利用混凝剂除去的是一些悬浮杂质,常用的混凝剂除明矾外,还有FeCl3等.三价铁盐能发生水解反应,生成的_____________能吸附水中的悬浮物而沉降,Fe(OH)3胶体生活中主要采用明矾作混凝剂,其净水的原理为:水解反应的化学方程式为__________________________________,离子方程式是__________________________________.\n\n某综合实践活动小组到自来水厂进行参观,了解到源水处理成自来水的工艺流程示意图如下:例1(1)源水中含Ca2+、Mg2+、HCO、Cl-等,加入CaO后生成Ca(OH)2,进而发生若干个复分解反应,试写出其中任意一个反应的离子方程式_________________________________.\n(2)加入凝聚剂可以除去其中的悬浮固体颗粒,该过程是________(填写下列各项的序号)。①只有物理过程,无化学过程②只有化学过程,无物理过程③既有化学过程又有物理过程FeSO4·7H2O是常用的凝聚剂,加入后最终生成红褐色胶状沉淀,则这种沉淀是________。\n(3)通入二氧化碳的目的是_____________________和____________________________.(4)气体A的作用是___________________________.(5)下列物质中,____________可以作为气体A的代替品.(填写下列各项的序号)①ClO2②浓氨水③SO2④浓硫酸\n思考感悟1.自来水厂处理水的过程是什么?【提示】(1)筛滤:用筛子对水进行筛滤,滤去颗粒较大的悬浮物。(2)沉淀:加入混凝剂静置,将水中的悬浮物沉淀到池底部。\n(3)过滤:使水通过细沙,以除去沉淀和残留的悬浮物.(4)曝气:把水暴露在空气中,使水与空气的接触面增大,增加水中氧的含量,以加速水中有机物的分解.(5)消毒:加入杀菌消毒剂杀灭水中的有害微生物.\n二、污水处理1.污水中的主要污染物有________、__________、植物养料、有机物质、其他矿物质、由土壤冲刷带来的沉积物、__________等,也可能会因情况不同而有不同成分.需氧废物传染性物质放射性物质\n2.污水处理的主要方法——生物化学方法(1)生物化学方法的定义:通常使用含有_______________的活性污泥,在强力通入空气(曝气)的条件下,微生物以水中的________为养料生长繁殖,将有机物分解为____、____等无机物,从而达到净化污水的目的.(2)生物化学方法的关键:培养好活性污泥中的_______,并提高处理过程的曝气效率,使需氧微生物获得足够的_____.大量需氧微生物有机废物CO2H2O微生物氧气\n3.水的DO与BOD(1)DO表示_______________.(2)BOD指水中有机物经微生物分解所需的氧气量,污水中有机物的含量越大,BOD越高,水的富营养化程度______.水中的溶解氧量越高\n4.城市污水的再利用城市污水中_________约占70%,其次是_________.工业污水中含有某些宝贵的资源,可________________.生活污水中含有_________________,是宝贵的肥源.城市污水经处理后,成为能二次利用的“中水”,可供农林灌溉、洒水、消防、冲洗厕所之用.在我国缺水严重的大连、青岛等城市,________缓解了水资源的短缺.工业污水生活污水回收再加工利用丰富的植物营养素“中水”\n思考感悟2.现代污水处理技术,按处理程度划分,可分为哪几种?【提示】可分为一级、二级和三级处理。一级处理,主要去除污水中呈悬浮状态的固体污染物质,物理处理法大部分只能完成一级处理的要求.经过一级处理的污水,BOD物质一般可去除30%左右,达不到排放标准.一级处理属于二级处理的预处理.\n二级处理,主要去除污水中呈胶体和溶解状态的有机污染物质(BOD,COD物质),去除率可达90%以上,使有机污染物达到排放标准。三级处理,进一步处理难降解的有机物、氮和磷等能够导致水体富营养化的可溶性无机物等。主要方法有生物脱氮除磷法,混凝沉淀法,砂滤法,活性炭吸附法,离子交换法和电渗析法等。\n课堂互动讲练现代水处理工艺要点一现代水处理工艺为:混凝→沉淀→过滤→消毒.1.混凝剂可加入Al3+或Fe3+,现代技术用聚合氯化铝和聚合硫酸铁作为混凝剂.\n2.混凝剂的净水原理是Al3+或Fe3+与水中的OH-结合成胶体,胶体能吸附水中的悬浮物质而沉降.\n\n(2)加入凝聚剂除去其中的悬浮固体颗粒,该过程是既有胶体的吸附作用也有化学反应,所以既有化学过程又有物理过程。FeSO4·7H2O加入后生成红褐色Fe(OH)3胶状沉淀。(3)通入二氧化碳的目的是除去钙离子并调节溶液酸度。(4)气体A应是氯气,其作用是杀菌消毒。(5)可以找具有强氧化性的ClO2代替。\n\n【规律方法】本题以自来水的工艺流程为出发点,考查了离子反应、胶体性质、氯气的消毒原理等知识点,是一道综合性较强的实验流程题。在解题时注意与必修内容相结合,如离子方程式书写的准确性,CO2和Cl2的用途等都是必修知识在化学与技术中的体现。\n变式训练1(2010年邯郸调研)聚合氯化铝是一种新型、高效絮凝剂和净水剂,其单体是液态的碱式氯化铝[Al2(OH)nCl6-n]。本实验采用铝盐溶液水解絮凝法制备碱式氯化铝。其制备原料为分布广、价格廉的高岭土,化学组成为:Al2O3(25%~34%)、SiO2(40%~50%)、Fe2O3(0.5%~3.0%)以及少量杂质和水分。\n已知氧化铝有多种不同的结构,化学性质也有差异,且一定条件下可相互转化;高岭土中的氧化铝难溶于酸。制备碱式氯化铝的实验流程如下:\n根据流程图回答下列问题:(1)“煅烧”的目的是_______________________.(2)配制质量分数为15%的盐酸需要200mL30%的浓盐酸(密度约为1.15g/cm3)和_______g蒸馏水,配制用到的仪器有烧杯、玻璃棒、_______.(3)“溶解”过程中发生反应的离子方程式为__________________________________________.\n(4)加少量铝粉的主要作用是_________________.(5)“调节溶液pH在4.2~4.5”的过程中,除添加必要的试剂,还需借助的实验用品是_______;“蒸发浓缩”需保持温度在90~100℃,控制温度的实验方法是________________________________________________________________________.\n解析:本题以框图形式考查了新型混凝剂的生产工艺.对于框图题首先要找到突破口,依此推导.(1)高岭土中Al2O3不溶于酸,故煅烧的目的是改变Al2O3的结构,使其溶于酸.(2)利用稀释前后溶质质量守恒解题,设蒸馏水的质量为m,则有(m+200mL×1.15g·cm-3)×15%=200mL×1.15g·cm-3×30%,m=230g.(3)高岭土煅烧后,Al2O3、Fe2O3均溶于盐酸,产生AlCl3、FeCl3.(4)加入少量铝粉的作用是除去溶液中的Fe3+。(5)pH=4.2~4.5必须用pH计或精密pH试纸测。\n答案:(1)改变高岭土中氧化铝的结构,使其能溶于酸(2)230量筒(3)Al2O3+6H+===2Al3++3H2O,Fe2O3+6H+===2Fe3++3H2O(4)除去溶液中的Fe3+(5)pH计(或精密pH试纸)水浴加热\n饮用水消毒的常用方法要点二\n特别提醒:由于上述消毒方法可产生Cl2,Cl2与水中有机物反应生成致癌物质,因此现在又使用ClO2、Na2FeO4等消毒物质.\n用自来水养鱼时,通常先将自来水晒一段时间后再注入鱼缸中,目的是()A.提高水温B.增加水中氯气的含量C.除去水中少量的次氯酸D.用紫外线杀死水中的细菌例2\n【解析】自来水中残留有Cl2,Cl2有毒,会使鱼类中毒。经日光曝晒时,Cl2和H2O反应生成HClO,HClO见光易分解,从而降低有害物质Cl2的含量。【答案】C【规律方法】本题利用一些基本常识考查了对自来水消毒的认识,对同学们分析问题的能力和思维能力进行了综合考查。\n变式训练2养殖场长途运输鱼苗时,需满足3个条件:①保持水中有适量的氧气;②及时排出鱼苗呼出的二氧化碳;③防止细菌滋生.已知下列物质加入水中都可以起到供氧、杀菌作用,在储运鱼苗的水中可加入的最佳药剂是()A.Na2O2B.CaO2C.Cl2D.H2O2\n解析:选B.解题时注意题给的附加条件,Na2O2与水反应过于激烈,会很快消耗完毕,生成的NaOH属强腐蚀性的物质;Cl2有毒;H2O2能提供O2,但不能吸收CO2.\n污水的处理方法要点三污水处理时,污水中的悬浮物可用混凝法除去;对其他溶解在水中的污染物,则要根据其化学性质采用有针对性的化学方法,如酸碱中和法、重金属离子沉淀法等。\n\n2.沉淀法对于含有重金属离子的工业废水,可以利用某些化学物质作为沉淀剂,与金属离子反应生成沉淀而析出,从废水中分离.例如,对于含有Hg2+的废水,可向其中加入Na2S,使Hg2+转化为HgS沉淀而除去:Hg2++S2-===HgS↓.由于HgS在水中的溶解度极小,当S2-过量时,Hg2+的浓度可降至极低.用这种处理方法,也能同时将水中所含的Pb2+、Cu2+等重金属离子除去,所以,经过处理的水成为不含重金属类污染物的水.\n3.处理工业废水还有其他方法,如氧化还原法等。在实际处理工业废水时,根据污染物组成和回收用水水质要求的不同,经常需要采用多种技术分步处理,才能达到排放标准或复用指标。\n为了测量水中有机物等还原性污染物的含量,通过把1L水样与强氧化剂完全作用时消耗氧化剂的量,折算成以氧气为氧化剂时的质量(O2mg·L-1)来表示,称为该水样的化学耗氧量(COD).我国明文规定:COD>500mg·L-1的污水不得直接排放.为了测定某工业废水的COD,实验如下:量取废水样品20.00mL,加入0.100mol·L-1KMnO4溶液10.00mL和少量稀H2SO4,在一定条件下充分反应后,再用0.200mol·L-1的草酸钠(Na2C2O4)溶液滴定过量的KMnO4,达到滴定终点时消耗Na2C2O4溶液11.00mL.例3\n(1)写出酸性介质中KMnO4(被还原为Mn2+)与Na2C2O4(被氧化为CO2)反应的离子方程式_____________________________________________________________________________________.(2)计算该水样的COD,写出计算过程。\n(3)如果每次取水样20.00mL,加入等体积的0.100mol·L-1酸性KMnO4溶液;为简化计算,令滴定过量KMnO4时,每消耗1.00mLNa2C2O4溶液,就相当于水样的COD为10mg·L-1,该Na2C2O4溶液的物质的量浓度应配制为多少?\n\n\n\n【答案】见解析【规律方法】本题题干内容很多,注意分析和提取有效信息,关键在于理解COD的含义,利用滴定实验原理,结合计算,巩固数据处理的能力.\n变式训练3某工厂排出的废水中含游离氯(Cl2)和H+的物质的量浓度分别为0.015mol/L和0.001mol/L,废水的排出速率为10.0mL/s。为除去游离氯,并使废水呈中性,某课外活动小组学生设计如图所示方案:在A、B两处分别注入物质的量浓度为0.1mol/L的NaOH溶液及0.15mol/L的Na2SO3溶液,以中和H+并还原Cl2。已知Cl2和Na2SO3溶液反应的化学方程式为Cl2+Na2SO3+H2O===Na2SO4+2HCl。\n(1)A处注入的溶液是________,B处注入溶液与废水发生反应的离子方程式为____________________________________________________________.(2)试计算两种溶液的注入速率(mL/s),写出计算过程.\n解析:分析题给信息,结合物质的性质,不难分析出应用Na2SO3除Cl2,用NaOH溶液除H+。由于Na2SO3被Cl2氧化时生成HCl,反应方程式是Na2SO3+Cl2+H2O===Na2SO4+2HCl,所以应先用Na2SO3溶液除去Cl2后,再加入NaOH溶液除去H+。结合有关反应的化学方程式即可求出两种溶液的流速。\n\n知能优化训练\n本部分内容讲解结束点此进入课件目录按ESC键退出全屏播放谢谢使用