- 175.50 KB
- 2023-01-02 08:31:27 发布
- 1、本文档共5页,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报电话:19940600175。
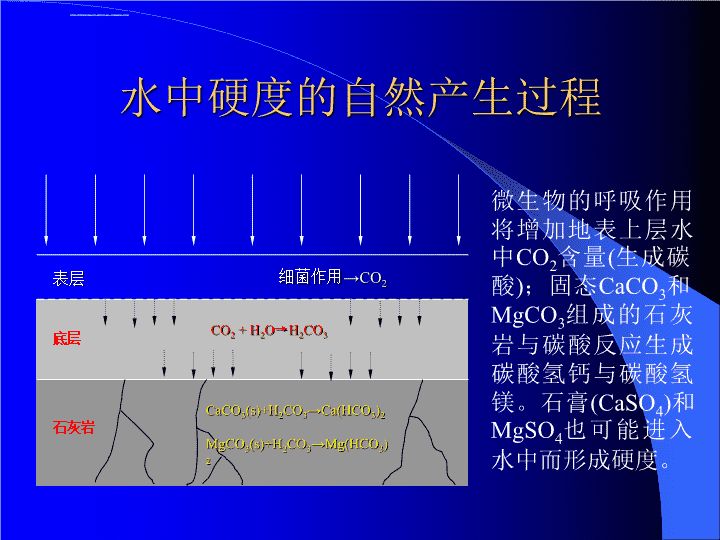
第二章水处理2.3软化概念介绍:硬度(hardness)硬度:所有多价阳离子浓度的总和。用于描述水的一种特征。含有硬度的水不易起泡,在澡盆内产生浮渣(主要是钙、镁与肥皂发生反应的结果)。在茶壶内会生成坚硬的、白色的粗糙沉积物(结垢)。Ca2++RCOO-Ca(RCOO)2(s)由于发生此反应,肥皂无法与衣服上的污垢作用,而Ca(RCOO)2本身就是沉淀。硬度的常用单位为mg/LCaCO3或毫当量/L。水厂将水软化即是去除水中的部分硬度。通常水处理的目标是使水的硬度维持在75~120mg/LCaCO3范围内。\n硬水的分类:硬度范围定性描述0~75软水75~100中等硬度水100~300硬水>300高硬度水虽然所有阳离子均会造成硬度,但最主要的离子是Ca2+和Mg2+。以下着重讨论Ca2+和Mg2+硬度。水中硬度的自然产生过程见下图。\n水中硬度的自然产生过程表层细菌作用→CO2CO2+H2O→H2CO3底层石灰岩CaCO3(s)+H2CO3→Ca(HCO3)2MgCO3(s)+H2CO3→Mg(HCO3)2微生物的呼吸作用将增加地表上层水中CO2含量(生成碳酸);固态CaCO3和MgCO3组成的石灰岩与碳酸反应生成碳酸氢钙与碳酸氢镁。石膏(CaSO4)和MgSO4也可能进入水中而形成硬度。\n水的总硬度(totalhardness,TH):钙和镁是主要的硬度来源,水的总硬度是这两种离子硬度的总和。TH=Ca2+硬度+Mg2+硬度这2种离子具有一致的浓度单位(mg/LCaCO3或毫当量/LCaCO3)。总硬度通常分为2个部分:(1)与碳酸氢根阴离子结合的部分(称为碳酸盐硬度,CH);(2)与其它阴离子结合的部分(称为非碳酸盐硬度,NCH)。因此,总硬度为:TH=CH+NCH。碳酸盐硬度是总硬度或总碱值中的较小者。由于加热可将碳酸盐硬度从水中去除,因此碳酸盐硬度通常称为暂时硬度。非碳酸盐硬度定义为总硬度与总碱度的差值。若总碱度大于或等于总硬度,则不存在非碳酸盐硬度。非碳酸盐硬度加热时无法去除,因此称为永久硬度。\n绘制水溶液组成物的柱状图通常有助于了解软化过程。柱状图中上面为阳离子柱,下面为阴离子柱。在阳离子柱中,将钙离子置于第一位,镁离子次之。其它阳离子则没有特定的次序。阴离子柱中,碳酸氢根离子在第一位,其它阴离子也没有特定的次序。Example:地下水水质分析结果如下表所示,请绘制柱状图:离子离子浓度CaCO3当量质量离子浓度(mg/L)/离子当量质量(mg/LCaCO3)Ca2+1032.50258Mg2+5.54.1223Na+162.1835HCO3-2550.82209SO42-491.0451Cl-371.4152碱度计算:(mg/L)(CaCO3与该化合物的当量质量之比)\n总阳离子浓度为316mg/LCaCO3,其中硬度为281CaCO3。总阴离子浓度为209mg/LCaCO3。碳酸盐硬度等于碱度,而非碳酸盐硬度等于总硬度与碳酸盐硬度的差值。HCO3-SO42-Cl-Ca2+Mg++Na+100200300阴离子阳离子碳酸盐硬度非碳酸盐硬度总硬度离子浓度(mg/LCaCO3)258281316209260312地下水水质组成柱状图\n2.3.1石灰-苏打软化硬度按照如下两个反应被去除:Ca2++CO32-CaCO3(s)Mg2++2OH-Mg(OH)2(s)为了产生CaCO3沉淀,则pH值则需调节至10.3左右。若要是镁离子产生沉淀,则pH值则需调节至11.0左右。如果天然水中没有足够的碳酸氢根碱度(HCO3-)用于形成CaCO3沉淀(即水的硬度为非碳酸盐硬度),则必须向水中添加CO32-离子。去除镁的费用比去除钙昂贵,因此,尽可能将镁留在水中。(1)软化化学通过加入化学药剂来增加CO32-离子和OH-离子的浓度,使沉淀反应向右移动。添加OH-离子将会使HCO3-变成CO32-离子。\n增加的OH-会使碳酸盐缓冲体系向右移动:CO2(g)CO2(solution)+H2OH2CO3H++HCO3-2H++CO32-OH-离子使HCO3-变成CO32-;而CO32-正是Ca2+沉淀所需要的。氢氧根离子的一般来源是Ca(OH)2。许多水处理厂使用生石灰(CaO),比熟石灰(Ca(OH)2)便宜。将生石灰与水混合生成浆状的熟石灰(这个过程称为熟化),然后加入水中进行软化反应。CaO+H2OCa(OH)2+热量1mol石灰会产生1MJ的热量。当必须加入碳酸根离子时,最常使用的化学药剂为Na2CO3(通常称之为苏打或苏打粉)。\n(2)软化反应软化反应可以通过控制pH值而调节。首先中和游离的酸,然后生成CaCO3沉淀。若有必要,pH值可调至更高以生成Mg(OH)2沉淀。以下讨论几个重要的软化反应:①中和碳酸为提高pH值,首先必须中和水中存在的游离酸,在未受污染的天然水体中,主要为碳酸(即CO2)。没有去除硬度。CO2+Ca(OH)2CaCO3(s)+H2O②沉淀Ca2+所形成的碳酸盐硬度需要将pH值调节到10.3,才能产生碳酸钙沉淀。Ca2++2HCO3-+Ca(OH)22CaCO3(s)+2H2O\n③沉淀Mg2+形成的碳酸盐硬度如果要去除Mg2+引起的碳酸盐硬度,则要添加更多的石灰,使pH值达到11左右。此反应分为两个阶段,转变所有碳酸氢根是第一阶段反应:Mg2++2HCO3-+Ca(OH)2CaCO3(s)+MgCO3(s)+2H2O同Mg(OH)2相比,MgCO3在水中的溶解度比较大,当再加入Ca(OH)2时,将会进一步转化成为Mg(OH)2沉淀。Mg2++CO3-+Ca(OH)2CaCO3(s)+Mg(OH)2(s)④去除Ca2+形成的非碳酸盐硬度该过程并不需要进一步提高pH值。但需要添加额外的碳酸根离子:Ca2++Na2CO3CaCO3(s)+2Na+⑤去除Mg2+形成的非碳酸盐硬度需要同时添加石灰与苏打。石灰能够提供Mg2+沉淀反应所需要的氢氧根离子。\nMg2++Ca(OH)2Mg(OH)2(s)+Ca2+注意:因为Ca2+仍然存在于溶液中,虽然Mg2+已被除去,但硬度并没有改变。需要添加苏打以去除Ca2+:Ca2++Na2CO3CaCO3(s)+2Na+该反应与去除钙形成的非碳酸盐硬度的反应相同。(3)过程控制和经验考验由于CaCO3和Mg(OH)2溶解度特性、搅拌和接触的限制以及缺乏足够的时间使反应进行完全等因素的影响,石灰-苏打软化工艺并不能生产完全没有硬度的水。可以达到的最小钙硬度约为30mg/LCaCO3,最小镁硬度约为10mg/LCaCO3。但是,如果水太软,则使用肥皂等洗涤剂时会发粘,因此,通常使水的最终硬度维持在75~120mg/LCaCO3范围。为了在合理的时间内达到合理的硬度去除效果,Ca(OH)2的添加量通常高于理论量20mg/LCaCO3。\n在热水器中,镁的浓度超过40mg/LCaCO3即会出现结垢现象。由于去除镁硬度的成本高,通常我们只去除高于40mg/LCaCO3的那部分镁硬度。为了去除小于20mg/LCaCO3的镁硬度,必须添加足够多过量的石灰。为了去除20mg/LCaCO3至40mg/LCaCO3之间的镁硬度,添加的过量石灰量必须等于被去除的镁的量。为了去除大于40mg/LCaCO3的那部分镁硬度,必须添加的过量石灰为40mg/LCaCO3,当添加的过量石灰大于40mg/LCaCO3时,并不能明显地改变反应动力学。\n软化水所需要的化学药剂(以CaCO3表示)添加量汇总:\n解决软化问题的流程图添加石灰=CO2添加石灰=HCO3-Mg2+>40添加石灰=20添加石灰=Mg2+-40是否Mg2+-40>40?Mg2+-40<20?是添加石灰=Mg2+-40添加石灰=40否是否NCH是否除去添加碳酸钠=去除的NCH是否停止\n2.3.2石灰-苏打软化的高级概念(1)估算CO2浓度在软化过程中CO2有2种重要作用:①消耗用于去除Ca2+和Mg2+的石灰;②中和软化工艺出水的酸度。利用碱度的定义(碱度=[HCO3-]+2[CO32-]+[OH-]-[H+])以及碳酸的离解平衡方程式,可以估计CO2的浓度。当然,必须先确定水的pH值和碱度。Example:已知水的pH值为7.65,总碱度为310mg/LCaCO3,试估算CO2浓度。Solution:当原水的pH值小于8.5时,可假设水中的碱度主要为HCO3-,因此可以忽略HCO3-转化成CO32-的情形。解题过程:①根据pH计算[H+],②根据碱度计算碳酸氢根浓度[HCO3-],③利用碳酸离解平衡表达式求[H2CO3],④假设[H2CO3]=[CO2],进行估算。\n[H+]=10-pH=10-7.65=2.2410-8mol/L[HCO3-]转化:310mg/LCaCO3mol/L[HCO3-]=310mg/L(61/50)(1/61/1000)=6.210-3mol/L式中:(61/50)为HCO3-的当量质量与CaCO3的当量质量之比。碳酸的离解平衡:Ka=[H+][HCO3-]/[H2CO3]式中Ka=10-6.35=4.4710-7,从而[H2CO3]=3.1110-4mol/L假设水中所有的CO2都形成碳酸,因此,CO2的估算浓度为:3.1110-4mol/L(44g/mol)=13.7mg/L;或者:13.7mg/LCO2(50/22)=31.14mg/LCaCO3。该式将CO2的估算浓度转化为mg/LCaCO3来表示。由于CO2消耗H+的摩尔比为2,因此其当量质量为44/2=22g/当量。\n(2)软化到实际限制值Example:试确定将下列成分的水软化到实际溶解度限制值所需要的化学药剂量?\n原水的柱状图为软化到理论溶解度限制值,需要的石灰与苏打的添加量如下表所示:CO2Ca2+Mg2+Na+HCO3-Cl-SO42-21.921.900238293.6198293.6369.6\n由于Mg2+含量与40mg/LCaCO3的差值等于15.6mg/LCaCO3,因此选择过量石灰的最小值20mg/LCaCO3。总石灰添加量为(275.5+20)=295.5mg/LCaCO3;苏打添加量为95.6mg/LCaCO3,或者:95.6mg/LCaCO3(53/50)=101.3mg/LNa2CO3(53/50)为碳酸钠与碳酸钙的当量质量比。与CO2反应:CO2+Ca(OH)2CaCO3(s)+H2O去除CO2以后的柱状图为:Ca2+Mg2+Na+HCO3-Cl-SO42-00238293.6198293.6369.6\n与HCO3-反应:Ca2++2HCO3-+Ca(OH)22CaCO3(s)+2H2O去除HCO3-以后的柱状图为:由于受到溶解度的限制,水中仍有“残余的30mg/LCaCO3”。Ca2+Mg2+Na+CO32-Cl-SO42-304095.695.6171.6Ca2+0151.8\n钙与苏打发生反应(去除钙离子形成的非碳酸盐硬度):Ca2++Na2CO3CaCO3(s)+2Na+镁与石灰、苏打反应:Mg2++Ca(OH)2Mg(OH)2(s)+Ca2+Ca2++Na2CO3CaCO3(s)+2Na+Ca2+Mg2+Na+CO32-Cl-SO42-3055.695.6171.60111.8\n处理后水的柱状图处理后水的总硬度为30mg/LCaCO3+10mg/LCaCO3=40mg/LCaCO3。图中Na+(1)为水中原有钠离子;Na+(2)为去除碳酸氢根硬度后的NCH部分(=40),由Ca2+与苏打的反应带入;Na+(3)为去除水中Mg2+硬度时由Ca2+与苏打的反应带入,等于Mg2+硬度(=55.6)。Ca2+Mg2+Na+(2)CO32-Cl-SO42-301095.6171.696.2OH-Na+(1)Na+(3)56.2151.8\n(3)分流处理在分流处理中,一部分原水不经过软化反应池和沉淀池。这种设计具有如下几种功能:①可将处理水调整至含镁40mg/LCaCO3或任何高于溶解度限制的浓度值;②由于不需要处理全部水,可以降低反应池的设备投资;③可以节省化学药剂的投加量;④可以利用水的天然碱度降低处理水的pH值,并有助于维持水质稳定。软化沉淀过滤原水Q旁流旁流比例=(X)(Q)流量=(1-X)(Q)充入CO2出水消毒\n分流量计算公式:式中:Mgi为第一阶段后的镁浓度;Mgr为原水镁浓度;Mgf为最终镁浓度;单位均为mg/LCaCO3。“操作的第一阶段”是指将水软化到软化的实际限制值。因此,Mgi通常设为10mg/LCaCO3;而Mgf通常设为其期望值,40mg/LCaCO3。\n2.3.3离子交换软化离子交换:离子在固相与液相间进行的可逆交换,交换过程中固体结构不会发生永久性改变。利用离子交换软化水,是使含有硬度的水流经装填离子交换材料的交换柱,水中硬度与离子交换剂进行离子交换反应。通常为钠离子型离子交换剂:Ca(HCO3)2+2NaRCaR2+2NaHCO3在离子交换过程中,碱度一般保持不变。离子交换法可以去除水中100%的硬度,直到离子交换剂的交换容量达到饱和为止。当离子交换剂饱和以后,将不再去除硬度,此时硬度会流过交换柱,这种现象称为“穿透”。此时,交换柱需要更换,离子交换剂需要再生。\n离子交换柱中硬度的去除出水硬度硬度进水硬度离子交换材料饱和时间\n再生方法:CaR2+2NaClCaCl2+2NaR再生后的离子交换剂,可以继续用来去除硬度,但含CaCl2的废液必须进行处理。离子交换法软化水主要用于家庭用水的软化器中。离子交换剂可以是天然的沸石或合成树脂。树脂的性能通常用单位体积的树脂可去除硬度的量,或树脂再生所需要的盐的量来表示。由于树脂可以去除100%的硬度,因此必须旁流部分原水,然后与处理过的水混合,以达到预期的最终硬度。旁流率的计算如下:旁流率=处理水预期的硬度值/原水硬度值。\n2.4反应器用于物理、化学、生物反应的容器称为反应器。①批处理反应器(或叫间歇式反应器,Batchreactor):反应器的混合效果良好,物料在任意瞬间均保持均匀状态,但反应器内的组分岁时间变化;②连续式反应器:操作为连续式的,物料依次连续地流入反应器、反应并流出反应器。在全混流反应器(CSTR)中,物料均匀分布,出水的组成与反应器中的组成相同。在柱塞流反应器(或叫平推流反应器)中,流体依次顺序通过反应器,先进入的部分先流出,反应器内没有侧向混合。截面\n对于随时间变化的反应,流体颗粒在反应器内停留的时间影响反应进行的完全程度。理想反应器内的停留时间定义为:t0=V/Q;V-反应器内流体的体积量;Q-流体流量。反应器设计:在一固定体积的反应器内转化物质A,对于间歇式反应器,流入量与流出量均为零。根据质量平衡方程得到:累计速率=转化率,微分表达式为:式中,r为反应速率。r=kCAn=k[A]n,k为速率常数,n为反应级数。\n速率常数的确定方法\n2.5混合和絮凝很明显,要使混凝和软化水的化学反应发生,化学药剂必须与水充分混合。本节主要讨论该过程中所必须具备的物理设备。混合,或称为快混(rapidmixing),是化学药剂快速且均匀地分散于水中的过程。理想情况下,化学药剂应在瞬间分散于整个水体中。由于发生混凝和软化反应,在快混时会形成沉淀物,如氢氧化铝和氢氧化铁,而软化时会产生碳酸钙和氢氧化镁。在这些过程中形成的沉淀物彼此接触、聚集,形成更大的颗粒,称为絮体(floc),这个接触过程称为絮凝(flocculation),可通过缓慢、温和的搅拌来实现。\n在水和废水处理中,混合的程度由速度梯度(Velocitygradient,G)来确定。速度梯度是表达剪切力大小的最好方式。即G值越高,搅拌越剧烈。G是单位体积的水的动力输入的函数,其计算公式如下:式中P为动力输入,W;V为混合池中水的体积;为粘度,Pa•S。颗粒碰撞的总数与G•t0成正比,t0为颗粒物在反应器内的理论停留时间。设备放大?\n2.5.1快混快混是影响混凝药剂效率的最重要的条件。混凝时完成化学反应所虚的时间在0.1秒以内。因此,应尽可能在瞬间完成混合。可利用反应器中的垂直轴搅拌器、管线中的线上混合器或管线中的静态混合器来完成。混凝主要有两种机制:①溶解性的水解物吸附在胶体上并使胶体脱稳;②胶体被氢氧化物沉淀物捕获所形成的扫除作用。吸附-脱稳反应在1秒内发生。扫除作用较为缓慢,需要1~7秒的时间。可用烧杯实验数据来判别主要的反应是吸附-脱稳,还是扫除作用。\n如果从剂量-浊度曲线可明显地观察到电荷逆转的情形(见左下图),则吸附-脱稳为主要反应机制;如果剂量-浊度曲线上没有显示出电荷逆转的情形(即在较高剂量时曲线仍然相对平直,则主要的作用为扫除机制。剂量浊度剂量浊度\n对于吸附-脱稳反应,建议G值维持在3000~5000S-1的范围内,停留时间为0.5s,这些值最常用于线上混合器中。对于扫除作用,建议停留时间在1~10秒,G值维持在600~1000S-1的范围内。(1)软化将CaO和Ca(OH)2溶解于软水,需要5~10分钟的停留时间。使颗粒分散并维持呈悬浮状态需要的G值为700S-1。(2)快混池快混池的设计主要根据经验进行,这里不详叙。\n垂直轴搅拌器:添加化学药剂\n2.5.2絮凝如果快混是影响混凝药剂效率的最重要的条件,那么絮凝则是影响颗粒去除效率的最重要因素。絮凝的目的是使颗粒互相接触,进一步发生碰撞与粘接,使颗粒长大到可迅速沉降的尺寸。过于剧烈的搅拌会剪碎絮体颗粒,形成小的絮体而分散于溶液中,因此速度梯度必须控制在比较窄的范围内。絮凝池至少分成3个室,速度梯度递减,G值从第一室至第三室递减,而将各分室的平均G值作为设计值。\n2.5.3动力要求在快混与混凝等混合设备的设计上,在挡板反应器中由搅拌桨提供给液体的动力,可以利用Rushton针对完全混流所提出的公式描述:式中:P为动力,W;KT为搅拌桨常数;n为转速,r/s;Di为搅拌桨直径,m。在未设置挡板的反应器中,流体所获得的动力仅为此公式预测的1/6。\n搅拌桨常数KT值:搅拌桨类型KT螺旋式,倾斜度1,3叶片0.32螺旋式,倾斜度2,3叶片1.00涡轮式,6片平叶片,叶瓣圆盘6.30涡轮式,6片弯曲叶片4.80风扇涡轮式,6片45度叶片1.65覆盖涡轮式,6片弯曲叶片1.08覆盖涡轮式,稳定叶片,无挡板1.12常数值设定条件:絮凝池壁上有四个挡板,其宽度等于絮凝池直径的10%。\nQuestions(1)根据下列水质分析结果,确定将水的硬度值软化到80mg/LCaCO3时,需要添加的石灰与苏打的量(以mg/LCaCO3表示)水的成分表提示:先绘制柱状图;CO2不造成硬度;注意结合解决软化问题的流程图进行求解。(2)pH值是如何影响Al2(SO4)3和FeCl3的溶解度的?