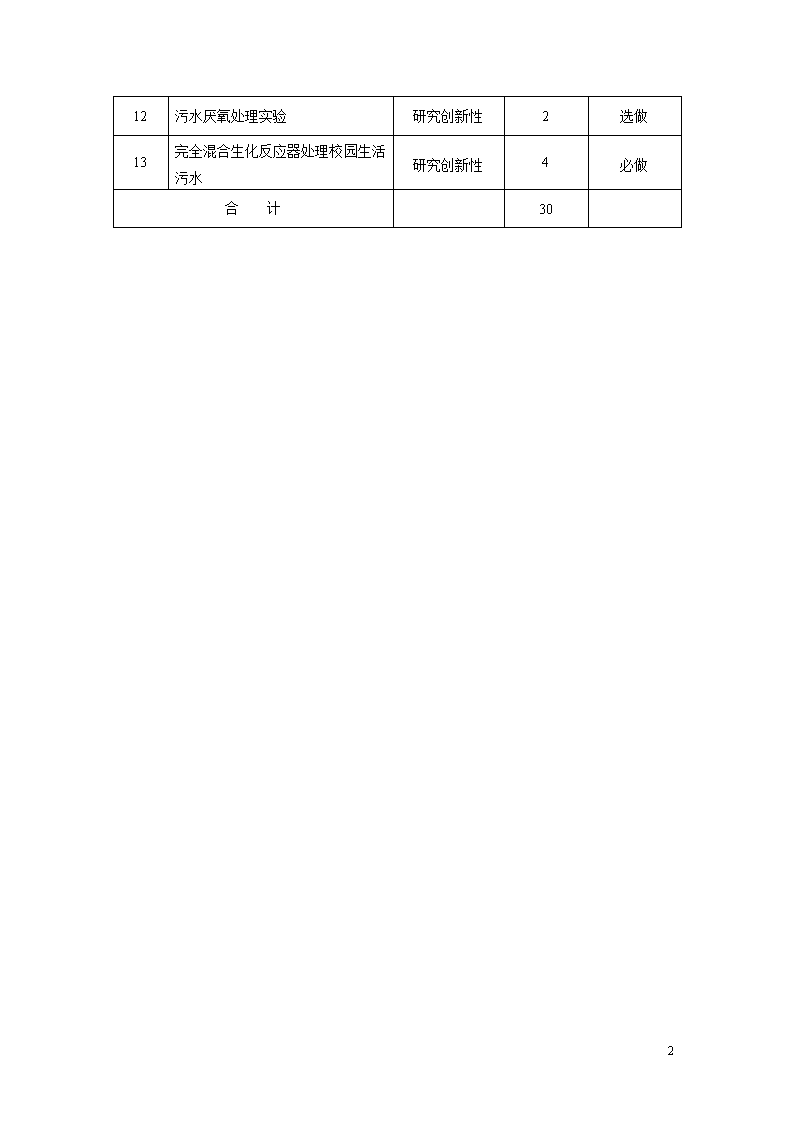- 1.85 MB
- 2022-04-22 13:50:46 发布
- 1、本文档共5页,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报电话:19940600175。
'四、水处理实验技术项目设置开设的实验项目包括基础型、提高性、研究创新性实验教学项目。基础型实验教学项目占实验总数的50%左右,共8项。其中验证性实验包括:颗粒自由沉淀实验;验证性实验包括活性炭吸附试验、离子交换软化实验、曝气设备充氧能力测定、混凝实验、过滤实验、污泥比阻测定实验、污泥沉降比和污泥指数测定实验。数据处理项目实验数据分析处理及实验设计。提高性实验教学项目占实验总数的30%左右,共3项。包括膜法水处理实验、食品废水中酵母的分离培养与核酸提取、有机废水处理好氧优势菌的分离、纯化及属的鉴定。研究创新性实验教学项目占实验总数的20%左右,共2项,实验项目为污水厌氧处理实验、完全混合生化反应器处理校园生活污水,设计多种工艺路线处理生活污水。详细见表4-1。表4-1实验项目一览表实验项目一览表序号实验(实训)项目名称项目类型计划课时备注1活性炭吸附实验验证性2必做2离子交换软化实验验证性2必做3曝气设备充氧能力测定实验验证性2必做4混凝实验验证性2必做5颗粒自由沉淀实验验证性2必做6过滤实验验证性2必做7污泥比阻测定实验验证性2必做8污泥沉降比和污泥指数(SVI)的测定实验验证性2必做9膜法水处理实验设计性2必做10食品废水中酵母的分离培养与核酸提取设计性2选做11有机废水处理好氧优势菌的分离、纯化及属的鉴定设计性4必做73
12污水厌氧处理实验研究创新性2选做13完全混合生化反应器处理校园生活污水研究创新性4必做合 计3073
实验一活性炭吸附实验活性炭吸附是目前国内外应用较多的一种水处理工艺,由于活性炭种类多、可去除物质复杂,因此掌握“间歇”法与“连续淤法确定活性炭吸附工艺设计参数的方法,对水处理工程技术人员至关重要。目的1.通过实验进一步了解活性炭的吸附工艺及性能,并熟悉整个实验过程的操作。2.掌握用“间歇”法、“连续流”法确定活性炭处理污水的设计参数的方法。原理活性炭吸附是目前国内外应用较多的一种水处理手段。由于活性炭对水中大部分污染物都有较好的吸附作用,因此活性炭吸附应用于水处理时往往具有出水水质稳定,适用于多种污水的优点。活性炭吸附常用来处理某些工业污水,在有些特殊情况下也用于给水处理。比如当给水水源中含有某些不易去除而且含量较少的污染物时;当某些偏远小居住区尚无自来水厂需临时安装一小型自来水生产装置时,往往使用活性炭吸附装置。但由于活性炭的造价较高,再生过程较复杂,所以活性炭吸附的应用尚具有一定的局限性。活性炭吸附就是利用活性炭的固体表面对水中一种或多种物质的吸附作用,以达到净化水质的目的。活性炭的吸附作用产生于两个方面,一是由于活性炭内部分子在各个方向都受着同等大小的力而在表面的分子则受到不平衡的力,这就使其它分子吸附于其表面上,此为物理吸附;另一个是由于活性炭与被吸附物质之间的化学作用,此为化学吸附。活性炭的吸附是上述二种吸附综合作用的结果。当活性炭在溶液中的吸附速度和解吸速度相等时,即单位时间内活性炭吸附的数量等于解吸的数量时,此时被吸附物质在溶液中的浓度和在活性炭表面的浓度均不再变化,而达到了平衡,此时的动平衡称为活性炭吸附平衡,而此时被吸附物质在溶液中的浓度称为平衡浓度。活性炭的吸附能力以吸附量q表示。(3-105)式中q——活性炭吸附量,即单位重量的吸附剂所吸附的物质重,g/g;V——污水体积,L;C0、C——分别为吸附前原水及吸附平衡时污水中的物质浓度,g/L;X——被吸附物质重量,g;M——活性炭投加量,g;在温度一定的条件下;活性炭的吸附量随被吸附物质平衡浓度的提高而提高,两者之间的变化曲线称为吸附等温线,通常用费兰德利希经验式加以表达。(3-106)式中q——活供发吸附量,g/g;C——被吸附物质平衡浓度g/L;K、h一一是与溶液的温度,pH值以及吸附剂和被吸附物质的性质有关的常数。K、h值求法如下:通过间歇式活性炭吸附实验测得q、C一一相应之值,将式(3-10673
)取对数后变为下式:(3-107)将q、C相宜值点绘在双对数坐标纸上,所的直线的斜率为截距则为k。如图(3-69)所示。由于间歇式静态吸附法处理能力低、设备多,故在工程中多采用连续流活性炭吸附法,即活性炭动态吸附法。采用连续流方式的活性炭层吸附性能可用勃哈特(Bohart)和亚当斯(Adams)所提出的关系式来表达。(3-108)(3-109)式中t——工作时间,h;V——流速,m/h;D——活性炭层厚度,m;K——速度常数,L/mg·h;N0——吸附容量、即达到饱和时被吸附物质的吸附量,mg//L;C0——进水中被吸附物质浓度,mg/L;CB——允许出水溶质浓度,mg/L。当工作时间t=0时,能使出水浓度小于CB的炭层理论深度称为活性炭层的临界深度,其值由上式t=0推出(3-110)炭柱的吸附容量(N)和速度常数(K),可通过连续流活性炭吸附实验并利用式(3-109)t~D线形关系回归或作图法求出。设备及用具1.间歇式活性炭吸附实验装置如图3-67所示;2.连续流活性炭吸附实验装置如图3-68所示;3.间歇与连续流实验所需设备及用具:(1)康氏振荡器一台。(2)500mL三角烧杯6个;(3)烘箱;(4)COD、SS等测定分析装置,玻璃器皿、滤纸等。(5)有机玻璃炭柱d=20~30mm,H=1.0m;73
(6)活性炭;(7)配水及投配系统。步骤及记录1.间歇式活性炭吸附实验(1)将某污水用滤布过滤,去除水中悬浮物,或自配污水,测定该污水的COD、pH、SS等值。(2)将活性炭放在蒸馏水中浸24小时,然后放在105℃烘箱内烘至恒重,再将烘干后的活性炭压碎,使其成为能通过200目以下筛孔的粉状炭。因为粒状活性炭要达到吸附平衡耗时太长,往往需数日或数周,为了使实验能在短时间内结束,所以多用粉状炭。(3)在六个500mL的三角烧瓶中分别投加0、100、200、300、4D0、500mg粉状活性炭。(4)在每个三角烧瓶中投加同体积的过滤后的污水,使每个烧瓶中的COD浓度与活性炭浓度的比值在0.05~5.0之间(没有投加活性炭的烧瓶除外)。(5)测定水温,将三角烧瓶放在振荡器上振荡,当达到吸附平衡(时间延至滤出液的有机物浓度COD值不再改变)时即可停止振荡。(振荡时间一般为30min以上)。(6)过滤各三角烧瓶中的污水,测定其剩余COD值,求出吸附量x。实验记录如表3-66示。表3-66活性发间歇吸附实验记录序号原污水出水污水体积(mL)或(L)活性炭投加量(mg)或(g)COD去除率(%)备注COD(mg/L)PH值水温℃SS(mg/L)COD(mg/L)pHSS(mg/L)2.连续流活性炭吸附实验(1)将某污水过滤或配制一种污水,测定该污水的COD、pH、SS、水温等各项指标并记人表3-67。(2)在内径为20~30mm,高为1000mm的有机玻璃管或玻璃管中装人500~750mm高的经水洗烘干后的活性炭。表3-67连续流炭柱吸附实验记录原水COD浓度(mg/L)允许出水浓度CB(mg/L))=水温T(℃)=pH=SS=(mg/L)进流率q(m3/m2·h)=滤速V(m/h)=炭柱厚D1=D2=D3=工作时间出水水质73
t(h)柱1柱2柱3(3)以每分钟40mL~200mL的流量(具体可参考水质条件而定),按升流或降流的方式运行(运行时炭层中不应有空气气泡)。本实验装置为降流式。实验至少要用三种以上的不同流速V进行。(4)在每一流速运行稳定后,每隔10~30min由各炭柱取样,测定出水COD值,至出水中COD浓度达到进水中COD浓度的0.9~0.95为止。并将结果记于表3-67中。成果整理1.间歇式活性炭吸附实验(1)按表3-66记录的原始数据进行计算。(2)按(3-105)式计算吸附量q。(3)利用q~c相应数据和式(3-106),经回归分析求出K、n值或利用作图法,将C和相应的q值在双对数坐标纸上绘制出吸附等温线,直线斜率为、截距为K.。值越小活性炭吸附性能越好,一般认为当=0.1~0.5时,水中欲去除杂质易被吸附;>2时难于吸附。当较小时多采用间歇式活性炭吸附操作;当较大时,最好采用连续式活性炭吸附操作。2.连续流活性炭吸附实验(1)求各流速下K、N0值1)将实验数据记入表3-67,并根据t~C关系确定当出水溶质浓度等于CB时各柱的工作时间t1、t2、t3。2)根据式(3-109)以时间ti为纵坐标,以炭层厚Dt为横坐标,点绘t、D值,直线截距为斜率为N0/C0·V。如图3-70示。3)将已知C0、CB、V等值代人,求出流速常数K和吸附常量N0值。4)根据式(3-110)求出每一流速下炭层临界深度值D0值。5)按表(3-68)给出各滤速下炭吸附设计参数K、D0、N0值,或绘制成如图3-71所示的图,以供活性炭吸附设备设计时参考。73
表3-68活性炭吸附实验结果流速V(m/h)N0(mg/L)K(L/mg·h)D0(m)思考题1.吸附等温线有什么现实意义,作吸附等温线时为什么要用粉状炭?2.连续流的升流式和降流式运动方式各有什么缺点?73
实验二离子交换软化实验离子交换软化法在水处理工程中有广泛的应用。强酸性阳离子交换树脂的使用也很普遍。作为水处理工程技术人员应当掌握这种树脂交换容量(即全交换容量)的测定方法并了解软化水装置的操作运行。一、强酸性阳离子交换树脂交换容量的测定目的1.加深对强酸性阳离子交换树脂交换容量的理解。2.掌握测定强酸性阳离子交换树脂交换容量的方法。原理交换容量是交换树脂最重要的性能,它定量地表示树脂交换能力的大小。树脂交换容量在理论上可以从树脂单元结构式粗略地计算出来。以强酸性苯乙烯系阳离于交换树脂为例,其单元结构式为:单元结构式中共有8个碳原子、8个氢原子、3个氧原子、一个硫原子,其分子量等于8×12.011+8×1.008+3×15.9994+1×32.06=184.2,只有强酸基因SO3H对中的H遇水电离形成H+离子可以交换,即每184.2g干树脂中只有1克当量可交换离子。所以,每克干树脂具有可交换离子1/184.2=0.00543e=5.43me。扣去交联剂所占份量(按8%重量计),则强酸干树脂交换容量应为5.43×92/100=4.99me/g。此值与实际测定值差别不大。0.01×7强酸性苯乙烯系阳离子交换树脂交换容量规定为≥4.2me/g(干树脂)。强酸性阳离子交换树脂交换容量测定前需经过预处理,即经过酸碱轮流浸泡,以去除树脂表面的可溶性杂质。测定阳离子交换树脂容量常采用碱滴定法,用酚酞作指示剂,按下式计算交换容量:(干氢树脂)(3-93)式中N——NaOH标准溶液的当量浓度;V—一NaOH标准溶液的用量,mL;W——样品湿树脂重,g。[设备及用具]1.天平万分之一克精度1架2.烘箱1台3.干燥器1个4.三角烧瓶250mL2个73
5.秒液管10mL2支步骤及记录1.强酸性阳离子交换树脂的预处理取样品约10g以2N硫酸(或1N盐酸)及1NNaOH轮流浸泡,即按酸一碱一酸一碱一酸顺序浸泡5次,每次两小时,浸泡液体积约为树脂体积的2~3倍。在酸碱互换时应用200mL无离子水进行洗涤。5次浸泡结束用无离子水洗涤至溶液呈中性。2.测强酸性阳离于交换树脂团体含量%称取双份1.0000g的样品,将其中一份放入105~110℃烘箱中约2小时,烘干至恒重后放入氯化钙干燥器中冷却至室温,称重,记录干燥后的树脂重。固体含量=干燥后的树脂重×100/样品重3.强酸性阳离子交换树脂交换容量的测定将一份1.0000g的样品置于250mL三角烧瓶中,投加0.5NNaCl溶液100mL摇动5分钟,放置两小时后加人l%酚酞指示剂3滴,用标准0.10000NNaOH溶液进行滴定,至呈微红色15秒钟不退,即为终点。记录NaOH标准溶液的当量浓度及用量。表3-50强酸性阳离子交换树脂交换容量测定记录湿树脂样品重W(g)干燥后的树脂重W1(g)树脂固体含量(%)NaOH标准溶液的当量浓度NaOH标准溶液的用量V(mL)交换容量me/g干氢树脂成果整理1.根据实验测定数据计算树脂固体含量。2.根据实验测定数据计算树脂交换容量。思考题1.测定强酸性阳离子交换树脂的交换容量为何用强碱液NaOH滴定?2.写出本实验有关化学反应式。二、软化实验目的1.熟悉顺流再生固定床运行操作过程。2.加深对钠离子交换基本理论的理解。原理当含有钙盐及镁盐的水通过装有阳离子交换树脂的交换器时,水中的Ca2+及Mg2+离子便与树脂中的可交换离子(Na+或H+)交换.使水中Ca2+、Mg2+含量降低或基本全部去除,这个过程叫做水的软化。树脂失效后要进行再生,即把树脂上吸附的钙、镁离子置换出来,代之以新的可交换离子。钠离子交换用食盐(NaCl)再生、氢离子交换用盐酸(HCI)或硫酸(H2SO4)再生。基本反应式如下:1.钠离子交换:软化:73
再生:(3-96)(3-97)2.氢离子交换:交换再生;钠离子交换的最大优点是不出酸性水,但不能脱碱。本实验采用钠离子交换。设备及用具1.软化装置二套,如图3-58,2.100mL量简1个、秒表1块(控制再生液流量用);3.200000钢卷尺1个;4.测硬度所需用品及测定方法详见水质分析书籍;5.食盐数百克。步骤及记录1.熟悉实验装置,搞清楚每条管路、每个阀门的作用;2.测原水硬度,测量交换柱内径及树脂层高度;73
3.将交换柱内树脂反洗数分钟,反洗流速采用15m八,以去除树脂层的气泡。4.软化。运行流速采用15m巾,每隔10min测一次水硬度,测两次并进行比较。5.改变运行流速。流速分别取20、25、30m/h,每个流速下运行5min,测出水硬度。6.反洗。冲洗水用自来水.反洗流速采用15m/h,反洗时间15min。反洗结束将水放到水面高于树脂表面10cm左右。7.根据软化装置树脂工作交换容量(e/L),树脂体积(L),顺流再生钠离子交换NaCl耗量(100~120g/e)以及食盐NaCl含量(海盐NaCI含量≥80~93%),计算再生一次所需食盐量。配制浓度10%的食盐再生液。8.再生。再生流速采用3~5m/h。调节定量投再生液瓶出水阀门开启度大小以控制再生流速。再生液用毕时,将树脂在盐液中浸泡数分钟。9.清洗。清洗流速采用15m/h,每5min测一次出水硬度,有条件还可测氯根,直至出水水质符号要求时为止。清洗时间约需50min。10.清洗完毕结束实验,交换柱内树脂应浸泡在水中。表3-51原水硬度及实验有关数据原水硬度(以CaCO3计)(mg/L)交换柱内径(cm)树脂层高度(cm)树脂名称及型号表3-52交换实验记录运行流速(m/h)运行流量(L/h)运行时间(min)出水硬度(以CaCO3计(mg/L))15152025301010555表3-53反洗记录反洗流速(m/h)反洗流量(L/h)反洗时间(min)表3-54再生记录再生一次所需食盐量(kg)再生一次所需浓度10%的食盐再生液(L)再生流速(m/h)再生流量(mL/s)表3-55清洗记录清洗流速(m/h)清洗流量(L?h)清洗历时(min)出水硬度(以CaCO3计(mg/L))151515155105073
注意事项1.反冲洗时注意流量大小,不要将树脂冲走。2.再生溶液没有经过过滤器,宜用精制食盐配制。成果整理1.绘制不同运行流速与出水硬度关系的变化曲线。2.绘制不同清洗历时与出水硬度关系的变化曲线。思考题1.本实验钠离子交换运行出水硬度是否小于0.05me/L?影响出水硬度的因素有哪些?2.影响再生剂用量的因素有哪些?再生液浓度过高或过低有何不利?73
实验三曝气设备充氧能力测定实验曝气是活性污泥系统的一个重要环节,它的作用是向池内充氧,保证微生物生化作用所需之氧,同时保持池内微生物、有机物、溶解氧,即泥、水、气三者的充分混合,为微生物降解创造有利条件。因此了解掌握曝气设备充氧性能,不同污水充氧修正系数a、B值及其测定方法,不仅对工程设计人员、而且对污水处理厂(站)运行管理人员也至关重要。此外,二级生物处理厂(站)中,曝气充氧电耗占全厂动力消耗的60—70%,因而高效省能型曝气设备的研制是当前污水生物处理技术领域面临的一个重要课题。因此本实验是水处理实验中的一个重要项目,一般列为必开实验。一、曝气设备清水充氧性能测定目的1.加深理解曝气充氧的机理及影响因素。2.了解掌握曝气设备清水充氧性能测定的方法。3.测定几种不同形式的曝气设备氧的总转移系数KLas,氧利用率η%,动力效率等,并进行比较。原理曝气是人为地通过一些设备加速向水中传递氧的过程,常用的曝气设备分为机械曝气与鼓风曝气两大类,无论哪一种曝气设备,其充氧过程均属传质过程,氧传递机理为双膜理论,如图3-43示在氧传递过程中,阻力主要来自液膜,氧传递基本方程式为:(3-58)式中——液体中溶解氧浓度变化速率mg/L·min;CS-C——氧传质推动力,mg/L;CS——液膜处饱和溶解氧浓度,mg/L;C—一液相主体中溶解氧浓度,mg/L;——氧总转移系数;DL——液膜中氧分子扩散系数;YL——液膜厚度A——气液两相接触面积;W——曝气液体体积。由于液膜厚度YL和液体流态有关,而且实验中无法测定与计算,同样气液接触面积A的大小也无法测定与计算,故用氧总转移系数KLa代替。将式(3-58)积分整理后得曝气设备氧总转移系数KLa计算式。73
(3-59)式中KLa——氧总转移系数。1/min或1/h;t0、t——曝气时间,min;C0——曝气开始时池内溶解氧浓度,t0=0时,C0=0,mg/L;CS——曝气池内液体饱和溶解氧值,mg/L;Ct——曝气某一时刻t时,池内液体溶解氧浓度,mg/L。由式中可见,影响氧传递速率KLa的因素很多,除了曝气设备本身结构尺寸,运行条件而外,还与水质水温等有关。为了进行互相比较,以及向设计、使用部门提供产品性能,故产品给出的充氧性能均为清水,标准状态下,即清水(一般多为自来水)一个大气压20℃下的充氧性能。常用指标有氧总转移系数Klas充氧能力Qc、动力效率E和氧利用率η%。曝气设备充氧性能测定实验,一种是间歇非稳态法,即实验时一池水不进不出,池内溶解氧浓度随时间而变;另一种是连续稳态测定法,即实验时池内连续进出水,池内溶解氧浓度保持不变。目前国内外多用间歇非稳态测定法,即向池内注满所需水后,将待曝气之水以无水亚硫酸钠为脱氧剂,氯化钻为催化剂,脱氧至零后开始曝气,液体中溶解氧浓度逐渐提高。液体中溶解氧的浓度C是时间t的函数,曝气后每隔一定时间t取曝气水样,测定水中溶解氧浓度,从而利用上式计算KLa值,或是以亏氧量(CS-Ct)为纵坐标,在半对数坐标纸上绘图,直线科率即为KLa值。设备及用具1.自吸式射流曝气清水充氧设备。见图3-441)曝气池:以钢板制成0.8×1.0×4.3m。2)射流暖气设备。喷嘴d=14mm,喉管D=32mm,喉管长L=2975mm。3)水循环系统,吸水池、塑料泵。4)计量装置:转子流量计、压力表、真空表、热球式测风仪。5)水中溶解氧测定设备,测定方法详见水质分析(碘量法),或用上海第二分析仪器厂的溶解氧测定仪。6)无水亚硫酸钠、氯化钴、秒表。2.穿孔管鼓风曝气清水充氧设备。见图3-45。73
1)有机玻璃柱:φ150mm(三套)、φ200mm(一套)H=3.2m。2)穿孔管布气装置:孔眼40φ0.5mm,与垂直线成45°夹角,两排交错排列。3)空气压缩机、贮气罐。3.平板叶轮表面曝气清水充氧实验设备。见图3-46。1)有机玻璃平板叶轮完全混合式暖气池,电动搅拌机调速器。2)溶解氧测定仪、记录仪。步骤及记录1.自吸式射流曝气设备清水充氧实验步骤:(1)关闭所有闸门,向曝气池内注人清水(自来水)至小2米,取水样测定水中溶解氧值,并计算池内溶解氧含量G=DO×V。(2)计算投药量:(a)脱氧剂采用无水亚硫酸钠。根据2Na2SO3+O2=2Na2SO4则每次投药量g=G×8×(1.1~1.5)。1.1~1.5值是为脱氧安全而取的系数。(b)催化剂采用氯化钻,投加浓度为0.1mg/L,将称得的药剂用温水化开,由池顶倒人池内,约10min后,取水样、测其溶解氧。(3)当池内水脱氧至零后,打开回水阀门和放气阀门,向吸水池灌水EK。(4)关闭水泵出水阀门,启动水泵,然后,徐徐打开阀门,至池顶压力表读数为0.15MPa为止。73
(5)开启水泵后,由观察孔观察射流器出口处,当有气泡出现时,开始计时,同时每隔1分钟(前3个间隔)和0.5分(后几个间隔)开始取样,连续取15个水样左右。(6)计量水量、水压、风速(m/s)(进气管d=32mm)。(7)观察曝气时喉管内现象和池内现象。(8)关闭进气管闸门后,记录真空表读数。(9)关闭水泵出水阀门,停泵。2.鼓风曝气清水充氧实验步骤:(1)河柱内注人清水至3.lin处时,测定水中溶解氧值,计算池内溶氧量G=DO·V。(2)计算投药量。(3)将称得药剂用温水化开由柱顶倒人柱内,几分钟后,测定水中溶解氧值。(4)当水中溶解氧为零后,打开空压机,向贮气罐内充气。空压机停止运行后,打开供气阀门,开始曝气,并记录时间;同时每隔一定时间(lmin)取一次样,测定溶解氧值,连续取样10一豆5个;而后,拉长间隔,直至水中溶解氧不再增长(达到饱和)为止;随后,关闭进气阀门。(5)实验中计量风量、风压、室外温度。并观察曝气时柱内现象。3.平板叶轮表面曝气清水充氧实验步骤(1)向池内注满清水,按理论加药量的1.5倍加入脱氧剂及催化剂。(2)当溶解氧测定仪的指针达到O后,开始启动电机进行曝气,直至池内溶解氧达到稳定值为止。4.记录(l)自吸式射流曝气设备清水充氧记录见表3-39。(2)化学滴定法测定水中溶解氧记录见表3-40。(3)溶解氧测定仪与记录仪配用的记录,记录纸自记的形式如图3-47。表3-39自吸式射流曝气清水充氧实验记录水温曝气池平面尺寸(m2)进水流量(m3)进风量气水比(体积比)风速风速风量进水压力(Mpa)池内水深(m)喷嘴直径d(mm)吼管直径d(mm)吼管长度L(mm)面积比D2/d2长径比L/D表3-40水中溶解氧测定记录表瓶号取样点(mL)V(mL)DO(mL)瓶号取样点(mL)V(ml)DO(ml)Na2S2O3(N=)注意事项1.每个实验所用设备、仪器较多,事前必须熟悉设备、仪器的使用方法及注意事项。73
2.加药时,将脱氧剂与催化剂用温水化开后,从柱或池顶,均匀加人。3.无溶解氧测定仪的设备,在曝气初期,取样时间间隔宜短。4.实测饱和溶解氧值时,一定要在溶解氧值稳定后进行。5.水温、风温(送风管内空气温度)宜取开始、中间、结束时实测值的平均值。[成果整理]1.参数选用因清水充氧实验给出的是标准状态下氧总转移系数KLas。,即清水(本次实验用的是自来水)在一个大气压,20℃下的充氧性能,而实验过程中曝气充氧的条件并非是一个大气压,20℃,但这些条件都对充氧性能有影响,故引入了压力、温度修正系数。(1)温度修正系数(3-60)修正后的氧总转移速率为(3-61)此为经验式,它考虑了水温对水的粘滞性和饱和溶解氧值的影响,国内外大多采用此式,本次实验也以此进行温度修正。(2)水中饱和溶解氧值的修正由于水中饱和溶解氧值受其中压力和所含无机盐种类及数量的影响,所以式(3-59)中的饱和溶解氧值最好用实测值,即曝气池内的溶解氧达到稳定时的数值。另外也可以用理论公式对饱和溶解氧标准值进行修正。用埃肯费尔德公式进行修正。(3-62)式中Pb——空气释放点处的绝对压力;(3-63)Pa——0.1MPaH——空气释放点距水面高度,m;Qt——空气中氧的克分子百分比;(3-64)η%——曝气设备氧的利用率,%。则式(3-59)中饱和溶解氧值CS应用下式求得:CSm=CS·P(3-65)式中CSm——清水充氧实验池内经修正后的饱和溶解氧值,mg/L;CS——1个大气压下某温度下氧饱和浓度理论值,mg/L;P——压力修正系数。有实测饱和溶解氧值用实测值,无实测值可采用理论修正值。2.氧总转移系数KLas氧总转移系数KLas是指在单位传质推动力的作用下,在单位时间、向单位曝气液体中所充入的氧量。它的倒数1/KLas73
单位是时间,表示将满池水从溶解氧为零充到饱和值时所用时间,因此KLas是反映氧传递速率的一个重要指标。KLas的计算首先是根据实验记录,或溶解氧测定记录仪的记录和式(3-59),按表3-41计算,或者是在半对数坐标纸上,以(CSm-Ct)为纵坐标,以时间t为横坐标绘图求KLa值。表3-41氧总转移系数KLa计算表t-t0(min)Ct(mg/L)CS-Ct(mg/L)KLa(min)求得KLa值后,利用式(3-61)求得KLas值。3.充氧能力Qc充氧能力是反映曝气设备在单位时间内向单位液体中充入的氧量。Qc=KLas·CSkg(O2)/h·m3(3-66)式中KLas——氧总转移系数(标准状态)1/h或l/min;CS——l个大气压,20℃时氧饱和值,CS=9.17mg/L。4.动力效率E(3-67)E是指曝气设备每消耗一度电时转移到曝气液体的氧量。由此可见,动力效率将曝气供氧与所消耗的动力联系在一起,是一个具有经济价值的指标,它的高低将影响到活性污泥处理厂(站)的运行费用。式中N——理论功率,即不计管路损失,不计风机和电机的效率,只计算曝气充氧所耗有用功。(3-68)式中Hb——风压,m;Qb——风量,m3/h。(3-69)由于供风时计量条件与所用转子流量计标定时的条件相差较大,而要进行如上修正。式中Qb0——仪表的刻度流量m3/h;Pb0——一标定时气体的绝对压力,0.1MPa;Tb0———标定时气体的绝对温度,293°TPb——气体的实际绝对压力MPa;Tb——被测气体的实际绝对温度,273°+t℃;Qb——修正后的气体实际流量,m3/h。5.氧的利用率(3-70)73
式中Q——标准状态下(1atmi、293°T时)的气量。(3-71)Qb、Tb、Pb——意义同前;Pa——1atm;Ta——293°T;0.28kg/m3——标准状态下一立方米空气中所含氧的重量。思考题1.论述曝气在生物处理中的作用。2.曝气充氧原理及其影响因素是什么?3.温度修正、压力修正系数的意义如何?如何进行公式推导?4.曝气设备类型、动力效率、优缺点是什么?5.氧总转移系数KLa的意义是什么?怎样计算?6.曝气设备充氧性能指标为何均是清水?标准状态下的值是多少?7.鼓风曝气设备与机械曝气设备充氧性能指标有何不同?二、污水充氧修正系数α、β值的测定目的l.了解测定α、β值的实验设备、掌握测试方法。2.进一步加深理解生物处理曝气过程及α、β值在设计选用曝气设备时的意义。原理由于氧的转移受到水中溶解有机物、无机物等的影响,造成同一曝气设备在同样曝气条件下清水与污水中氧的转移速率不同,水中氧的饱和浓度不同,而曝气设备充氧性能指标又均为清水中之值,为此引人修正系数α、β值。(3-72)(3-73)式中KLaw、KLa——在曝气设备相同的条件下,污水和清水中暖气充氧肘氧总转移系数,1/min或1/h;Csw、CS——曝气设备向污水中充氧时水中氧的饱和浓度值,同温度下清水中氧饱和浓度理论值,mg/L。由此可知,α、β的测定实际上就是分别测定同一曝气设备在清水和污水中充氧的氧总转移系数及饱和溶解氧值。1.对曝气液体内无生物耗氧物质的清水、曝气池的上清液等,曝气池内存在如下关系式,2.对曝气池混合液曝气充氧时,由于有生物耗氧物质,池内存在如下关系式73
(3-74)式中——曝气液体内溶解氧浓度随时间的变化率;KLaw——污水中曝气设备氧总转移系数;Csw、C——污水中氧饱和浓度及t时刻的氧的浓度;r——单位污泥耗氧速率;x——污泥浓度。实验采用间歇非稳态方法进行,当水样为污水或曝气池上清液时,在相同条件下按照清水充氧实验方法,分别进行清水与污水充氧实验,求出清水充氧的KLa、CS和污水中充氧的KLaw、Csw,并按式(3-72)、(3-73)求出α、β值。当水样为曝气池内混合液肘,除在同一条件下先进行数组清水充氧实验,求得曝气设备清水充氧的KLa、CS外,对混合液的实验要利用式(3-74)进行测定。首先向曝气罐内曝气到池内溶解氧达到稳定后停止曝气,同时开启搅拌装置,此时由于不曝气,故式(374)有如下形式(3-75)由于罐内活性污泥不断消耗溶解氧,造成溶解氧值的降低,其变化如图卜48(1)由式(3-75)可见,直线斜率即为rx值,在内源呼吸期,污泥耗氧速率r值可看为一常量。当罐内溶解氧值降到DO=1~2mg/L时,再次曝气,并测定罐内溶解氧值随时间的变化,如图3-48(2)所示,将式(3-74)变换后得(3-76)以为横坐标,以C为纵坐标绘图,直线斜率为,截距为Csw,如图3-49示。或用数理统计方法进行回归,求解KLaw与Csw值。设备及用具实验设备如图3-50示。1.曝气罐:有机玻璃内径25cm,容积10L,内设工字形布气管,孔径0.75mm,热电偶测温计,搅拌叶片,溶解氧测定仪探头等。2.仪器控制箱:装有溶解氧测定仪(上海第M分析仪器厂STG-203型)转子流量计,电压表(控制叶片转速),温度表、可控硅电压调整器(控制恒温装置)等。溶解氧记录仪。3.小型空气压缩机。步骤及记录1.方法采用间歇非稳态的测试法。这是一种较为普遍、简单的实验方法。2.步骤73
2.1α值测定步骤(1)自来水、初次沉淀池进水、出水、二次沉淀池出水的测试。1)预热溶解氧测定仪一小时,调整溶解氧仪零度、满度。2)向曝气罐内投加待测曝气液体。3)测定液体溶解氧值并计算投加无水亚硫酸钠和氨化钻的数量,以消除水中溶解氧。4)调节叶片转速以满足溶解氧探头所需流速,而后开动风机,充氧,由转子流量计调整所需风量。打开记录仪开关。5)当溶解氧测定仪指针从零点启动,开始计时,至溶解氧达饱和指针稳定不动为止。(2)曝气池内混和液的测试1)预热溶解氧测定仪一小时。2)取生产或实验曝气池内混合液,其中污泥浓度X和停留时间t要尽量与生产运行结果一致,注入曝气柱或罐内,并测定混合液浓度X(g/L)。3)开动空压机充氧至溶解氧量稳定时,停止供风。4)在有搅拌的条件下,测混合液污泥耗氧速率r值5)当溶解氧值下降至1.0~2.0mg/L时,再曝气记录溶解氧随时间变化过程。2.2β值的测定1)预热溶氧仪一小时。2)加入待测液体。3)开动风机,曝气至溶解氧达饱和稳定止。实验记录本处只给出混合液无溶解氧记录仪时的测试记录,见表3-42,3-43。73
表3-42活性污泥耗氧速率表序号时间(min)柱内DD(mg/L)C1=备注10.521.031.542.053.064.0tC2=C2应在1~2mg/L左右表3-43曝气充氧记录序号时间(min)池内溶解氧(mg/L)备注10213243546576注意事项1.认真调试仪器设备,特别是溶解氧测定仪,要定时更换探头内溶解液,使用前定零点及满度。2.溶解氧测定仪探头的位置对实验影响较大,要保证位置的固定不变,探头应保持与被测溶液有一定相对流速,一般在20~30cm/s,测试中应避免气池和探头直接接触,引起表针跳动影响读数。3.应严格控制各项基本实验条件,如水温、搅拌强度、供风风量等,尤其是对比实验更应严格控制。4.所取曝气池混合液浓度,应为正常条件(设计或正常运行)下的污泥浓度。5.罐内液体搅动强度应尽可能与生产池相一致。成果整理1.利用清水充氧计算方法,分别计算自来水、初次沉淀池进、出水,二次沉淀池出水的KLa与CS值。2.计算混合液中曝气时的KLa及Csw值。(1)以时间t为横坐标,溶解氧值为纵坐标,将关闭风机后罐内溶解氧值与相应时间—一点绘,如图3-48(1)示,直线斜率为rx值。(2)将再次曝气后,各不同时间t和相应溶解氧值点绘在上图中,如图3-48(2)并用作图法求定曲线上各点C的切线斜率值,最少5个点以上。(3)以为横坐标,以C为纵坐标绘图,直线斜率即为,纵轴截距即为Csw值,如图3-49示。3.根据清水充氧求得的KLa,CS和各水样充氧求得的KLawCsw值,可求得73
思考题1.α、β值的测定有何意义?影响α、β的因素有哪些?2.测定时,为何使用的混合液浓度及它们的停留时间,要与生产池尽量一致?3.比较同一曝气池混合液及其混合液的上清液所得的。、产值是否相同?为什么?4.有机物为何影响α值,无机盐类为何影响β值?5、推流式曝气池内α值沿池长如何变化?73
实验四混凝沉淀实验混凝沉淀实验是给水处理的基础实验之一,被广泛地用于科研、教学和生产中。通过混凝沉淀实验,不仅可以选择投加药剂种类,数量,还可确定其它混凝最佳条件。目的1.通过本实验,确定某水样的最佳投药量。2.观察矾花的形成过程及混凝沉淀效果。原理天然水中存在大量胶体颗粒,是使水产生浑浊的一个重要原因,胶体颗粒靠自然沉淀是不能除去的。水中的胶体颗粒,主要是带负电的粘土颗粒。胶粒间的静电斥力,胶粒的布朗运动及胶粒表面的水化作用,使得胶粘具有分散稳定性,三者中以静电斥力影响最大。向水中投加混凝剂能提供大量的正离子,压缩胶团的扩散层,使ξ电位降低,静电斥力减小。此时,布朗运动由稳定因素转变为不稳定因素,也有利于胶粒的吸附凝聚。水化膜中的水分子与胶粒有固定联系,具有弹性和较高的粘度,把这些水分子排挤出去需要克服特殊的阻力,阻碍胶粒直接接触。有些水化膜的存在决定于双电层状态,投加混凝剂降低ξ电位。有可能使水化作用减弱。混凝剂水解后形成的高分子物质或直接加入水中的高分子物质一般具有链状结构在胶粒与胶粒间起吸附架桥作用,即使ξ电位没有降低或降低不多,胶粒不能相互接触,通过高分子链状物吸附胶粒,也能形成絮凝体。消除或降低胶体颗粒稳定因素的过程叫做脱稳。脱稳后的胶粒,在一定的水力条件下,才能形成较大的絮凝体,俗称矾花。直径较大且较密实的矾花容易下沉。自投加混凝剂直至形成较大矾花的过程叫混凝。混凝离不开投混凝剂。混凝过程见表3-8。表3-8混凝过程阶段凝聚絮凝过程混合脱稳异向絮凝为主同向絮凝为主作用药剂扩散混凝剂水解杂质胶体脱稳脱稳胶体聚集微絮凝体的进一步碰撞聚集动力质量迁移溶解平衡各种脱稳机理分子热运动(布朗扩散)液体流动的能量消耗处理构筑物混合设备反应设备胶体状态原始胶体脱稳胶体絮凝胶体矾花胶体粒径0.01~0.001μm约5~10μm0.5~2mm由于布朗运动造成的颗粒碰撞絮凝,叫“异向絮凝”。由机械运动或液体流动造成的颗粒碰撞絮凝,叫“同向絮凝”。异向絮凝只对微小颗粒起作用,当粒径大于1~5μm时。布朗运动基本消失。从胶体颗粒变成较大的矾花是一连续的过程,为了研究的方便可划分为混合和反应两个阶段。混合阶段要求浑水和混凝剂快速均匀混合,一般说来,该阶段只能产生用眼睛难以看见的微絮凝体;反应阶段则要求将微絮凝体形成较密实的大粒径矾花。混合和反应均需消耗能量,而速度梯度G73
值能反映单位时间单位体积水耗能值的大小,混合的G值应大于300~500S-1,时间一般不超过30S,G值大时混合时间宜短。水泵混合是一种较好的混合方式,本实验水量小便可采用机械搅拌混合。由于粒径大的矾花抗剪强度低,易破碎,而G值与水流剪力成正比,故反应开始至反应结束,随着矾花逐渐增大,G值宜逐渐减小。从理论上讲反应开始时的G值宜接近混合设备出口的G值,反应终止时的G值宜接近沉淀设备进口的G值,但这样会带来一些问题。例如反应设备构造较复杂,在沉淀设备前产生沉淀。实际设计中G值在反应开始时可采用100S-1左右,反应结束时可采用10S-1左右。整个反应设备的平均G值约为20~70S-1,反应时间约15~30min,本实验采用机械搅拌反应,G值及反应时间T值(以秒计)应符合上述要求。近年来出现若干高效反应设备,由于能量利用率高,反应时间比15min短。混合或反应的速度梯度G值(3-18)式中P——混合或反应设备中水流所耗功率W;IW=1J/S=1N·m/S;V——混合或反应设备中水的体积,m3;μ——水的动力粘度Pa·S,1Pa·S=1N·S/m2。不同温度水的动力粘度μ值见表3-9。表3-9不同水温水的动力粘度μ值温度(℃)05101520253040μ(10-3N·S/m2)1.7811.5181.3071.1391.0020.8900.7980.653本实验搅拌设备垂直轴上装设两块桨板,如图(3-17)示,桨板绕轴旋转时克服水的阻力所耗功率P为(3-19)式中L——桨板长度,m;r2——桨板腊旋转半径,m;r1——桨板内缘旋转半径,m;ω——相对于水的桨板旋转角速度,可采0.75倍轴转速,rad/s;r——水的重度。N/m3;g——重力加速度,9.81m/s2;CD——阻力系数,决定于桨板长宽比,见表3-10。表3-10阻力系数CD值b/L小于11~22.5~44.5~1010.5~18大于18CD1.101.151.191.291.402.00当CD=1.10(即b/L<1),r=9810N/m3,=9.81m/s2,及转速为n(r/min)(即rad/s时)。式中P、L、r2、r1符号意义及单位同前。73
设备及用具1.无极调速六联搅拌机1台,如图3-18。2.1000mL烧杯12个。3.200mL烧杯14个。4.100mL注射器2个,移取沉淀水上清液。5.100mL洗耳球1个,配合移液管移药用。6.lmL移液管1根。7.5mL移液管1根。8.10mL移液管1根。9.温度计1个、测水温用。10.秒表1块测转速用。11.J000ffiL量筒1个。量原水体积。12.1%浓度硫酸铝(或其它混凝剂)溶液1瓶。13.PHS-2型酸度计1台。14.GDS-3型光电式浑浊度仪1台。步骤及记录1.测原水水温、浑浊度及PH。2.用1000mL量简量取12个水样至12个1000mL烧杯中。3.设最小投药量和最大投药量,利用均分法确定第一组实验其它四个水样的混凝剂投加量。4.将第一组水样置于搅拌机中,开动机器,调整转速,中速运转数分钟,同时将计算好的投药量,用移液管分别移取至加药试管中。加药试管中药液少时,可掺入蒸馏水,以减小药液残留在试管上产生的误差。5.将搅拌机快速运转(例如300—500转/分,但不要超过搅拌机的最高允许转速),待转速稳定后,将药液加入水样烧杯中,同时开始记时,快速搅拌30秒钟。6.30秒钟后,迅速将转速调到中速运转(例如120转/分)。然后用少量(数毫升)蒸馏水洗加药试管,并将这些水加到水样杯中。搅拌5分钟后,迅速将转速调至慢速(例如80转/分)搅拌10分钟。7.搅拌过程中,注意观察并记录帆花形成的过程、帆花外观、大小、密实程度等,并记入表3-11中。表3-11实验记录实验组号观察记录小结水样编号帆花形成及水样过程的描述Ⅰ12345673
Ⅱ1234561.搅拌过程完成后,停机,将水样取出,置一旁静沉15分钟,并观察记录帆花沉淀的过程。与此同时,再将第二组六个水样置于搅拌机下。2.第一组六个水样,静沉15分钟后,用注射器每次汲取水样杯中上清液约130mL(够浊度仪、pH即可),置于六个洗净的200mL烧杯中,测浊度及pH并记入表3-12中。3.比较第一组实验结果。根据六个水样所分别测得的剩余浊度,以及水样混凝沉淀时所观察到的现象,对最佳投药量的所在区间,做出判断。缩小实验范围(加药量范围)重新设定第M组实验的最大和最小投药量值a和b,重复上述实验。表3-12原始数据记录表实验组号混凝剂名称原水浑浊度原水温度℃原水pHⅠ水样编号123456投药量剩余浊度沉淀后pH值Ⅱ水样编号123456投药量剩余浊度沉淀后pH值注意事项1一电源电压应稳定,如有条件,电源上宜设一台稳压装置(例如614系列电子交流稳压器)。2.取水样时,所取水样要搅拌均匀,要一次量取以尽量减少所取水样浓度上的差别。3.移取烧杯中沉淀水上清液时,要在相同条件下取上清液,不要把沉下去的矾花搅起来。[成果整理]以投药量为横坐标,以剩余浊度为纵坐标,绘制投药量-剩余浊度曲线,从曲线上可求得不大于某一剩余浊度的最佳投药量值。思考题1.根据实验结果以及实验中所观察到的现象,简述影响混凝的几个主要因素。2.为什么最大投药量时,混凝效果不一定好。3.测量搅拌机搅拌叶片尺寸,计算中速、慢速搅拌时的G值及GT73
值。计算整个反应器的平均G值。4.参考本实验步骤,编写出测定最佳沉淀后pH值实验过程。5、当无六联搅拌机时,试说明如何用0.618法安排实验求最佳投药量。实验五颗粒自由沉淀实验一、颗粒自由沉淀实验颗粒自由沉淀实验是研究浓度较稀时的单颗颗粒的沉淀规律。一般是通过沉淀柱静沉实验,获取颗粒沉淀曲线。它不仅具有理论指导意义,而且也是给水排水处理工程中,某些构筑物如给水与污水的沉砂池设计的重要依据。目的1.加深对自由沉淀特点、基本概念及沉淀规律的理解。2.掌握颗粒自由沉淀实验的方法,并能对实验数据进行分析、整理、计算和绘制颗粒自由沉淀曲线。原理浓度较稀的、粒状颗粒的沉淀属于自由沉淀,其特点是静沉过程中颗粒互不干扰、等速下沉,其沉速在层流区符合Stokes(斯笃克斯)公式。但是由于水中颗粒的复杂性,颗粒粒径、颗粒比重很难或无法准确地测定,因而沉淀效果、特性无法通过公式求得而是通过静沉实验确定。由于自由沉淀时颗粒是等速下沉,下沉速度与沉淀高度无关,因而自由沉淀可在一般沉淀柱内进行,但其直径应足够大,一般应使D≥100mm以免颗粒沉淀受柱壁干扰。具有大小不同颗粒的悬浮物静沉总去除率与截留速度U。、颗粒重量百分率的关系如下:(3-1)此种计算方法也称为悬浮物去除率的累积曲线计算法。设在一水深为H的沉淀柱内进行自由沉淀实验,如图3一且示。实验开始,沉淀时间为0,此时沉淀柱内悬浮物分布是均匀的,即每个断面上颗粒的数量与粒径的组成相同,悬浮物浓度为C0(mg/L),此时去除率E=0。实验开始后,不同沉淀时间I;,颗粒最小沉淀速度U;相应为(3-2)此即为ti,时间内从水面下沉到池底(此处为取样点)的最小颗粒di所具有的沉速。此时取样点处水样悬浮物浓度为Ci,而(3-3)73
此时去除率E0,表示具有沉速u≥ui(粒径d≥di)的颗粒去除率,而(3-4)则反映了ti时,未被去除之颗粒即d
您可能关注的文档
- 石油炼制工业污水处理技术研究2700
- abs公司生物污水处理技术介绍
- 打印常见工业废水处理技术介绍
- 电厂水处理技术的讲解.ppt课件
- 蚕丝厂副产品废水处理技术设计方案(20160830)
- 纳米结构材料在水处理技术中的应用研究讲解课件
- 水处理技术项目设置
- 蚕丝厂副产品废水处理技术设计方案(2016年0830)
- 医院污水处理技术指南(环保总局版)
- 常见工业废水处理技术介绍
- 高考化学一轮复习-专题一 多样化的水处理技术单元集训习题[苏教版选修]2
- 常见工业废水处理技术介绍04323
- 物化水处理技术
- 水处理技术教学体系
- 大型火电厂化学水处理技术研究进展
- 绿色水处理技术ppt课件
- 水处理技术教学体系
- 抛光漂洗废水处理技术方案