- 1.09 MB
- 2022-04-22 13:51:41 发布
- 1、本文档共5页,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报电话:19940600175。
'中国科技论文在线http://www.paper.edu.cn用于改善生物学性质的钛表面含锶海藻酸#钠涂层的研究**贾莉莉,李朝阳5(天津大学材料科学与工程学院,天津300354)摘要:骨移植失败的主要原因归因于移植物与骨组织之间结合不好。移植物表面修饰是一种减少移植失败概率的有效方法。锶(Sr)可刺激成骨细胞的增殖和分化,同时降低破骨细胞的活性。在本研究中,利用静电固定的方法在钛(Ti)表面通过共价键结合依次接枝多巴胺2+(DOPA),海藻酸钠(SA)和Sr。通过扫描电子显微镜(SEM),X射线光电子能谱(XPS),10傅立叶变换红外光谱(FTIR)和接触角测试来表征Ti表面制备的涂层。结果表明,含Sr2+涂层被成功制备并且Sr均匀分散在Ti表面。在Sr释放研究中可以观察到持久且稳定的Sr释放。Ti/DOPA/SA/Sr表现出很小的细胞毒性,并且Sr的掺入对MG63细胞的粘附和扩散2+有很好的促进作用。将Sr固定在SA接枝的Ti表面,有助于MG63细胞的增殖,同时提高了碱性磷酸酶(ALP)的活性。含Sr涂层展现出了优异的生物相容性和成骨活性,可为15促进移植物与宿主骨组织的整合提供良好的方法。关键词:钛;海藻酸钠;锶;生物活性;细胞毒性中图分类号:R318.08StudyontheIncorporationofStrontiuminaSodium20AlginateCoatingonTitaniumSurfacesforImprovedBiologicalPropertiesJIALili,LIZhaoyang(SchoolofMaterialsScience&Engineering,TianjinKeyLaboratoryofCompositeandFunctionalMaterials,TianjinUniversity,Tianjin,300354)25Abstract:Orthopedicimplantfailureismainlyattributedtothepoorbondingoftheimplanttobonetissue.Aneffectiveapproachtominimizetheimplantfailurewouldbemodifyingthesurfaceoftheimplant.Strontium(Sr)canstimulatetheproliferationanddifferentiationofosteoblastsandreducetheactivityofosteoclasts.Inthisstudy,atitanium(Ti)surfacewassuccessivelyfunctionalizedby2+covalentlygraftingdopamine,sodiumalginate(SA),andSrviatheelectrostaticimmobilization30method.Theas-preparedcoatingsontheTisurfacewerecharacterizedbyusingscanningelectronmicroscopy(SEM),X-rayphotoelectronspectroscopy(XPS),Fouriertransforminfraredspectroscopy(FTIR),andcontactangle.TheresultsprovedthattheSr-incorporatedcoatingsweresuccessfullypreparedandthatSrwasdistributeduniformlyonthesurface.Along-lastingandsustainedSrrelease2+hadbeenobservedinSrreleasestudies.TheTi/DOPA/SA/Srexhibitedlittlecytotoxicityandarobust35effectofSrincorporationontheadhesionandspreadingofMG63cells.Theproliferationandalkaline2+phosphatase(ALP)activityofMG63cellswereenhancedbyimmobilizingSrontheSA-graftedTi.TheSr-containingcoatings,whichdisplayedexcellentbiocompatibilityandosteogenicactivity,mayprovideapromisingsolutionforpromotingthetissueintegrationofimplants.Keywords:titanium;sodiumalginate;strontium;bioactivity;cytotoxicity400引言钛(Ti)金属及其合金以其优异的机械性能和化学稳定性等优点被广泛用做骨科和牙科基金项目:高等学校博士学科点专项科研基金(20130032110003);中国国家自然科学基金(31200715)作者简介:贾莉莉(1992-),女,生物材料通信联系人:李朝阳(1978-),男,副教授、硕导,生物材料.E-mail:zyli@tju.edu.cn-1-
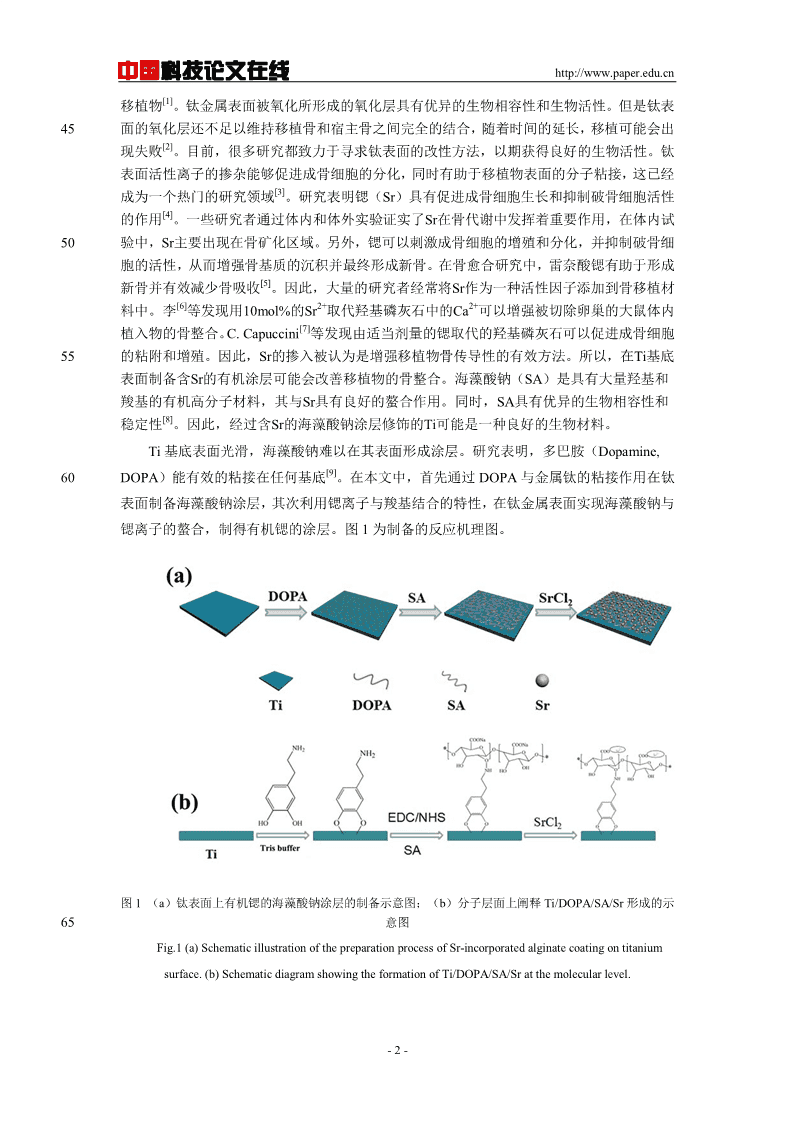
中国科技论文在线http://www.paper.edu.cn[1]移植物。钛金属表面被氧化所形成的氧化层具有优异的生物相容性和生物活性。但是钛表45面的氧化层还不足以维持移植骨和宿主骨之间完全的结合,随着时间的延长,移植可能会出[2]现失败。目前,很多研究都致力于寻求钛表面的改性方法,以期获得良好的生物活性。钛表面活性离子的掺杂能够促进成骨细胞的分化,同时有助于移植物表面的分子粘接,这已经[3]成为一个热门的研究领域。研究表明锶(Sr)具有促进成骨细胞生长和抑制破骨细胞活性[4]的作用。一些研究者通过体内和体外实验证实了Sr在骨代谢中发挥着重要作用,在体内试50验中,Sr主要出现在骨矿化区域。另外,锶可以刺激成骨细胞的增殖和分化,并抑制破骨细胞的活性,从而增强骨基质的沉积并最终形成新骨。在骨愈合研究中,雷奈酸锶有助于形成[5]新骨并有效减少骨吸收。因此,大量的研究者经常将Sr作为一种活性因子添加到骨移植材[6]2+2+料中。李等发现用10mol%的Sr取代羟基磷灰石中的Ca可以增强被切除卵巢的大鼠体内[7]植入物的骨整合。C.Capuccini等发现由适当剂量的锶取代的羟基磷灰石可以促进成骨细胞55的粘附和增殖。因此,Sr的掺入被认为是增强移植物骨传导性的有效方法。所以,在Ti基底表面制备含Sr的有机涂层可能会改善移植物的骨整合。海藻酸钠(SA)是具有大量羟基和羧基的有机高分子材料,其与Sr具有良好的螯合作用。同时,SA具有优异的生物相容性和[8]稳定性。因此,经过含Sr的海藻酸钠涂层修饰的Ti可能是一种良好的生物材料。Ti基底表面光滑,海藻酸钠难以在其表面形成涂层。研究表明,多巴胺(Dopamine,[9]60DOPA)能有效的粘接在任何基底。在本文中,首先通过DOPA与金属钛的粘接作用在钛表面制备海藻酸钠涂层,其次利用锶离子与羧基结合的特性,在钛金属表面实现海藻酸钠与锶离子的螯合,制得有机锶的涂层。图1为制备的反应机理图。图1(a)钛表面上有机锶的海藻酸钠涂层的制备示意图;(b)分子层面上阐释Ti/DOPA/SA/Sr形成的示65意图Fig.1(a)SchematicillustrationofthepreparationprocessofSr-incorporatedalginatecoatingontitaniumsurface.(b)SchematicdiagramshowingtheformationofTi/DOPA/SA/Sratthemolecularlevel.-2-
中国科技论文在线http://www.paper.edu.cn1实验部分1.1实验试剂与仪器70氢氧化钠(NaOH)、无水乙醇(C2H5OH)、二甲基亚砜(DMSO)购于天津市华东试剂厂。多聚甲醛、PBS、MTT、海藻酸钠(SA)、多巴胺(DOPA)、三羟甲基氨基甲烷(Tris)、碳二亚胺(EDC)、N-羟基琥珀酰亚胺(NHS)购于Sigma-Aldrich。氯化锶(SrCl2•6H2O)购于天津联星生物试剂公司。盐酸(HCl)和硝酸(HNO3)购于天津市科密欧化学试剂有限公司。低糖培养基(L-DMEM)和胎牛血清(FBS)购于Hyclone试剂(USA)。FITC购于75Calbiochem试剂(USA)。MG63(人成骨肉瘤细胞)购于上海酶联生物科技有限公司。表面涂层的官能团通过衰减全反射傅里叶红外光谱技术(ATR-IR)测得。不同涂层表面元素的存在及价态通过X射线光电子能谱(XPS)测定分析。样品表面形态和能谱的分析通过场发射扫描电子显微镜(SEM)测定。样品表面接触角在接触角测试仪上进行测试。锶离子含量采用电感耦合等离子体发射光谱仪测试(ICP-OES)801.2钛片表面的前处理商业用的纯钛基体材料被切割成10mm×15mm的钛片。切割后的钛片用200目、400目、800目和1500目的砂纸打磨至表面平整光滑,然后依次在丙酮、无水乙醇、去离子水中超声清洗10min,清洗后干燥备用。为了去除表面多余沉积的碳化物,同时在钛表面生成纳米级的致密多孔结构,将上述打85磨好的钛片置于质量分数为40%的硝酸溶液中,超声振荡40min,之后把上述酸处理的钛片取出,在去离子水中超声振荡10min,去除表面多余的硝酸。把酸处理的钛片放于浓度为5mol/L的NaOH溶液中,在90℃水浴锅中恒温放置5h,然后把碱处理的钛片用水超声清洗30min,干燥后备用。1.3钛片表面有机锶涂层的制备90利用多巴胺中邻二苯酚官能团能与金属基底紧密结合的特性,首先在酸碱处理后的钛表面制备多巴胺涂层。称取0.061g的Tris碱,溶解于50ml的去离子水中,搅拌均匀后,分别用1mol/L的HCl和1mol/L的NaOH调节溶液的pH值至8.5。避光条件下加入0.05g的DOPA,配置成质量分数为0.5%的DOPA的Tris水溶液。把上述酸碱处理后表面干燥的钛片浸没于上述的溶液中,避光静置24h后,用超纯水清洗表面并在氮气中干燥,将此步得到的钛片95记为Ti/DOPA。钛表面多巴胺涂层上接枝海藻酸钠,具体做法如下:将0.5gSA加入到50mlH2O中,配成质量分数为10g/LSA水溶液,缓慢加入搅拌至溶液呈透明均一的凝胶状。将0.3881g(50mmol/L)EDC加入到SA溶液中,在磁力搅拌下活化20min,之后加入0.2875g(50mmol/L)NHS,持续搅拌活化1h。把Ti/DOPA置于SA溶液中,37℃恒温保存24h。取出钛片,100用超纯水清洗除去表面附着的SA,干燥后备用。将此步得到的钛片记为Ti/DOPA/SA。称取0.02g和1.05gSrCl2·6H2O粉末,分别溶于20ml的去离子水,配置质量分数为0.1%、0.5%的SrCl2•6H2O水溶液,超声振荡10min,充分溶解后,用0.22um的过滤器过滤。将经过上述步骤处理得到的Ti/DOPA/SA,分别放置于上述配置的不同浓度的SrCl2•6H2O溶液中,静置浸泡24h后取出,用超纯水清洗除去表面附着的SrCl2。此步得到的样品记为-3-
中国科技论文在线http://www.paper.edu.cn105Ti/DOPA/SA/Sr1和Ti/DOPA/SA/Sr5。1.4钛片表面螯合锶总量的测定取三组Ti/DOPA/SA/Sr1和Ti/DOPA/SA/Sr5平行试样,放于浓HCl与浓HNO3混合比例为3:1的王水中,静置6h,等钛表面有机锶涂层完全溶解,溶解液呈清澈透亮后,利用电感耦合等离子体发射光谱仪(ICP-OES)对溶解液中的锶元素进行测试分析,实验结果为110测试数据的平均值。其主要的工作参数为:等离子体功率1150W,辅助气流量1.0LPM,雾化气压力179.27kPa,蠕动泵转数100r/min。测定标准曲线时选用的锶标准溶液为10ppm,20ppm,30ppm,40ppm,50ppm。1.5钛片表面锶离子释放实验通过在37℃,湿度为90%的恒温恒湿的环境中,将Ti/DOPA/SA/Sr1和Ti/DOPA/SA/Sr52+2+115浸入5mlPBS中来研究Sr的释放行为。为了能精确研究Sr的释放行为,在12h,24h,3d,5d,7d,9d,13d,17d,21d,28d时间点均换液1次,使用ICP-OES精确测量释2+2+放的Sr的量。最后以时间为横坐标,Sr的累积释放量为纵坐标作图。换液的具体做法是:首先倒出浸泡液PBS,然后再加入PBS至最初的液体水平。1.6细胞培养120本研究采用的细胞均为人成骨肉瘤细胞(MG63)。细胞培养液采用的是添加10%胎牛血清(FBS),100单位/ml青霉素和100μg/ml链霉素的高葡萄糖培养基(DMEM)。将样品放于12孔板中,MG63均匀地平铺在样品表面,置于37℃恒温、5%CO2的空气气氛中培养,每2-3天更换一次培养基,细胞每2天传代一次。1.6.1样品表面细胞生长及形貌4125将样品置于12孔板中,每组试样设置3个平行样,正反面紫外杀菌30min,以2×10个细胞/孔的密度在样品表面均匀接种MG63细胞。为了保证接种细胞的均匀,先用DMEM4培养基稀释MG63细胞,然后按比例取50μL细胞悬浮液(2×10细胞/50μL)小心地接种在样品上,接种过程中避免细胞粘附在孔板侧壁上,然后向每个孔中加入1mL培养基,轻轻摇晃均匀。培养6h和12h后,用吸管轻轻吸取培养基,向每个孔中加入1mL4%多聚甲130醛,将细胞在样品上固定30min。此后,将30%,50%,70%,90%,100%梯度酒精依次加入到孔中用于细胞脱水,每种酒精溶液保持脱水10min。样品表面干燥后喷金,通过SEM观察样品表面细胞的生长情况。1.6.2MTT实验为了检测试样的细胞活性,对试样进行了MTT实验。MTT实验的具体做法如下:取生135长状态良好、铺满整个培养瓶底部的对数期MG63细胞,弃去培养液,加入3mlPBS清洗培养瓶,倒出PBS,加入1ml的胰蛋白酶悬浮贴壁细胞,在加入3mlDMEM混合均匀,小心将细胞悬浮液转移到15ml离心管中,并以每分钟1000转速离心3min,倒出上层液体,加入4mlDMEM,将贴壁细胞吹打起来。取10μL细胞悬浮液用细胞计数板进行细胞浓度计数。将样品置于12孔板中,每组试样设置3个平行样,正反面紫外杀菌30min后,将细胞4140以4×10个细胞/孔的密度接种在对照组纯钛样品和表面改性样品的表面,选择培养时间为1d、3d、5d,观察试样材料的毒性。在37℃,5%CO2的恒温孵箱中培养1d,3d和5d后,-4-
中国科技论文在线http://www.paper.edu.cn向每个孔中加入10μLMTT(5mg/mL),并将细胞在37℃下继续培养4h。终止培养,小心弃去培养液,向每个孔中加入1mLDMSO,并将12孔板放在150rpm下连续振荡10分钟,使结晶物完全溶解,然后将上述溶液转移至96孔板,采用酶联免疫检测仪在490nm处测量145每个样品的吸光度。1.6.3细胞的粘附、分布和增殖4将样品置于12孔板中,每组试样设置3个平行样,正反面紫外杀菌30min后,以1×10个细胞/孔的密度在样品表面接种MG63细胞,接种过程中避免细胞粘附在孔板侧壁上。然后向每个孔中加入1mL培养基,轻轻摇晃均匀。培养1d后,弃去培养基,用PBS清洗样品表面3150次,然后向每个孔中加入500μL多聚甲醛(4%)以固定细胞,静置30分钟。吸取固定液,向每个孔中加入300μL异硫氰酸荧光素(FITC,50μg/ml)染色30min,弃去FITC染液,用PBS清洗3次。使用的FITC染料染色细胞骨架蛋白,其激发最大波长为490nm,发射最大波长为520nm。染色后的样品使用配备有数码相机的IX-51荧光显微镜获取荧光显微镜图像。计算接种1d,3d和7d后样品表面细胞的数量可以用来评价不同涂层上细胞的增值情况。4155将样品置于12孔板中,每组试样设置3个平行样,正反面紫外杀菌30min后,以1×10个细胞/孔的密度在样品表面接种MG63细胞,向每个孔中加入1mL培养基,轻轻摇晃均匀。培养1d,3d和7d后,弃去培养液,加入胰蛋白酶悬浮贴壁细胞,待细胞完全悬浮后使用Vi-CELLXR分析仪计算细胞数。1.6.4碱性磷酸酶的活性4160将样品置于12孔板中,每组试样设置3个平行样,正反面紫外杀菌30min后,以1×10个细胞/孔的密度在样品表面接种MG63细胞。培养3d,7d和14d后,小心地吸出培养基,用PBS清洗样品两次,然后向每个孔中加入500μL体积分数为0.2%TritonX-100,在孵箱中培养2小时后,将溶液转移至离心管中,于-80℃下冻存2h。重复溶冻三次将溶液混合均匀。加入3mL考马斯亮蓝染色溶液、0.6mL细胞裂解液和0.4mL双蒸水,混合10分钟后,165使用ELISA测试仪测量混合溶液的光密度(OD)值。用牛血清蛋白作为对照组测定蛋白质浓度。将100μL细胞裂解液和100μL对硝基苯基磷酸二钠盐(PNPP,25μg/mL)加入96孔板中,作为平行试样,每组设置6个孔,30min反应后,加入50μLNaOH(3mol/L)终止反应。100μL体积分数为0.2%TritonX-100,100μLPNPP(25μg/mL)和50μL的NaOH(3mol/L)作为空白组。于405nm波长下测量OD值,并计算其所对应的蛋白含量。1701.7统计学分析实验采用标准的单因素方差分析(ANOVA)对实验测得的各项数据进行显著性检验,测试数据采用平均值±标准偏差的形式表示,在p<0.05考虑统计学差异。所有实验均完成五次,每次实验重复三次。-5-
中国科技论文在线http://www.paper.edu.cn2结果与讨论1752.1钛表面涂层形貌和成分的表征分析图2不同涂层的扫描图像(a)Ti,(b)Ti/DOPA,(c)Ti/DOPA/SA,(d)Ti/DOPA/SA/Sr1,(e)Ti/DOPA/SA/Sr5,(f)Ti/DOPA/SA/Sr5局部放大图Fig.2SEMimagesofthecoatings(a)Ti,(b)Ti/DOPA,(c)Ti/DOPA/SA,(d)Ti/DOPA/SA/Sr1,(e)180Ti/DOPA/SA/Sr5,(f)particalenlargeddrawingofTi/DOPA/SA/Sr5图2为经过不同处理的钛片表面低倍和高倍形貌示意图。图(a)-(e)分别为酸碱处理的钛,DOPA处理的钛(Ti/DOPA),SA处理的钛(Ti/DOPA/SA),1%SrCl2处理的钛(Ti/DOPA/SA/Sr1)和5%SrCl2处理的钛(Ti/DOPA/SA/Sr5)。从酸碱处理后的钛(图2a)[10]185可以看出表面呈致密多孔结构,这有利于多巴胺的共价键接枝。在Ti/DOPA样品上(图2b),可以清楚地看到经过酸碱处理形成的致密多孔的结构被覆盖,表面出现一层致密而均匀的薄膜,使表面趋于平坦,这表明DOPA成功地在钛表面上接枝,形成聚(多巴胺)涂层。在经过与海藻酸钠的酰胺反应之后(图2c),钛表面致密多孔的结构完全被覆盖,呈现平坦状,这主要归因于海藻酸钠水溶液的流动性和成膜性。在Ti/DOPA/SA/Sr1和190Ti/DOPA/SA/Sr5上(图2d,图2e),表面形成了大量凝胶状均匀分布的球形颗粒,同样类[11]似的形貌也出现在BuchengLi研究中。这是因为海藻酸钠分子中存在的大量羟基和羧基2+2++与Sr有很强的螯合性,同时Sr也会和海藻酸钠中的Na发生置换反应,最终形成海藻酸锶,以圆形颗粒沉淀的形式存在。对比图2d和图2e,发现当锶离子溶液浓度提高时,球形2+颗粒也呈现的更多,这也表明海藻酸钠对Sr具有良好的螯合性。195图3显示了Ti/DOPA/SA/Sr1和Ti/DOPA/SA/Sr5元素组成的EDS分析。对比于SrCl2中Sr/Cl的原子比是0.5,Ti/DOPA/SA/Sr1和Ti/DOPA/SA/Sr5中Sr/Cl的原子比是1.36和2.57,这明显高于SrCl2的理论Sr/Cl原子比,说明样品表面大量的锶与海藻酸钠螯合形成海藻酸锶。EDS谱图中少量Cl元素的出现是因为表面不可避免的SrCl2的污染。此外,随着SrCl2浓度的提高,Sr的原子比从0.34增加到0.59,说明了海藻酸钠对锶离子具有很强的螯200合性。-6-
中国科技论文在线http://www.paper.edu.cn图3不同涂层元素组成的EDS谱图(a)Ti/DOPA/SA/Sr1,(b)Ti/DOPA/SA/Sr5Fig.3EDSanalysisofelementalcompositionofthecoatings(a)Ti/DOPA/SA/Sr1,(b)Ti/DOPA/SA/Sr5.2.2钛表面涂层的结构表征分析205图4所有合成涂层的红外光谱图(a)Ti,(b)Ti/DOPA,(c)Ti/DOPA/SA,(d)Ti/DOPA/SA/Sr1,(e)Ti/DOPA/SA/Sr5Fig.4FT-IRspectraofallas-synthesizedcoatings(a)Ti,(b)Ti/DOPA,(c)Ti/DOPA/SA,(d)Ti/DOPA/SA/Sr1,(e)Ti/DOPA/SA/Sr5210为了对钛表面制备的不同涂层结构进行表征分析,借助于衰减全反射傅里叶红外光谱仪对Ti、Ti/DOPA、Ti/DOPA/SA、Ti/DOPA/SA/Sr1及Ti/DOPA/SA/Sr5进行分析。图4显示-1了在500-4000cm范围内合成样品涂层的红外光谱。图4a为酸碱处理后钛的红外光谱,-1568cm处微弱的振动峰对应于Ti-O-Ti的伸缩振动。Ti/DOPA(图4b)的主要特征峰出现-1-1-1-1-1215在3365cm,2939cm,1616cm,1495cm和577cm,分别对应于-NH2伸缩振动,-CH2[12]伸缩振动,-C=O伸缩振动,-CH2弯曲振动和Ti-O-Ti的伸缩振动,这些峰的出现表明DOPA成功地接枝在钛表面上。在经过与海藻酸钠的酰胺反应之后(图4c),-OH伸缩振动峰、-CH-7-
中国科技论文在线http://www.paper.edu.cn伸缩振动峰、-NH伸缩振动峰、-C=O伸缩振动峰、-CH弯曲振动峰、-C-O-C伸缩振动峰等-1-1-1-1-1-1[13]海藻酸钠的特征峰出现在3530cm,2939cm,2243cm,1627cm,1416cm和1100cm。-1220在这些峰中,2243cm(-NH伸缩振动峰)的出现归因于DOPA的氨基和SA的羟基反应产生的酰胺键,这表明了海藻酸钠涂层被成功地制备。与图4c相比,除了一部分峰偏移到较低波数之外,Ti/DOPA/SA/Sr1和Ti/DOPA/SA/Sr5红外谱图(图4d和4e)没有显示出显著的差异,峰的偏移主要归因于SrCl2极性分子增强了极性键(-NH,>C=O)的振动频率,使相应峰的波数出现降低。2252.3钛表面涂层的元素成分分析图5不同基体表面的XPS谱图(a)Ti,(b)Ti/DOPA,(c)Ti/DOPA/SA,(d)Ti/DOPA/SA/Sr1,(e)Ti/DOPA/SA/Sr5Fig.5XPSspectraofthesubstratesurfaces:(a)Ti,(b)Ti/DOPA,(c)Ti/DOPA/SA,(d)Ti/DOPA/SA/Sr1,(e)230Ti/DOPA/SA/Sr5为了分析基体材料表面涂层的成分,对不同试样的表面涂层进行XPS检测。图5显示了对照组Ti、实验组Ti/DOPA、Ti/DOPA/SA、Ti/DOPA/SA/Sr1、Ti/DOPA/SA/Sr5的,XPS谱图,表1显示了通过XPS检测确定的原始Ti和功能化Ti基底表面的元素组成。在对照235组Ti上(图5a),出现比较明显的峰是C1s,Ti2p,O1s,这些峰的结合能出现在285eV,460eV和531eV。碳峰在纯Ti的总光谱图中的出现是由于不可避免的碳氢化合物的污染,C1s在284.6eV处的结合能也常用于校准峰位置的内部参考。在Ti/DOPA上(图5b),由于DOPA中氨基的存在,N1s结合能显然出现在399eV,对比表1所示的Ti和Ti/DOPA各元素的含量,N和C的含量明显增加,Ti含量显著减少,这表明多巴胺成功地接枝在Ti上。240Ti/DOPA样品表面C/N原子比是10.44,明显高于多巴胺中C/N的理论值8,这可能是由于钛片表面碳化物的污染。在Ti/DOPA/SA上,C1s和O1s含量进一步增加以及Ti2p含量进一步减少,结合ATR-IR中酰胺键的出现,说明海藻酸钠成功地接枝在多巴胺上。在Ti/DOPA/SA/Sr1和Ti/DOPA/SA/Sr5(图5d和图5e)上,Sr的结合能主要出现在135eV,-8-
中国科技论文在线http://www.paper.edu.cn270eV和360eV,对应的峰分别为Sr3d,Sr3p3,Sr3s。相比于Ti、Ti/DOPA及Ti/DOPA/SA,245SrCl2处理后的钛片表面的XPS谱图中明显出现了Sr的峰位,再根据Sr峰位处的结合能分析Sr的价态,确定不是锶离子及锶单质,综合可知,锶是与羧基螯合的形式存在。与2+Ti/DOPA/SA/Sr1相比,Ti/DOPA/SA/Sr5表面涂层的含量达到5.5%,这表明当Sr浓度相对较低时,海藻酸钠对锶具有良好的螯合作用。250表1通过XPS确定的原始Ti和功能化Ti基底表面的元素组成Table1ElementalCompositionattheSurfaceofPristineandFunctionalizedTiSubstratesasDeterminedbyXPSSubstrateC%O%Ti%N%Sr%Ti42.6±0.4641.8±0.5715.6±0.74--Ti/DOPA63.7±0.5821.5±0.498.7±0.686.1±0.56-Ti/DOPA/SA66.5±0.2324.7±0.282.0±0.786.8±0.50-Ti/DOPA/SA/Sr166.0±0.4824.5±0.722.1±0.384.8±0.392.6±0.82Ti/DOPA/SA/Sr564.6±0.3923.6±0.611.7±0.454.6±0.515.5±0.762.4钛表面涂层接触角测试分析图6不同基体表面的接触角测试(a)Ti,(b)Ti/DOPA,(c)Ti/DOPA/SA,(d)Ti/DOPA/SA/Sr1,(e)255Ti/DOPA/SA/Sr5Fig.6Watercontactanglesmeasuredonvariouscoatings:(a)Ti,(b)Ti/DOPA,(c)Ti/DOPA/SA,(d)Ti/DOPA/SA/Sr1,(e)Ti/DOPA/SA/Sr5图6显示了对照组Ti和功能修饰后Ti基底表面的接触角。实验组Ti/DOPA、260Ti/DOPA/SA、Ti/DOPA/SA/Sr1和Ti/DOPA/SA/Sr5样品表面的水接触角分别为33.26±4.35°,15.71±4.12°,33.08±3.65°,35.40±1.68°,都明显小于对照组纯钛,59.00±6.12°,这表明表面功能修饰改性可以有效地提高Ti表面的亲水性。五组样品中Ti/DOPA/SA具有最小的接触-9-
中国科技论文在线http://www.paper.edu.cn角,亲水性明显优于其他涂层,这是因为海藻酸钠分子中存在的大量亲水性的羟基。相比于Ti/DOPA/SA,虽然Ti/DOPA/SA/Sr1和Ti/DOPA/SA/Sr5的接触角都略有增加,但这也表明265有机锶涂层的成功制备,水接触角的测量也为Ti表面成功改性提供了证据。2.5海藻酸钠涂层对锶离子螯合能力的研究5432concentration/ppm2+Sr10Ti/DOPA/SA/Sr1Ti/DOPA/SA/Sr5图7Ti/DOPA/SA/Sr1和Ti/DOPA/SA/Sr5负载Sr的总量Fig.7ThetotalamountofstrontiuminTi/DOPA/SA/Sr1andTi/DOPA/SA/Sr52+270为了探究在不同浓度的SrCl2溶液中,海藻酸钠涂层螯合Sr含量的变化,将样品Ti/DOPA/SA/Sr1和Ti/DOPA/SA/Sr5置于5ml王水中,等钛片表面涂层完全消溶后,溶液呈澄清透明状,采用等离子体发射光谱仪对溶解液进行测试,结果如图7所示。样品Ti/DOPA/SA/Sr1和Ti/DOPA/SA/Sr5总的负载量达到3.063ppm和4.771ppm,即单位面积2(cm)上分别约含有10.21μg和15.90μgSr,相比于Ti/DOPA/SA/Sr1,当SrCl2溶液的浓度275提高时,单位面积螯合Sr的含量可以得到提高。由此可知,当SrCl2溶液的浓度低于5wt%时,增加溶液中的锶离子浓度,单位面积钛片上螯合锶的含量可以得到提高。2.6锶离子释放动力学和释放速率研究2+图8(a)随时间的变化,Ti/DOPA/SA/Sr1和Ti/DOPA/SA/Sr5累积Sr释放量;(b)280Ti/DOPA/SA/Sr1和Ti/DOPA/SA/Sr5释放效率Fig.8(a)CumulativeSrconcentrationofTi/DOPA/SA/Sr1andTi/DOPA/SA/Sr5asafunctionoftime,(b)therelevantreleaseefficiencyofTi/DOPA/SA/Sr1andTi/DOPA/SA/Sr5-10-
中国科技论文在线http://www.paper.edu.cn将样品Ti/DOPA/SA/Sr1和Ti/DOPA/SA/Sr5浸泡于5mlPBS中,通过设置不同的时间2+2+点更换PBS,用ICP-OES测试Sr浓度来评估Sr的释放行为。Ti/DOPA/SA/Sr1和2+285Ti/DOPA/SA/Sr5的Sr的释放行为如图2-9(a)所示。整个释放过程可以分为两个阶段:2+快速释放和缓慢释放。在最初5天里,Ti/DOPA/SA/Sr1和Ti/DOPA/SA/Sr5均显示出了Sr2+的快速释放,释放的Sr含量分别为1.839ppm和3.168ppm,相应的释放比例达到95.31%2+和83.00%。快速释放之后Sr的释放减慢,在5-28天的时间内逐渐减少。在第28天,Ti/DOPA/SA/Sr1和Ti/DOPA/SA/Sr5释放的Sr总浓度达到了1.930ppm和3.817ppm。锶的290缓释主要是因为锶以与海藻酸钠螯合的形式存在,共价键的作用使锶实现了长时间的释放,这也证实了海藻酸钠能够实现Sr长期持续的释放。该体外释放实验说明,有机锶涂层在释[14]放初期具有较大的释放速率,这在载药材料上称为突释效应。在植入初期,骨移植材料能够释放较多的锶离子,这更有利于提高植入材料局部范围内锶离子的浓度,使其发挥有效的成骨活性作用,随着浸泡时间的延长,锶离子进入缓慢的释放阶段,长达一个月的缓释更[15]295能促进锶离子在体内长期有效地发挥其成骨活性。在Sr释放实验测定后,评价Sr的释放效率。负载效率由公式η=m1/m0×100%计算,其[16]中η是释放效率,m1是释放溶液中Sr的总量,m0是表面螯合Sr的总量。图2-9(b)显示出了Ti/DOPA/SA/Sr1和Ti/DOPA/SA/Sr5的释放效率。如图所示,在初始表面冲洗后,大约有60%-80%的Sr保留在Ti/DOPA/SA/Sr1和Ti/DOPA/SA/Sr5的样品表面上,说明海300藻酸钠对锶具有比较强的螯合性。对比Ti/DOPA/SA/Sr1和Ti/DOPA/SA/Sr5,发现Ti/DOPA/SA/Sr5的释放效率高于Ti/DOPA/SA/Sr1的释放效率。由此推测,在锶元素的掺入没有达到饱和时,增加SrCl2溶液的浓度可以提高有机锶涂层中锶的含量。2.7钛表面涂层的细胞形态观察MG63细胞活性的提高可以通过细胞的粘附生长、细胞增殖、ALP活性和钙矿物的沉积305等来表征。钛材料要想在体内具有较好的骨整合性,首先MG63细胞在其表面良好的粘附生长是一个重要的先决条件。经过消化后的细胞是球体状形貌,当细胞接触基体材料时,细胞中特异性受体会结合材料表面特异性分子,其与植入材料表面产生接触点,以伪足的形式附着在材料表面。随着时间的增加,细胞呈放射状逐渐伸展生长,其中心部分会变的扁平,同时细胞也会开始分裂和分泌细胞外基质。310图9显示了不同涂层表面接种MG63细胞6h和12h后细胞的形态。如图9所示,在对照组Ti上(图a和a1),6h后大多数MG63细胞还保持为分离的圆形单细胞,并没有展示出太多扩散。MG63细胞在Ti/DOPA和Ti/DOPA/SA(图c、c1和图e、e1)的生长行为类似2+于在对照组纯Ti上观察到的行为。然而,负载Sr以后(图g、g1和图i、i1),细胞的形[17]态可以观察到显著的差异,几乎每个细胞都伸展并连接到其他细胞。Panzavoltaetal研究315表明Sr的掺入对早期细胞粘附有轻微积极的作用,这个结果与本实验得到的结果一致。培养12h后,MG63细胞还并不能在纯Ti上完全扩散(图b,b1),在DOPA和SA表面修饰后(图d,d1和图f,f1),可以看出MG63细胞的扩散更强。在Ti/DOPA/SA/Sr1和Ti/DOPA/SA/Sr5(图h,h1和图k,k1)上,附着的细胞数明显增加,细胞伸展良好,呈聚集状生长。相比与Ti/DOPA/SA/Sr1,Ti/DOPA/SA/Sr5上细胞数目的进一步提高归因于涂层320表面掺入Sr含量的增加。本研究也证明了Sr掺入对MG63细胞的粘附和伸展都有促进的效果。-11-
中国科技论文在线http://www.paper.edu.cn图9不同涂层表面培养6h和12h后细胞的SEM图像:(a,b)Ti,(c,d)Ti/DOPA,(e,f)Ti/DOPA/SA,(g,h)Ti/DOPA/SA/Sr1,(i,k)Ti/DOPA/SA/Sr5(比例尺,100μm);(a1,b1)Ti,(c1,d1)Ti/DOPA,(e1,f1)Ti/DOPA/SA,325(g1,h1)Ti/DOPA/SA/Sr1,(i1,k1)Ti/DOPA/SA/Sr5(比例尺,50μm)Fig.9SEMimagesofcellsafter6hand12hofcultureondifferentsamples:(a,b)Ti,(c,d)Ti/DOPA,(e,f)Ti/DOPA/SA,(g,h)Ti/DOPA/SA/Sr1,(i,k)Ti/DOPA/SA/Sr5(scalebars,100μm);(a1,b1)Ti,(c1,d1)Ti/DOPA,(e1,f1)Ti/DOPA/SA,(g1,h1)Ti/DOPA/SA/Sr1,(i1,k1)Ti/DOPA/SA/Sr5(scalebars,50μm)2.8钛表面涂层的体外细胞毒性测试330对不同涂层试样进行MTT测定,评估涂层表面粘附细胞的存活性。MTT测试的原理是活细胞体内存在的琥珀酸脱氢酶具有活性,能使外加的MTT还原为不溶的蓝紫色沉淀,通过DMSO对沉淀的溶解可以测其吸光度,而死细胞没有这样的功能。一般认为吸光度值与活细胞数成正比,吸光度越高说明细胞生长的越好,试样的生物相容性也越好。4图10显示了12孔板中以4×10细胞/孔的密度培养的MG63细胞在1d,3d和5d时MTT335测试结果。如图所示,Ti和Ti/DOPA的细胞活性有相似的水平,海藻酸钠接枝修饰之后的细胞活性明显增加,这可能是由于SA优异的生物相容性,一般认为海藻酸钠中存在大量的[18]羟基可以促进MG63细胞的增殖。与Ti相比,Ti/DOPA/SA/Sr1和Ti/DOPA/SA/Sr5均显示比较好的细胞活力,这样的研究结果表明:负载Sr的海藻酸钠具有良好的细胞活性和生物相容性。-12-
中国科技论文在线http://www.paper.edu.cn340图10Ti,Ti/DOPA,Ti/DOPA/SA,Ti/DOPA/SA/Sr1和Ti/DOPA/SA/Sr5上不同时间点MG63的细胞活性(与Ti相比,*p<0.05,**p<0.01)Fig.10CellviabilityofMG63culturedfordifferentperiodsoftimeonTi,Ti/DOPA,Ti/DOPA/SA,Ti/DOPA/SA/Sr1,Ti/DOPA/SA/Sr5(*p<0.05comparedwithTi,**p<0.01comparedwithTi)3452.9钛表面涂层的细胞粘附、增殖和碱性磷酸酶活性研究MG63细胞在培养24小时后的代表性荧光显微镜图像,可以用以分析不同涂层表面上细胞的生长状态。图11a-j显示了MG63细胞在培养一天后在不同涂层的粘附和分布情况:(a,f)Ti,,(b,g)Ti/DOPA,(c,h)Ti/DOPA/SA,(d,i)Ti/DOPA/SA/Sr1,(e,j)Ti/DOPA/SA/Sr5,其中图像a-e放大40倍,图像f-j放大100倍。总体来看,细胞在不同的350钛片表面都能生长良好。当与对照组纯钛(图11a)相比时,Ti/DOPA(图10b)细胞密度相对较低。负载Sr以后(图11e,f),可以看出MG63细胞的伸展和密度都有显著的提高。对比SEM图像,荧光显微镜图像得出了一致的结果,这也充分说明了Sr在促进细胞增殖和粘附时具有良好的效果。尽管负载Sr的海藻酸钠涂层能够有效地促进细胞的粘附和伸展,但细胞是否能在其表355面增殖仍需进一步的研究。培养1d,3d和7d后,表面不同的改性修饰对MG63细胞增殖的影响如图11(k)所示。当与对照组纯Ti比较时,Ti/DOPA显示出轻微地减少细胞增殖的趋势,Ti/DOPA/SA并没有显著的增加趋势。然而,在Ti/DOPA/SA/Sr1和Ti/DOPA/SA/Sr5上,与不含Sr的涂层样品相比,细胞增殖有着显著的提高,并且随着SrCl2浓度的提高,有机锶涂层中锶的负载量增加,增殖效果更显著。这样显著的增值效果也表明本实验采用的[19]360SrCl2浓度都是在安全剂量范围内,对细胞的粘附和增值起促进作用。ALP活性被广泛用于评价成骨细胞的早期分化,除了考虑初期细胞的粘附和增殖以外,它是提高移植材料骨整合性的一个重要考虑因素。图11(l)显示了培养MG63细胞3d、7d和14d后不同涂层样品的ALP活性。如图(l)所示,Ti,Ti/DOPA和Ti/DOPA/SA培养3天后MG63细胞的ALP活性处于相似的水平,Ti/DOPA/SA/Sr1和Ti/DOPA/SA/Sr5MG63365细胞的ALP活性均呈现轻微增加的趋势。当培养7天时,Ti/DOPA/SA的ALP活性出现明显的提高,这可能是因为细胞生物学行为受移植材料的表面形貌与成分的共同影响,其表达主要是通过蛋白质的传导,所以移植材料对蛋白质行为的影响会直接改变细胞的行为。有研-13-
中国科技论文在线http://www.paper.edu.cn究表明海藻酸钠中羧基和羟基基团,能有效的促进蛋白质的吸附,从而可以促进MG63细[20]胞的增值和分化。与Ti/DOPA/SA相比,在Ti/DOPA/SA/Sr1和Ti/DOPA/SA/Sr5上培养370的MG63细胞的ALP活性又有了显著的提高。当培养MG63细胞14天时,可以看到更显著的变化。有研究表明,Sr可以直接与Ca感应受体结合,进入成骨细胞并引起细胞的有丝[21]分裂。图11(l)证实了Sr的负载可以刺激MG63细胞的分化并增强ALP活性。图11培养一天后MG63细胞的粘附和分布(a,f)Ti,(b,g)Ti/DOPA,(c,h)Ti/DOPA/SA,(d,i)375Ti/DOPA/SA/Sr1,(e,j)Ti/DOPA/SA/Sr5(a-e:放大40倍);(f-j:放大100倍).(k)培养1d,3d和7d后通过荧光显微镜的计数表示的细胞增殖.(l)培养3d,7d和14d后MG63细胞的ALP活性.显著性差异(*p<0.05,**p<0.01).Fig.11MG63cellsadhesionanddistributionafter1dayofincubation.(a,f)Ti,(b,g)Ti/DOPA,(c,h)Ti/DOPA/SA,(d,i)Ti/DOPA/SA/Sr1,(e,j)Ti/DOPA/SA/Sr5(a-e:magnified40times);(f-j:magnified100380times).(k)Cellproliferationmeasuredbycountingunderafluorescencemicroscopeafter1,3,7daysofincubation.(l)ALPactivityofMG63cellsafter3,7and14daysofincubation.Statisticallysignificantdifferences(*p<0.05,**p<0.01)3结论本文利用DOPA强粘附作用在钛表面接枝SA,随后依据Sr与SA螯合的特性制备有机385锶涂层,进一步提高Sr浓度,研究Sr含量对纯钛表面成骨活性的提高,最后对不同改性的钛片进行SEM、XPS、FTIR、接触角等涂层结构和形貌的测试及MTT、细胞粘附、细胞增殖、ALP活性等生物学评价。主要结论如下:(1)SEM、EDS结果表明钛表面有机锶涂层成功制备,改变了钛表面形貌,并且Sr是以与海藻酸钠螯合的形式存在,Ti/DOPA/SA/Sr1和Ti/DOPA/SA/Sr5样品表面锶的原子含390量占到了0.34%和0.59%。(2)FT-IR结果表明SA与DOPA发生了酰胺反应,SA成功接枝在DOPA上。XPS谱图上Ti/DOPA/SA/Sr1和Ti/DOPA/SA/Sr5明显出现了Sr峰位,确定了有机Sr涂层的成功制备。提高SrCl2浓度,涂层中Sr的含量会相应地增加,说明SA对Sr具有良好的螯合作-14-
中国科技论文在线http://www.paper.edu.cn用。接触角测试表明有机锶涂层提高了Ti表面亲水性。2395(3)ICP测试显示Ti/DOPA/SA/Sr1和Ti/DOPA/SA/Sr5单位面积(cm)上Sr含量达到了10.21μg和15.90μg,Sr释放动力学实验表明尽管前期存在Sr爆释的现象,但Sr的总释放时间长达1个月,促进了Sr在体内长期有效地发挥成骨活性。(4)SEM细胞形态图上可以看出Sr掺入对MG63细胞的粘附和伸展都有促进的效果。MTT测试表明Ti/DOPA/SA/Sr1和Ti/DOPA/SA/Sr5均显示较好的细胞活性。荧光显微镜图400像和细胞增殖图上可以看出负载Sr以后,MG63细胞的伸展和密度都有了显著的提高。ALP活性的测试证实了Sr的负载可以刺激MG63细胞的分化并增强ALP活性。致谢本工作由中国国家自然科学基金(31200715)和高等学校博士学科点专项科研基金(20130032110003)资助。405[参考文献](References)[1]MEIS,WANGH,WANGW,etal.Antibacterialeffectsandbiocompatibilityoftitaniumsurfaceswithgradedsilverincorporationintitaniananotubes[J].Biomaterials,2014,35:4255-4265.410[2]ALGHAMDIHS,BOSCOR,VANDENBEUCKENJP,etal.Osteogenicityoftitaniumimplantscoatedwithcalciumphosphateorcollagentype-Iinosteoporoticrats[J].Biomaterials,2013,34:3747-3757.[3]PULEODA,NANCIA.Understandingandcontrollingthebone-implantinterface[J].Biomaterials,1999,20:2311-2321.[4]MEUNIERPJ,ROUXC,SEEMANE,etal.Theeffectsofstrontiumranelateontheriskofvertebralfracture415inwomenwithpostmenopausalosteoporosis[J].TheNewEnglandJournalofMedicine,2004,350:459-468.[5]ZHAOL,WANGH,HUOK,etal.Theosteogenicactivityofstrontiumloadedtitaniananotubearraysontitaniumsubstrates[J].Biomaterials,2013,34:19-29.[6]LIY,LIQ,ZHUS,etal.Theeffectofstrontium-substitutedhydroxyapatitecoatingonimplantfixationinovariectomizedrats[J].Biomaterials,2010,31:9006-9014.420[7]CAPUCCINIC,TORRICELLIP,SIMAF,etal.Strontium-substitutedhydroxyapatitecoatingssynthesizedbypulsed-laserdeposition:invitroosteoblastandosteoclastresponse[J].ActaBiomaterialia,2008,4:1885-1893.[8]ORIVEG,PONCES,HERNANDEZRM,etal.Biocompatibilityofmicrocapsulesforcellimmobilizationelaboratedwithdifferenttypeofalginates[J].Biomaterials,2002,23:3825-3831.[9]LEEH,DELLATORESM,MILLERWM,etal.Mussel-inspiredsurfacechemistryformultifunctional425coatings[J].Science,2007,318:426-430.[10]SUNF,ZHOUH,LEEJ.Variouspreparationmethodsofhighlyporoushydroxyapatite/polymernanoscalebiocompositesforboneregeneration[J].ActaBiomaterialia,2011,7:3813-3828.[11]LIB,LIUH,YEX,etal.Rubidiumandcesiumionadsorptionbyapotassiumtitaniumsilicate-calciumalginatecompositeadsorbent[J].SeparationScienceandTechnology,2014,49:1076-1085.430[12]WEIH,RENJ,HANB,etal.Stabilityofpolydopamineandpoly(DOPA)melanin-likefilmsonthesurfaceofpolymermembranesunderstronglyacidicandalkalineconditions[J].ColloidsandSurfacesB:Biointerfaces,2013,110:22-28.[13]FALKEBORGM,PAITAIDP,SHUAN,etal.Dodecenylsuccinylatedalginateasanovelmaterialforencapsulationandhyperactivationoflipases[J].CarbohydratePolymers,2015,133:194-202.435[14]WEIW,SHIS,LIUJ,etal.Lipidnanoparticlesloadedwith10-hydroxycamptothecin-phospholipidcomplexdevelopedforthetreatmentofhepatomainclinicalapplication[J].Journalofdrugtargeting,2010,18:557-566.[15]ZHANGC,LIC,HUANGS,etal.Self-activatedluminescentandmesoporousstrontiumhydroxyapatitenanorodsfordrugdelivery[J].Biomaterials,2010,31:3374-3383.[16]POPATKC,ELTGROTHM,LATEPATJ,etal.Decreasedstaphylococcusepidermisadhesionand440increasedosteoblastfunctionalityonantibiotic-loadedtitaniananotubes[J].Biomaterials,2007,28:4880-4888.[17]PANZAVOLTAS,TORRICELLIP,STURBAL,etal.Settingpropertiesandinvitrobioactivityofstrontium-enrichedgelatin-calciumphosphatebonecements[J].JournalofBiomedicalMaterialsResearchPartA,2008,84:965-972.[18]FANL,CAOM,GAOS,etal.Preparationandcharacterizationofsodiumalginatemodifiedwithcollagen445peptides[J].CarbohydratePolymers,2013,93:380-385.-15-
中国科技论文在线http://www.paper.edu.cn[19]ZHANGW,SHENY,PANH,etal.Effectsofstrontiuminmodifiedbiomaterials[J].ActaBiomaterialia,2011,7:800-808.[20]ARPORNMAEKLONGP,SUWATWIROTEN,PRIPATNANONTP,etal.Growthanddifferentiationofmouseosteoblastsonchitosan-collagensponges[J].InternationalJournalofOralandMaxillofacialSurgery,2007,45036:328-337.[21]CAVERZASIOJ.Strontiumranelatepromotesosteoblasticcellreplicationthroughatleasttwodifferentmechanisms[J].Bone,2008,42:1131-1136.-16-'
您可能关注的文档
- 酒店餐饮国庆节营销活动方案.doc
- 银行管理培训心得体会范文.doc
- 预备党员转正决议例文.doc
- 高中阶段教育发展统计公报范文.doc
- 高级党课心得体会2500字.doc
- 一种基于片上网络的分布式容错方法设计实现.pdf
- 基于修正KMV模型商业银行客户信贷风险测度.pdf
- 基于多范式建模与仿真的电动汽车充换电站优化配置研究.pdf
- 基于稳定性控制的自适应MANET分簇策略.pdf
- 网络虚拟团队信任影响因素和模型研究.pdf
- 遗传算法在化工精馏中的运用.pdf
- 高压缩比天然气发动机性能研究.pdf
- GB 12337-2014 钢制球形储罐 标准释义及算例.pdf
- GB 19147-2016 车用柴油.pdf
- GBT 16783.1-2014 石油天然气工业 钻井液现场测试 第1部分:水基钻井液.pdf
- GBT 16855.2-2015 机械安全 控制系统安全相关部件 第2部分:确认.pdf
- GBT 17421.5-2015 机床检验通则 第5部分:噪声发射的确定.pdf
- GBT 17477-2012 汽车齿轮润滑剂黏度分类.pdf
相关文档
- 施工规范CECS140-2002给水排水工程埋地管芯缠丝预应力混凝土管和预应力钢筒混凝土管管道结构设计规程
- 施工规范CECS141-2002给水排水工程埋地钢管管道结构设计规程
- 施工规范CECS142-2002给水排水工程埋地铸铁管管道结构设计规程
- 施工规范CECS143-2002给水排水工程埋地预制混凝土圆形管管道结构设计规程
- 施工规范CECS145-2002给水排水工程埋地矩形管管道结构设计规程
- 施工规范CECS190-2005给水排水工程埋地玻璃纤维增强塑料夹砂管管道结构设计规程
- cecs 140:2002 给水排水工程埋地管芯缠丝预应力混凝土管和预应力钢筒混凝土管管道结构设计规程(含条文说明)
- cecs 141:2002 给水排水工程埋地钢管管道结构设计规程 条文说明
- cecs 140:2002 给水排水工程埋地管芯缠丝预应力混凝土管和预应力钢筒混凝土管管道结构设计规程 条文说明
- cecs 142:2002 给水排水工程埋地铸铁管管道结构设计规程 条文说明