- 669.37 KB
- 2022-04-22 11:24:47 发布
- 1、本文档共5页,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报电话:19940600175。
'果蝇精巢fasⅢ基因原核表达载体的构建费紫薇,生命科学学院摘要:果蝇fasⅢ基因是蛋白编码类基因,在精巢中fasⅢ基因主要在hubcell中表达,本实验运用基因克隆技术,以PET28a质粒为载体,选用BamHI、HindⅢ两种酶做双酶切,将目的基因fasⅢ导入质粒载体PET28a,从而构建原核表达载体PET28a-fasⅢ,再将重组质粒转化到大肠杆菌TOP10中,实现fasⅢ基因的原核表达。实验所用质粒载体用卡那抗性(Kanr)标记,只有转化成功的大肠杆菌才能在涂有卡那霉素的LB培养基中生长。最终目的是实现fasⅢ蛋白的原核表达与纯化,为以后制备多克隆抗体奠定基础。关键词:基因克隆;fasⅢ基因;原核表达载体;原核表达;TheconstructionoffasIIIprokaryoticexpressionvectorsziweiFei,CollegeoflifescienceAbstract:DrosophilaFasgeneisproteincodinggeneintestis,mainlyexpressedinhubcell.Inthisexperiment,bymeansofgenecloningtechnique,thetargetgeneFasIIIwasinsertedintotheplasmidvectorPET28awhichwasdigestedbytwoenzymesofBamHIandHindⅢ.soastoconstructtheprokaryoticexpressionvectorPET28a-fasⅢ,thentherecombinantplasmidwastransformedintoEscherichiacoliTOP10,achieveFasIIIgeneprokaryoticexpression.Theplasmidvectorwasmarkedwithkanamycinresistant(Kanr),OnlywastransformedsuccessfullyEscherichiacolicangrowinLBmediumwhichwascoatedwithkanamycin.TheultimateaimistorealizetheprokaryoticexpressionandpurificationofFasIIIprotein,forthefuturelaythefoundationforpreparingpolyclonalantibody.Keywords:Genecloning;fasⅢ;theprokaryoticexpressionvector;prokaryoticexpression;15
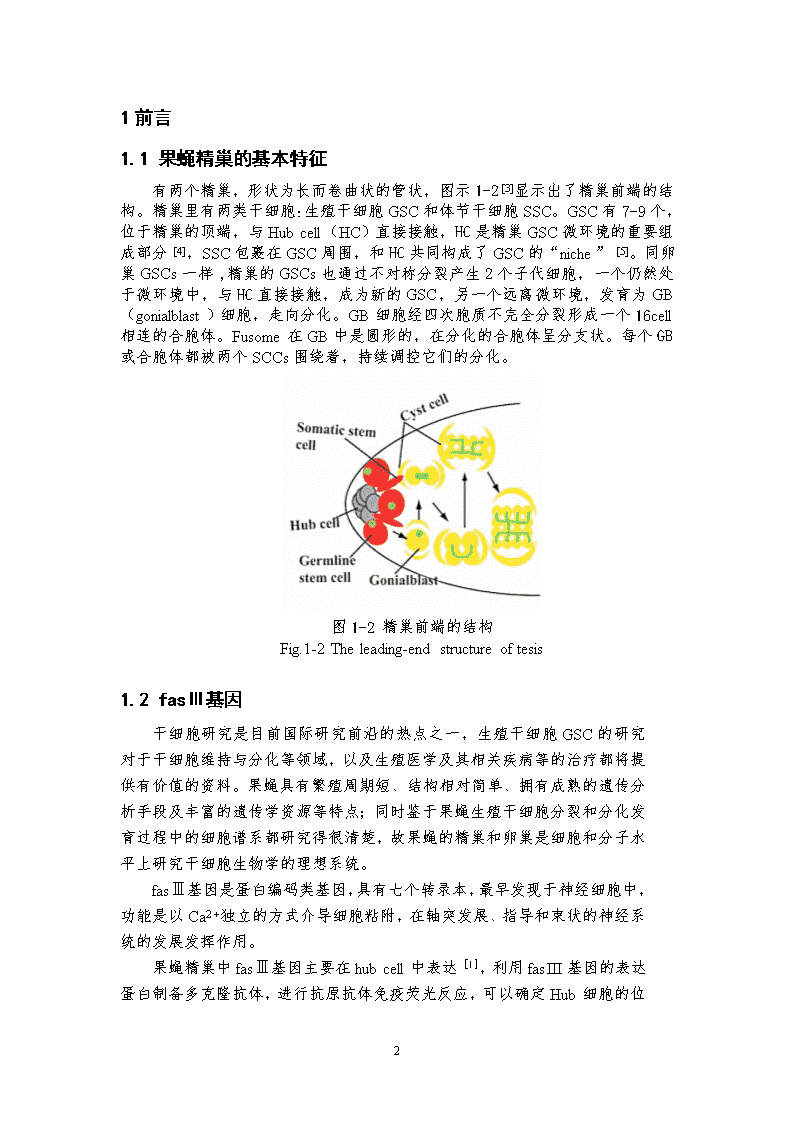
1前言1.1果蝇精巢的基本特征有两个精巢,形状为长而卷曲状的管状,图示1-2[3]显示出了精巢前端的结构。精巢里有两类干细胞:生殖干细胞GSC和体节干细胞SSC。GSC有7-9个,位于精巢的顶端,与Hubcell(HC)直接接触,HC是精巢GSC微环境的重要组成部分[4],SSC包裹在GSC周围,和HC共同构成了GSC的“niche”[5]。同卵巢GSCs一样,精巢的GSCs也通过不对称分裂产生2个子代细胞,一个仍然处于微环境中,与HC直接接触,成为新的GSC,另一个远离微环境,发育为GB(gonialblast)细胞,走向分化。GB细胞经四次胞质不完全分裂形成一个16cell相连的合胞体。Fusome在GB中是圆形的,在分化的合胞体呈分支状。每个GB或合胞体都被两个SCCs围绕着,持续调控它们的分化。图1-2精巢前端的结构Fig.1-2Theleading-endstructureoftesis1.2fasⅢ基因干细胞研究是目前国际研究前沿的热点之一,生殖干细胞GSC的研究对于干细胞维持与分化等领域,以及生殖医学及其相关疾病等的治疗都将提供有价值的资料。果蝇具有繁殖周期短、结构相对简单、拥有成熟的遗传分析手段及丰富的遗传学资源等特点;同时鉴于果蝇生殖干细胞分裂和分化发育过程中的细胞谱系都研究得很清楚,故果蝇的精巢和卵巢是细胞和分子水平上研究干细胞生物学的理想系统。fasⅢ基因是蛋白编码类基因,具有七个转录本,最早发现于神经细胞中,功能是以Ca2+独立的方式介导细胞粘附,在轴突发展、指导和束状的神经系统的发展发挥作用。果蝇精巢中fasⅢ基因主要在hubcell中表达[1],利用fasIII基因的表达蛋白制备多克隆抗体,进行抗原抗体免疫荧光反应,可以确定Hub细胞15
的位置[2],从而有利于对果蝇精巢干细胞的研究。1.3载体(Vectors)广义上通常把能携带外源基因进入受体细胞的运载工具叫载体。在基因工程操作中,把能携带外源DNA进入受体细胞的DNA分子叫载体[6]。1、基因工程对载体的要求:(1)具有对受体细胞的可转移性,可提高载体导入受体细胞的效率。(2)具有与特定受体细胞相适应的复制原点或整合位点,使得外源基因可在受体细胞中大量繁殖或稳定遗传。(3)具有多种单一的核酸酶切位点(多克隆位点),可用于外源基因的插入,同时不影响载体的扩增和繁殖。(4)具有合适的选择标记,便于重组DNA分子的检测。(5)具有较好的安全性,不能任意转移,避免基因的非控制性扩散,给人类造成危害。本实验选用的PET28a为质粒载体,长度为5369bp。1.4抗菌素的抗性工作原理卡那霉素(kanamycin,Kan)杀菌原理:通过与70S核糖体结合,导致mRNA发生错读。杀死细菌。细菌抗性原理:Kanr编码的氨基糖苷磷酸转移酶,对卡那霉素进行修饰,阻断其与核糖体结合作用。2实验材料与方法2.1实验材料2.1.1实验仪器表2.1实验仪器及厂家Table2.1Experimentalinstrumentsandmanufacturers仪器名称nameofapparatus生产厂家manufacturers恒温水浴锅HH-2江苏金坛市宏华仪器厂双人单面净化工作台SW-CJ-2FD苏州净化设备有限公司高速冷冻离心机EppendorfDNA扩增仪Lcycler电热恒温培养箱上海博讯实业有限公司医疗设备厂立式压力蒸汽灭菌器上海申安医疗器械厂气浴恒温振荡器SH2-82A金坛市宏华仪器厂智能电热鼓风干燥箱上海成顺仪器仪表有限公司15
2.1.2实验试剂限制性核酸内切酶:BamHIHindⅢ10×KBuffer通用BufferBSAprimerSTARMAXpremixcDNA模板CIAP碱性磷酸酶琼脂糖1×TAE缓冲液溴化乙锭溶液EBDNA分子量Marker15kb10×loadingbuffer5MNacl苯酚、氯仿无水乙醇75%乙醇溶液T4DNA连接酶10×T4DNAligasebufferInoue转化缓冲液DMSO二甲亚矾LB液体培养基试剂盒:琼脂糖凝胶DNA回收试剂盒离心柱型质粒小提试剂盒(离心柱型)2.1.3引物本实验所用的扩增引物和测序序列均由生工生物工程上海有限公司合成部合成。引物片段:Fas-bamH/F:ataggatccCTCCTCAACGAAGGCATCGFas-Hind/R:ataaagcttctaGAGGCTGCTGCTGGGCGGTTTG2.1.4质粒载体本实验所用质粒载体PET28a来自于本实验室保存。15
2.2实验方法2.2.1目的基因的获取1、PCR反应体系表2.1PCR反应体系150μlTable2.1PCRreactionsystem(150μl)反应组分体积2×primerSTARMAXpremix75.0μl上游引物fasⅢ-bamH/F1.5μl下游引物fasⅢ-Hind/R1.5μlcDNA模板6.0μlddH2O66.0μl2、PCR反应程序98℃5min98℃20s30cycles55℃20s72℃1min30s72℃5min16℃4min3、琼脂糖凝胶电泳检测(1)制备0.1%琼脂糖凝胶:称取0.25g琼脂糖,加入25ml1×TAE缓冲液,置微波炉加热至完全融化,取出摇匀。(2)胶板的制备:1)将塑料内槽洗净、晾干,放置于水平制胶器中,并放好样品梳;2)待胶液冷到60℃左右时,加入2—3μl的溴化乙锭,轻轻混匀后将胶液倒入塑料内槽,至塑料板上形成一层胶面;3)待胶液凝固后,将梳子轻轻垂直拔出;4)将塑料内槽取出放入电泳槽内,并加入1×TAE缓冲液至电泳槽中使缓冲液浸没胶面,高出凝胶。(3)加样:取约2μl10×loadingbuffer与2μlPCR产物混合均匀,用移液枪加到凝胶孔中,并用DL15000TMDNAMaker做对照。(4)电泳:盖好电泳槽盖子,接通电泳槽与电泳仪的电源,选择电泳电压120V,开始电泳。(5)观察结果:取出样品,在紫外灯下观察,摄像,根据片段大小判断目的片段是否扩增成功。15
2.2.2酶切1、DNA产物的纯化产物共150μL,集中到1.5mLEP管,加无菌水至500μL(1)酚抽:在EP管中加入等体积,即500μL苯酚/氯仿混合液,颠倒混匀,室温12000r/min离心5min,吸取上层液到新的EP管,吸约450μL(2)加入1/10体积的5MNaCl(按450uL换算,即45μLNaCl)(3)加入2-3倍体积无水乙醇1mL,混匀,4℃12000r/min离心10min,吸走上清液,产物沉淀在底部。(4)漂洗:用70%乙醇清洗沉淀1-2次,离心,彻底吸走上清液。(5)干燥和溶解:自然干燥5min至残留乙醇挥发干净,加入20μL无菌水溶解。2、酶切,体系如表2.2所示表2.2酶切体系50μlTable2.2Enzymedigestionsystem(50μl)反应组分体积无菌水18.0μlBSA5.0μl10×K.Buffer5.0μlBamHI1.0μlHindⅢ1.0μl质粒或片段20.0μl溶液配好混匀后瞬时离心,使溶液集中于管底,放在37℃水浴锅水浴1h;其中PET28a质粒酶切管在水浴1h后需加入1μlCIAP,接着水浴30min。2.2.3琼脂糖凝胶电泳法回收DNA1、制胶2、切胶3、琼脂糖凝胶DNA回收试剂盒操作步骤(1)柱平衡步骤:向吸附柱CA2中加入500μl平衡液BL,12000rpm离心1min,倒掉收集管中的废液,将吸附柱重新放回收集管中。(2)将单一的目的DNA条带从琼脂糖凝胶中切下,放入干净的离心管中,称取重量。(3)向胶块中加入3倍体积溶胶液PN,50℃水浴放置10min,其间不断温和地上下翻转离心管,以确保胶块充分溶解。(4)将上一步所得的溶液加入一个吸附柱CA2中,室温放置2min,12000rpm离心30sec,倒掉收集管中的废液,将吸附柱CA2放入收集管中。15
(5)将吸附柱CA2中加入600μl漂洗液PW,12000rpm离心30sec,倒掉收集管中的废液,将吸附柱CA2放入收集管中。(6)重复操作步骤5(7)将吸附柱CA2放入收集管中,12000rpm离心2min,尽量除尽漂洗液。将吸附柱CA2置于室温放置数分钟,彻底晾干。(8)将吸附柱CA2放到一个干净的离心管中,向吸附膜中间位置悬空滴加适量洗脱缓冲液EB,室温放置2min。12000rpm离心2min收集DNA溶液。(9)电泳检测:分别取3μl酶切样品与2μl10×loadingbuffer混合后加到凝胶孔中开始电泳,电泳结束后取出样品,在紫外灯下观察,摄像。2.2.4DNA片段的体外连接(目的基因导入质粒载体)1、配制连接体系,各成分如表2.3所示,体系中外源基因量要多些,载体的量要少些;表2.3连接体系10μlTable2.2Connectionsystem(10μl)反应组分体积10×T4DNAligaseBuffer1.0μlT4DNAligase0.8μl酶切的PET28a质粒3.0μl酶切的fasⅢ片段5.2μl2、混匀后用瞬时离心,使液体全部集中于管底;3、将离心管放于16℃水浴锅保温过夜;4、取出连接体系,利用感受态细胞进行转化实验。2.2.5连接体系的转化1、取1管100μl的TOP10超级感受态细胞,在冰上化冻后,在无菌操作台里向EP管中加入7μl连接体系,用枪轻轻吹打混匀;2、将EP管插在冰水复合物中冰浴30min;3、将EP管放到42℃恒温水浴锅中保温90s,然后迅速放到冰水复合物中冰浴2min;4、在无菌操作台里向EP管中加入1ml的含K的液体LB培养液,混匀后放于摇床上37℃振荡培养45min,转速为150rpm/min,使细胞恢复正常生长状态;5、45min之后,3000r/min离心3min6、在无菌操作台中弃去950μl上清液,余下的150μl用移液枪轻轻打匀,吸至含K的LB培养基平板中,用事先已经加热灭菌并冷却后的三角推棒轻轻涂布均匀;7、待涂布液干燥后,将平板37℃培养箱中倒置过夜培养。15
2.2.6挑菌落做菌落PCR1、PCR反应体系表2.4PCR反应体系25μlTable2.4PCRreactionsystem(25μl)反应组分体积10×PCRBuffer2.5μldNTP0.25μl上游引物fasⅢ-bamH/F0.25μl下游引物fasⅢ-Hind/R0.25μlrTaq酶0.25μl模板ddH2O21.5μl模板:阳性对照—重组质粒的连接体系阴性对照—无菌水实验组—待检测的菌落2、PCR反应程序97℃3min94℃30s30cycles52℃30s72℃1min72℃3min16℃3min3、琼脂糖凝胶电泳检测:以DNAMamker和阳性对照作参考,判断实验组条带大小是否正确,进而判断是否为阳性克隆。2.2.7重组质粒的转管培养1、经过菌落PCR鉴定后,挑选4个初步鉴定是阳性克隆的菌落转管培养。2、将无菌操作台灭菌后,取4个15mlEP管,分别加入约4ml含卡那霉素(Kan)的LB液体培养基。3、用无菌枪头挑取单菌落,在EP管的培养基中轻轻搅拌,并将枪头打入EP管中,盖紧管盖,放于摇床上37℃振荡培养过夜,转速为180rpm/min。15
2.2.8PET28a-fasⅢ质粒的少量制备1、菌液保种:将选取的菌液扩大培养,浑浊后分别取450μl菌液并各加入50μlDMSO于-20℃冻存。2、用质粒小提试剂盒(离心柱型)提取并制备质粒。操作步骤:(1)柱平衡步骤:向吸附柱CP3中加入500μl平衡液BL,倒掉收集管中的废液,将吸附柱重新放回收集管中。(2)取1.5ml过夜培养的菌液,加入离心管中,使用常规台式离心机,12000rpm离心1min,尽量吸除上清。(3)向留有菌体沉淀的离心管中加入250μl溶液P1(使用前已加入RNaseA),用移液枪彻底悬浮细菌沉淀。(4)向离心管中加入250μl溶液P2,温和地上下翻转6-8次使菌体充分裂解,所用时间不超过5分钟。(5)向离心管中加入350μl溶液P3,立即温和地上下翻转6-8次,充分混匀,将出现白色絮状沉淀。12000rpm离心10min。(6)将上一步收集的上清液用移液枪转移到吸附柱CP3中,尽量不要吸出沉淀。12000rpm离心30sec,倒掉收集管中的废液,将吸附柱CP3放入收集管中。(7)向吸附柱CP3中加入500μl去蛋白液PD,12000rpm离心30sec,倒掉收集管中的废液,将吸附柱CP3重新放回收集管中。(8)向吸附柱CP3中加入600μl漂洗液PW,12000rpm离心30sec,倒掉收集管中的废液,将吸附柱CP3放回收集管中。(9)重复操作步骤(8)(10)将吸附柱CP3放入收集管中,12000rpm离心1min,将吸附柱中残余的漂洗液去除。(11)将吸附柱CP3置于一个感觉离心管中,向吸附膜中间部位滴加70μl洗脱缓冲液EB,室温放置2min,12000rpm离心2min将质粒溶液收集到离心管中。3、离心管中收集制备好的质粒,进行琼脂糖凝胶电泳检测:分别取3μl提取的质粒DNA样品与2μl10×loadingbuffer混合后加到凝胶孔中开始电泳,电泳结束后取出样品,在紫外灯下观察,摄像,根据片段大小判断质粒是否制备成功。15
2.2.9重组质粒双酶切鉴定1、酶切体系如表2.5所示表2.5酶切体系30μlTable2.5Enzymedigestionsystem(30μl)反应组分体积无菌水4.0μlBSA3.0μl10×K.Buffer3.0μlBamHI1.0μlHindⅢ1.0μl质粒或片段18.0μl溶液配好混匀后瞬时离心,使溶液集中于管底,放在37℃水浴锅水浴1.5h;2、琼脂糖凝胶电泳检测:将所有双酶切产物与2μl10×loadingbuffer混合后加到凝胶孔中开始电泳,电泳结束后取出样品,在紫外灯下观察,摄像。以15kbDNAMamker作参考,判断实验组条带大小是否正确。15
三、实验结果与分析3.1目的基因PCR12M1000bp琼脂糖凝胶电泳检测,鉴定结果如下图3-1所示,本实验所用DNAMarker为15000bp,DNAMarker:250-1000-5000-7500-10000-15000。目的基因fasⅢ为950bp,与Marker第二条带(1000bp)基本对应。说明PCR产物为目的基因fasⅢ片段。图3-1目的基因fasⅢ的PCR鉴定Fig.3-1IdentificationofPCRgeneFasIII1,2;目的基因片段M,DNAMarker;3.2质粒和目的基因片段酶切反应1M25369bp1000bp琼脂糖凝胶电泳检测,鉴定结果如下图3-2所示,实验所用DNAMarker为15000bp,目的基因fasⅢ为950bp,与Marker第二条带(1000bp)基本对应。质粒PET28a为5369bp,位于Marker第三条带(5000bp)和第四条带(7500bp)之间。图3-2目的基因片段与质粒酶切反应后鉴定Fig.3-2Theidentificationoftargetgenefragmentandtheplasmid1,目的基因fasⅢ的酶切结果;M,DNAMarker;2,质粒PET28a酶切结果;15
3.3琼脂糖凝胶DNA回收试剂盒回收DNA1M21000bp5369bp琼脂糖凝胶电泳检测,鉴定结果如下图3-3所示,实验所用DNAMarker为15000bp,目的基因fasⅢ为950bp,与Marker第二条带(1000bp)基本对应。质粒PET28a为5369bp,位于Marker第三条带(5000bp)和第四条带(7500bp)之间。目的条带清晰明亮,回收效果较好。图3-3DNA回收后鉴定Fig.3-3TheidentificationofDNArecovery1,质粒PET28a;2,目的基因fasⅢ;M,DNAMarker;3.4菌落PCR鉴定琼脂糖凝胶电泳检测:以DNAMamker(15000bp)和阳性对照作参考,其中,4是阳性对照,M是DNAMamker,1,2,3,5,为菌落PCR产物,条带清晰明亮,与阳性对照的条带大小一致,说明是阳性克隆。12345M1000bp图3-4菌落PCR的鉴定Fig.3-4TheidentificationofcolonyPCR1,2,3,5,菌落PCR产物;4,阳性对照;M,DNAMarker;15
3.5质粒制备的鉴定琼脂糖凝胶电泳检测,鉴定结果如下图3-5所示,制备目的基因fasⅢ与PET28a的重组质粒,片段大小约6000bp,以DNAMamker(15000bp)作参考,位于Marker第三条带(5000bp)和第四条带(7500bp)之间。其中1,2,3,分别对应EP管上编号为3,4,10。123M7500bp5000bp图3-5质粒制备的鉴定Fig.3-5TheIdentificationofplasmidM,DNAMarker;1,2,3,重组质粒;3.6重组质粒双酶切鉴定琼脂糖凝胶电泳检测,鉴定结果如下图3-6所示,双酶切后的产物为两条带,分别是目的基因fasⅢ片段与质粒PET28a片段,其中目的基因片段与DNAMarker(15000bp)第一条带对应,质粒PET28a片段与DNAMarker第四条带对应,1,2,3,分别对应EP管上编号为3,4,1012M35369bp1000bp图3-6重组质粒双酶切鉴定Fig.3-6Therecombinantplasmidwasidentifiedbydoubleenzymedigestion1,2,3,双酶切产物;M,DNAMarker;15
四、讨论实验成功构建了果蝇精巢fasⅢ基因原核表达载体,最终目的是实现fasⅢ蛋白的原核表达与纯化,为以后制备多克隆抗体奠定基础。后续实验还需将重组载体导入表达菌株BL21,实现fasⅢ基因的高效表达,并通过镍琼脂糖凝胶层析法纯化标记蛋白。利用fasⅢ表达蛋白制备多克隆抗体,可用于抗原抗体免疫荧光反应,从而标记hubcell的位置,更利于了解和研究果蝇精巢结构。参考文献:[1]PeterM.Snow,AllanJ.Bieber,andCoreyS.GoodmanFasciclinIII:ANovelHomophilicAdhesionMoleculeinDrosophila.Cel[J],1989:313-323.[2]EihachiroKawase1,MarcoD.Wong1,BeeC.Ding1andTingXie,Gbb/BmpsignalingisessentialformaintaininggermlinestemcellsandforrepressingbamtranscriptionintheDrosophilatestis.TheCompanyofBiologists[J],2004,131(59):1365-1375.[3]Kawase,E.etal.Gbb/bmpsignalingisessentialformaintaininggermlinestemcellsandforrepressingbamtranscriptionintheDrosophilatestis.Development[J],2004.131(6):1365-1375.[4]Yamashita,Y.M.,M.T.Fuller,andD.L.Jones.Signalinginstemcellniches:lessonsfromtheDrosophilagermline.JournalofcellScience[J],2005.118(4):665-672.[5]Decotto,E.andA.C.Spradling.TheDrosophilaovarianandtestisstemcellniches:similarsomaticstemcellandsignals.Developmentalcell[J],2005.9(4):501-510.[6]刘祥林,聂刘旺.基因工程[B].科学出版社,2005:59-98.15
致谢时光荏苒,岁月如梭。转眼间美好的大学四年生活已经接近了尾声,经过四年的学习我在各个方面都有所提高。生命不止,奋斗不息。大学生活的结束,意味着我要踏上新的征程,再次扬帆起航。经过多天的努力,逐渐完成了本科毕业论文的实验操作部分和写作部分。这次的经历让我受益匪浅,同时也暴露出我在多方面的不足与缺陷。从开始不熟练的实验操作到最后的独立完成,从开始写论文时的无从下手到最后的游刃有余,这一点一滴的进步都是在和同学的互帮互助以及老师的耐心指导下取得的。在论文实验设计和写作过程中,我得到了陈冬生老师极大地帮助和耐心的指导。从课题的选择、实验操作到项目的最终完成,陈老师始终耐心在一旁给于指导,在实验的过程之中,耐心的帮我解决遇到的问题,每个步骤都力争做到最好。在论文初稿到成稿的过程之中,不厌其烦的为我修改。陈老师严肃的科学态度,严谨的治学精神,精益求精的工作作风,深深地感染和激励着我并将积极影响我今后的学习和工作。陈老师是我的良师,不仅在毕业论文期间给力我很大的帮助,同时在我考研期间也给了我很多宝贵的意见。在此谨向陈老师致以崇高的敬意和诚挚的谢意,愿您一生幸福,安康!感谢实验室所有成员:师姐朱翔翔、王双,师兄王剑;同窗潘慧敏,曹治杰,李国芳。感谢你们的陪伴与帮助,尤其感谢师姐师兄对我的耐心指导和悉心解说,给予我很大的帮助,让我受益匪浅,在这里请接受我诚挚的谢意。 最后,我要感谢我的母校——安徽师范大学和生命科学学院在这四年来对我的精心栽培。还有我的爸爸妈妈,姑姑、舅舅对我生活方方面面的关心,你们是我坚强的后盾,是我温馨的港湾,愿你们一生平安幸福!费紫薇2015年4月15
目录摘要11前言21.1果蝇精巢的基本特征21.2fasⅢ基因21.3载体31.4抗菌素的抗性工作原理32实验材料与方法32.1实验材料32.1.1实验仪器32.1.2实验试剂42.1.3引物52.1.4质粒载体52.2实验方法52.2.1目的基因的获取52.2.2酶切62.2.3琼脂糖凝胶电泳法回收DNA72.2.4DNA片段的体外连接(目的基因导入质粒载体)72.2.5连接体系的转化82.2.6挑菌落做菌落PCR82.2.7重组质粒的转管培养92.2.8PET28a-fasⅢ质粒的少量制备92.2.9重组质粒双酶切鉴定10三、实验结果与分析113.1目的基因PCR113.2质粒和目的基因片段酶切反应123.3琼脂糖凝胶DNA回收试剂盒回收DNA123.4菌落PCR鉴定123.5质粒制备的鉴定133.6重组质粒双酶切鉴定13四、讨论14参考文献14致谢15'
您可能关注的文档
- 机电一体化技术毕业论文数控车床刀架的安装与调试 (1).doc
- 机电一体化毕业论文 大棚温湿度自动控制系统设计.doc
- 机电一体化毕业论文浅谈机电一体化发展走向(1).doc
- 机电专业毕业论文_新型节能智能路灯.doc
- 机电系机械设计与制造专业毕业论文.doc
- 材控毕业论文中厚板压下规程优化及模型开发.doc
- 材料成型及控制工程毕业论文.doc
- 材料成型及控制工程毕业设计论文 支撑架外套注塑成型工艺及模具设计.doc
- 林毕业论文.doc
- 某中学框架结构毕业论文设计.doc
- 某地办公楼结构设计 毕业设计论文.doc
- 某大学教学楼建筑节能设计毕业论文.doc
- 某年产20万吨乙二醇项目锅炉烟气除尘系统的设计环境监测与治理技术毕业设计论文(1).doc
- 校园二手商品交易平台的设计与开发信息管理与信息系统毕业论文.doc
- 校园网整体设计计算机应用技术专业毕业论文.doc
- 核电机组二回路热力系统经济性分析毕业论文.doc
- 档案学毕业论文《档案法》在保障档案利用权方面存在的问题及修改意见(1).docx
- 档案管理毕业论文加强劳动合同档案管理,规避企业用工风险.doc
相关文档
- 施工规范CECS140-2002给水排水工程埋地管芯缠丝预应力混凝土管和预应力钢筒混凝土管管道结构设计规程
- 施工规范CECS141-2002给水排水工程埋地钢管管道结构设计规程
- 施工规范CECS142-2002给水排水工程埋地铸铁管管道结构设计规程
- 施工规范CECS143-2002给水排水工程埋地预制混凝土圆形管管道结构设计规程
- 施工规范CECS145-2002给水排水工程埋地矩形管管道结构设计规程
- 施工规范CECS190-2005给水排水工程埋地玻璃纤维增强塑料夹砂管管道结构设计规程
- cecs 140:2002 给水排水工程埋地管芯缠丝预应力混凝土管和预应力钢筒混凝土管管道结构设计规程(含条文说明)
- cecs 141:2002 给水排水工程埋地钢管管道结构设计规程 条文说明
- cecs 140:2002 给水排水工程埋地管芯缠丝预应力混凝土管和预应力钢筒混凝土管管道结构设计规程 条文说明
- cecs 142:2002 给水排水工程埋地铸铁管管道结构设计规程 条文说明