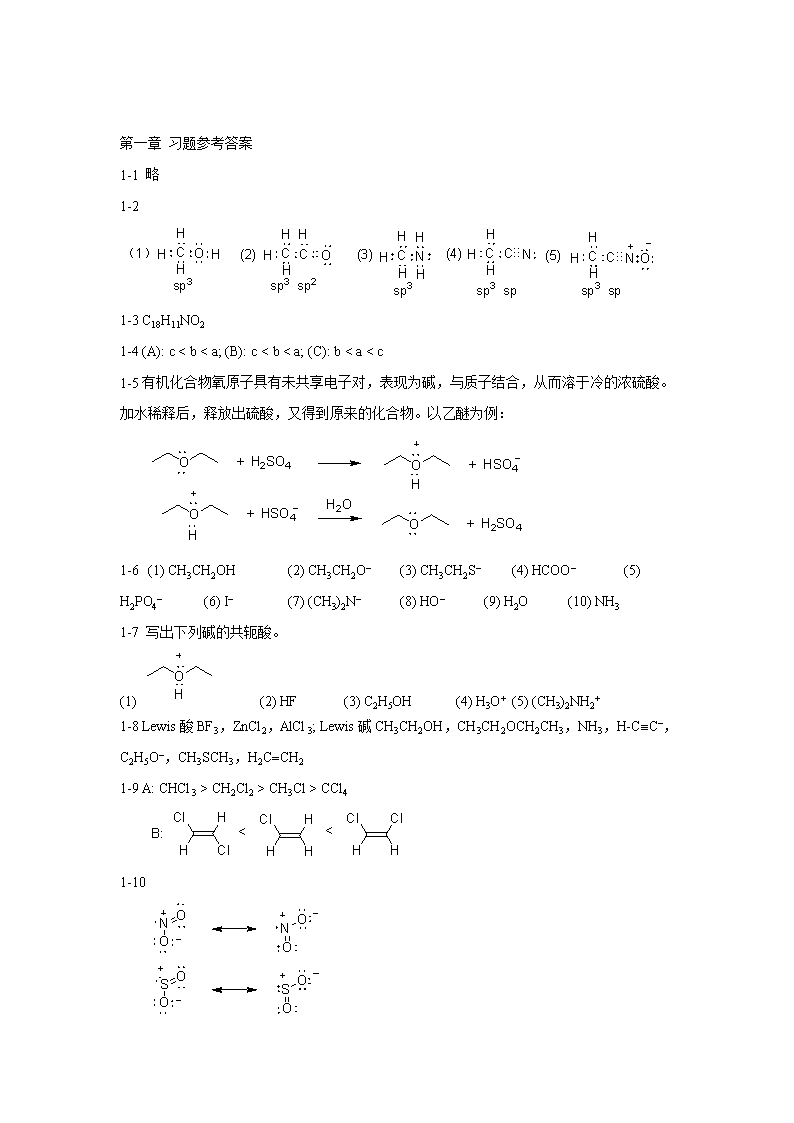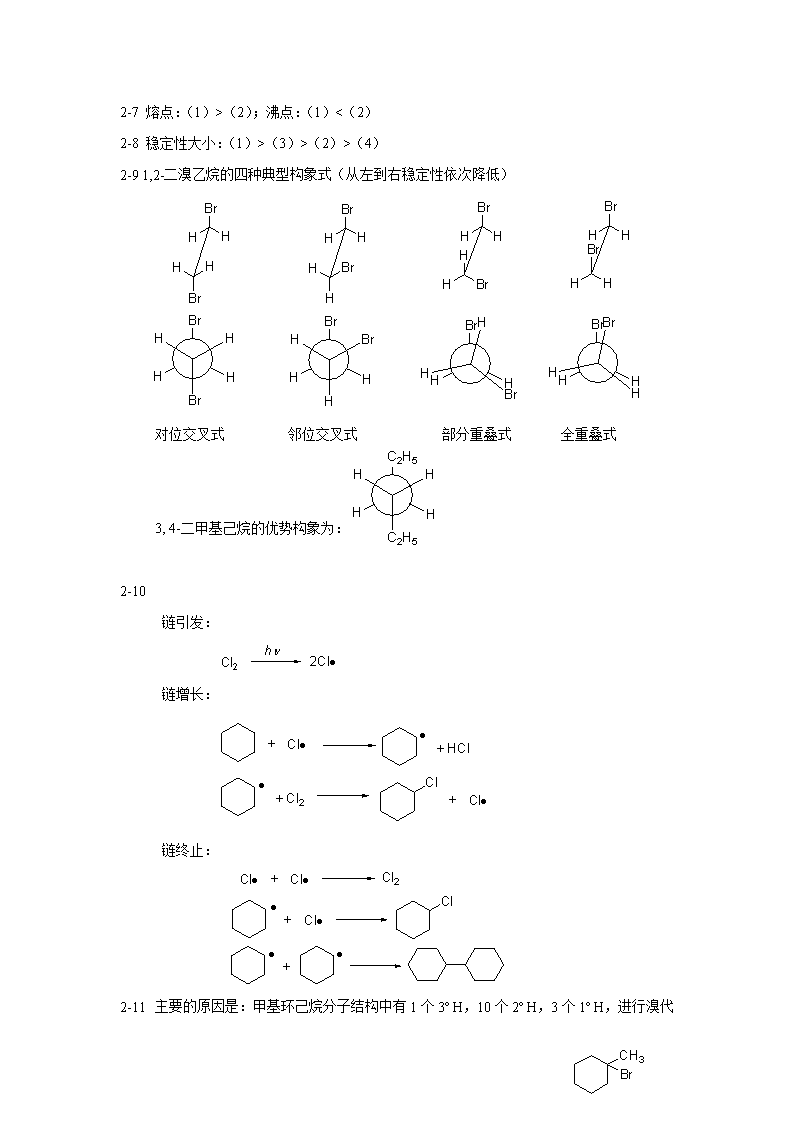- 13.68 MB
- 2022-04-22 11:34:02 发布
- 1、本文档共5页,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报电话:19940600175。
'第一章习题参考答案1-1略1-21-3C18H11NO21-4(A):cCH2Cl2>CH3Cl>CCl41-10
第二章习题参考答案2-1(1)3-甲基-4-乙基庚烷;(2)2-甲基-4-异丙基己烷;(3)新壬烷;(4)2-甲基-5-乙基庚烷(5)4-异丙基庚烷;(6)4-叔丁基辛烷;2-22-32-42-5该化合物分子式为C8H18,结构式命名为:2,2,3,3-四甲基丁烷2-6化合物沸点依次降低顺序:(4)>(2)>(3)>(5)>(1)
2-7熔点:(1)>(2);沸点:(1)<(2)2-8稳定性大小:(1)>(3)>(2)>(4)2-91,2-二溴乙烷的四种典型构象式(从左到右稳定性依次降低)对位交叉式邻位交叉式部分重叠式全重叠式3,4-二甲基己烷的优势构象为:2-10链引发:链增长:链终止:2-11主要的原因是:甲基环己烷分子结构中有1个3ºH,10个2ºH,3个1º
H,进行溴代反应时,不同类型氢原子的反应活性大小是3ºH∶2ºH∶1ºH=1600∶82∶1,可以初步计算出3ºH被溴取代后的产物所占百分比例大约是66%,因此反应主要得到2-13该化合物为:第三章习题参考答案3-1(1)甲基环戊烷(2)1-甲基-4-乙基环己烷(3)2-甲基-3-环丙基-6-环丁基辛烷(4)反-1-甲基-2-异丙基环丁烷(5)1-甲基-3-环戊基环己烷(6)2-甲基-8-乙基螺[4.5]癸烷(7)2,7,7-三甲基二环[4.1.0]庚烷(8)二环[3.3.3]十一烷(9)1-甲基二环[2.2.2]辛烷(10)(11)(12)(13)3-2该烃分子可能为下列化合物之一:甲基环己烷乙基环戊烷丙基环丁烷丁基环丙烷3-3
3-4顺-1-甲基-4-丙基环己烷的椅式构象式反-1-甲基-4-丙基环己烷的椅式构象式最优势构象3-5(1)(2)(3)(4)(5)3-63,4-二溴-1-叔丁基环己烷可能的构象异构体如下:3-7化合物A是:化合物B是:反应式:
3-83-9反-1,2-二甲基环己烷采用ee构象时,亚甲基和甲基是处在对位交叉式,分子内能较小;而在aa构象中,亚甲基和甲基是处在邻位交叉式,分子扭转张力相对比较大,同时由于1,3-竖键作用,空间张力大。综合比较而言,反-1,2-二甲基环己烷的优势构象是ee构象,所以室温下反-1,2-二甲基环己烷的90%是二个甲基处在e键上。在反-1,3-二溴环己烷的ee构象中,尽管溴原子与亚甲基是处在对位交叉式,但是Br原子的体积比甲基大许多,同时C—Br键是极性共价键,所以极性排斥力大,内能高;而aa构象中,同样存在较大的扭转张力和空间张力,综合比较结果是反-1,3-二溴环己烷的ee构象和aa构象的分子内能相近,因此,两种构象比例各占一半。3-10
第四章习题参考答案思考题4-1s键:(1)成键轨道沿键轴以“头碰头”的方式重叠,重叠程度较大,键能较大。(2)电子云为柱状,在成键两个原子之间,受原子核约束较大,键的极化性较小。(3)成键的两个原子可以沿键轴自由旋转。(4)可以单独存在。p键:(1)成键轨道以“肩并肩”的方式平行重叠,重叠程度较小,键能较小。(2)电子云为块状,通过键轴有一对称平面,电子云分对称布在该平面的上下方,受原子核约束较小,键的极化性较大。(3)成键的两个原子不能沿键轴自由旋转。(4)不能单独存在,只能在双键或三键中与s键共存。思考题4-2思考题4-3思考题4-4
思考题4-5思考题4-6习题4-1(1)Z-4-甲基-3-庚烯(2)4-丁基-3-辛烯(3)5-甲基-4-丙基-1-庚炔(4)6-甲基4-辛烯-2-炔(5)(3Z,5E)-3,6-二甲基-4,5-二乙基-3,5-壬二烯(6)8-甲基-3-壬烯-6-炔4-2
4-34-44-5
4-6(c)>(b)>(a)4-74-8(1)2-丁烯<2-甲基丙烯(2)1-丁烯<2-甲基丙烯(3)丙烯>3,3,3-三氟丙烯(4)2-丁烯>1,4-二氯2-丁烯4-94-10
4-11第五章习题参考答案思考题5-1历史上提出比较有代表性的苯的表达方式有:棱晶烷杜瓦苯凯库勒式现代有机化学表达苯通常采用价键式,也就是凯库勒式。思考题5-2二甲苯有三种异构体,在铁粉催化下,可以分别发生以下反应:
思考题13-2酯水解的产物为酸和醇。在皂化反应中,水解产物酸会和介质中的碱反应生成盐和水,该步反应为不可逆的。因此,虽然酯水解是可逆的,但皂化反应是不可逆的。习题5-1正丙苯,邻异丁基甲苯,2-叔丁基-1,3,5-三甲苯,3-苯基-1-丁炔,4-异丙基邻二甲苯习题5-2
习题5-32和5具有芳香性习题5-4
习题5-5第六章习题参考答案问题6-1(1)实物与镜像不能重合的现象称为手性。(2)使得偏振光的振动方向发生旋转的性质称为旋光性。(3)使得偏振光的振动方向发生旋转的角度称为旋光度。(4)1mL含1g旋光性物质的溶液,放在1dm长的旋光管中,用一定波长的入射光所测得的旋光度。(5)彼此成镜像关系,又不能重叠的一对立体异构体互为对映异构体。
问题6-2答案:=-59.5º问题6-3(1)C6H5C*HDCH3有(2)CH3CHClCH3无(3)CH3C*H(NH2)CO2H有(4)CH3CH2C*HOHCH3有问题6-4(1)c>a>b>d(2)b>d>a>c(3)a>b>c>d(4)d>b>a>c问题6-5分子式为C3H6DCl化合物共有五种构造异构体,其中B、C有手性。问题6-6将熔点为19º
C的进行拆分,可以得到两个旋光度绝对值相同、方向相反的一对对映体的反应结果说明得到是邻二醇的一对对映体。邻二醇共有三个构型异构体,包括一个內消旋体和一对对映体。由此推断它们的构型如下:m.p19ºCm.p.32ºC问题6-7(1)有(2)无(3)有(4)有习题答案6-1(1)构型:分子中原子或原子团在空间的不同排列。构象:由于碳碳单键的旋转使分子中原子或原子团在空间的不同排列。(2)构造异构:是指分子中原子或官能团的连接方式或顺序不同而产生的异构现象。立体异构:是指具有相同的分子式,原子的连接方式或顺序相同,但是原子的空间排列方式不同所引起的异构现象。(3)手性:实物与其镜像不能重叠的特性叫手性。手性碳:和四个不同的原子或原子团相连的碳原子称为手性碳。(4)旋光度:偏振光振动平面旋转的角度称为旋光度。比旋光度:以1mL中含有1g溶质的溶液,放在1dm长的旋光管中测出的旋光度。(5)对映异构体:互为实物和镜像关系的异构体。非对映异构体:不是互为实物和镜像关系的异构体。(6)外消旋体:等量的左旋体和右旋体组成的混合物称为外消旋体。内消旋体:分子中有手性碳,但是没有旋光活性的物质。(7)S和R:在手性碳原子所结合的四个基团a、b、c、d中,若a>b>c>d,从d的对面看a、b、c基团顺序,如果是顺时针方向,则此手性碳的构型是右旋R型;反之为左旋S型。(8)+和–:使偏振光振动平面右旋叫“+”,左旋的叫“-”。6-2(1)、(2)、(3)和(4)有旋光异构体。(1)(2)
(3)(4)6-36-4(1)否(2)否(3)否(4)对(5)对6-5
6-6(1)无(2)无(3)有(4)无(5)有(6)无6-7(1)为外消旋体,旋光度为0。(2)+7.8º。6-86-9
6-106-11
6-126-13对称烯烃与溴的加成才有可能有内消旋体和外消旋体的区别,不对称烯烃不会有。6-14第七章参考答案
问题7-1(1)2-甲基2-溴丁烷;叔卤代物(2)3,3-二甲基4-碘-1-丁炔;伯卤代物(3)3-氯-1,4-戊二烯;仲卤代物(4)氯苯;乙烯型卤代物(5)5-氯-2-庚烯;烯丙型卤代物(6)4-溴环戊烯;仲卤代物问题7-2用AgNO3/醇来鉴别。其中(1)在室温下有沉淀产生,(2)不反应;(3)在加热条件下有沉淀产生。问题7-3问题问题7-5(1)SN2。甲基体积小,I-为非常好的离去基团,有利于SN2反应。(2)SN1。+C(CH3)3稳定,有利于SN1;叔丁基体积大,不利于亲核试剂从碳氯键背向进攻,不利于SN2反应。(3)SN1。水的极性大,亲核试剂较弱,可按SN1进行反应的过渡态产生稳定化作用,降低了反应的活化能。思考题7-6对于E1历程,主要是由于叔卤代烃所
生成的叔碳正离子最稳定,其次为仲碳正离子,伯碳正离子最不稳定。此外,碳-碳双键(C=C)上烃基越多,则消除产物烯烃越稳定,也就愈容易生成。因此,卤代烃按E1历程发生反应,其活性顺序是叔卤代烷活性最高。在E2历程中,碱试剂进攻β-碳原子上的氢原子。α-碳原子所连烃基的空间位阻因素对于碱试剂进攻β-碳原子上的氢原子的影响不大。此外,叔卤代烃发生消除后所生成的烯烃的相对稳定性高。因此,叔卤代烃按E2历程发生消除反应的活性较大。思考题7-73>4>5>2>6>1习题7-17-27-3
7-4(1)SN2;(2)SN1;(3)SN2;(4)SN1;(5)SN2;(6)SN27-5写出下列反应的主要产物。
7-6(1)C6H5CH(CH3)Br>C6H5CH2Br>C6H5CH2CH2Br(2)(CH3)3CI>(CH3)3CBr>(CH3)2CHBr(3)(CH3)3CBr>(CH3)2CHBr>CH3CH2CH2Br7-7(1)CH3CH2CH2I比CH3CH2CH2Cl反应速度快。因为I-更容易离去。(2)CH3CH2CH(CH3)Br的速度更快一些。因为该物质的中心碳原子(仲碳)的空间位阻与叔碳原子相比更小。(3)CH3CH2CH2Cl的速度更快一些。因为它是伯氯代烃,而后者是烯基氯,分子中存在p-π共轭,C-Cl键更强一些。7-8
7-97-10(1)AgNO3/醇溶液,1-氯丙烷长时间加热有沉淀,2-氯丙烷稍微加热有沉淀,1-氯丙烯不反应。(2)AgNO3/醇溶液,PhCH2Br室温下有沉淀,CH3CH2CH2CH2Br长时间加热有沉淀,CH3CH(CH3)Br稍微加热有沉淀。(3)AgNO3/醇溶液,CH3CH=CHBr不反应,CH2=CHCH2Br室温下有沉淀,CH3CH2CH2Br长时间加热有沉淀。7-117-12
7-13(2)更合理一些。因为在强碱NaOCH2CH3存在下,叔卤代烃易发生消除反应生成相应的烯烃,而BrCH2CH3(伯氯)不易发生消除,易发生取代反应。7-14图示化合物为手性叔卤代烃。叔卤代烃水解主要通过SN1机理进行。SN1机理中,首先发生叔卤代烃的C-X键的异裂,生成X-和相应的碳正离子R+。因此,原来连接氯原子的手性碳转变为具有平面结构的碳正离子,OH-从平面的两侧进攻碳正离子,从而生成顺、反两种构型的醇。第八章参考答案思考题8-1:2,3-二甲基-2,3-丁二醇、2-丙烯醇、(1R,2S,5R)-2-异丙基-5-甲基环己醇、(Z)-3-己烯醇、3,7-二甲基-6-辛烯醇和(2R,3R,4R,5R)-1,2,3,4,5,6-己六醇。思考题8-2:醇和水之间存在分子间氢键作用力。思考题8-3:NaH和Na。思考题8-4:叔丁基溴难于发生亲核取代反应;而碘甲烷不发生消除反应。思考题8-5:思考题8-6:(1)PBr3,(2)SOCl2,(3)a)TsCl,Py;b)NaCl
思考题8-7:思考题8-8:思考题8-9.将混合物用碱处理后,用乙醚萃取,有机相除去溶剂后得到4-氯环己醇,水相用酸中和以后萃取得到对氯苯酚。习题8-1(1)3-甲基-1-丁醇;(2)4-环丙基-3-己醇;(3)反-4-甲基环己醇;(4)羟甲基环己烷;(5)(2R,4R)-4-甲基-2-己硫醇;(6)1,2,4-丁三醇;(7)2,4,6-三甲基苯硫酚;(8)3-叔丁基苯酚;(9)1,2,4-苯三酚;(10)4-羟基苯甲酸。8-28-38-4
8-58-6(1)在FeCl3作用下呈蓝色的为苯酚;(2)能够溶于NaOH水溶液的为苯酚。8-78-88-98-10
第九章参考答案思考题9-11)i-PrBr,EtOH;2)PhCH2Br,MeOH;3)PhOH,i-PrBr。思考题9-2机理略。习题9-11)4-甲基-2-甲氧基戊烷;2)苯基异丙基醚;3)异丁醚;4)1,1,1-三氟-2-氯乙基-1",1"-二氟甲基醚;5)甲基-2-氯乙基硫醚;6)反-3-甲基-2-丙基氧杂环丁烷;9-29-3
9-1B。9-21,3,3-三甲基-2-氧杂双环[2.2.2]辛烷9-39-4化合物B的反应比较快。因为B的稳定构象中大基团叔丁基处于横键,羟基化氯原子都在竖键,分子内亲核取代易发生。化合物A则需要进行构象转换,需较高能量。9-5第十章参考答案思考题10-1(1)4-苯基丁醛(2)2-甲基丁醛(3)2-己酮(4)3-丁烯-2-酮(5)2,4-二甲基环己酮思考题10-2
有电子因素和空间因素的影响。思考题10-3思考题10-4(1)(2)思考题10-5(1)PhCOCH3,CH2Br(2)环己酮,CH3Br(3)2-甲基丁醛,CH3CH2Br思考题10-6思考题10-7利用碘仿反应,反应液变混浊的是2-丁醇,没有的正丙醇。思考题10-8思考题10-9习题10-1
(1)4-甲基-3-戊烯醛(2)3-己酮(3)2-甲基-4-氯苯甲醛(4)7-苯基-6-氯-6-辛烯醛(5)苯丙酮10-210-310-4与苯甲醛反应的主要产物:与丙酮反应的主要产物:10-5
10-610-710-8(1)丙醛丙酮正丙醇异丙醇Tollens试剂+---NaHSO3+--I2/NaOH--(2)2-戊酮3-戊酮环己酮I2/NaOH+--NaHSO3-+(3)苯甲醛苯乙酮l-苯基-2-丙酮丙醛Tollens试剂+--+NaHSO3-+Fehling试剂+(4)二甲基缩乙醛正丙醚H+/Tollens试剂+-10-9
10-10第十一章参考答案问题11-1:(1)σ→σ*,n→σ*;(2)n→π*;π→π*;(3)n→π*;π→π*;(4)π→π*问题11-2A:n→π*B:π→π*问题11-3振动自由度3´3-6=3;氨分子在IR图谱中有3个(基频)吸收峰。问题11-5环己烷问题11-6根据Hückel规则,
[18]-轮烯具有芳香性。由于环电流所产生的感应磁场方向在环外与外加磁场方向相同,为去屏蔽区,而环内则是屏蔽区。环外12个质子是强烈去屏蔽,共振吸收在低场;环外6个质子受到强烈屏蔽,共振吸收在高场。问题11-7(5)中,b/b¢以及c/c¢分别是化学等价而磁不等价质子。习题11-111-2除(1)外,其余都有。11-3
11-411-5a:环己酮;(b)CH3CO(CH2)2-CH=CH2;(c)CH3(CH2)2-CºC-CH2OH(解释略)11-6(1)d==4.5ppm;(2)d仍然为4.5ppm;吸收频率低于TMS=400MHz´(4.5´10-6)=1800Hz.11-7
11-811-911-1011-911-1111-12111-13分子式C10H12O,Ω=5,化合物可能含有苯基,同时可能有C=C或C=O双键;1HNMR谱由低场至高场积分简比为4:2:3:3,其数字之和与分子式中氢原子总数一致,故积分比等于质子数目之比。d6.5~7.5的多重峰对称性强,可知含有X-C6H5-Y(对位二取代)结构;其中2H的δ<7ppm,表明苯环与供电子基(-OR)相连。d3.73ppm(s,3H)可归属于CH3O;d1.82(d,3H)为CH3-CH=;δ5.5~6.5(m,2H)为双取代烯氢(C=CH2或HC=CH)的四重峰,其中一个氢又与CH3有邻位偶合,故可排除=CH2基团的存在,化合物应存在-CH=CH-CH3片断,且为反式结构(大的J值)。综合上述信息,推断该化合物结构为:
第十二章参考答案思考题12-1(1)4-苯基2-氯丁酸(2)2-甲基丁酸(3)2-乙基戊酸(4)3-环戊基丙酸(5)(2R,3R)-2-甲基-3-溴-丁二酸思考题12-2将丙酸和正己烷的混合物与碳酸钠反应,由于丙酸可以与碳酸钠反应生成丙酸钠,该组分会在无机相,而正己烷不能与碳酸钠反应,留在有机相,因此可通过分液进行分离,无机相的丙酸钠用酸处理后可回到原来的丙酸,再通过分液操作可得到纯的丙酸。思考题12-3由于羧基的吸电子效应,首先离解的羧基酸性增强,第一个羧基离解后形成羧酸负离子,其电子效应与羧基相反,是推电子的,使得第二个羧基难于离解,酸性减弱。思考题12-4(1)CH3CH2COOH>CH3CH(CH3)COOH(2)CH3CH2CH2OH>CH3CH2CH(CH3)OH思考题12-5思考题12-6思考题12-7
思考题12-8思考题12-9(5)>(3)>(4)>(2)>(1)习题12-1(1)2R,3R-2,3-二羟基-1,4-丁二酸(2)5-甲基-4-庚烯酸(3)2-乙基-4-戊酮酸(4)1S,2R-1,2-二羧基环己烷(5)3,4-二羟基苯甲酸(6)2,2-二甲基丁酸12-2根据化合物的名称写出相应的结构。12-3(1)CH3CH2NH2Cl>H>CH3>OH>NH2苯环上的吸电子取代基硝基和Cl使得苯环对羰基的吸电子性增加,
羰基的极性增加,羰基的电正性就越强,进行亲核加成反应更有利,因此两者进行亲核取代反应的速率比苯甲酸乙酯快。而硝基的吸电子能力比Cl强,因此对硝基苯甲酸乙酯进行亲和取代反应的速率比对氯苯甲酸乙酯快。同理,CH3、OH和NH2表现为推电子的性质,而推电子能力的顺序为CH3CH3COOCH3>CH3COOCH2CH3>CH3COOCH(CH3)2>CH3COOC(CH3)3当羧酸衍生物中烃基的位阻越大,四面体中间体就越拥挤并且不稳定,不容易生成,进行亲核加成的速率越慢,亲核取代反应的速率就越慢。13-413-5(1)CH3(CH2)2COOH+C2H5OH(2)CH3(CH2)2CONHC2H5+C2H5OH(3)CH3(CH2)2CH2OH(4)+C2H5OH(5)CH3(CH2)2COH(CH3)2
(6)(7)CH3(CH2)2CHO13-6(1)CH3(CH2)2COOH+HCl(2)CH3(CH2)2CONHC2H5+HCl(3)CH3(CH2)2CH2OH(4)HCl(5)CH3(CH2)2COH(CH3)2(7)CH3(CH2)2CHO(1)H3O+(2)C2H5NH2(3)LiAlH4,然后H3O+(4)环戊醇(5)CH3MgBr,然后H3O+(6)乙醇钠/乙醇,然后H3O+(7)DIBAL,然后H3O+13-713-813-9
13-10用反应式解释为什么乙酰乙酸乙酯会发生如下反应:乙酰乙酸乙酯是酮式和烯醇式平衡的混合物,在室温时含92.3%的酮式和7.7%的烯醇式,因此它既有酮的典型性质,又有烯醇的反应特征。烯醇式乙酰乙酸乙酯可以使FeCl3水溶液呈紫色;而烯醇式中的双键可以使Br2/H2O褪色13-1113-12化合物A和B的分子式均为C10H12O。其IR以及1HNMR谱图分别如下。请写出化合物A和B的结构,并对化合物A的1HNMR谱数据进行归属。1HNMRd7.48-7.06(m,5H,C6H5),3.67(s,2H,CH2C6H5),2.45(q,2H,CH2CH3),1.02(t,3H,CH2CH3).第十四章参考答案思考题:14-1(1)异丙胺(2)乙基异丙胺(3)三甲基乙烯基溴化铵(4)N-甲基-N-乙基苯胺(5)β-萘胺(6)N,N-二甲基对氯苯胺思考题14-2
思考题14-3思考题14-4。思考题14-5答案:参见Hinsberg反应。思考题14-6
思考题14-7填空。思考题14-8思考题14-9
思考题14-10习题14-1.14-2.(1)三丙胺(2)2-甲基-5-氨基己烷(3)间氯苯胺(4)2-甲基-4-氨基苯甲酸(5)3-甲基-4-羟基偶氮苯(6)二甲基十二烷基苄基溴化铵(7)1,7-庚二胺(8)N-亚硝基二乙基胺14-3.试解析下列诸现象。(1)丁胺与丁醇虽然都可以形成分子间氢键,但氮原子形成氢键的能力比氧原子小。(2)因为在分子中,与羰基碳直接相连的氨基中氮原子孤对电子与羰基形成p-π共轭,降低了它的亲核能力。(3)因为(CH3)3N中氮原子可与水中氢原子形成氢键。
14-4.(2)与(4)存在对映异构体。14-5.(3)>(1)>(4)>(2)>(5)因为季铵碱是强碱,碱性与苛性碱相当。酰胺由于存在p-π共轭,碱性减弱,近乎中性。14-6.(1)、(2)、(3)、(4)可作为亲核试剂。14-7.(1)CH3CH2NH2CH3CH2NHCH2CH3(CH3CH2)3Np-CH3C6H4SO2Cl+(↓)+(↓)-NaOH+-(2)苯胺环己胺苯酚Br2↓-↓NaOH--+14-8.
14-914-10
14-1114-12第十五章参考答案:思考题15-1(1)2-硝基-4-溴呋喃(2)4-甲基噁唑(3)γ-溴代吡啶(4)1-甲基-7-氯异喹啉(5)4-甲基-2-氨基嘧啶思考题15-2思考题15-3思考题15-4
思考题15-5思考题15-6习题15-7答案:因为咪唑环上有两个电负性比较大的氮原子环上电子云密度比吡咯小,所以稳定性增加,同时也正是由于这一原因,所以亲电反应活性没有吡咯强。思考题15-8
进攻3位和5位所得到中间体都有一个不稳定结构,而进攻4位无此不稳定共振结构。思考题15-9因为吡啶环上有氮原子,而氮原子上有孤对电子可与FeBr3络合,而后氮原子带有正电荷,使环更钝化,不易发生亲电取代反应。思考题15-102-吡啶酮,与2-羟基吡啶互为互变异构体。思考题15-11因为邻溴吡啶亲核反应的离去基团Br-碱性比吡啶亲核反应的离去基团H-弱,碱性越强越不容易离去。所以邻溴吡啶的亲核反应比吡啶的快。思考题15-12思考题15-13
习题15-1(1)2-甲基-5硝基噻吩(2)4-甲氧基噁唑(3)5-溴呋喃甲醛(4)6-羟基-3-吡啶甲酰胺(5)5-甲基-4-嘧啶磺酸(6)2-氯-4-吲哚甲酰氯15-2(1)A,B(2)六氢吡啶>甲胺>吡啶>对甲基苯胺>苯胺>吡咯(3)吡啶,呋喃(4)用浓硫酸:噻吩可与硫酸反应,产物溶解在浓硫酸中,苯不行。(5)吡啶g-甲基吡啶苯胺H2O++-KMnO4-+15-3
15-4
15-515-615-7
因为吡咯中氮原子孤对电子参与组成芳香性,而四氢吡咯氮上孤对电子不参与共轭。苯胺分子中氮原子上孤对电子与苯环组成p-π共轭。吡啶环上氮原子孤对电子不参加共轭,吡咯中氮原子上孤对电子参与共轭。15-815-915-10第十六章参考答案16-2化合物(2)、(4)和(5)可作乳化剂。
16-4倍半萜倍半萜二萜倍半萜倍半萜单萜四萜16-5.16-6.(1)一种甘油三酸酯,属于一种脂肪;(2)属于一种蜡;(3)一种烷基硫酸酯,属于洗涤剂;(4)一个倍半萜,属萜类化合物;(5)一种甾族化合物。16-7.
(1)胆固醇分子中有8个手性碳原子,理论上有28=256个旋光异构体;(2)都不是;(3)β-构型;(4)(5)16-6.此物质是一种油脂类化合物,与溴发生加成反应,与NaOH溶液发生皂化反应。16-7.(1)a)H2/Ni,b)LiAlH4;(1)H2/Ni;(2)a)H2/Ni,b)SOCl2,c)1-十八醇(3)O3,Zn/H2O(4)KMnO4/H+16-10.鲸蜡糖苷结构中糖的头部是极性的和水溶性的,而像烷烃一样的尾部是非极性的和疏水性的,这是一个好的非离子型表面活性剂(是一种不带电荷的洗涤剂)。
16-11.16-12.此甘油酯的结构及皂化、氢化反应式如下:16-13.第十七章参考答案17-3.(1)(2)(3)(4)
(5)(6)17-4α-D-吡喃甘露糖β-D-吡喃甘露糖α-D-吡喃半乳糖β-D-吡喃半乳糖17-5化合物A17-617-7(1)Br2/H2O(2)Benedict试剂或Tollens试剂(3)Bial反应(4)I2(5)I2(6)Benedict试剂或Tollens试剂17-8设半乳糖的α异构体的百分含量为x,β异构体的百分含量为y,则:
x(+150.7°)+y(+52.8°)=+80.2°x+y=1经计算,平衡时α异构体的百分含量为28%,β异构体的百分含量为72%。17-9L-古罗糖的结构如下:17-10推断结构如下:17-11(a)在碱性条件下,D-果糖可转化为D-葡萄糖和D-甘露糖,形成三者混合物。(b)溴水的pH=6左右,不会发生差向异构化。第十八章参考答案思考题18-1苏氨酸的所有立体构型如下,其中Ⅲ式为蛋白质中存在的主要构型。
考题18-2:Val和Glu均带负电荷向正极泳动,但Glu所带负电荷较多,泳动速率快。His不动。思考题18-3:四肽苯-缬-组-天冬的结构式如下:思考题18-4:由于与HNO2反应无N2产生,表明在N-端无游离-NH3+,故为一环状肽。它具有部分序列为Gly-Ala-Gly,余下部分为Phe和Val,故有两种可能的结构式:思考题18-5:(1)在α-螺旋中存在有Pro残基,因它含的是亚氨基,故在N原子上已无H原子存在,不能形成氢键,使肽链发生扭折,而且Pro残基中N是环的组成部分,不能使N-C键发生转动。(2)使胶原蛋白纤维变得更坚硬和更脆,腱更易受损伤。思考题18-6:各组蛋白质混合物在pH=4.9时分离效果最佳,血清白蛋白不泳动,卵清蛋白思考题18-7:在加工过程中使酶变性而失去了生物活性。习题答案18-1(1)(2)(3)(4)(5)(6)18-2
18-318-4(1)与NaOH反应的产物分别是:a)b)c)(2)与HCl反应的产物分别是:a)b)c)(3)与CH3OH/H+反应的产物分别是:
a)b)c)(4)与(CH3CO)2O反应的产物分别是:a)b)c)(5)与NaNO2+HCl反应的产物分别是:a)b)c)18-5在pH=6.20时,甲硫氨酸具有较多的负电荷数。18-6在pH=2时,结构式分别为:在pH=7时,结构式分别为:在pH=12时,结构式分别为:
18-7(1)Gly呈弱酸性,Glu呈酸性,Lys呈碱性(2)Gly带负电荷,Glu带负电荷,Lys带正带电荷(3)Gly加入少量酸,Glu加入少量酸,Lys加入少量碱等电点时的结构式:18-8(1)茚三酮(2)亚硝酸反应3)缩二脲反应(4)茚三酮,亚硝酸反应18-9(1)酪氨酰苏氨酰色氨酸;(2)丙氨酰半胱氨酰半胱氨酰缬氨酸;(3)谷氨酰天冬酰胺酰异亮氨酰甲硫氨酰甘氨酸;(4)赖胺酰天冬氨酰天冬氨酰亮氨酰酪氨酰丝氨酸。18-10(1)二肽Asp-Phe中有2个不同的手性碳原子,故有4种可能的立体异构体:(S,S)、(R,R)、(S,R)和(R,S)。(2)由于自然界中存在的Asp、Phe这两种氨基酸均为S构型,故结合的异构体为(S,S)。在合成过程中无外消旋产物,其结构式为:18-1甲硫氨酸脑啡肽的结构式为:18-12
18-13A的结构为:苯丙氨酰甘氨酰丙氨酸(Phe-Gly-Ala)有关反应为:第十九章参考答案19-4.19-5.B股多核苷酸链中的碱基是:19-6.DNA序列是TAAGCCGTG19-7.
这是因为在胞嘧啶与腺嘌呤之间只能形成一个氢键,在胸腺嘧啶与鸟嘌呤之间形成二个氢键,以此形式配对形成的DNA分子中氢键少于正常DNA分子中可形成的氢键数目(5个),氢键越多,DNA分子越稳定。19-8.19-9.
'
您可能关注的文档
- 《智能仪器》(第二版程德福林君)课后习题参考答案.pdf
- 《暖通空调》复习详细习题集和答案 (1).doc
- 《暖通空调》复习详细习题集和答案.doc
- 《有机化学-结构和性质相关分析与功能》第三版_课本答案全.doc
- 结构和性质相关分析与功能》第三版_课本答案全_主编傅建熙_.doc
- 《有机化学》 习题答案.doc
- 《有机化学》中国农业出版社 课后习题答案.doc
- 《有机化学》习题及思考题答案.pdf
- 《有机化学》习题答案(汪小兰主编).pdf
- 《有机化学》第四版(高鸿宾)课后习题答案 高等教育出版社.doc
- 《有机化学》第四版(高鸿宾)课后习题答案.doc
- 《有机化学》第四版. 高鸿宾版 课后练习答案.doc
- 》第四版._高鸿宾版_课后练习答案(新).doc
- 》第四版._高鸿宾版_课后练习答案.doc
- 》第四版[1]._高鸿宾版_课后练习答案(新).doc
- 》第四版[1]._高鸿宾版_课后练习答案.doc
- 》第四版_习题答案_高等教育出版社[1].doc
- 《期货投资分析》习题集附答案.doc
相关文档
- 施工规范CECS140-2002给水排水工程埋地管芯缠丝预应力混凝土管和预应力钢筒混凝土管管道结构设计规程
- 施工规范CECS141-2002给水排水工程埋地钢管管道结构设计规程
- 施工规范CECS142-2002给水排水工程埋地铸铁管管道结构设计规程
- 施工规范CECS143-2002给水排水工程埋地预制混凝土圆形管管道结构设计规程
- 施工规范CECS145-2002给水排水工程埋地矩形管管道结构设计规程
- 施工规范CECS190-2005给水排水工程埋地玻璃纤维增强塑料夹砂管管道结构设计规程
- cecs 140:2002 给水排水工程埋地管芯缠丝预应力混凝土管和预应力钢筒混凝土管管道结构设计规程(含条文说明)
- cecs 141:2002 给水排水工程埋地钢管管道结构设计规程 条文说明
- cecs 140:2002 给水排水工程埋地管芯缠丝预应力混凝土管和预应力钢筒混凝土管管道结构设计规程 条文说明
- cecs 142:2002 给水排水工程埋地铸铁管管道结构设计规程 条文说明