- 6.05 MB
- 2022-04-22 11:33:56 发布
- 1、本文档共5页,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报电话:19940600175。
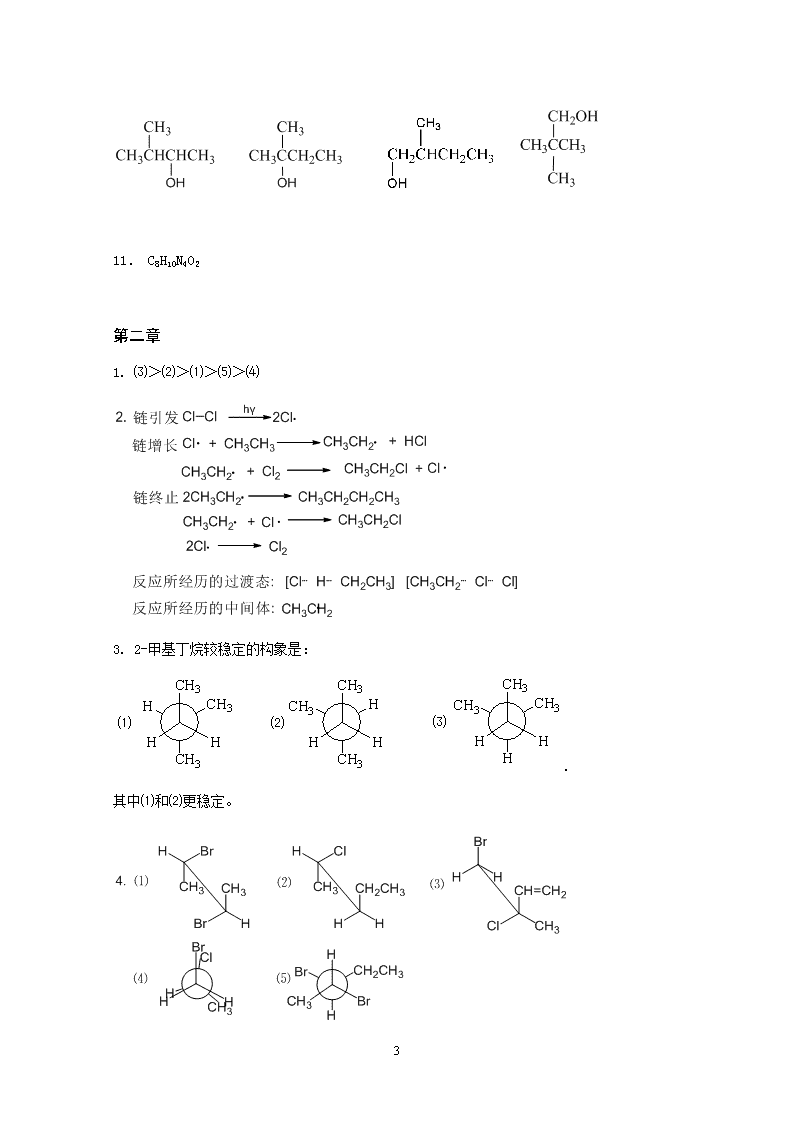
'习题答案第一章1.(1)有机化合物:含碳化合物(一氧化碳、二氧化碳、碳酸盐、金属碳化物等少数简单含碳化合物除外)或碳氢化合物及其衍生物的总称。有机物是生命产生的物质基础。(2)共价键:共价键(covalentbond)是化学键的一种,两个或多个原子共同使用它们的外层电子,在理想情况下达到电子饱和的状态,由此组成比较稳定的化学结构叫做共价键。(3)同分异构:同分异构是一种有相同化学式而有不同的原子排列的化合物的异构现象。(4)杂化:在形成多原子分子的过程中,中心原子的若干能量相近的原子轨道重新组合,形成一组新的轨道,这个过程叫做轨道的杂化。(5)偶极矩:正、负电荷中心间的距离r和电荷中心所带电量q的乘积,叫做偶极矩μ=r×q。它是一个矢量,化学中方向规定为从正电荷中心指向负电荷中心。(6)诱导效应:在有机分子中引入一原子或基团后,使分子中成键电子云密度分布发生变化,从而使化学键发生极化的现象,称为诱导效应(InductiveEffects)。(7)异裂:共价键断裂时,共用电子对完全转移给成键原子中的某个原子,形成了正、负离子,这种断键方式称为异裂。(8)范德华力:在化学中通常指分子之间的作用力。(9)键角:分子中两个相邻化学键之间的夹角。(10)Lewis酸:路易斯酸(LewisAcid,LA)是指电子接受体,可看作形成配位键的中心体。(11)疏水作用:非极性分子间或分子的非极性基团间的吸引力。导致这些基团在水性环境中的缔合。(12)官能团:决定有机物性质的原子或原子团称为官能团。2.(1)(2)(3)(4)56
(5)(6)(7)(8)(9)3.具有偶极的分子:(1)两H原子中心指向O原子方向;(2)由H原子指向Br原子;(4)H原子指向三个Cl原子的中心方向;(5)乙基指向羟基方向4.(1)正庚烷;(2)异丁烷;(3)异己烷;(4)新戊烷5.(1)(2)(3)(4)6.酸:Cu2+FeCl3CH3CN碱:NH3CH3NH2C2H5OC2H5加合物:CH3COOHCH3OH7.(1)CH3COOH/CH3COO-H3O+/H2O(2)H2SO4/HSO4-CH3OH2+/CH3OH(3)HNO3/NO3-(CH3)3NH+/(CH3)3N8.(2)CH3F>(3)CH3Cl>(4)CH3Br>(5)CH3I>(1)CH49.单键最长,双键次之,叁键最短.单键中两个原子间的电子云密度小,叁键两个原子间的电子云密度最大,共同的电子把两个原子吸引得最近.所以说,叁键最短,单键最长,双键处于中间.10.C5H12O56
11.C8H10N4O2第二章1.⑶>⑵>⑴>⑸>⑷3.2-甲基丁烷较稳定的构象是:.其中⑴和⑵更稳定。56
7.⑵>⑴>⑷>⑶8.⑴7,7-二甲基三环[2.2.1.02,6]庚烷⑵三环[3.3.1.13,7]癸烷11.该烷烃的分子式为C8H18。由于只能生成一种一氯产物,说明该烷烃中的18个氢原子是等性的,其结构式为:(CH3)3C—C(CH3)312.2-甲基-1-溴丙烷的含量为0.6%,2-甲基-2-溴丙烷的含量为99.4%。第三章2.⑶、⑷为共轭化合物;⑴、⑶、⑷有顺反异构。56
3.⑴E型⑵E型⑶Z型⑷E型4.⑴沸点:顺-2-丁烯>反-2-丁烯,因为顺式的偶极矩大;熔点:反式>顺式,因为反式的对称性好,分子排列紧密。⑵熔点:2-丁炔>1-丁炔,因为2-丁炔对称性好,分子排列紧密。沸点:2-丁炔>1-丁炔,因为末端炔烃具有较低的沸点。5.56
7.生成的主要产物是4-甲基-3-溴环戊烯。反应机理为自由基取代历程(略)。10.⑴第一步用顺丁烯二酸酐检验,有沉淀生成者为1,3-丁二烯;第二步用溴水检验,不褪色者为丁烷;第三步用酸性高锰酸钾溶液检验,褪色者为1-丁烯;余者为甲基环丙烷。⑵第一步用硝酸银的氨溶液或氯化亚铜的氨溶液检验,有沉淀者为1-戊炔;第二步用溴水检验,不褪色者为环戊烷;第三步用酸性高锰酸钾溶液检验,褪色者为环戊烯。余者为乙基环丙烷。11.⑴p-π共轭,σ-p共轭⑵p-π共轭,σ-π共轭⑶p-π共轭⑷π-π共轭,p-π共轭,σ-p共轭56
13.⑶﹤⑴﹤⑵15.⑴后一个式子是错误的,不符合八隅体结构。⑵后一个式子是错误的,它的未成对电子数目不对。⑶正确。⑷两个式子间不是单纯的电子转移,原子位置发生了改变。56
17.A.环丁烷 B.甲基环丙烷 C.1-丁烯 D.2-甲基丙烯 E、F为顺式和反式2-丁烯第四章3.⑴对叔丁基甲苯⑵2-硝基-4-氯甲苯⑶对乙烯基苯甲酸56
⑷2,4,6-三硝基甲苯⑸2-甲基-3-苯基丁烷6.⑵和⑺56
其中(7)采取椅式构象,Cl在e键上,更稳定。11.⑴3,6-二甲基-2硝基萘⑵9,10-二溴菲13.四甲基苯的异构体有:其中⑶的对称性最好,熔点最高。56
反应式略。16.⑴有⑵无⑶无⑷无⑸有⑹有第五章1.(略)2.(1)正确。(2)不正确。R、S构型是人为规定的,而(+)、(-)是测定得到的,二者没有必然联系。(3)不正确。分子中没有对称面、对称轴与对称中心,也可以有旋光性如螺环化合物,有空间为阻的联苯类化合物、丙二烯型化合物等。(4)不正确。如2,3-二溴丁烷,含有2个不对称碳原子,只有一对对映异构体,一个内消旋体。只有3个立体异构体。(5)不正确。如内消旋体,分子内有手性碳,但因其有对称面并不具有光学活性。(6)不正确。如内消旋体,分子内虽具有不对称碳原子,但无旋光性。(7)正确。3.+2.3.0°4.(4)(7)不同,其他相同。56
6.薄荷醇分子中有3手性碳原子,可能有8个异构体。7.(1)(6)有对称中心,(4)有对称面,均没有手性。8.四个构型异构体,分别是9.用R/S标记下列化合物中不对称碳原子的构型。(1)S(2)S(3)1S,3S(4)R(5)2R,3R(6)2S,3R(7)1S,2R(8)S(9)R(10)R56
13.(3)相同,其它为对映体。56
14.(1)(A)BrCH=CBrCH(CH3)CH2CH3,(B)CH2=CHCH(CH3)CH2CH3,(C)CH3COCH(CH3)CH2CH3,(D)CH2=CClCH(CH3)CH2CH3, (2)都是旋光体(3)都具有相同构型(4)都不能预测15.(4)无,其它有。16.(1)使用旋光性酸形成两个非对映体,然后进行分级结晶,得到结晶后,再用碱水解得到纯净的产物(如酒石酸)。(2)使用旋光性碱形成两个非对映体,然后进行分级结晶,得到结晶后,再用酸水解得到纯净的产物(如生物碱类)。(3)先与丁二酸酐作用形成半酯,再与具有旋光性的碱作用,形成非对映体,然后进行分级结晶,得到结晶后,再用酸水解得到纯净的产物。17.略第六章1.(略)2.(1)正戊基碘(2)正丁基溴(3)正庚基溴(4)间溴甲苯沸点相对较高。3.(1)C2H5I(2)CH3CH2Br(3)CH3CH2F(4)CH2==CHCl偶极矩相对较大。4.(略)56
6.(1)(B)>(A)(2)(C)>(A)>(B)(3)(C)>(B)>(A)4)(A)>(B)>(C)7.(1)SN2(2)SN2(3)SN1(4)SN1(5)SN1(6)SN2(7)SN1(8)SN28.(1)SN1,第一个反应快,形成的碳正离子更稳定。(2)SN2,第一个反应快,空间位阻更小些。(3)SN2,第一个反应快,空间位阻更小些。(4)SN2,第二个反应快,空间位阻更小些。(5)SN2,第二个反应快,Br-更容易离去。(6)SN2,SH-亲核能力更强些。(7)SN1,第二个反应快,形成的碳正离子更稳定。10.SN1SN2E1E2(1)(A)>(C)>(B)(B)>(C)>(A)(A)>(C)>(B)(A)>(C)>(B)(2)(B)>(C)>(A)(A)>(C)>(B)(B)>(C)>(A)(B)>(C)>(A)11.(1)(C)>(A)>(B)(2)(A)>(C)>(D)>(B)(3)(A)>(C)>(B)56
(4)(C)>(A)>(D)>(B)13.下列化合物中(1)、(2)、(4)、(5)不能用来制备Grignard试剂。因为在(1)、(5)分子中含有活泼氢,(2)的β-碳原子上连有烷氧基CH3O-,易发生消除反应,生成烯烃。(4)分子中有羰基,会能与Grignard试剂反应。(3)可以制备Grignard试剂,但需使用络合能力较强的THF,和/或高沸点溶剂,或在较强的条件下才能进行。56
56
第七章1.分子中原子的振动可以分为两大类,一类叫伸缩振动。振动时键长发生变化,键角不变。另一类叫弯曲振动,振动时键长不变,键角发生变化。只有偶极矩大小或方向有改变的振动才能吸收红外光而产生红外光谱。2.官能团区中的吸收峰对应着分子中某一对键连原子之间的伸缩振动,受分子整体结构的影响较小。因而可用于确定分子中某种特殊键或官能团是否存在。指纹区出现的峰比较复杂。但在指纹区内,各个化合物在结构上的微小差异都会得到反映。因此在确认有机化合物时用处很大。3.(1)2(2)4(3)5/4(4)3(5)44(1)(2)(3)(4)(5)(6)5.分子内氢键与分子间氢键6(1)伸缩振动吸收峰。56
(2)伸缩振动吸收峰。(3)共轭体系中伸缩振动吸收峰,由于分子对称,只出现一个峰。(4)弯曲振动吸收峰。(5)弯曲振动吸收峰。(6)面外弯曲振动吸收峰。7.由图5-20IR谱知为型,再由1HNMR图分析结构为:8(1)a:b:c:(2)a:b:c:9.依次为环己烷、氯仿、苯和正己烷10.1-丁醇(上)2-丁醇(下)11.元素分析得知分子式为C2H5X,X=156-29,X=I,化合物为碘乙烷。12.IR表明有O-H,Ar-H和苯环单取代。1HNMRδ7.2(s,5H)为C6H5-;4.3(m,1H)为-CH-;3.9(d,1H)为O-H;1.7(m,2H)为-CH2-;0.9(t,3H)为-CH3。构造为1-苯基丙醇。13.丙醛56
第八章1.(1)3-氯-2-戊醇(2)(E)-4-氯-2-甲基-2-丁烯-1-醇(3)(E)-3-辛烯-6-炔-2-醇(4)5-甲基-2-环戊烯-1-醇(5)2-苯基-1-丙醇(6)4-硝基-1-萘酚2.3.(1)d>b>a>c>e理由:化合物在水中的溶解度主要取决于分子极性及其亲水性,分子中羟基越多,极性越大,亲水性越强,溶解度越大。(2)b>a>c>d(3)(a)对甲氧基苄醇>苄醇>对硝基苄醇(b)α-苯基乙醇>苄醇>β-苯基乙醇(4)f>e>g>d>b>c>a56
理由:酚酸性一般强于醇,酚的酸性看苯环上所连基团的给电子或吸电子能力的强弱,吸电子的能力强,酸性强。4.(1)SN1反应机理,叔丁基碳正离子不稳定,发生消除反应。(2)SN2反应机理,但未涉及到C-O键的断裂,所以构型保持。5.(9)6.56
7.56
8.9.10.11.第九章56
1.(1)苯乙酮(2)2-(1-甲基)丙基苯甲醛(3)环己酮缩乙二醇(4)1,5,5-三甲基-2-氧代环己甲醛(5)2-甲基-1-苯基-3-羟基-1-丁酮(6)4-甲基-7-氧代辛醛(7)5-乙基-6-庚烯醛(8)3-丁烯-2-酮(9)(E)-1,4-二苯基-2-丁烯-1,4-二酮(10)对溴苯基苯基甲酮肟(11)5-硝基-2-萘甲醛(12)1-环丙基-2-丙酮2.3.56
4.(1)正丁醇>丁酮>乙醚>正戊烷(2)(3)(4)丙酮>丁酮>2-戊酮5.以上化合物能发生碘仿反应6.56
7.Na8.56
56
9.56
10.11.12.13.56
14.(1)红外光谱,后者在1700cm-1附近有醛羰基的红外吸收峰。(2)核磁共振氢谱,前者CH2CH3显示一组三重峰和一组四重峰,CH2和CH3后者显示两个单峰。第十章1.(1)2,2-二甲基-3-氯-丁酸(2)3-甲酰基-4-硝基苯甲酸(3)(E)-2-戊烯酸(4)3-氯丙酸苯酯(5)甲基丙二酸(6)N,N-二甲基甲酰胺(7)2-甲基丙酰氯(8)N-甲基-3-甲基戊酰胺(9)烯丙基丙二酰氯(10)1,1-环丙二甲酸2.3.56
4.(1)C>B>A(2)C>A>B>D(3)A>D>B>C(4)D>C>B>A(5)B>C>D>A5.6.(1)因为醋酸和乙酰胺能形成分子间氢键。(2)因为甲酸乙酯中含有醛基,醛基有还原性,所以能发生银镜反应。(3)因为酰胺分子中的N原子上孤对电子与羰基发生共轭,因此,碱性弱。7.56
8.56
(7)56
9.10.11.12.56
13.14.15.第十一章1.(1)异丙胺(2)3-戊胺(3)N-乙基苯胺(4)氢氧化二乙基铵56
(5)N,N-二甲基对硝基苯胺(6)溴化对甲基苯基重氮盐(7)六氢吡啶(哌啶)(8)环己胺(9)2-氨基-4-甲氧基-1-戊醇(10)2-甲基-1,3-丙二胺2.3.4.(1)B>D>A>C(2)D>C>A>B(3)F>B>A>>C>E>D(4)E>A>B>D>C(5)A>B>D>C56
5.溴代叔丁烷在氨水碱性条件下易发生E1消除,脱去HBr水生成烯烃。溴代新戊烷属于伯溴代烷,同时由于叔丁基的立体位阻,在氨水条件下按SN1机理进行,生成正碳离子,,此正碳离子不稳定,甲基迁移生成叔正碳离子,而后在氨水碱性条件下发生消除反应,收率较低。因此,可采用羧酸为原料,经Hoffmann降解反应制备。6.从分子间氢键的角度考虑,伯胺和仲胺能形成分子间氢键,但伯胺形成氢键能力最强,沸点最高,叔胺不能形成分子间氢键,沸点最低。7.56
8.(1)加入亚硝酸钠和盐酸的溶液振摇,丙胺与亚硝酸反应生成丙醇,在水相,二乙胺与亚硝酸反应生成N-亚硝基化物,为油层,然后加盐酸将亚硝基除去,用氢氧化钠中和提取液,乙醚提取,蒸馏得到二乙胺。(2)加入乙酰氯,N-甲基苯胺被乙酰化,N,N-二甲基苯胺不被乙酰化,然后用盐酸的溶液搅拌,N,N-二甲基苯胺溶于盐酸溶液,用乙醚提取乙酰化物,水相用碱中和,油层为N,N-二甲基苯胺,洗涤、蒸馏得到纯品。9.56
10.11.56
12.13.56
14.第十二章1.4>2>1>32.(1)(2)(3)(4)或(5);(6)(7)(8)+(9)(10)(11)(12)(13)(14)(15),(16)56
(17)(18)3.(1)(2)(3)(4)第十三章1(1)(2)(3)(4)(5)(6)2(1)8-羟基喹啉中苯环上连有—OH,易和FeCl3发生显色反应。喹啉环能被KMnO4氧化,使KMnO456
褪色,萘不会发生上述反应;喹啉与萘的另一差别是喹啉有有碱性,可溶于稀酸中,而萘没有碱性,不溶解于稀酸中。(2)可从水溶液的差异区分。吡啶易溶于水,而喹啉难溶于水(喹啉较吡啶多一个疏水的苯环)。(3)噻吩的亲电取代反应比苯容易进行,在室温时同浓硫酸作用即可磺化,生成α-噻吩磺酸,后者能溶于浓硫酸;而苯在室温下较难磺化,利用该特性,可除去苯少量的噻吩。(4)①吡啶易溶于水,而甲苯不溶于水。②利用吡啶的碱性。向混合物中加入稀HCl,吡啶呈盐溶于盐酸中,与甲苯分层。(5)六氢吡啶的氮上有氢,可被磺酰化,而吡啶中的氮上无氢,不能被磺酰化。向混合物中加入对甲苯磺酰氯/NaOH溶液,六氢吡啶形成不溶于水的磺酰胺固体,经过滤可除去。3有芳香性的是下列化合物,参与π体系的未共用电子对如结构式所示。4用盐酸处理吡咯时,如果吡咯能生成正离子,它的结构将应该是用轨道表示如下:由于π电子体系只有4个电子,不符合Huckle规则,所以它没有芳香性。5.(1)(2)(3)(4)(5)(6)56
(7)(8)(9)(10)(11)(12),,,(13),6.(1)(2)7.六氢吡啶具有脂肪族仲胺的结构特征,其中的氮原子为sp3杂化,有一对未参与杂化的孤对电子处于sp3杂化轨道中,离核较远,容易给出,故碱性较强;而吡啶中氮原子参与了芳环的构造,氮原子上的孤对电子电子处于sp2杂化轨道中,离核较近,不易给出,碱性较弱。8.喹啉与亲核试剂反应时,进攻C2可形成更稳定的负离子中间体,使反应活化能降低,反应速度加快:56
异喹啉与亲核试剂反应时,进攻C1可形成更稳定的负离子中间体,使反应活化能降低,反应速度加快:9.2,3-吡啶二甲酸是以偶极离子的形式存在的,而且N原子上的正电荷可以共振到2-、4-、6-位,但不能共振到3-位:其中正电荷带在2-位上的(II),有利于在2-上发生脱羧反应:10.咪唑的结构如下:3-N上孤对电子与吡啶中N上孤对电子的分布相似,不参与芳环的共轭(A),碱性较强;1-N上一对电子与吡咯中N上一对电子的分布相似,参与芳环的共轭(B),碱性较弱。56
所以,在酸性溶液中3-N将被质子化,以下列形式存在:11.咪唑分子间存在较强的氢键作用,可以通过氢键形成链状缔合物:而呋喃、噻吩、吡咯、噻唑均不能形成类似的分子间氢键。12原来的C5H4O2是糠醛。13.这是一个E2反应。吡啶具有一定的碱性,它可以进攻溴原子的β-H,使溴代丁酸乙酯消除一分子HBr,形成稳定的产物。吡啶的优点是它的碱性小于氢氧化钾/乙醇溶液,不会使酯皂化,而KOH/乙醇则会使酯皂化。14.吡啶与Lewis酸作用,生成吡啶-Lewis酸络合物,后者对亲电试剂不敏感。15.脂环氮上的未共用电子为sp3杂化,受饱和脂环的作用,电子云更加集中,碱性强。而奎啉环氮上的未共用电子为sp2杂化,受苯环的影响,电子云更加分散,碱性较弱。56
16.(A)和(B)的结构分别为:(A)(B)进行亲电取代反应时,苯环比吡啶环活泼。因为苯环上电子云密度大于吡啶环。17.根据共振论,1-甲基异喹啉负离子的结构可表示如下:共振结构式(B)具有特殊的稳定性:负电荷分散到电负性较大的N上的同时,还保持了一个完整的苯环;另外,1-甲基异喹啉负离子有三个共振结构式保持了完整的苯环,使真实结构较稳定性。3-甲基异喹啉负离子的结构可表示如下:共振结构式(III)的稳定性不如(B):虽然负电荷分散到电负性较大的N上,但却不能保持完整的苯环。另外,在3-甲基异喹啉负离子中,只有两个共振结构式保持了完整的苯环,使得3-甲基异喹啉负离子的稳定性不如1-甲基异喹啉负离子。所以,1-甲基异喹啉甲基上质子的酸性比3-甲基异喹啉甲基上质子的酸性大。18.(A)和(B)的结构式分别为:(A)(B)56
第十四章1.类脂化合物是指不溶于水,而易溶于非极性或弱极性有机溶剂的一类有机化合物。油脂是油和脂肪的总称,包括猪油、牛油、花生油、豆油和桐油等动植物油。磷脂是含有磷酸酯基团的类脂化合物,它广泛存在于动物的脑、肝脏和蛋黄,以及植物的种子和微生物中,是构成细胞膜的基本成分。2.单萜由两个异戊二烯单位组成,是某些植物香精油的主要组分。二萜是含有四个异戊二烯单位的化合物,广泛分布于动植物界。三萜是由鲨烯经过不同的途径环合而成,而鲨烯是由倍半萜金合欢醇的焦磷酸酯尾尾缩合而成。3.大豆油、花生油等食用油均为植物油,是不饱和脂肪酸,其双键多为顺式结构,使得碳链的结构锯齿化,分子间更松散,作用力更弱,所以熔点较低。猪油、牛油等为动物油,是饱和脂肪酸,碳链结构固定,分子间作用力较强,熔点较高。4.胆固醇的分子结构如图:从其结构可以看出,分子的疏水性较强,而且比较刚性,和细胞膜中的脂肪链有较强的作用。由于疏水力的相互作用,切分子的刚性,导致胆固醇会较多的聚集在一起,并且和磷脂双分子相比,流动性较差。一旦聚集的较多,形成一个平面,就构成了“脂筏”。胆固醇在脂筏中,因为其的分子刚性和疏水性,起到粘合脂筏中分子的作用。56
5.(1)(2)(3)(4)6.第十五章1.(略)56
3.(1),(2),(4),(6)是还原糖;(3),(5),(7),(8),(9),(10)是非还原糖。5.D-葡萄糖在不同条件下可得到两种结晶,α-型和β-型D-葡萄糖,其稳定性不同,熔点和比旋光度也不相同。但是不管开始时是α-型还是β-型,当它们溶于水放置一段时间后可达到溶液平衡,其比例保持恒定,其中α-型约为37%,β-型约为63%,开链式约0.1%,此时平衡体系的比旋光度恒定在+52.7°。6.(1)(2R,3R,4R,5R)-2,3,4,5,6-五羟基己醛(2)(2R,3S,4R,5R)-2,3,4,5,6-五羟基己醛(3)(2S,3R,4R,5R)-2,3,4,5,6-五羟基己醛9.果糖中的羰基碳具有前手性。56
10.没有游离的醛基和羰基。对映体略第十六章1.(1)α-螺旋:指多肽链骨架中源自的局部空间排列,并不涉及侧链的构象。多肽链主链围绕中心轴有规律的螺旋式上升,每隔3.6个氨基酸残基螺旋上升一圈,每个氨基酸残基向上平移0.15nm。(2)β-折叠:存在于各种天然蛋白质中的一种特定的瓦楞状立体结构,β-折叠层是两条或两条以上肽链并列在一起,彼此以氢键连接构成的层状结构。层状结构中的肽链彼此间或平行排列(N端同处一侧),或反平行排列(N端分处两侧),分别构成平行和反平行β-折叠。(3)三级结构:56
具有二级结构的一条多肽链,由于其序列上相隔较远的氨基酸残基侧链的相互作用,而进行范围广泛的盘曲与折叠,形成包括主、侧链在内的空间排列,这种在一条多肽链中所有原子在三维空间的整体排布称为三级结构。(4)等电点:对于每个蛋白都存在一个pH使它的表面净电荷为零即等电点。(5)变性:指蛋白质在某些物理和化学因素作用下其特定的空间构象被改变,从而导致其理化性质的改变和生物活性的丧失,这种现象称为蛋白质的变性。(6)酶的性质:酶是活细胞产生的具有催化能力的生物分子。2.酸性:天冬氨酸、谷氨酸碱性:赖氨酸、精氨酸、组氨酸中性:亮氨酸脯氨酸3.(1)(2)(3)(4)4.略5.(1)精氨酰组氨酸Arg-His(2)赖氨酰丝氨酰苏氨酸Lys-Ser-Thr(3)谷氨酰苯丙氨酰异亮氨酸Glu-Phe-Ile(4)酪氨酰缬氨酰甘氨酸Tyr-Val-Gly56
6.强酸:强碱:等电点:谷氨酸有两个羧基,谷氨酰胺有两个氨基。7.腺嘌呤(A)鸟嘌呤(G)胞嘧啶(C)胸腺嘧啶(T)56
尿嘧啶(U)8.(1)(2)(3)(4)(5)9.Ser-Ile-Arg-Val-Val-Pro-Tyr-Leu-Arg10.DNA相对分子质量大,含脱氧核糖核酸,有两条链,有胸腺嘧啶而RNA没有;RNA相对分子质量小,含核糖核酸,单链,有尿嘧啶而DNA没有。11.利用等电点时氨基酸和多肽在水溶液中溶解度最小的方法。先调PH=6.0,让甘氨酸先析出。溶液过滤得到甘氨酸。然后向剩下母液中加入氢氧化钠,调PH=9.8,赖氨酸从溶液中析出,过滤可得。12.略第十七章1,56
2.1)光照;2)[4+2]环加成,4n电环化;3)第1步加热(4n)体系顺选开环,第2步(4n+2)体系加热对选关环;4)[1,3]烷基异面迁移;5)[1,5]烷基同面迁移6)[3,3]迁移;7)[1,3]烷基异面迁移;8)a)加热对旋,b)[1,3]烷基同面迁移,构型翻转;9)c)[1,7]烷基迁移,d)[1,7]烷基迁移,e)4n体系光照对旋关环10)光照下发生两步反应,第一步是4n+2体系开环,第二步是甲基的[1,7H]迁移反应。56
56'
您可能关注的文档
- 《无机及分析化学原理和应用》补充习题以及答案.doc
- 《普通化学》(第二版)赵士铎主编 习题答案.doc
- 《普通逻辑》课后习题答案 上海人民出版社.doc
- 《普通逻辑》课后习题答案.doc
- 《智能仪器》(第二版程德福林君)课后习题参考答案.pdf
- 《暖通空调》复习详细习题集和答案 (1).doc
- 《暖通空调》复习详细习题集和答案.doc
- 《有机化学-结构和性质相关分析与功能》第三版_课本答案全.doc
- 结构和性质相关分析与功能》第三版_课本答案全_主编傅建熙_.doc
- 《有机化学》中国农业出版社 课后习题答案.doc
- 《有机化学》习题及思考题答案.pdf
- 《有机化学》习题答案(汪小兰主编).pdf
- 《有机化学》习题答案.doc
- 《有机化学》第四版(高鸿宾)课后习题答案 高等教育出版社.doc
- 《有机化学》第四版(高鸿宾)课后习题答案.doc
- 《有机化学》第四版. 高鸿宾版 课后练习答案.doc
- 》第四版._高鸿宾版_课后练习答案(新).doc
- 》第四版._高鸿宾版_课后练习答案.doc
相关文档
- 施工规范CECS140-2002给水排水工程埋地管芯缠丝预应力混凝土管和预应力钢筒混凝土管管道结构设计规程
- 施工规范CECS141-2002给水排水工程埋地钢管管道结构设计规程
- 施工规范CECS142-2002给水排水工程埋地铸铁管管道结构设计规程
- 施工规范CECS143-2002给水排水工程埋地预制混凝土圆形管管道结构设计规程
- 施工规范CECS145-2002给水排水工程埋地矩形管管道结构设计规程
- 施工规范CECS190-2005给水排水工程埋地玻璃纤维增强塑料夹砂管管道结构设计规程
- cecs 140:2002 给水排水工程埋地管芯缠丝预应力混凝土管和预应力钢筒混凝土管管道结构设计规程(含条文说明)
- cecs 141:2002 给水排水工程埋地钢管管道结构设计规程 条文说明
- cecs 140:2002 给水排水工程埋地管芯缠丝预应力混凝土管和预应力钢筒混凝土管管道结构设计规程 条文说明
- cecs 142:2002 给水排水工程埋地铸铁管管道结构设计规程 条文说明