- 4.51 MB
- 2022-04-22 11:47:56 发布
- 1、本文档共5页,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报电话:19940600175。
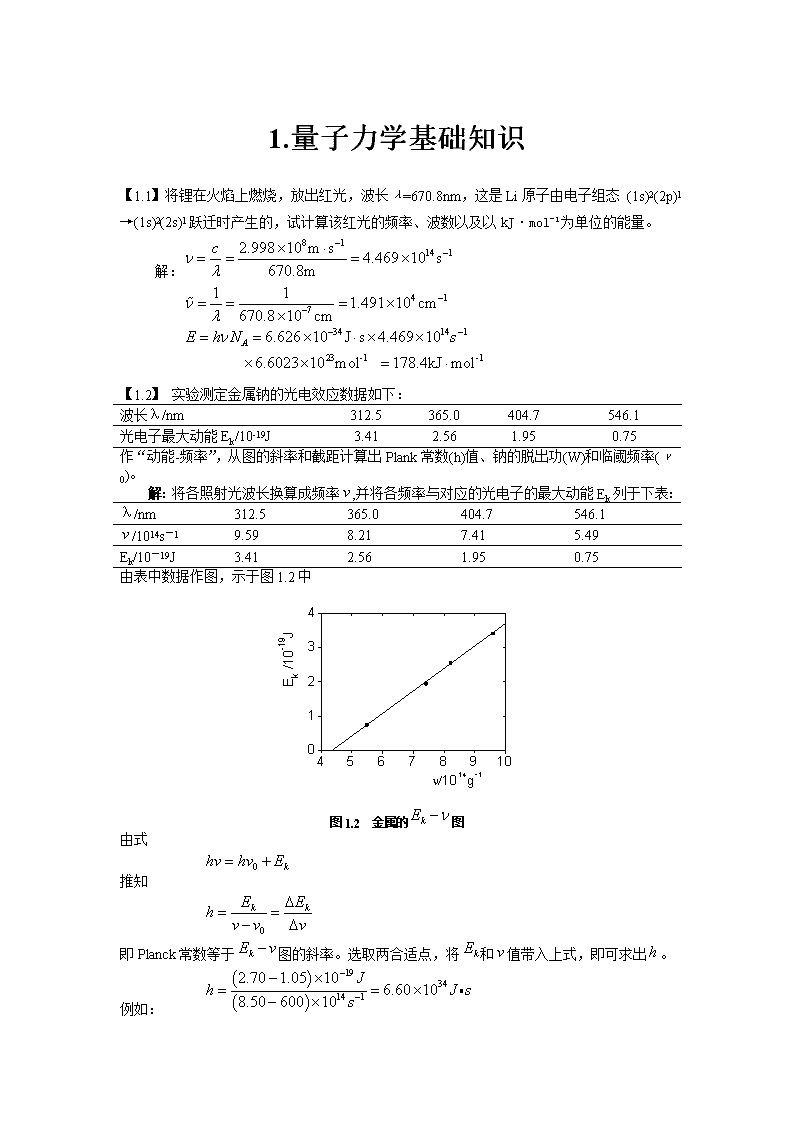
'1.量子力学基础知识【1.1】将锂在火焰上燃烧,放出红光,波长λ=670.8nm,这是Li原子由电子组态(1s)2(2p)1→(1s)2(2s)1跃迁时产生的,试计算该红光的频率、波数以及以kJ·mol-1为单位的能量。解:【1.2】实验测定金属钠的光电效应数据如下:波长λ/nm312.5365.0404.7546.1光电子最大动能Ek/10-19J3.412.561.950.75作“动能-频率”,从图的斜率和截距计算出Plank常数(h)值、钠的脱出功(W)和临阈频率(ν0)。解:将各照射光波长换算成频率,并将各频率与对应的光电子的最大动能Ek列于下表:λ/nm312.5365.0404.7546.1/1014s-19.598.217.415.49Ek/10-19J3.412.561.950.75由表中数据作图,示于图1.2中图1.2金属的图由式推知即Planck常数等于图的斜率。选取两合适点,将和值带入上式,即可求出。例如:
图中直线与横坐标的交点所代表的即金属的临界频率,由图可知,。因此,金属钠的脱出功为:【1.3】金属钾的临阈频率为5.464×10-14s-1,如用它作为光电极的阴极当用波长为300nm的紫外光照射该电池时,发射光电子的最大速度是多少?解:【1.4】计算下列粒子的德布罗意波的波长:(a)质量为10-10kg,运动速度为0.01m·s-1的尘埃;(b)动能为0.1eV的中子;(c)动能为300eV的自由电子。解:根据关系式:(1)
【1.5】用透射电子显微镜摄取某化合物的选区电子衍射图,加速电压为,计算电子加速后运动时的波长。解:根据deBroglie关系式:【1.6】对一个运动速度(光速)的自由粒子,有人进行了如下推导:结果得出的结论。上述推导错在何处?请说明理由。解:微观粒子具有波性和粒性,两者的对立统一和相互制约可由下列关系式表达:式中,等号左边的物理量体现了粒性,等号右边的物理量体现了波性,而联系波性和粒性的纽带是Planck常数。根据上述两式及早为人们所熟知的力学公式:知①,②,④和⑤四步都是正确的。微粒波的波长λ服从下式:式中,u是微粒的传播速度,它不等于微粒的运动速度υ,但③中用了,显然是错的。在④中,无疑是正确的,这里的E是微粒的总能量。若计及E中的势能,则⑤也不正确。【1.7】子弹(质量0.01kg,速度1000m·s-1),尘埃(质量10-9kg,速度10m·s-1)、作布郎运动的花粉(质量10-13kg,速度1m·s-1)、原子中电子(速度1000m·s-1)等,其速度的不确定度均为原速度的10%,判断在确定这些质点位置时,不确定度关系是否有实际意义?解:按测不准关系,诸粒子的坐标的不确定度分别为:子弹:尘埃:
花粉:电子:【1.8】电视机显象管中运动的电子,假定加速电压为1000,电子运动速度的不确定度为的10%,判断电子的波性对荧光屏上成像有无影响?解:在给定加速电压下,由不确定度关系所决定的电子坐标的不确定度为:这坐标不确定度对于电视机(即使目前世界上最小尺寸最小的袖珍电视机)荧光屏的大小来说,完全可以忽略。人的眼睛分辨不出电子运动中的波性。因此,电子的波性对电视机荧光屏上成像无影响。【1.9】用不确定度关系说明光学光栅(周期约)观察不到电子衍射(用电压加速电子)。解:解法一:根据不确定度关系,电子位置的不确定度为:这不确定度约为光学光栅周期的10-5倍,即在此加速电压条件下电子波的波长约为光学光栅周期的10-5倍,用光学光栅观察不到电子衍射。解法二:若电子位置的不确定度为10-6m,则由不确定关系决定的动量不确定度为:在104V的加速电压下,电子的动量为:由Δpx和px估算出现第一衍射极小值的偏离角为:
这说明电子通过光栅狭缝后沿直线前进,落到同一个点上。因此,用光学光栅观察不到电子衍射。【1.10】请指出下列算符中的线性算符和线性自轭算符:解:由线性算符的定义:为线性算符;而为线性自轭算符.【1.11】是算符的本征函数,求其本征值。解:应用量子力学基本假设Ⅱ(算符)和Ⅲ(本征函数,本征值和本征方程)得:因此,本征值为。【1.12】下列函数中,哪几个是算符的本征函数?若是,求出本征值。解:,是的本征函数,本征值为1。是的本征函数,本征值为1。
【1.13】和对算符是否为本征函数?若是,求出本征值。解:,所以,是算符的本征函数,本征值为。而所以不是算符的本征函数。【1.14】证明在一维势箱中运动的粒子的各个波函数互相正交。证:在长度为的一维势箱中运动的粒子的波函数为:=1,2,3,……令n和n’表示不同的量子数,积分:和皆为正整数,因而和皆为正整数,所以积分:根据定义,和互相正交。【1.15】已知在一维势箱中粒子的归一化波函数为
式中是势箱的长度,是粒子的坐标,求粒子的能量,以及坐标、动量的平均值。解:(1)将能量算符直接作用于波函数,所得常数即为粒子的能量:即:(2)由于无本征值,只能求粒子坐标的平均值:(3)由于无本征值。按下式计算px的平均值:【1.16】求一维势箱中粒子在和状态时,在箱中范围内出现的概率,并与图1.3.2(b)相比较,讨论所得结果是否合理。解:(a)由上述表达式计算和,并列表如下:
01/81/41/33/81/200.2931.0001.5001.7262.00001.0002.0001.5001.00005/82/33/47/811.7261.5001.0000.29301.0001.5002.0001.0000根据表中所列数据作图示于图1.16中。图1.16(b)粒子在状态时,出现在和间的概率为:粒子在ψ2状态时,出现在0.49l和0.51l见的概率为:
(c)计算结果与图形符合。【1.17】链型共轭分子在长波方向处出现第一个强吸收峰,试按一维势箱模型估算其长度。解:该分子共有4对电子,形成离域键。当分子处于基态时,8个电子占据能级最低的前4个分子轨道。当分子受到激发时,电子由能级最高的被占轨道(n=4)跃迁到能级最低的空轨道(n=5),激发所需要的最低能量为ΔE=E5-E4,而与此能量对应的吸收峰即长波方向460nm处的第一个强吸收峰。按一维势箱粒子模型,可得:因此:计算结果与按分子构型参数估算所得结果吻合。【1.18】一个粒子处在的三维势箱中,试求能级最低的前5个能量值[以h2/(8ma2)为单位],计算每个能级的简并度。解:质量为m的粒子在边长为a的立方箱中运动,其能级公式为:
E122=E212=E221=9E113=E131=E311=11E222=12【1.19】若在下一离子中运动的电子可用一维势箱近似表示其运动特征:估计这一势箱的长度,根据能级公式估算电子跃迁时所吸收的光的波长,并与实验值510.0比较。解:该离子共有10个电子,当离子处于基态时,这些电子填充在能级最低的前5个型分子轨道上。离子受到光的照射,电子将从低能级跃迁到高能级,跃迁所需要的最低能量即第5和第6两个分子轨道的的能级差。此能级差对应于棘手光谱的最大波长。应用一维势箱粒子的能级表达式即可求出该波长:实验值为510.0nm,计算值与实验值的相对误差为-0.67%。【1.20】已知封闭的圆环中粒子的能级为:式中为量子数,是圆环的半径,若将此能级公式近似地用于苯分子中离域键,取R=140pm,试求其电子从基态跃迁到第一激发态所吸收的光的波长。解:由量子数n可知,n=0为非简并态,|n|≥1都为二重简并态,6个电子填入n=0,1,等3个轨道,如图1.20所示:
图1.20苯分子能级和电子排布实验表明,苯的紫外光谱中出现β,和共3个吸收带,它们的吸收位置分别为184.0nm,208.0nm和263.0nm,前两者为强吸收,后面一个是弱吸收。由于最低反键轨道能级分裂为三种激发态,这3个吸收带皆源于电子在最高成键轨道和最低反键之间的跃迁。计算结果和实验测定值符合较好。【1.21】函数是否是一维势箱中粒子的一种可能状态?若是,其能量有无确定值?若有,其值为多少?若无,求其平均值。解:该函数是长度为的一维势箱中粒子的一种可能状态。因为函数和都是一维势箱中粒子的可能状态(本征态),根据量子力学基本假设Ⅳ(态叠加原理),它们的线性组合也是该体系的一种可能状态。因为常数所以,不是的本征函数,即其能量无确定值,可按下述步骤计算其平均值。将归一化:设=,即:所代表的状态的能量平均值为:
也可先将和归一化,求出相应的能量,再利用式求出所代表的状态的能量平均值:2原子的结构和性质【2.1】氢原子光谱可见波段相邻4条谱线的波长分别为656.47、486.27、434.17和410.29nm,试通过数学处理将谱线的波数归纳成为下式表示,并求出常数R及整数n1、n2的数值。解:将各波长换算成波数:由于这些谱线相邻,可令,……。列出下列4式:(1)÷(2)得:
用尝试法得m=2(任意两式计算,结果皆同)。将m=2带入上列4式中任意一式,得:因而,氢原子可见光谱(Balmer线系)各谱线的波数可归纳为下式:式中,。【2.2】按Bohr模型计算氢原子处于基态时电子绕核运动的半径(分别用原子的折合质量和电子的质量计算并精确到5位有效数字)和线速度。解:根据Bohr提出的氢原子结构模型,当电子稳定地绕核做圆周运动时,其向心力与核和电子间的库仑引力大小相等,即:n=1,2,3,……式中,和分别是电子的质量,绕核运动的半径,半径为时的线速度,电子的电荷和真空电容率。同时,根据量子化条件,电子轨道运动的角动量为:将两式联立,推得:;当原子处于基态即n=1时,电子绕核运动的半径为:若用原子的折合质量代替电子的质量,则:基态时电子绕核运动的线速度为:
【2.3】对于氢原子:(a)分别计算从第一激发态和第六激发态跃迁到基态所产生的光谱线的波长,说明这些谱线所属的线系及所处的光谱范围。(b)上述两谱线产生的光子能否使:(i)处于基态的另一氢原子电离?(ii)金属铜中的铜原子电离(铜的功函数为)?(c)若上述两谱线所产生的光子能使金属铜晶体的电子电离,请计算出从金属铜晶体表面发射出的光电子的德补罗意波的波长。解:(a)氢原子的稳态能量由下式给出:式中n是主量子数。第一激发态(n=2)和基态(n=1)之间的能量差为:原子从第一激发态跃迁到基态所发射出的谱线的波长为:第六激发态(n=7)和基态(n=1)之间的能量差为:所以原子从第六激发态跃迁到基态所发射出的谱线的波长为:这两条谱线皆属Lyman系,处于紫外光区。(b)使处于基态的氢原子电离所得要的最小能量为:ΔE∞=E∞-E1=-E1=2.18×10-18J而ΔE1=1.64×10-18J<ΔE∞ΔE6=2.14×10-18J<ΔE∞所以,两条谱线产生的光子均不能使处于基态的氢原子电离,但是ΔE1>ФCu=7.44×10-19JΔE6>ФCu=7.44×10-19J所以,两条谱线产生的光子均能使铜晶体电离。(c)根据德布罗意关系式和爱因斯坦光子学说,铜晶体发射出的光电子的波长为:式中ΔE为照射到晶体上的光子的能量和ФCu之差。应用上式,分别计算出两条原子光谱线照射到铜晶体上后铜晶体所发射出的光电子的波长:
【2.4】请通过计算说明,用氢原子从第六激发态跃迁到基态所产生的光子照射长度为的线型分子,该分子能否产生吸收光谱。若能,计算谱线的最大波长;若不能,请提出将不能变为能的思路。解:氢原子从第六激发态(n=7)跃迁到基态(n=1)所产生的光子的能量为:而分子产生吸收光谱所需要的最低能量为:显然,但此两种能量不相等,根据量子化规则,不能产生吸收光效应。若使它产生吸收光谱,可改换光源,例如用连续光谱代替H原子光谱。此时可满足量子化条件,该共轭分子可产生吸收光谱,其吸收波长为:【2.5】计算氢原子在和处的比值。解:氢原子基态波函数为:该函数在r=a0和r=2a0处的比值为:
而在在r=a0和r=2a0处的比值为:e2≈7.38906【2.6】计算氢原子的1s电子出现在的球形界面内的概率。解:根据波函数、概率密度和电子的概率分布等概念的物理意义,氢原子的1s电子出现在r=100pm的球形界面内的概率为:那么,氢原子的1s电子出现在r=100pm的球形界面之外的概率为1-0.728=0.272。【2.7】计算氢原子的积分:,作出图,求P(r)=0.1时的r值,说明在该r值以内电子出现的概率是90%。解:
根据此式列出P(r)-r数据表:r/a000.51.01.52.02.53.03.54.0P(r)1.0000.9200.6770.4230.2380.1250.0620.0300.014根据表中数据作出P(r)-r图示于图2.7中:由图可见:时,时,时,即在r=2.7a0的球面之外,电子出现的概率是10%,而在r=2.7a0的球面以内,电子出现的概率是90%,即:图2.7P(r)-r图【2.8】已知氢原子的归一化基态波函数为(a)利用量子力学基本假设求该基态的能量和角动量;(b)利用维里定理求该基态的平均势能和零点能。解:(a)根据量子力学关于“本征函数、本征值和本征方程”的假设,当用Hamilton算符作用于ψ1s时,若所得结果等于一常数乘以此ψ1s,则该常数即氢原子的基态能量E1s。氢原子的Hamiltton算符为:由于ψ1s的角度部分是常数,因而与θ,ф无关:将作用于ψ1s,有:
(r=a0)所以=…=-2.18×10-18J也可用进行计算,所得结果与上法结果相同。注意:此式中。将角动量平方算符作用于氢原子的ψ1s,有:=0ψ1s所以M2=0|M|=0此结果是显而易见的:不含r项,而ψ1s不含θ和ф,角动量平方当然为0,角动量也就为0。通常,在计算原子轨道能等物理量时,不必一定按上述作法、只需将量子数等参数代人简单计算公式,如:即可。(b)对氢原子,,故:
此即氢原子的零点能。【2.9】已知氢原子的,试回答下列问题:(a)原子轨道能E=?(b)轨道角动量|M|=?轨道磁矩|μ|=?(c)轨道角动量M和z轴的夹角是多少度?(d)列出计算电子离核平均距离的公式(不算出具体的数值)。(e)节面的个数、位置和形状怎么样?(f)概率密度极大值的位置在何处?(g)画出径向分布示意图。解:(a)原子的轨道能:(b)轨道角动量:轨道磁矩:(c)轨道角动量和z轴的夹角:,(d)电子离核的平均距离的表达式为:(e)令,得:r=0,r=∞,θ=900节面或节点通常不包括r=0和r=∞,故的节面只有一个,即xy平面(当然,坐标原点也包含在xy平面内)。亦可直接令函数的角度部分,求得θ=900。(f)几率密度为:
由式可见,若r相同,则当θ=00或θ=1800时ρ最大(亦可令,θ=00或θ=1800),以表示,即:将对r微分并使之为0,有:解之得:r=2a0(r=0和r=∞舍去)又因:所以,当θ=00或θ=1800,r=2a0时,有极大值。此极大值为:(g)根据此式列出D-r数据表:r/a001.02.03.04.05.06.0D/00.0150.0900.1690.1950.1750.134r/a07.08.09.010.011.012.0D/0.0910.0570.0340.0191.02×10-25.3×10-3按表中数据作出D-r图如下:
图2.9H原子的D-r图由图可见,氢原子的径向分布图有n-l=1个极大(峰)和n-l-1=0个极小(节面),这符合一般径向分布图峰数和节面数的规律。其极大值在r=4a0处。这与最大几率密度对应的r值不同,因为二者的物理意义不同。另外,由于径向分布函数只与n和l有关而与m无关,2px、2py和2pz的径向分布图相同。【2.10】对氢原子,,所有波函数都已归一化。请对所描述的状态计算:(a)能量平均值及能量出现的概率;(b)角动量平均值及角动量出现的概率;(c)角动量在z轴上的分量的平均值及角动量z轴分量出现的概率。解:根据量子力学基本假设Ⅳ-态叠加原理,对氢原子所描述的状态:(a)能量平均值能量出现的概率为(b)角动量平均值为角动量出现的概率为(c)角动量在z轴上的分量的平均值为
角动量z轴分量h/π出现的概率为0。【2.11】作氢原子图及图,证明极大值在处,说明两图形不同的原因。解:H原子的分析和随r的变化规律,估计r的变化范围及特殊值,选取合适的r值,计算出和列于下表:r/a00*0.100.200.350.500.700.901.101.301.000.820.670.490.370.250.170.110.0700.030.110.240.370.480.540.540.50r/a01.602.002..302.503.003.504.004.505.000.040.020.010.0070.0030.001<0.001--0.420.290.210.170.090.040.020.010.005*从物理图象上来说,r只能接近于0。根据表中数据作图及图如下:图2.11图和D1s-r图
【2.12】试在直角坐标系中画出氢原子的5种3d轨道的轮廓图,比较这些轨道在空间的分布,正、负号,节面及对称性。解:5种3d轨道的轮廓图如图2.12所示。它们定性地反映了H原子3d轨道的下述性质:(1)轨道在空间的分布:的两个极大值分别在z轴的正、负方向上距核等距离处,另一类极大值则在平面,以核为心的圆周上。其余4个3d轨道彼此形状相同,但空间取向不同。其中分别沿轴和轴的正、负方向伸展,,和的极大值(各有4个)夹在相应的两坐标之间。例如,的4个极大值(若以极坐标表示)分别在,;,;,和,方向上。图2.123d轨道轮廓图(2)轨道的节面:有两个锥形节面(),其顶点在原子核上,锥角约。另外4个3d轨道各有两个平面型节面,将4个瓣分开。但节面的空间取向不同:的节面分别为平面()和平面();的节面分别为平面()和平面();的节面分别是平面()和平面();而的节面则分别为和(任意)两个平面。节面的数目服从规则。根据节面的数目可以大致了解轨道能级的高低,根据节面的形状可以了解轨道在空间的分布情况。(3)轨道的对称性:5个3d轨道都是中心对称的,且轨道沿轴旋转对称。(4)轨道的正、负号:已在图中标明。原子轨道轮廓图虽然只有定性意义,但它图像明确,简单实用,在研究轨道叠加形成化学键时具有重要意义。【2.13】写出He原子的Schrödinger方程,说明用中心力场模型解此方程时要作那些假设,计算其激发态(2s)1(2p)1的轨道角动量和轨道磁矩.解:He原子的Schrodinger方程为:
式中和分别是电子1和电子2到核的距离,是电子1和电子2之间的距离,若以原子单位表示,则He原子的Schrodinger方程为:用中心力场解此方程时作了如下假设:(1)将电子2对电子1(1和2互换亦然)的排斥作用归结为电子2的平均电荷分布所产生的一个以原子核为中心的球对称平均势场的作用(不探究排斥作用的瞬时效果,只着眼于排斥作用的平均效果)。该势场叠加在核的库仑场上,形成了一个合成的平均势场。电子1在此平均势场中独立运动,其势能只是自身坐标的函数,而与两电子间距离无关。这样,上述Schrodinger方程能量算符中的第三项就消失了。它在形式上变得与单电子原子的Schrodinger方程相似。(2)既然电子2所产生的平均势场是以原子核为中心的球形场,那么它对电子1的排斥作用的效果可视为对核电荷的屏蔽,即抵消了个核电荷,使电子1感受到的有效电荷降低为。这样,Schrodinger方程能量算符中的吸引项就变成了,于是电子1的单电子Schrodinger方程变为:按求解单电子原子Schrodinger方程的方法即可求出单电子波函数及相应的原子轨道能。上述分析同样适合于电子2,因此,电子2的Schrodinger方程为:电子2的单电子波函数和相应的能量分别为和。He原子的波函数可写成两单电子波函数之积:He原子的总能量为:He原子激发态角动量加和后L=,故轨道角动量和轨道磁距分别为:
【1.14】写出Li2+离子的Schrödinger方程,说明该方程中各符号及各项的意义,写出Li2+离子1s态的波函数并计算或回答:(a)1s电子径向分布最大值离核的距离;(b)1s电子离核的平均距离;(c)1s电子几率密度最大处离核的距离;(d)比较Li2+离子的2s和2p态能量的高低;(e)Li原子的第一电高能(按Slater屏蔽常数算有效核电荷)。解:Li2+离子的Schrödinger方程为:方程中,μ和r分别代表Li2+的约化质量和电子到核的距离;▽2,ψ和E分别是Laplace算符、状态函数及该状态的能量,h和ε0分别是Planck常数和真空电容率。方括号内为总能量算符,其中第一项为动能算符。第二项为势能算符(即势能函数)。Li2+子1s态的波函数为:(a)又1s电子径向分布最大值在距核处。(b)(c)
因为随着r的增大而单调下降,所以不能用令一阶导数为0的方法求其最大值离核的距离。分析的表达式可见,r=0时最大,因而也最大。但实际上r不能为0(电子不可能落到原于核上),因此更确切的说法是r趋近于0时1s电子的几率密度最大。(d)Li2+为单电子“原子”,组态的能量只与主量子数有关,所以2s和2p态简并,即E2s=E2p。(e)Li原子的基组态为(1s)2(2s)1。对2s电子来说,1s电子为其相邻内一组电子,σ=0.85。因而:根据Koopmann定理,Li原子的第一电离能为:I1=-E2s=5.75eV【2.15】Li原子的3个电离能分别为I1=5.39eV,I2=75.64eV,I3=122.45eV,请计算Li原子的1s电子结合能.解:根据电子能的定义,可写出下列关系式:Li(1s22s1)Li+(1s22s0)(1)Li+(1s22s0)Li2+(1s12s0)(2)Li2+(1s12s0)Li3+(1s02s0)(3)根据电子结合能的定义,Li原子1s电子结合能为:而(4)(5)所以或
1s电子结合能为:【2.16】已知He原子的第一电离能I1=24.59eV,试计算:(a)第二电离能;(b)基态能量;(c)在1s轨道中两个电子的互斥能;(d)屏蔽常数;(e)根据(d)所得结果求H-的基态能量.解:(a)He原子的第二电离能是下一电离过程所需要的最低能量,即:He+(g)He2+(g)+cHe+是单电子“原子”,可按单电子原子能级公式计算,因而:(b)从原子的电离能的定义出发,按下述步骤推求He原子基态的能量:He(g)He+(g)+e(1)He+(g)He2+(g)+e(2)由(1)式得:将(2)式代入,得:推而广之,含有n个电子的多电子原子A,其基态能量等于各级电离能之和的负值,即:(c)用J(s,s)表示He原子中两个1s电子的互斥能,则:也可直接由减求算J(s,s),两法本质相同。
(d)(e)H-是核电荷为1的两电子“原子”,其基组态为(1s)2,因而基态能量为:【2.17】用Slater法计算Be原子的第一到第四电离能,将计算结果与Be的常见氧化态联系起来.解:原子或离子Be(g)→Be+(g)→Be2+(g)→Be3+(g)→Be4+(g)组态根据原子电离能的定义式,用Slater法计算Be原子的各级电离能如下:计算结果表明:;和相近(差为),和相近(差为62.7eV),而和相差很大(差为136.8eV)。所以,Be原子较易失去2s电子而在化合物中显正2价。【2.18】用式计算Na原子和F原子的3s和2p轨道的有效半径r*。式中n和Z*分别是轨道的主量子数和该轨道上的电子所感受到的有效核电荷。解:Na原子基态为(1s)2(2s)2(2p)6(3s)1
代入计算公式得:F原子基组态为代入公式计算得:【2.19】写出下列原子能量最低的光谱支项的符号:(a)Si;(b)Mn;(c)Br;(d)Nb;(e)Ni解:写出各原子的基组态和最外层电子排布(对全充满的电子层,电子的自旋互相抵消,各电子的轨道角动量矢量也相互抵消,不必考虑),根据Hund规则推出原子最低能态的自旋量子数S,角量子数L和总量子数J,进而写出最稳定的光谱支项。(a)Si:(b)Mn:(c)Br:(d)Nb:(e)Ni:【2.20】写出Na原子的基组态、F原子的基组态和碳原子的激发态(1s22s22p13p1)存在的光谱支项符号。解:Na原子的基组态为。其中1s,2s和2p三个电子层皆充满电子,它们对对整个原子的轨道角动量和自旋角动量均无贡献。Na
原子的轨道角动量和自旋角动量仅由3s电子决定:,故光谱项为;J只能为,故光谱支项为。F原子的基组态为(1s)2(2s)2(2p)5。与上述理由相同,该组态的光谱项和光谱支项只决定于(2p)5组态。根据等价电子组态的“电子----空位”关系,(2p)5组态与(2p)1组态具有相同的项谱。因此,本问题转化为推求(2p)1组态的光谱项和光谱支项。这里只有一个电子,,故光谱项为。又或,因此有两个光谱支项:和。对C原子激发态(1s22s22p13p1),只考虑组态(2p)1(3p)1即可。2p和3p的电子是不等价电子,因而(2p)1(3p)1组态不受Pauli原理限制,可按下述步骤推求其项谱:由得;由得。因此可得6个光谱项:。根据自旋----轨道相互作用,每一光谱项又分裂为数目不等的光谱支项,如,它分裂为和等三个支项。6个光谱项共分裂为10个光谱支项:。【2.21】基态Ni原子的可能的电子组态为:(a)[Ar]3d84s2;(b)[Ar]3d94s1,由光谱实验确定其能量最低的光谱支项为3F4。试判断它是哪种组态。解:分别求出a,b两种电子组态能量最低的光谱支项,与实验结果对照,即可确定正确的电子组态。组态a:。因此,能量最低的光谱支项为,与光谱实验结果相同。组态b:。因此,能量最低的光谱支项为,与光谱实验结果不同。所以,基态Ni原子的电子组态为。【2.22】列式表明电负性的Pauling标度和Mulliken标度是怎样定的?解:Pauling标度:式中和分别是原子A和B的电负性,Δ是A—B键的键能与A-A键和B-B键键能的几何平均值的差。定F的电负性=4。Mulliken标度:式中I1和Y分别为原子的第一电离能和电子亲和能(取以eV为单位的数值),0.18为拟合常数。[评注]电负性是个相对值,在Mulliken标度中拟合常数有的选0.21,有的选0.5,用Mulliken标度时应予以注意。
【2.23】原子吸收光谱分析较原子发射光谱分析有那些优缺点,为什么?解:原子从某一激发态跃迁回基态,发射出具有一定波长的一条光线,而从其他可能的激发态跃迁回基态以及在某些激发态之间的跃迁都可发射出具有不同波长的光线,这些光线形成了原子发射光谱。原子吸收光谱是由已分散成蒸气状态的基态原子吸收光源所发出的特征辐射后在光源光谱中产生的暗线形成的。基于上述机理,原子吸收光谱分析同原子发射光谱分析相比具有下列优点:①灵敏度高。这是因为,在一般火焰温度下(2000~3000K),原子蒸气中激发态原于数目只占基态原子数目的10-13~10-3左右。因此,在通常条件下,原子蒸气中参与产生吸收光谱的基态原子数远远大于可能产生发射光谱的激发态原子数。②准确度较好。如上所述,处于热平衡状态时,原子蒸气中激发态原子的数目极小,外界条件的变化所引起的原子数目的波动,对于发射光谱会有较大的影响,而对于吸收光谱影响较小。例如,假设蒸气中激发态原子占0.1%,则基态原子为99.9%。若外界条件的变化引起0.1%原子的波动,则相对发射光谱会有1%的波动影响,而对吸收光谱.波动影响只近于0.1%。③谱线简单,受试样组成影响小。空心阴极灯光源发射出的特征光,只与待测元素的原子从其基态跃迁到激发态所需要的能量相当,只有试样中的待测元素的原子吸收、其他元素的原子不吸收此光。因而不干扰待测元素的测定。这使谱线简单,也避免了测定前大量而繁杂的分离工作。④仪器、设备简单,操作方便、快速。【2.24】什么是X射线荧光分析?X射线怎样分光?解:利用能量足够高的X射线照射试样,可产生频率低于原生X射线的次生X荧光射线。产生X荧光的机理与产生原生特征X射线的机理相似,即由高能的原生X射线的光子轰击原于内层电子,再由其他内层电子补位而产生X荧光。这些具有一定特征的次生X光形成了X荧光光谱。利用分光计分析X射线荧光光谱(即测定特征谱线的波长和强度),鉴定样品的化学成分及其含量,称为X射线荧光分析。X射线一般用晶体光栅进行分光。【2.25】什么是电子探针?有何优点?解:电子探针全名为电子探针X射线显微分析仪,又叫微区X射线谱分析仪。它是利用经过加速和聚焦的极细的电子束作为探针,激发试样中某一微小区域,使其发出特征X射线,测定该X射线的波长和强度,即可对该微区所含的元素作定性和定量分析。电子探针已成为人们研究物质亚微观结构的有力工具。它具有以下优点:
(1)能进行微区分析。可分析体积为数个(μm)3内元素的成分。(2)能进行现场分析。无需把分析对象从样品中取出,可直接对大块试样中的微小区域进行分析。把电子显微境和电子探针结合,可把在显微镜下观察到的显微组织与元素成分联系起来。(3)分析范围广。除H,He,Li,Be等少数轻元素外,其他元素都可用它进行定性和定量分析3共价键和双原子分子的结构化学【3.1】试计算当和相距时,两离子间的静电引力和万有引力;并说明讨论化学键作用力时,万有引力可以忽略不计。(已知:完有引力;静电引力)解:万有引力静电引力由上计算可见,在这情况下静电引力比万有引力大倍,所以万有引力可以忽略不计。【3.2】写出,,的键级,键长长短次序和磁性。解:分子(或离子)键级2.521.51键长次序磁性顺磁顺磁顺磁抗磁【3.3】分子基态的电子组态为,其激发态有,,试比较,,三者能级的高低次序,说明理由,能量最低的激发态是顺磁性还是反磁性?解:。因为(c)中两个电子都在反键轨道上,与H原子的基态能量相比,约高出。而(a)和(b)中的2个电子分别处在成键轨道和反键轨道上,
和都与H原子的基态能量相近,但(a)中2个电子的自旋相反,(b)中的2个电子的自旋相同,因而稍高于。能级最低的激发态(b)是顺磁性的。【3.4】试比较下列同核双原子分子:,,,,的键级、键能和键长的大小关系,在相邻两个分子间填入“”或“”符号表示。解:键级键能键长【3.5】基态为反磁性分子,试写出其电子组态;实验测定分子键长为,比原子共价双键半径和短,试说明其原因。解:分子的基组态为:由于s-p混杂,为弱反键,分子的键级在之间,从而使实测键长比按共价双键半径计算得到的值短。【3.6】据分子轨道理论,指出的键比的键是强还是弱,为什么?解:的键比的键弱。原因是:的基态价电子组态为,键级为1。比少1个反键电子,键级为1.5。【3.7】画出的分子轨道示意图,写出基态电子组态,计算键级及磁矩(忽略轨道运动对磁矩的贡献)。解:CN-与N2为等电子“分子”。其价层分子轨道与N2分子大致相同,分子轨道轮廓图如图3.7。
基态的价电子组态为。键级=(成键电子数-反键电子数)=未成对电子数为0,因而磁距为0。【3.8】画出的分子轨道示意图,计算键级及自旋磁矩,试比较和何者的键更强?哪一个键长长一些?解:NO的价层分子轨道能级示意图如图3.8所示。键级图3.8NO价层分子轨道能级图不成对电子数为1,自旋磁矩。由于NO+失去了1个反键的2π电子,因而键级为3,所以它的化学键比NO化学键强。相应地,其键长比NO的键长短。【3.9】按分子轨道理论写出,,基态时的电子组态,说明它们的不成对电子数和磁性(提示:按类似的能级排)。解:NF,NF+和NF-分别是O2,和的等电子体,它们的基态电子组态、键级、不成对电子数及磁性等情况如下:“分子”基态电子组态键级不成对电子数磁性NF22顺磁性NF+2.51顺磁性NF-1.51顺磁性【3.10】试用分子轨道理论讨论分子的电子结构,说明基态时有几个不成对电子。解:在SO分子的紫外光电子能谱中观察到6个峰。它们所对应的分子轨道的归属和性质已借助于量子力学半经验计算(CNDO)得到指认。结果表明,SO分子的价电子结构与O2分子和S2分子的价电子结构相似。但SO是异核双原子分子,因而其价电子组态可表述为:
其中,和轨道是成键轨道,和轨道是反键轨道。这些价层分子轨道是由O原子的2s、2p轨道和S原子的3s、3p轨道叠加成的。根据价层分子轨道的性质和电子数,可算出SO分子的键级为:在简并的轨道上各有一个电子,因而SO分子的不成对电子数为2,若忽略轨道运动对磁距的影响,则SO分子的磁距为。【3.11】和的键能分别为548和753,试用分子轨道理论探讨其键级(按能级次序)。解:CF的基态价电子组态为:因而其键级为。而CF+比CF少一个反键电子,因而,其键级为3。所以CF+的键能比CF的键能大。【3.12】下列AB型分子:,,,,,,,中,哪几个是得电子变为后比原来按中性分子键能大?哪几个是失电子变为后比原来中性分子键能大?解:就得电子而言,若得到的电子填充到成键分子轨道上,则AB-比AB键能大;若得到的电子填充到反键分子轨上,则AB-比AB键能小。就失电子而言,若从反键分子轨道上失去电子,则AB+比AB键能大;若从成键轨道上失去电子,则AB+比AB键能小。根据这些原则和题中各分子的电子组态,就可以的出如下结论:得电子变为AB-后比原中性分子键能大者有C2和CN。失电子变为AB+后比原中性分子键能大者有NO,O2,F2和XeF。N2和CO无论得电子变为负离子(N2-,CO-)还是失电子变为正离子(N2+,CO+),键能都减小。【3.13】写出,的价电子组态和基态光谱项。解::,基态光谱项:。CN:,基态光谱项:。【3.14】分子于1964年在星际空间被发现。(a)试按分子轨道理论只用原子的轨道和原子的轨道叠加,写出其电子组态
(a)在哪个根子轨道中有不成对电子?(b)此轨道是由和的原子轨道叠加形成,还是基本上定域于某个原子上?(c)已知的第一电离能为,的第一电离能为,它们的差值几乎和原子与原子的第一电离能的差值相同,为什么?(d)写出它的基态光谱项。解:(a)H原子的1s轨道和O原子的轨道满足对称性匹配、能级相近(它们的能级都约为-13.6eV)等条件,可叠加形成轨道。OH的基态价电子组态为。实际上是O原子的,而实际上是O原子的或。因此,OH的基态价电子组态亦可写为。和是非键轨道,OH有两对半非键电子,键级为1。(b)在轨道上有不成对电子。(c)轨道基本上定域于O原子。(d)OH和HF的第一电离能分别是电离它们的电子所需要的最小能量,而轨道是非键轨道,即电离的电子是由O和F提供的非键电子,因此,OH和HF的第一电离能差值与O原子和F原子的第一电离能差值相等。(e),基态光谱项为:【3.15】在远红外区有一系列间隔为的谱线,计算分子的转动惯量和平衡核间距。解:双原子分子的转动可用刚性转子模型来模拟。据此模型,可建立起双原子分子的Schrödinger方程。解之,便得到转动波函数、转动能级ER和转动量子数J。由ER的表达式可推演出分子在相邻两能级间跃迁所产生的吸收光的波数为:而相邻两条谱线的波数之差(亦即第一条谱线的波数)为:B为转动常数:由题意知,H79Br分子的转动常数为B=16.94cm-1/2=8.470cm-1所以,其转动惯量为:
H79Br的约化质量为:所以,其平衡核间距为:【3.16】的核间距为,计算其纯转动光谱前4条谱线所应具有的波数。解:12C16O的折合质量为:因而其转动常数为:第一条谱线的波数以及相邻两条谱线的波数差都是2B,所以前4条谱线的波数分别为:亦可用式:进行计算,式中的J分别为0,1,2,和3。【3.17】的转动惯量为。(a)计算分子中键的键长;(b)假定同位素置换不影响键的键长,试计算、和、组成的分子的转动惯量。提示:线型分子的转动惯量可按下式计算:解:(a)由于CO2分子的质心和对称中心重合,C原子对分子转动惯量无贡献,所以:
(b)由于假定同位素置换不改变C=O键键长,因而有:由于(a)中一开始就阐明的原因,的转动惯量和的转动惯量相等,即:线型分子ABC的转动惯量为:本题亦可按此式进行计算。【3.18】在、和混合气体的远红外光谱中,前几条谱线的波数分别为:16.70,20.70,33.40,41.85,50.10,62.37。计算产生这些谱线的分子的键长。解:N2是非极性分子,不产生红外光谱,故谱线是由HCl和HBr分子产生的。分析谱线波数的规律,可知这些谱线由下列两个系列组成:第一系列:16.70,33.40,50.10第二系列:由于,,因而。根据知,,所以,第一系列谱线是由HBr产生的,第二组谱线是由HCl产生的。对HBr:对HCl:
【3.19】在的振动光谱图中观察到强吸收峰。若将HI的简正振动看作谐振子,请计算或说明:(a)这个简正振动是否为红外活性;(b)HI简正振动频率;(c)零点能;(d)的力常数。解:按简谐振子模型,H127I的振动光谱中只出现一条谱线,其波数就是经典振动波数,亦即2309.5。既然只出现一条谱线,因此下列关于H127I分子振动光谱的描述都是指与这条谱线对应的简正振动的。(a)H127I分子是极性分子,根据选律,它应具有红外活性。(b)振动频率为:(c)振动零点能为:(d)H127I的约化质量为:H127I的力常数为:【3.20】在的振动光谱中观察到强吸收峰,若将的简正振动看做谐振子,计算的简正振动频率、力常数和零点能。
解:【3.21】写出、和的基态光谱项,今有3个振动吸收峰,波数分别为1097、1580和1865,请将这些吸收峰与上述3种微粒关联起来。解:写出O2,O2+和O2-的价电子组态,推求它们的量子数S和,即可求出基态光谱项。根据价电子组态,比较力常数大小,即可根据表达式判定波数大小次序。结果如下:分子或离子基态光谱项键级波数/O22.01580O2+2.51865O2-1.51097【3.22】在的基本振动吸收带的中心处,有波数分别为2925.78、2906.25、2865.09和2843.56的转动谱线,其倍频为,请计算:(a)非谐性常数;(b)力常数;(c)键长;(d)平衡解离能。解:(a)在此振---转光谱中,波数为2925.78和2906.25的谱线属R支,波数为2865.09和2843.56的谱线属P支,在两支转动谱线的中心即振动基频:已知倍频为,根据非谐振子模型,得联立方程如下:解得:
(a)由,得(b)由和得(c)由H35Cl的振—转光谱P支=2865.09,2843.56可得【3.23】已知的平衡解离能,其基本振动波数为。计算光谱解离能值。解:按简谐振子模型,N2的光谱解离能为:按非谐振子模型,N2的光谱解离能为:【3.24】的光谱解离能为,振动基频波数为。若与的力常数、核间距和等相同,计算的光谱解离能。解:按双原子分子的谐振子模型,D2的光谱解离能为:
因此,只要求出和,即可算出。依题意,D2平衡解离能为:仍依题意,,由式可推得所以:【3.25】和分子的简正振动数目各有多少?画出简正振动方式,并分别表明其红外活性或活性。解:由n个原子组成的非线型分子有3n-6个简正振动,而由n个原子组成的线型分子有3n-5个简正振动。因此,H2O2和C2H2的简正振动数目分别为3×4-6=6和3×4-5=7。C2H2的简正振动方式如下:(Raman活性)(Raman活性)(红外活性)(Raman活性,二重简并)(红外活性,二重简并)【3.26】画出的简正振动方式,已知与3个基频对应的频带波数分别为1361,1151,519,指出每种频率所对应的振动,说明是否为红外活性或活性。(参看4.6节)。解:SO2分子有3种(3n-6=3×3-6)简正振动,其中2种(n-1)为伸缩振动,1
种(2n-5)为弯曲振动。这些简正振动方式示意如下:对称伸缩振动不对称伸缩振动弯曲振动一般说来,改变键长所需要的能量比改变键角所需要的能量大,因此,伸缩振动的频率比弯曲振动的频率大。而不对称伸缩振动的频率又比相应的对称伸缩振动的频率大。据此,可将3个波数()与三种简正振动方式一一联系起来。简单说来,SO2分子的三种振动方式均使其偶极距发生变化,因而皆是红外活性的。同时,这三种振动方式又使SO2的极化率发生变化,所以,又都是Raman活性的。根据分子的对称性,用特征标表可判断简正振动是否为红外活性和Raman活性。【3.27】用作为激发源,的3个分子轨道的电子电离所得光电子动能为多少?(按图3.6.3估计)。解:图3.27是N2的光电子能谱图,与各谱带相应的分子轨道也在图中标出。图3.27N2的光电子能谱图根据该谱图估计,基态N2分子的各价层分子轨道的绝热电离能分别为:;:;:;:。HeⅠ线的能量为,它只能使和电子电离。对气体样品,忽略能谱仪本身的功函数,光电子的动能可由下式计算:式中,和分别为激发源的能量、电离轨道的能级(电子结合能)和电离轨道的绝热电离能。将有关数据带入,可得从N2分子的和三个分子轨道电离出的光电子功能,它们分别为:【3.28】什么是垂直电离能和绝热电离能?试以分子的电力能谱图为例(参看图3.6.3
),说明3个轨道的数据。解:分子价层电子的电离必然伴随着振动和转动能级的改变。因此,分子的紫外光电子能谱(UPS)并非呈现一个个单峰,而是有精细结构。但由于分子的转动能级间隔太小,通常所用的激发源(如HeI线和HeII线)产生的UPS只能分辨气体分子的振动精细结构。分子从其振动基态()跃迁到分子离子的振动基态()的电离过程叫绝热电离,相应的电离能称为绝热电离能,用IA表示。它对应于UPS中各振动精细结构的第一个小峰。分子亦可从振动基态跃迁到分子离子跃迁概率最大的振动态,即Franck—Condon跃迁,这一电离过程称为垂直电离,相应的电离能称为垂直电离能,用IV表示,它对应于各振动精细结构中强度最大的小峰。从图3.27中估计,相应于N2分子轨道的;相应于轨道的,而,两者之差()即()的振动能级间隔;相应于轨道的。这与从分子轨道理论得到的下述结论是一致的:若电子从非键轨道电离,IA和IV相等;若电子从弱成键轨道或弱反键轨道电离.则IA和IV近似相等。若电子从强成键或强反键轨道电离,则IA和IV不等,两者棚差一个或数个振动能级间隔。【3.29】怎样根据电子能谱区分分子轨道的性质。答:紫外光电子能谱不仅能够直接测定分子轨道的能级,而且还可区分分子轨道的性质。这主要是通过分析分子离子的振动精细结构(即谱带的形状和小峰间的距离)来实现的。(1)非键电子电离,平衡核间距不变,分子从其振动基态跃迁到分子离子振动基态的概率最大,IA=IV。当然,分子也可从其振动基态跃迁到分于离子的其他振动态,但跃迁概率很小。因此,若“电离轨道”是非键轨道,则跃迁概率集中,相应谱带只呈现一个尖锐的强峰和一两个弱峰,且强度依次减小(弱峰的产生主要源于非Franck—Condon跃迁)。(2)成键电子电离,分子离子的平衡核间距比原分子的平衡核间距大。反键电子电离,分子离子的平衡核间距比原分子的平衡核间距小。核间距增大或减小的幅度与成键或反键的强弱有关。此时垂直跃迁的概率最大。但到分子离子其他振动能级的跃迁也有一定的概率,因此分子离子的振动精细结构比较复杂,谱带的序列较长,强度最大的峰不再是第一个峰。“电离轨道”的成键作用越强,垂百跃迁对应的振动量子数越大,分子离子的振动能级间隔越小。“电离轨道”的反键作用越强,垂直跃迁对应的振动量子数越大,分子离子的振动能级间隔也越大。(3)若分子离子的平衡核间距与分子(基态)的平衡核间距相差很大,则分子离子的振动能级间隔很小,电子能谱仪已不能分辨,谱线表现为连续的谱带。综上所述,根据紫外光电子能谱的振动精细结构(谱带形状和带中小峰间的距离)
,便可判断被打出电子所在的分子轨道的性质:若谱带中有一个强峰和一两个弱峰,则相关分子轨道为非键轨道或弱键轨道。至于是弱成键轨道还是弱反键轨道,须进一步看振动能级间隔的大小。振动能级间隔变小者为弱成键轨道,反之为弱反健轨道。若谱带的振动序列很长且振动能级间隔变小(与原分子相比),则相关分子轨道为强成键轨道,若谱带的振动序列很长且振动能级间隔变大,则相关分子轨道为强反键轨道。例如,在N2的紫外光电子能谱中(参见图3.27),与和轨道对应的谱带振动序列很短,跃迁概率集中,说明和皆为弱键轨道。但谱带的振动能级间隔小(2100cm-1),谱带的振动能级间隔大(2390cm-1),所以为弱成键轨道,为弱反键轨道。而相应于轨道的谱带振动序列很长,包含的峰很多,峰间距较小(1800cm-1),而且第一个峰不是最大峰,所以为强成键轨道。与对应的谱线已变成连续的谱带,说明是特强成键分子轨道。【3.30】由紫外光电子能谱实验知,分子的第一电离能为,比的小很多,试从分子的电子组态解释其原因。解:基态CO分子的价层电子组态为:基态NO分子的价层电子组态为:CO分子的第一电离能是将其电子击出所需要的最低能量,NO分子的第一电离能则是将其电子击出所需要的最低能量。电子是成键电子,能量较低。电子是反键电子,能量较高。所以,NO分子的第一电离能比CO分子的第一电离能小很多。【3.31】三氟代乙酸乙酯的XPS谱中,有4个不同化学位移的C1s峰,其结合能大小次序如何?为什么?解:三氟代乙酸乙酯分子在此分子中,碳原子的有效电负性的大小次序为C1>C2>C3>C4,所以,1s电子结合能大小次序为C1>C2>C3>C4。【3.32】银的下列4个XPS峰中,强度最大的特征峰是什么?峰,峰,峰,峰解:X射线光电子能谱特征峰也有一些经验规律:就给出峰的轨道而言,主量子数小的峰比主量子数大的峰强;主量子数相同时,角量子数大者峰强;主量子数和角量子数都相同时,总量子数大者峰强。根据这些经验规律,Ag的3d峰最强。【3.33】由于自旋-轨道耦合,的紫外光电子能谱第一条谱线分裂成强度比为2:1
的两个峰,它们所对应的电离能分别为15.759和15.937。(a)指出相应于此第一条谱线的光电子是从原子的哪个轨道被击出的;(b)写出原子和离子的基态光谱支项;(c)写出与两电离能对应的电离过程表达式;(d)计算自旋-轨道耦合常数。解:(a)从Ar原子的某一轨道(设其轨道角量子数为)打出一个电子变成Ar+后,在该轨道上产生一空穴和一未成对电子。自旋—轨道耦合的结果产生了两种状态,可分别用量子数和表示:。这两种状态具有不同的能量,其差值为自旋—轨道耦合常数。因自旋—轨道耦合产生的两个峰的相对强度比为:依据题意,,因此,即电子是从3p轨道上被打出的。(b)Ar原子:电子组态量子数光谱支项Ar+离子:电子组态量子数光谱支项(c)根据Hund规则,所以两电离过程及相应的电离能分别为:Ar()Ar+()+Ar()Ar+()+微粒的状态及能量关系可简单示意如下:(d)自旋—轨道耦合常数为:15.937eV-15.759eV=0.178Ev此即图3.33所示的两个分裂峰之间的“距离”。
图3.33Ar的紫外光电子能谱(一部分)4分子的对称性【4.1】和都是直线型分子,写出该分子的对称元素。解:HCN:;CS2:【4.2】写出分子中的对称元素。解:【4.3】写出三重映轴和三重反轴的全部对称操作。解:依据三重映轴S3所进行的全部对称操作为:,,,,依据三重反轴进行的全部对称操作为:,,,,【4.4】写出四重映轴和四重反轴的全部对称操作。解:依据S4进行的全部对称操作为:依据进行的全部对称操作为:
【4.5】写出和通过原点并与轴重合的轴的对称操作的表示矩阵。解:,【4.6】用对称操作的表示矩阵证明:(a)(b)(c)解:(a),推广之,有,即:一个偶次旋转轴与一个垂直于它的镜面组合,必定在垂足上出现对称中心。(b)这说明,若分子中存在两个互相垂直的C2轴,则其交点上必定出现垂直于这两个C2轴的第三个C2轴。推广之,交角为的两个轴组合,在其交点上必定出现一个垂直于这两个C2轴轴,在垂直于轴且过交点的平面内必有n个C2轴。进而可推得,一个轴与垂直于它的C2轴组合,在垂直于的平面内有n个C2轴,相邻两轴的夹角为。(c)这说明,两个互相垂直的镜面组合,可得一个轴,此轴正是两镜面的交线。推而广之,若两个镜面相交且交角为,则其交线必为一个n次旋转轴。同理,轴和通过该轴的镜面组合,可得n个镜面,相邻镜面之交角为。【4.7】写出(反式)分子全部对称操作及其乘法表。解:反式C2H2Cl2分子的全部对称操作为:对称操作群的乘法为:EEE
EEE【4.8】写出下列分子所归属的点群:,,氯苯,苯,萘。解:分子HCNSO3C6H5ClC6H6C10H8点群【4.9】判断下列结论是否正确,说明理由。(a)凡直线型分子一定有轴;(b)甲烷分子有对称中心;(c)分子中最高轴次与点群记号中的相同(例如中最高轴次为轴);(d)分子本身有镜面,它的镜像和它本身相同。解:(a)正确。直线形分子可能具有对称中心(点群),也可能不具有对称中心(点群)。但无论是否具有对称中心,当将它们绕着连接个原子的直线转动任意角度时,都能复原。因此,所有直线形分子都有轴,该轴与连接个原子的直线重合。(b)不正确。因为,若分子有对称中心,则必可在从任一原子至对称中心连线的延长线上等距离处找到另一相当原子。甲烷分子(点群)呈正四面体构型,显然不符合此条件。因此,它无对称中心。按分子中的四重反轴进行旋转-反演操作时,反演所依据的“反轴上的一个点”是分子的中心,但不是对称中心。事实上,属于点群的分子皆无对称中心。(c)就具体情况而言,应该说(c)不全错,但作为一个命题,它就错了。这里的对称轴包括旋转轴和反轴(或映轴)。在某些情况中,分子最高对称轴的轴次(n)与点群记号中的n相同,而在另一些情况中,两者不同。这两种情况可以在属于,和等点群的分子中找到。在点群的分子中,当n为偶数时,最高对称轴是轴或轴。其轴次与点群记号中的n相同。例如,反式C2H2Cl2分子属点群,其最高对称轴为轴,轴次与点群记号的n相同。当n为基数时,最高对称轴为,即最高对称轴的轴次是分子点群记号中的n的2倍。例如,H3BO3分子属点群,而最高对称轴为。在点群的分子中,当n为基数时,最高对称轴为轴或轴,其轴次(n)与点群记号中的n相同。例如,C6H6分子属点群,在最高对称轴为或,轴次与点群记号中的n相同。而当n为奇数时,最高对称轴为,轴次为点群记号中的n的2倍。例如,
CO3-属点群,最高对称轴为,轴次是点群记号中的n的2倍。在点群的分子中,当n为奇数时,最高对称轴为轴或轴,其轴次与分子点群记号中的n相同。例如,椅式环己烷分子属点群,其最高对称轴为或,轴次与点群记号中的n相同。当n为偶数时,最高对称轴为,其轴次是点群记号中n的2倍。例如,丙二烯分子属点群,最高对称轴为。轴次是点群记号中的n的2倍。(d)正确。可以证明,若一个分子具有反轴对称性,即拥有对称中心,镜面或4m(m为正整数)次反轴,则它就能被任何第二类对称操作(反演,反映,旋转-反演或旋转-反映)复原。若一个分子能被任何第二类对称操作复原,则它就一定和它的镜像叠合,即全同。因此,分子本身有镜面时,其镜像与它本身全同。【4.10】联苯有三种不同构象,两苯环的二面角分别为:(a),(b),(c),试判断这三种构象的点群。解:【4.11】分子的形状和相似,试指出它的点群。解:SF6分子呈正八面体构型,属点群。当其中一个F原子被Cl原子取代后,所得分子SF5Cl的形状与SF6分子的形状相似(见图4.11),但对称性降低了。SF5Cl分子的点群为。图4.11SF5Cl的结构【4.12】画一立方体,在8个顶角上放8个相同的球,写明编号。若:(a)去掉2个球,(b)去掉3
个球。分别列表指出所去掉的球的号数,指出剩余的球的构成的图形属于什么点群?解:图4.12示出8个相同求的位置及其编号。(a)去掉2个球:去掉的球的号数所剩球构成的图形所属的点群图形记号1和2,或任意两个共棱的球A1和3,或任意两个面对角线上的球B1和7,或任意两个体对角线上的球C(b)去掉3个球去掉的球的号数所剩球构成的图形所属的点群图形记号1,2,4或任意两条相交的棱上的三个球D1,3,7或任意两条平行的棱上的三个球E1,3,8或任意由轴联系起来的三个球F【4.13】判断一个分子有无永久偶极矩和有无旋光性的标准分别是什么?解:凡是属于和点群的分子都具有永久偶极距,而其他点群的分子无永久的偶极距。由于,因而点群也包括在点群之中。凡是具有反轴对称性的分子一定无旋光性,而不具有反轴对称性的分子则可能出现旋光性。“可能”二字的含义是:在理论上,单个分子肯定具有旋光性,但有时由于某种原因(如消旋或仪器灵敏度太低等)在实验上测不出来。反轴的对称操作是一联合的对称操作。一重反轴等于对称中心,二重反轴等于镜面,只有4m次反轴是独立的。因此,判断分子是否有旋光性,可归结为分子中是否有对称中心,镜面和4m
次反轴的对称性。具有这三种对称性的分子(只要存在三种对称元素中的一种)皆无旋光性,而不具有这三种对称性的分子都可能有旋光性。【4.14】作图给出可能的异构体及其旋光性。解:见图4.14图4.14【4.15】由下列分子的偶极矩数据,推测分子立体构型及其点群。(a)(b)(c)(d)(e)(f)(g)解:
注:由于N原子中有孤对电子存在,使它和相邻3个原子形成的化学键呈三角锥形分布。【4.16】指出下列分子的点群、旋光性和偶极矩情况:(a)(b)(c)(d)(环形)(e)(交叉式)(f)(g)解:兹将各分子的序号,点群,旋光性和偶极距等情况列表如下:序号点群旋光性偶极距无有无有c无有d无无e无无f无有g有有注:在判断分子的点群时,除特别注明外总是将—CH3看作圆球对称性的基团。【4.17】请阐明表4.4.3中4对化学式相似的化合物,偶极矩不同,分子构型主要差异是什么?解:在C2H2分子中,C原子以sp杂化轨道分别与另一C原子的sp杂化轨道和H原子的1s轨道重叠形成的两个键;两个C原子的轨道相互重叠形成键,轨道相互重叠形成键,分子呈直线形,属点群,因而偶极距为0。而在H2O2分子中,O原子以杂化轨道(也有人认为以纯p轨道)分别与另一个O原子的杂化轨道和H原子的1s
轨道重叠形成的两个夹角为的键;两键分布在以过氧键为交线、交角为的两个平面内,分子呈弯曲形(见4.15题答案附图),属点群,因而有偶极距。在C2H4分子中,C原子以杂化轨道分别与另一C原子的杂化轨道及两个H原子的1s轨道重叠形成共面的3个键;两C原子剩余的p轨道互相重叠形成键,分子呈平面构型,属点群()。对于N2H4分子,既然偶极距不为0,则其几何构型既不可能是平面的:也不可能是反式的:它应是顺式构型:属点群[见4.15题(f)],或介于顺式和反式构型之间,属点群。反式-C2H2Cl2和顺式-C2H2Cl2化学式相同,分子内成键情况相似,皆为平面构型。但两者对称性不同,前者属点群,后者属点群。因此,前者偶极距为0,后者偶极距不为0。分子的偶极距为0,表明它呈平面构型,N原子以杂化轨道与C原子成键,分子属点群。分子的偶极距不为0,表明S原子连接的两苯环不共面。可以推测,S原子以杂化轨道成键,分子沿着连线折叠成蝴蝶形,具有点群的对称性。【4.18】已知连接苯环上键矩为,键矩为。试推算邻位、间位和对位的的偶极矩,并与实验值4.15,5.94,相比较。解:若忽略分子中键和键之间的各种相互作用(共轭效应、空间阻碍效应和诱导效应等),则整个分子的偶极距近似等于个键距的矢量和。按矢量加和规则,C6H4ClCH3三种异构体的偶极距推算如下:
由结果可见,C6H4ClCH3间位异构体偶极距的推算值和实验值很吻合,而对位异构体和邻位异构体,特别是邻位异构体两者差别较大。这既与共轭效应有关,更与紧邻的Cl原子和-CH3之间的空间阻碍效应有关。事实上,两基团夹角大于。【4.19】水分子的偶极矩为,而只有,它们的键角值很近,试说明为什么的偶极矩要比小很多。解:分子和均属于点群。前者的键角为,后者的键角为。由于O和H两元素的电负性差远大于O和F两元素的电负性差,因而键矩大于键矩。多原子分子的偶极矩近似等于各键矩的矢量和,H2O分子和F2O分子的偶极距可分别表达为:因为两分子键角很接近,而远大于,所以H2O分子的F2O分子的偶极距比F2O分子的偶极距大很多。不过,两分子的偶极距的方向相反,如图4.19所示。
图4.19【4.20】八面体配位的有哪些异构体?属什么点群?旋光性情况如何?解:有如下两种异构体,它们互为对应体,具有旋光性,属点群,如图4.20所示。图4.20配位结构式意图【4.21】利用表4.4.5所列有关键的折射度数据,求算分子的摩尔折射度值。实验测定醋酸折射率,密度为,根据实验数据计算出实验值并进行比较。解:摩尔折射率是反映分子极化率(主要是电子极化率)大小的物理量。它是在用折射法测定分子的偶极距时定义的。在高频光的作用下,测定物质的折光率n,代入Lorenz-Lorentz方程:即可求得分子的摩尔折射度。常用高频光为可见光或紫外光,例如钠的D线。摩尔折射率具有加和性。一个分子的摩尔折射度等于该分子中所有化学键摩尔折射度的和。据此,可由化学键的摩尔折射度数据计算分子的摩尔折射度。将用此法得到的计算值与通过测定n,d等参数代入Lorenz-Lorentz方程计算得到的实验值进行比较,互相验证。利用表中数据,将醋酸分子中各化学键的摩尔折射度加和,得到醋酸分子的摩尔折射度:R计将n,d等实验数据代入Lorenz-Lorentz方程得到醋酸分子的摩尔折射度:
R实结果表明,计算值和实验值非常接近。【4.22】用群的元进行相似变换,证明4个对称操作分四类。[提示:选群中任意一个操作为,逆操作为,对群中某一个元(例如)进行相似变换,若,则自成一类。]解:一个对称操作群中各对称操作间可以互相交换,这犹如对称操作的“搬家”。若将群中某一对称操作X借助于另一对称操作S变换成对称操作Y,即:则称Y与X共轭。与X共轭的全部对称操作称为该群中以X为代表的一个级或一类级。级的阶次是群的阶次的一个因子。若对称操作S和X满足:则称S和X这两个操作为互换操作。互换操作一定能分别使相互的对称元素复原。例如,反式-C2H2Cl2中和可使和复原。若一个群中每两个操作都是互换的,则这样的群称为互换群。可以证明,任何一个四阶的群必为互换群(读者可以用和等点群为例自行验证)。在任何一个互换群中,每个对称操作必自成一个级或类。这一结论可证明如下:设X为互换群中的任一操作,S为群中X以外的任一操作,根据互换群的性质,有:将上式两边左乘,得:这就证明了X按S变换成的对称操作仍为X。即X自成一类。点群为4阶互换群,它的4个对称操作是:。选以外的任一对称操作(例如)对进行相似变换:或(因为,故可以将第一个表示矩阵右上角的-1去掉)根据上述说明,自成一类。同理,其它3个对称操作也各自成一类。这就证明了点群的4个对称操作分4类。
【4.23】用群的元进行相似变换,证明6个对称操作分三类。证明:点群是6阶群,其乘法表如下:相应的对称图像和对称元素系表示于图4.23。图4.23(1)根据乘法表可得:(反映操作与其逆操作相等)由上题的说明可知,是相互共轭的对称操作,它们形成以为代表的一类。当然,亦可借助于以外的任一对称操作对进行相似交换,或借助于以外的任一对称操作对进行相似变换,结果相同。(2)根据乘法表得:根据(1)相同的理由,和共轭,形成一类。借助于以外的任一对称元素对进行相似变换,结果相同。(3)在任何群中,,即主操作自成一类。综上所述,群的6个对称操作分成三类,即3
个反映操作形成一类,两个旋转操作也形成一类,主操作自成一类。【4.24】试述红外活性的判据。解:严格意义上的红外光谱包括处在近红外区和中红外区的振动光谱及在远红外或微波区的转动光谱。但通常所说的红外光谱是指前者,而把后者称作远红外光谱。分子在一定条件下产生红外光谱,则称该分子具有红外活性。判断分子是否具有红外活性的依据是选择定则或称选律。具体的说:非极性双原子分子,,不产生振动-转动光谱,即无红外活性。极性双原子分子,……,,产生振动-转动光谱,即有红外活性。在多原子分子中,每一种振动方式都有一特征频率,但并非所有的振动频率都能产生红外吸收从而得到红外光谱。这是因为分子的红外光谱起源于分子在振(转)动基态和振(转)动激发态之间的跃迁。可以证明,只有在跃迁过程中有偶极距变化的振(转)动()才会产生红外光谱。偶极距改变大者,红外吸收带就强;偶极距变化小者,吸收带弱;偶极距不变者,不出现红外吸收,即为非红外活性。【4.25】试述活性的判据。解:Raman光谱的选律是:具有各向异性的极化率的分子会产生Raman光谱。例如H-H分子,当其电子在电场作用下沿轴方向变形大于垂直于键轴方向时,就会产生诱导偶极距,出现Raman光谱活性。利用群论可很方便地判断分子的哪些振动具有红外活性,哪些振动具有Raman活性。判断的标准是:(1)若一个振动隶属的对称类型和偶极距的一个分量隶属的对称类型相同,即和(或,或)隶属的对称类型相同,则它具有红外活性。(2)若一个振动隶属的对称类型和极化率的一个分量隶属的对称类型相同,即一个振动隶属于这样的二元乘积中的某一个,或者隶属于这样的一个乘积的组合,则它就具有Raman活性。【4.26】将分子或离子:,,,,,丁三烯,,等按下列条件进行归类:(a)既有极性又有旋光性;(b)既无极性又无旋光性;(c)无极性但有旋光性;(d)有极性但无旋光性。解:
(a)FHC=C=CHF(C2)(b)丁三烯(),(),()(c)(d)【4.27】写出,,,,椅式环己烷,等分子所属的点群。解:分子点群椅式环己烷【4.28】正八面体6个顶点的原子有3个被另一个原子取代,有几种可能的方式?取代产物各属于什么点群?取代后所得产物是否具有旋光性和偶极矩?解:只有下列两种取代方式,产物a属于点群,产物b属于点群。两产物皆无旋光性,而皆有偶极距。5多原子分子中的化学键【5.1】利用价电子互斥理论,说明等分子的形状。解:
分子m+n(不计电子)64456价电子空间分布八面体四面体四面体三角双锥八面体孤对电子对数20131配位原子数(电子对)44325几何构型正方形四面体三角锥直线形四方锥【5.2】利用价电子互斥理论,说明的分子和离子的几何形状,说明哪些分子有偶极矩?解:分子或离子m+n数453434价电子空间分布四面体三角双锥平面三角形四面体平面三角形四面体孤对电子对数120101配位原子数333333几何形状三角锥T形平面三角形三角锥平面三角形三角锥是否有偶极距有有无---表中分子中Cl原子周围的5对价电子按三方双锥分布,可能的形状有下面三种:孤对电子排布方式(A)(B)(C)lp-lp010lp-bp436bp-bp220(A)和(B)相比,(B)有lp-lp(孤对-孤对)排斥作用代替(A)的lp-bp(孤对-键对)相互作用,故(A)比(B)稳定。(A)和(C)比较,(C)有两个lp-bp相互作用代替了(A)的2个bp-bp相互作用,故(A)最稳定。【5.3】画出下列分子中孤对电子和键对电子在空间的排布图:(a),(b),,;(c),,,;(d),。解:这是VSEPR方法的具体应用,现将分子中孤对电子和键对电子在空间的排布图示于图5.3。
图5.3【5.4】写出下列分子或离子中,中心原子所采用的杂化轨道:,,,,,,,,,,,,。解:分子或离子几何构型中心原子的杂化轨道CS2直线形直线形三角形三角形四面体四面体八面体四方锥八面体
八面体四面体三角双锥准四面体【5.5】由,,,轨道组成等性杂化轨道,,这些轨道极大值方向按平面四方形分别和轴平行。根据原子轨道正交、归一性推出各个杂化轨道的的组合系数,验证它们是正交,归一的。解:因为4个杂化轨道是等性的,所以每一条杂化轨道的s,p和d成分依次为1/4,1/2和1/4。这些成分值即s,p和d轨道在组成杂化轨道时的组合系数的平方。据此,可求出各轨道的组合系数并写出杂化轨道的一般形式:根据题意,4个杂化轨道的极大值方向按平面四方形分别和x,y轴平行。设4个杂化轨道和的极大值方向分别在x轴的正方向、x轴的负方向、y轴的正方向和y轴的负方向,则这4个杂化轨道可写成:这4个杂化轨道是正交,归一的。归一性可用该杂化轨道的一般形式证明如下:正交性证明如下:
任选两个杂化轨道,都得同样结果。【5.6】臭氧的键角是。若用杂化轨道描述中心氧原子的成键轨道,试按键角与轨道成分的关系式计算:(a)成键杂化轨道中系数和值;(b)成键杂化轨道的每个原子轨道贡献的百分数。解:(a)根据杂化轨道的正交、归一性可得下列联立方程[在本方程中(2)作为已知条件给出]:解之,得所以,O3原子的O原子的成键杂化轨道为:ψ成而被孤对电子占据的杂化轨道为:孤可见,孤中的s成分比成中的s成分多。(b)按态叠加原理,杂化轨道中某一原子轨道所占的成分(即该原子轨道对杂化轨道的贡献)等于该原子轨道组合系数的平方。因此,和对成的贡献分别为和,即分别约为0.3108和0.6892。【5.7】为直线型对称构型,是已知最强的氢键。(a)试画出由原子轨道叠加成分子轨道的图形;
(a)画出的分子轨道能级图;(b)判断这离子是顺磁性还是反磁性;(c)估计中键的键级。提示:取键轴为轴,原子为轨道,原子用轨道(其中只有一个电子),沿轴从正负两个方向和轨道叠加,和同号想加:没有节面为成键轨道,出现一个节面为非键轨道,两个节面为反键轨道。解:(a)根据分子轨道理论,由原子轨道有效地组合成分子轨道必须满足能级高低相近、轨道最大重叠和对称性匹配等3个条件。其中对称性匹配是首要条件。因此,由原子轨道叠加成分子轨道的图形[见图5.7(a)]必须体现出轨道最大重叠和对称性匹配这两个条件,而轨道能级图[见图5.7(b)]则应当反映出参与组合的原子轨道的能级相近这一条件。以z轴为键轴,F原子的轨道(其中只有一个电子)沿z轴的正、负方向与H原子的1s轨道重叠,形成分子轨道。若两个轨道都与1s轨道同号重叠,则形成成键轨道;若一个轨道与另一个轨道异号重叠,而H原子的1s轨道不参加,则形成非键轨道;若两个轨道都与1s轨道异号重叠,则形成反键轨道。三个分子轨道都是型的,它们分别具有0,1和2个节面。由原子轨道叠加成成键分子轨道的轮廓图示于图5.7(a)中(图形未反映出轨道的相对大小)。(b)的分子轨道能级图示于图5.7(b)中。图5.7(a)成键分子轨道图图5.7(b)分子轨道能级图【5.8】直线形对称构型的离子,若成键电子只是轨道上的电子(即将电子作为原子实的一部分)。(a)画出中每个和轨道的原子轨道叠加图;(b)画出分子轨道能级图;
(c)中键的键级是多少?实验测定分子中键长为,试对计算的键级和键长的关系进行讨论。解:(a)以z轴为键轴,按简单分子轨道理论,将中和轨道的原子轨道叠加图示于图5.8(a)。图5.8(a)原子轨道叠加图(和形状一样,只是方向不同)(b)按题意,离子的分子轨道只由I原子的5p轨道叠加而成。因此,离子中只有9个分子轨道,其中3个轨道,6个轨道(成键、非键和反键轨道各两个,分别沿x,y方向分布)。16个电子按能量最低原理、Pauli原理和Hund规则排布在8个分子轨道上,能级图示于图5.8(b)中。图5.8(b)能级图(a)[I-I-I]-的总键级为(6-4)/2=1,但其中有2个I-I键,所以每个I-I
键的键级为1/2,即I原子与I原子之间只形成了半个键。这和实验测定的中I-I键长值较I2中I-I键长大,是完全一致的。离子中无不成对电子,因而它是反磁性的。【5.9】分子呈三方双锥构型,原子采用杂化轨道与原子成键。若将杂化轨道视为和两杂化轨道的组合,请先将安放在一直角坐标系中,根据坐标系和杂化轨道的正交、归一性写出原子的5个杂化轨道。解:PF5分子的坐标管子如图5.9所示。图5.9根据图中各原子轨道、杂化轨道的相应位置和空间方向以及杂化轨道的正交、归一性质,P原子的5个杂化轨道为:【5.10】有两种同分异构体,是哪两种?为什么只有一种同分异构体?解:N2H2分子中N=N为双键,不能自由旋转(因双键中轨道叠加有方向性),故有顺式和反式两种异构体,它们的结构式如下:
顺N2H2反N2H2两种异构体中N原子都用杂化轨道成键,分子呈平面形。顺-N2H2分子属点群,反-N2H2分子属点群。两者皆无旋光性。C2H2分子的C原子采用杂化轨道成键,分子呈直线形,属点群,因而它无同分异构体。C2H2分子的结构如图5.10。图5.10【5.11】试证明含、、、的有机分子,若相对分子质量为奇数。则分子中含有原子数必为奇数;若相对分子含量为偶数,则含原子数亦为偶数。论证:本题所涉及的是分子中各原子相互化合时的数量关系,其实质是共价键的饱和性。这些数量关系对于确定有机化合物的结构式很有用。分子中各个原子周围化学键数目的总和为偶数(n重键计作n个单键)。由此可推得,具有奇数个单键的原子的数目之和必为偶数,即奇数价元素的原子数之和必为偶数。在含C,H,O,N的有机物分子中,C和O是偶数价原子,H和N是奇数价原子。因此,H和N原子数之和为偶数,即H原子数为奇数时N原子数亦为奇数;H原子数为偶数时N原子数亦为偶数。含C,H,O,N的有机化合物,其相对分子质量为:式中和,分别是C,O,N和H的原子数。由于前三项之和为偶数,因而相对分子质量的奇偶性与H原子数的奇偶性一致。而上面已证明,H原子数的奇偶性与N原子数的奇偶性一致,所以,相对分子质量的奇偶性与N原子数的奇偶性一致,即相对分子质量为奇数时N原子数必为奇数;相对分子质量为偶数时N原子数必为偶数。【5.12】用HMO法解环丙烯正离子的离域键分子轨道波函数,并计算键键级和原子的自由价。解:(1)的骨架如图5.12(a)所示:
图5.12(a)按LCAO,其离域键分子轨道为:式中为参与共轭的C原子的p轨道,为变分参数,即分子轨道中C原子的原子轨道组合系数,其平方表示相应原子轨道对分子轨道的贡献。按变分法并利用HMO法的其本假设进行简化,可得组合系数应满足的久期方程:用除各式并令,则得:欲使为非零解,则必须使其系数行列式为零,即:解此行列式,得:将值代入,得:能级及电子分布如图5.12(b)。图5.12(b)将代入久期方程,得:
解之,得:。根据归一化条件,,求得:将代入久期方程,得:即:利用分子的镜面对称性,可简化计算工作:若考虑分子对过的镜面对称,则有:根据归一化条件可得:波函数为:若考虑反对称,则。根据归一化条件可得:波函数为:所以,的离域键分子轨道为:三个分子轨道的轮廓图示于图5.12(c)中(各轨道的相对大小只是近似的)。
图5.12(c)在已经求出和关系式的基础上,既可根据“每一碳原子对各分子轨道的贡献之和为1”列方程组求出和,也可以利用正交性求出和。此不赘述。(2)共轭体系中相邻原子间键键级为:式中和分别是第个分子轨道中和的原子轨道组合系数,则是分子轨道中的电子数。中有2个电子,基态时都在上。所以键键级为:(3)既然,各C原子的自由价必然相等,即:【5.13】用HMO法求丙二烯双自由基的型分子轨道及相应的能量,并计算键键级。解:(1)求分子轨道及相应的能量。方法1:中有2个互相垂直的离域键。对每一个,简化的久期方程为:用除式中各项并令,得:欲使不全为零,则必须使其系数(此处系数是指,因为是要求的未知数)行列式为0,即:解之,得。将值代入,得:中2个的分子轨道的能级及基态电子分布如图5.13(a)。
图5.13(a)2个中电子的总能量为:总因而丙二烯双自由基的离域能为:将代入久期方程,得:将此三式与归一化条件式联立,解之,得:由此得第一个分子轨道:同法,可求出分别与和对应的另两个分子轨道:的三个分子轨道的轮廓图示于图5.13(b)中。图5.13(b)各轨道的大小、正负号、对称性、节面等性质可根据轮廓图进行讨论。在用本法求共轭体系的型分子轨道时,更简捷的做法是直接从写含的久期行列式开始。设相应于某一原子的元为,则与该原子相连原子的元为1,不相连原子的元为0。解行列式,求出。将各值代入含和的久期方程,结合归一化条件,即可写出各原子轨道的组合系数,进而写出各分子轨道。将值代入,即可求出与各分子轨道相应的能量。方法2:将分子中各C原子编号并根据编号写出久期方程:
123其中,为C原子p轨道(下面用表示)的组合系数,而。根据分子的镜面()对称性将久期方程简化。考虑对称,则,久期方程简化为:系数行列式为:解之,得。将代入简化的久期方程,得:结合归一化条件,可得:由此得分子轨道:将代入,得。将代入简化的久期方程,得:结合归一化条件,得:由此得分子轨道:将代入,得。考虑反对称,则,由此推得。将代入,得。根据归一化条件,可推得:
由此得分子轨道:总之,丙二烯双自由基的3个分子轨道及相应的能量分别为:比较上述两法可见,其难易、繁简程度差别不大,这是因为丙二烯双自由基分子中的共轭键较小,其久期行列式阶数低,解起来并不困难,但对于一个含较大共轭键的体系,其久期方程复杂,久期行列式阶数高,用通常的方法按部就班地求解很复杂。在此情况下,要应用对称性概念化简久期方程,分别求解简化了的行列式,结合归一化条件求出原子轨道组合系数,进而求出各分子轨道。读者可通过C6H6的HMO处理体会用对称性概念和方法处理这类问题的优越性。(1)计算键键级对于一个,C原子1和2(亦即2和3)间键键级为:因此,丙二烯双自由基中原子间总键键级为:【5.14】说明的几何构型和成键情况;用HMO法求离域键的波函数及离域能。解:叠氮离子是CO2分子的等电子体,呈直线构型,属点群。中间的N原子以sp杂化轨道分别与两端N原子的轨道叠加形成2个键。3个N原子的轨道相互叠加形成离域键,轨道相互叠加形成离域键。成键情况示于下图:对一个,久期方程为:方程中和是分子轨道中原子轨道(p轨道)的组合系数。欲使组合系数不全为0,则必使的行列式为0,即:解此行列式,得:
将代入久期方程,得:结合归一化条件,得:由此得分子轨道为:相应的能量为。同法,得另外2个分子轨道及相应的能量:的2个中的电子的能量为:按生成定域键计算,电子的总能量为:所以的离域能为:【5.15】已知三次甲基甲烷为平面形分子,形成键。试用HMO法处理,证明中心碳原子和周围3个碳原子间的键键级和为。提示:列出久期行列式,解得,0,0,,然后再求。解:画出分子骨架并给各C原子编号,如图5.15(a)。图5.15(a)根据Huckel近似,写出相应于此骨架的久期方程如下:
利用分子的对称性将久期方程化简,求出,代回久期方程,结合归一化条件求出组合系数,进而写出分子轨道。将,可求出与分子轨道相应的能级。考虑对镜面Ⅰ和Ⅱ都对称,则有,于是久期方程可化简为:令其系数行列式为:解之,得。将代入简化的久期方程并结合归一化条件,得:由此可得分子轨道:相应的能量为:将代入简化的久期方程并结合归一化条件,得:由此可得分子轨道:相应的能量为:考虑镜面Ⅱ反对称,有。代入久期方程后可推得。将代入,得。根据归一化条件推得,分子轨道为:考虑镜面Ⅱ是对称的,有,代入久期方程后推得。根据归一化条件,得。由此可得分子轨道:
相应的能量为:总之,按能级从高到低的顺序排列,的4个分子轨道及其相应的能级为:能级及电子的分布如图5.15(b)所示。图5.15(b)由分子轨道和电子排布情况可计算C原子之间键的键级:因而,中间C原子和周围3个C原子间键键级之和为:加上3个键,中心C原子的总成键度为:这是C原子理论上的最高成键度(虽然有人主张用根据丙二烯双自由基计算得到的C原子的最大成键度作为C原子的最大成键度,但由于该分子不具代表性,因而仍未被多数人采纳)。【5.16】某富烯的久期行列式如下,试画出分子骨架,并给碳原子编号。解:
【5.17】用前线轨道理论分析加反应,说明只有使用催化剂该反应才能顺利进行。解:基态CO分子的HOMO和LUMO分别为和,基态H2分子的HOMO和LUMO分别为和。它们的轮廓图示于图5.17(a)。图5.17(a)CO和H2的前线轨道轮廓图由图可见,当CO分子的HOMO和H2分子的LUMO接近时,彼此对称性不匹配;当CO分子的LUMO和H2分子的HOMO接近时,彼此对称性也不匹配。因此,尽管在热力学上CO加H2(生成烃或含氧化合物)反应能够进行,但实际上,在非催化条件下,该反应难于发生。图5.17(b)CO和H2在Ni催化剂上轨道叠加和电子转移情况若使用某种过度金属催化剂,则该反应在不太高的温度下即可进行。以金属Ni为例,Ni原子的d电子转移到H2分子的LUMO上,使之成为有电子的分子轨道,该轨道可与CO分子的LUMO叠加,电子转移到CO分子的LUMO上。这样,CO加H2反应就可顺利进行。轨道叠加及电子转移情况示于图5.17(b)中。Ni原子的d电子向H2分子的LUMO转移的过程即H2分子的吸附、解离而被活化的过程,它是CO加H2反应的关键中间步骤。【5.18】用前线轨道理论分析加热或光照条件下,环己烯和丁二烯一起进行加成反应的规律。解:环己烯与丁二烯的加成反应和乙烯与丁二烯的加成反应类似。在基态时,环己烯的型HOMO与丁二烯的型LUMO对称性匹配,而环己烯的型LUMO与丁二烯的型HOMO对称性也匹配。因此,在加热条件下,两者即可发生加成反应:前线轨道叠加图示于图5.18中。
图5.18环己烯和丁二烯前线轨道叠加图在光照条件下,电子被激发,两分子激发态的HOMO与LUMO对称性不再匹配,因而不能发生加成反应(但可发生其他反应)。5.19用前线轨道理论分析乙烯环加成变为环丁烷的反应条件及轨道叠加情况。解:在加热条件下,乙烯分子处在基态,其HOMO和LUMO分别为和。当一个分子的HOMO与另一个分子的LUMO接近时,对称性不匹配,不能发生环加成反应,如图5.19(a)。图5.19(a)图5.19(b)但在光照条件下,部分乙烯分子被激发,电子由轨道跃迁到轨道,此时轨道变为HOMO,与另一乙烯分子的LUMO对称性匹配,可发生环加成反应生成环丁烷,如图5.19(b)。5.20试用分子轨道对称守恒原理讨论己三烯衍生物电环合反应在光照和加热条件下产物的立体构型。解:分子轨道对称守恒原理的基本思想是,在一步完成的反应中,若反应物的分子轨道和产物的分子轨道对称性一致,则该反应容易进行。换言之,若整个反应体系从反应物、中间态到产物,分子轨道始终保持某一点群的对称性,则该反应容易进行。己三烯衍生物电环合为环己二烯衍生物是一步完成的单分子反应。若顺旋闭环,则反应自始至终保持着点群对称性;若对旋闭环,则反应自始至终保持着点群的对称性。因此,对这两种闭环方式,应分别按轴和镜面对反应物和产物的分子轨道进行分类。分类情况见轨道能级相关图(图中S和A分别表示对称和反对称)。在讨论反应条件、关环方式及产物的立体构型时,只需考虑那些参与旧键断裂和新键形成的分子轨道,并且把它们作为一个整体一起考虑。对产物而言,和间形成的轨道以及和,和间形成的轨道是反应中所涉及的分子轨道。根据节面数目的多少,确定反应物和产物分子轨道的能级次序(这是一种简便的方法,其结果与由计算得到的能级次序一致)。根据反应物的分子轨道与产物的分子轨道一一对应、相关轨道的对称性相同并且能量相近以及对称性相同的关联线不相交等原则,作出己三烯电环合反应的分子轨道能级相关图,如图5.20所示。
图5.20己三烯电环合反应分子轨道能级相关图由图可见,在进行顺旋闭环时,反应物的成键轨道与产物的反键轨道相关联,而产物的成键轨道却与反应物的反键轨道相关联,这说明反应物必须处在激发态(即电子由被激发到)才能转化为产物的基态。因此,顺旋闭环需在光照条件下进行,得到反式产物。而在对旋闭环时,反应物的成键轨道与产物的成键轨道相关联,反应物处于基态就可直接转化为产物,反应活化能较低,在一般加热条件下即可进行,得到顺式产物。总之,根据分子轨道对称守恒原理,己三烯衍生物电环合为环己二烯衍生物(有)的反应具有鲜明的立体选择性。在加热条件下,分子保持镜面对称,进行对旋闭环,得顺式产物。在光照条件下,分子保持轴对称性,采取顺旋闭环,得反式产物。5.21试分析下列分子中的成键情况,比较Cl的活泼性,说明理由。H3CCl;;解:(a)H3CCl:该分子为CH4分子的衍生物。同CH4分子一样,C原子也采用杂化轨道成键。4个杂化轨道分别与3个H原子的1s轨道及Cl原子的3p轨道重叠共形成4个键,分呈四面体构型,属点群。(b):该分子为分子的衍生物,其成键情况与C2H4分子的成键情况既有相同之处又有差别。在C2H3Cl分子中,C原子(1)的3个杂化轨道分别与两个H原子的1s轨道和C原子(2)的杂化轨道重叠形成3个键;C原子(2)的3个杂化轨道则分别与H原子的1s轨道、Cl原子的3p轨道及C原子(1)的杂化轨道重叠共形成3个键。此外,两个C原子和Cl原子的相互平行的p轨道重叠形成离域键。成键情况示于下图:
C2H3Cl分子呈平面构型,属于点群。的形成使键缩短,Cl的活泼性下降。(c):该分子为C2H2分子的衍生物。其成键情况与C2H2分子的成键情况也既有相同之处又有差别。在C2HCl分子中,C原子采取sp杂化。C原子的sp杂化轨道分别与H原子的1s轨道(或Cl原子的3p轨道)及另一个C原子sp杂化轨道共形成两个键。此外,C原子和Cl原子的p轨道(3个原子各剩2个p轨道)相互重叠形成两个离域键:和。分子呈直线构型,属于点群。两个的形成使C2HCl中键更短,Cl原子的活泼性更低。根据以上对成键情况的分析,键键长大小次序为:5.22试分析下列分子中的成键情况,指出键键长大小次序,并说明理由。解:在C6H5Cl分子中,一方面,C原子相互间通过杂化轨道重叠形成键,另一方面,一个C原子与一个Cl原子间通过轨道重叠形成键。此外,6个C原子和Cl原子通过p轨道重叠形成垂直于分子平面的离域键。由于Cl原子参与形成离域键,因而其活性较低。在C6H5CH2Cl分子中,苯环上的C原子仍采用杂化轨道与周边原子的相关轨道重叠形成键,而次甲基上的C原子则采用杂化轨道与周边原子的相关轨道重叠形成键。此外,苯环上的6个C原子相互间通过p轨道重叠形成离域键:。在中性分子中,次甲基上的C原子并不参与形成离域键,但当Cl原子被解离后,该C原子的轨道发生了改组,由杂化轨道改组为杂化轨道,此时它就有条件参加形成离域键。因此,在[C6H5CH2]+中存在。由于电子的活动范围扩大了,的能量比的能量低,这是C6H5CH2Cl分子中的Cl原子比C6H5Cl分子中的Cl原子活性高的另一个原因。在分子中,苯环上的C原子采用杂化轨道与周边原子的相关轨道重叠形成键,而非苯环上的C原子则采用杂化轨道与周边原子的相关轨道重叠形成键。这些键和各原子核构成了分子骨架。在中性分子中,非苯环上的C原子不参与形成离域键,分子中有2个。但当Cl原子解离后,该C原子形成键所用的杂化轨道由改组为,于是它就有条件参与共轭,从而在中形成更大的离域键。这使得分子中的Cl原子更活泼。在分子中,C原子形成键的情形与上述两分子相似。非苯环上的C原子也不参与共轭,分子中有3个。但Cl原子解离后,非苯环上的C原子改用杂化轨道形成键,剩余的p轨道与18个C原子的p轨道重叠,形成更大更稳定的离域键
,这使得分子中的Cl原子在这4个分子中最活泼。综上所述,Cl原子的活泼性次序为:5.23试比较,和丙酮中键键长大小次序,并说明理由。解:三个分子中碳-氧键键长大小次序为:丙酮丙酮分子中的碳-氧键为一般双键,键长最长。CO2分子中除形成键外还形成两个离域键。虽然碳-氧键键级也为2,但由于离域键的生成使键能较大,键长较短,但比一般三键要长。在CO分子中,形成一个键,一个键和一个配键,键级为3,因而碳-氧键键长最短。丙酮、CO2和CO分子中碳-氧键键长分别为121pm,116pm和113pm。5.24苯胺的紫外可见光谱和笨差别很大,但其盐酸盐的光谱和苯相近,解释这现象。解:通常,有机物分子的紫外可见光谱是由电子在不同能级之间的跃迁产生的。苯及简单的取代物在紫外可见光谱中出现三个吸收带,按简单HMO理论,这些吸收带是电子在最高被占分子轨道和最低空轨道之间跃迁产生的。苯分子中有离域键,而苯胺分子中有离域键。两分子的分子轨道数目不同,能级间隔不同,电子的状态不同,因而紫外可见光谱不同,但在分子中,N原子采用杂化轨道成键,所形成的离域键仍为,所以其紫外可见光谱和苯相近。5.25试分析下列分子中的成键情况,比较其碱性的强弱,并说明理由。解:碱性的强弱和提供电子对能力大小有关,当N原子提供孤对电子的能力大,碱性强。分子的几何构型和有关性质主要决定于分子中骨干原子的成键情况。下面将分析4个分子中的骨干原子特别是N原子的成键轨道以及所形成的化学键的类型,并结合有关原子或基团的电学性质,比较N原子上电荷密度的大小,从而推断出4个分子碱性强弱的次序。分子C原子成键所用轨道-N原子成键所用轨道N原子成键类型及数目有关原子或基团电学性质甲基的推电子作用使N原子上的电荷密度增大N原子的孤对电子参加形成键比左边两个电荷密度低除参加形成外,O原子电负性大,拉电子作用使N原子上的电荷密度下降碱性强弱较强最强较弱最弱4.754.29.3812.605.26下列化合物的值列于相应结构式的括号里,试从结构上解释它们的大小。
解:F是电负性最高的元素,F原子的极强的吸电子能力以及羰基的诱导作用,使分子中的羰基O原子的正电性增强,从而对H原子的吸引力减弱而使其易于解离。当H原子解离后,生成的阴离子中形成离域键,大大增强了该阴离子的稳定性。因此,具有很强的酸性。分子中的H原子解离后,生成的阴离子中存在着稳定的离域键,这是该分子具有强酸性的原因之一。是强吸电子基团(其吸电子能力比基团稍强),它的吸电子作用以及羰基的诱导作用使羰基O原子的负电性降低从而使H原子易于解离。这是具有强酸性的原因之二。但是,由于分子较大,的吸电子作用传递到对位的羟基上时已减弱。所以,尽管分子也具有强酸性,但其酸性比弱。在分子中,羰基具有诱导作用,且H原子解离后生成具有离域键的稳定阴离子,因而也具有较强的酸性。在分子中,无吸电子基团,只是H原子解离后生成的阴离子具有离域键,因而该分子具有酸性,但酸性较弱。分子中不存在任何是羟基上的H原子易于解离的因素(中无离域键),因而它的酸性极弱,基本上为中性。5.27分子中碳—碳键长比乙烷中碳—碳键长短越,试述其结构根源。解:在分子中,C原子采用杂化。其中一个杂化轨道与另一个C原子的杂化轨道叠加形成C-C键,另一个杂化轨道与N原子的轨道叠加形成C-N键,分子呈直线构型。分子骨架(含3个键)及两端孤对电子可简示为。此外,分子中4个原子皆剩余2个p轨道(),每个p轨道上只含一个电子。这些p轨道沿着z轴(键轴)“肩并肩”地重叠,形成两个离域键:和。分子的成键情况可表示为:由于C原子间除形成键外还有离域键,因而分子中的碳—碳键级比乙烷分子中的碳—碳键键级大,而键长则缩短。分子的分子轨道图示于图5.27中,4个电子填充在两个成键分子轨道(和)上。和的情况相似。
图5.27C2N2的分子轨道图5.28对下列分子和离子,,,,,,等,判断它们的形状,指出中性分子的极性,以及每个分子和离子的不成对电子数。解:根据价键理论(特别是杂化轨道理论)和分子轨道理论(包括离域键理论)分析诸“分子”的成键情况,即可推断它们的形状、极性和不成对电子数。兹将结果列于下表:分子或离子成键情况几何构型点群极性情况不成对电子数直线形非极性0直线形—0弯曲形极性1弯曲形—0弯曲形极性0弯曲形极性1弯曲形极性05.29指出,,中键的相对长度,并说明理由。解:三个“分子”中N-O键的相对长度次序为:理由简述如下:在离子中,N原子除采用sp杂化轨道成键外,还与2个O原子共同形成2个离域键,键级较大,从而使N-O键大大缩短。有人认为,由于N原子采用的杂化轨道中s成分较高而导致了N-O键键长缩短,这似乎不妥。而在分子和离子中,N原子采用杂化轨道与O原子形成键,此外还形成1个离域键,键级较小,因而N-O键相对长些。在分子中,N原子的一个
杂化轨道上只有一个孤电子,它对键对电子的排斥作用较小,使得键角相对较大而键长相对较小。而在中,N原子的一个杂化轨道上有一对孤对电子,它们对键对电子的排斥作用较大,使得键角相对较小而键长相对较大。有人从此比较分子和离子键键级的相对大小出发来说明两者N-O键长的差别,但论据不是很有力。从分析成键情况出发,对3个“分子”的键参数相对大小的预测与列于下表的实验结果一致。分子或离子键角值键长/pm115.4120.1123.65.30分子中原子排成三方双锥多面体,试计算它的数码,并画出它的结构式。解:封闭式硼烷的s和均为0,数据为0330,即中有3个B-B共价单键和3个3c-2e键。结构式可写为:5.31计算封闭式分子的数码,用硼烷结构所遵循的规则,说明它不可能稳定存在的理由。解:解:封闭式硼烷的s和均为0,数据为0330,即中有3个B-B共价单键和2个3c-2e键。它的结构式为:
这种结构违背了:“两个B原子不能同时通过二中心B-B键和3中心BBB键结合”的规则。所以不能稳定存在,迄今没有制得这种化合物。5.32已知分子的键能为,而原子和分子的第一电离能分别为1250和1085,试计算的键能,并讨论和哪一个键能大,说明理由。解:在0.1013Mpa,298K时,双原子分子的解离能即它的键能,可直接从热化学测量中得到。根据热力学第一定律,利用本题所给数据,设计下列循环,即可求得的键能。由计算结果可见,的键能大于的键能。这是因为比少一个反键()电子,键级增大(1.5)的缘故。当然,的有效核电荷比大,原子轨道重叠程度大,使键强度增大,也是一个原因。5.33苯、环己烯、环己烷和的燃烧热分别为3301.6,3786.6,3953.0和285.8,试计算苯的离域能。解:离域能是由共轭效应引起的。按照HMO法,苯分子中6个C原子的p轨道组合成6和离域键分子轨道,其中成键轨道和反键轨道各占一半。分子轨道能级和电子排布如下图所示:按此电子排布,体系中电子的总能量为:而根据定域键的经典结构,苯分子中生成3个2c-2e键,电子的总能量为:因此,生成离域键比生成3个定域键体系中电子的总能量降低了(即键能增加了),此能量降低值即苯的离域能或称共振能。苯的离域能相当于环己烯氢化热的3倍与苯氢化热的差值,即环己烯苯这一过程的。据此,利用题中所给的热化学参数,即可按以下步骤计算出苯的离域能。
5.34的生成热,键键能为,而和的解离能分别为436和495,试求键的键能?解:下式表示的生成:分子中包含一个O-O键和2个三电子键,键级为2,相当于1个双键。的解离能是打开此双键所需要的能量,当然不等于O-O单键的键能。5.35为什么存在和,而不存在,为什么存在,而不存在?解:根据价键理论和分子轨道理论,原子的成键数目主要取决于该原子能够提供的符合成键条件的原子轨道数目。C,N,O都是第二周期的元素,它们的原子都只有4个价层轨道,最多可形成4个共价单键。不管这些原子以纯原子轨道还是以杂化轨道参与成键,与之以单键相结合的配位原子数最大为4。这是由共价键的饱和性所决定的。因此,和都可存在,而和不存在。在中,O原子的杂化轨道与H原子的1s轨道重叠形成键,离子呈三角锥形,属点群。作为一种理解,的形成可用下式表示:由于O原子的半径较小,已带正电荷,剩下的杂化轨道上的孤对电子很难再接受质子而生成。的成键情况与相似,只是几何构型不同、所属点群不同而已(属点群)。
对于第三周期的元素,其原子有9个价层轨道,理论上最多可形成9个共价单键,但d轨道能否有效地参加成键,还要看它的分布情况。若d轨道分布弥散,离核较远,则成键效率低,或根本不能参与成键;反之,则可有效地参与成键。分子的成键情况属于后者,又由于S原子的半径较大,周围有足够的空间容纳6个配位原子,因而分子能够稳定地存在。在该分子中,S原子以杂化轨道与F原子成键,分子呈正八面体构型,属于点群。这样的结构决定了的某些性质,如它是绝缘性能良好的液体,可作变压器油。5.36为一椭球形分子,它有12个五元环的面,25个六元环的面,试计算它的棱数和键数。平均而言,每个棱的键数是多少?若按价键结构表达,单键和双键的数目各多少?碳原子的键长值处在什么范围?解:按Euler公式,棱数(E)为:按键数(b)计算公式得:平均而言,每条棱的键数为(140/105)=。按价键结构表达相当于70条C-C单键和35条C=C双键。中每条棱的平均键数和相同,都为,键长值在之间。5.37下图示出氙的氟化物和氧化物的分子(或离子)的结构。图中:(a),(b),(c),(d),(e)(f),(g),(h),(),(j)(k),(),(m),(n),(o)(a)根据图形及理论,指出分子的几何构型名称和所属点群;(b)原子所用的杂化轨道;(c)原子的表现氧化态;(d)已知在加合物晶体中,两种分子的构型与单独存在时的几何构型相同,不会相互化合成,从中说明什么问题?解:(a),(b),(c)题的答案列于下表:化合物分子几何构型分子点群Xe的杂化轨道氧化态(a)四面体形8(b)三角锥形6(c)马鞍形6(d)三方双锥形8
(e)马鞍形6(f)四方锥形6(g)T形4(h)八面体形8(i)平面四方形4(j)变形八面体6(k)四方锥形6(l)平面五角形4(m)直线形2(n)V形2(o)立方体形6图5.37氙的氧化物和氟化物的分子结构(d)在
加和物晶体中,两种分子的几何构型依然保持单独存在时的情况,说明它们都很稳定,不会化合成或形成的结构。6配位化合物的结构和性质【6.1】写出下列配合物中各配位体提供给中心金属原子的电子数目,计算中心原子周围的价电子总数:(a)(b)(c)(d)解:(a)每个配位体提供给Fe原子5个电子,Fe原子周围18个电子。(b)每个CN-提供给Ni+2个电子,Ni周围18个电子。(c)每个Cl原子提供1个电子,提供2个电子,Pt原子周围16个电子。(d)每个en提供4个电子,每个Cl-提供2个电子,周围18个电子。【6.2】计算下列配合物中金属原子的配位数:(a)(b)(c)(d)解:(a)8,(b)4,(c)6,(d)6【6.3】判断下列配位离子是高自旋还是低自旋型,画出d电子排布方式,计算(用表示):(a)(b)(c)解:兹将各项结果列于下表:配位离子d电子排布自旋情况HSLSHSLFSE()02.40【6.4】试给出配位离子的分子轨道能级图,指出配位离子生成前后电子的配布,并在能级图上表明分裂能位置。解:
【6.5】已知的为,为;上午为,为,试说明这两离子的电子排布。解:23000137002200030000HS或LSLSHSd电子排布【6.6】解释为什么水溶液中八面体配位的不稳定,而八面体配位的却稳定。解:水是弱场配位体,故为高自旋配位离子(),其d电子排布为,配位场稳定化能为。处在轨道上的电子易失去,失去后配位场稳定化能增大为。这就是不稳定的原因。另外,它还容易发生Jahn-Teller畸变。中d电子排布为,配位场稳定化能为,反键轨道上无电子,是较稳定的原因。该配位离子不发生Jahn-Teller畸变。【6.7】解释为什么大多数的配位化合物都是无色的。解:的3d轨道已充满电子,它通常以杂化轨道形成配位键,无d-d能级跃迁。因此,其配位化合物一般是无色的。【6.8】作图给出下列每种配位离子可能出现的异构体:(a) (b) (c)
解:可能出现的异构体如图6.8所示。【6.9】许多的配位化合物为平面四方形结构,试写出的轨道能级排布及电子组态。解:为构型,在平面四方形配合物中d轨道的能级分裂及电子排布情况如下:【6.10】利用配位场理论考虑下列配位离子的结构及不成对电子数。(a) (b) (c) (d)(e) (f) (g)解:离子D电子数形状D电子排布不成对电子数四面体2正方形0四面体2八面体1
八面体3八面体1正方形0一个配位离子究竟采取何种几何构型,主要取决于它在能量上和几何上是否有利。对于六配位的离子,比较容易判断,只是有时需要考虑是否会发生Jahn-Teller效应。但对于四配位的离子,因素复杂些,判断起来费点脑筋。本题中的离子,从配位场稳定化能来看,采取正方形()比采取四面体形()有利。但由于(Ⅴ)半径较小(47pm),若采用正方形构型,则配体之间的排斥力较大,不稳定;若采取四面体构型,则配体之间的排斥力减少,离子较稳定[此时(Ⅴ)的半径也略有增大]。在配离子中,尽管属构型,但由于它的半径仍较小,而的半径较大()且电负性也较大,因而采取正方形构型时配体之间的斥力太大。而采取四面体构型可使斥力减少,因而稳定。同是构型的和,它们分属第二和第三长周期,半径较大,周围有较大的空间,此时配位场稳定化能是决定配位离子几何构型的主要因素。由于采取正方形构型比采取四面体构型可获得较大的配位场稳定化能,因而它们的四配位离子[如和]一般采取平面四方形,呈反磁性。【6.11】解释为什么极易氧化为。解:按分子轨道理论近似处理,Co原子的9个价层轨道(3d,4s,4p)和的10个分子轨道(每个环提供5个)组合成为的19个分子轨道。基态时19个电子(10个来自两个,9个来自Co原子)填充在能级较低的前10个分子轨道上,其中能级最高的4个分子轨道及d电子的排布情况如下:处在高能级轨道上的电子易失去,所以易被氧化成为。【6.12】用效应说明下列配位离子中哪些会发生变形。(a) (b) (c) (d)(e) (f)解:Jahn-Teller效应的大意是:在对称的非线型配合物中,若出现简并态,则该配合物是不稳定的。此时它必然会发生变形,使其中一个轨道能级降低,消除简并,获得额外的稳定化能。对过度金属配合物来说,产生Jahn-Teller效应的根源是中心原子d电子分布的不对称性。对于六配位的配合物,d电子的构型为和时,其电子分布是球对称的,最稳定的几何构型是正八面体。d电子的构型为和
时,其分布是八面体对称,配合物也呈正八面体构型。若d电子分布不对称,则配合物将发生畸变,产生长键和短键之别。若d电子分布的不对称涉及到能级较高的轨道,则畸变程度大;若d电子分布的不对称只涉及到能级较低的轨道,则畸变程度小。具体情况是:d电子构型为和时,配合物发生小畸变;d电子构型为和时,配合物发生大畸变。根据上述分析,和会发生较大的变形;会发生较小变形;若为四面体,则会发生变形。【6.13】作图示出离子中和间化学键的轨道叠加情况(注明各用什么轨道、形成什么键及电子的提供情况),并回答:(a)和间化学键对碳-碳键强度有什么影响?(b)是否符合18电子规律?解释其原因。解:和间的化学键是配键。其形成情况示于图6.13:由图可见,的空的杂化轨道与的分子轨道叠加,由提供电子,形成配键(左图)。而的充满电子的d轨道与的轨道叠加,由提供d电子,形成配键(右图)。这种成键方式及电子的授受作用,既避免了由于键的形成而使电荷过分集中到金属原子上,又加强了和分子的结合,并使具有特定的几何构型。(a)和间配键的电子授受作用,相当于把的轨道上的电子抽调到轨道上,因而削弱了碳-碳键强度。在自由的分子中,碳—碳键长为133.7pm,而在中,碳—碳键键长增大为137.1pm。相应地,自由分子中碳—碳的伸缩振动波数为,而在中,碳—碳键的伸缩振动波数减小到。(b)在平面正方形配位场中,能级太高,一般无电子占据该轨道,这使得不符合18电子规律,周围只有16个电子。
【6.14】写出下列分子的结构式,使其符合18电子规则:(a) (b)(羰基成桥)(c) (d)(e)0(有2个单键,1个双键)解:(a)每个V原子周围的价电子数为:5(V原子本身的电子)+1(由金属键摊到的)+26(6个配体提供的)=18(b)每个Ni原子周围的价电子数为:10+2+1+5=18(c)每个Cr原子周围的价电子数为:6++3+5=18(d)每个Mo原子周围的价电子数为:6(Mo原子本身的电子)+5(由Cp提供)+(由CO提供)+2(由金属键提供)+1(由S原子提供)=18(e)与4个CO相连的Re原子周围的价电子数为:7(Re原子本身的)+1(H原子提供的)+(4个CO提供的)+(两个Re—Re键各提供一个)=18与3个CO相连的Re原子周围的价电子数为:7(Re原子本身具有的)+1(H原子提供的)+1(由Re—Re单键提供)+2(由Re—Re双键提供)+(由3个CO提供)+1(外来电子)=18【6.15】硅胶干燥剂常加入(蓝色),吸水后变为粉红色,试用配位场理论解释其原因。解:为组态。在无水中,受配体的作用d轨道能级发生分裂,7个d电子按电子排布三原则填充在分裂后的轨道上。当电子发生d-d跃迁时,吸收波长为的红光,因而显示蓝色。但吸水后,变为,即由相对较强的配体取代了相对较弱的,引起d轨道分裂能变大,使电子发生d-d跃迁时吸收的能量增大,即吸收光的波长缩短(蓝移)。吸收波长为的蓝光,因而呈粉红色。
【6.16】尖晶石的化学组成可表示为,氧离子紧密堆积构成四面体空隙和八面体空隙。当金属离子占据四面体空隙时,称为正常尖晶石;而当占据八面体空隙时,则称为反式尖晶石。试从配位场稳定化能计算结果说明,是何种尖晶石结构。解:若占据四面体空隙,则其d电子的组态为。此时配位场稳定化能为:若占据八面体空隙,则其d电子的组态为。此时配位场稳定化能为:显然,,所以占据八面体空隙,采取反式尖晶石结构。【6.17】某学生测定了三种配合物的跃迁光谱,但忘记了贴标签,请帮他将光谱波数与配合物对应起来。三种配合物是:,以及;三种光谱波数是:,和。解:d-d跃迁光谱的波数与配位场分裂能的大小成正比:。而分裂能大小又与配体的强弱及中心离子的性质有关。因此,光谱波数与配体强弱及中心离子的性质有关。而在这三种配合物中,中心离子及其电子组态都相同,因此光谱波数只取决于各自配体的强弱。配体强者,光谱波数大;反之,光谱波数小。据此,可将光谱波数与配合物对应起来:【6.18】试画出三方柱形的配合物的全部几何异构体。解:【6.19】写出羰基配合物的结构式,说明它是否符合18电子规则。已知端接羰基的红外伸缩振动频率为,而架桥羰基的振动频率为,解释原因。解:该羰基配合物的结构式如图6.19。每个Fe原子周围的价电子数为:8+(端接CO提供)+(桥式CO提供)+1(Fe-Fe键提供)=18,即结构式符合18电子规则。
相对于端接CO,桥上的CO同时与2个Fe原子配位,其反键轨道同时接受来自2个Fe原子的d电子,形成较强的反馈键,CO键级下降更多,故其红外伸缩振动频率更低。【6.20】二氯二氨合铂有两种几何异购体,一种是顺式,一种是反式,简称顺铂和反铂。顺铂是一种常用的抗癌物,而反铂没有抗癌作用。(a)写出顺铂和反铂的结构式;(b)若用二氨基环丁烯二酮代替2个与铂配位,则生成什么结构的化合物,有无顺反异构体?分析化合物中原子的成键情况;(c)若把二氨基环丁烯二酮上的双键加氢然后再代替两个与铂配位,则生成什么化合物?写出其结构式。该化合物有无键形成?解:(a)(b)用1,2-二氨基环丁烯二酮与铂原子配位,只生成顺式配合物,其结构式为:Pt原子用杂化轨道分别与Cl原子的p轨道与N原子的杂化轨道叠加形成4个键。Pt原子、Cl原子和N原子处在一个平面上。该平面与C,O原子所在的平面交成一定角度。(c)该化合物无配键。【6.21】把亚铜盐分散到分子筛表面上可制得固体吸附剂,它能够把从工业废气中吸附下来,从而避免了对环境的污染,解吸后又可获得高纯。试从表面化学键的形成说明吸附剂的作用原理。
解:烯烃可与生成稳定的配位化合物而烷烃却不能。因此,当它们的混合物通入银盐溶液时,两者即可被分离。现以乙烯与的结合为例予以说明:乙烯分子中有成键的轨道和反键的轨道。的外层电子组态为。当乙烯分子和结合时,乙烯分子的轨道和的5s空轨道叠加,乙烯的电子进入的5s轨道而形成键。与此同时,乙烯分子的轨道和的d轨道(如)叠加,的d电子进入乙烯分子的轨道,形成键。这样,在乙烯分子和间形成了配键。其他烯烃和的结合情形与乙烯相似。配键的形成使烯烃和形成稳定的化合物,从而使烯烃和烷烃分离。【6.22】把亚铜盐分散到分子筛表面上可制得固体吸附剂。它能够把CO从上业废气中吸附下来,从而避免了对环境的污染.解吸后又可获得高纯CO。试从表面化学键的形成说明CO吸附剂的作用原理。解:大量实验表明,某些亚铜盐(例如CuCl)能够自发地分散到分子筛的内、外表面,形成单层或亚单层。乍一看来,这是不可思议的。因为按热力学观点,固体的分散必将引起表面积和自由能的增加,因而它不应该是自发过程。但是,注意到载体的作用,这一现象就容易理解了。上述固体吸附剂中除含亚铜盐外,还有具有相当大比面积的稳定的分子筛。在此情况下,体系的总表面积和自由能将不增加。相反,总自由能由于亚铜盐离子和载体的表面原子间形成的表面化学键或离子和表面偶极子的相互作用而降低。而且,由于三维结构变为二维结构,熵将增加(这于气—固吸附和液—固吸附不同)。因此,从热力学上看,亚铜盐在分子筛表面上的分散应该是自发过程,从动力学上看,原子沿载体表面扩散比向载体内部扩散容易得多,即原子表面扩散活化能比体相扩散活化能小得多。因此,在不太高的温度下,即可通过固—固吸附实现亚铜盐在分子筛表面的分散,从而制得固体吸附剂。当CO分子接近该吸附剂时,由于与Cu原子生成表面化学键而被吸附在固体表面上。这种表面化学键是键。CO分子一方面以孤对电子给予Cu原子的空轨道形成键,另一方面又以空的反键轨道和Cu原子的d轨道形成键,由Cu原子提供电子。配键的电子授受作用互相促进,使CO分子被吸附(化学吸附)在固体表面,从废气中分离出来。由于这种吸附具有很大的表面积和其他表面结构特性,它对CO的吸附容量大,选择性强。在一定条件(例如减压和升温)下,配键可以被破坏,CO解吸下来,从而获得高纯度的气体产物。【6.23】根据磁性测定结果知为顺磁性,而为抗磁性,试推测它们的几何构型。解:为组态,半径较小,其四配位化合物既可呈四面体构型,也可呈平面正方形构型,决定因素是配体间排斥作用的大小。若的四配位化合物呈四面体构型,则d电子的排布方式如图所示。配合物因有未成对的d电子而显顺磁性。若呈平面正方形,则d电子的排布方式如图所示。
配合物因无不成对电子而显抗磁性。反之,若的四配位化合物显顺磁性,则它呈四面体构型;若显抗磁性,则它呈平面正方形。此推论可推广到其他具有组态过度金属离子的四配位化合物。为顺磁性离子,因而呈四面体构型。为抗磁性离子,因而呈平面正方形。【6.24】试用表6.6.1数据计算的摩尔抗磁性磁化率,并和实验测定值比较。解:将中的O采用O(羰基),查表可得摩尔抗磁磁化率:(苯环)此数据和实验测定值相近。【6.25】试用表6.6.1数据计算的摩尔抗磁性磁化率。实验测得正戊醇为,异戊醇为,试予以比较。解:此计算值介于正戊醇和异戊醇之间,由于查表并未获得有关碳架结构校正数据,故无法判断应为哪种异构体。【6.26】试从下列化合物实验测定的磁矩数据,判断其自旋态,未成对电子数,磁矩的计算值及轨道角动量对磁矩的贡献。(a) (b) (c) 6.061.83.9解:(a):弱八面体场,高自旋态,未成对电子数n=5,,接近实验值,轨道角动量贡献很小。(b):强八面体场,低自旋态,未成对电子数n=1,,接近实验值,轨道角动量贡献很小。
(c):八面体场,未成对电子数n=3,,接近实验值,轨道角动量贡献很小。【6.27】下列各个配位离子分别具有八面体(六配位)和四面体(四配位)构型,由它们组成的配合物,哪些能给出顺磁共振信号。(a) (b) (c) (d)(e) (f) (g) (h)()解:配位离子配位体场自旋态电子组态顺磁信号(a)弱八面体场高自旋有(b)强八面体场低自旋无(c)强八面体场低自旋有(d)弱八面体场高自旋有(e)强八面体场低自旋无(f)强八面体场低自旋有(g)弱四面体场高自旋有(h)弱四面体场-无(I)弱四面体场-无【6.28】用波长为的微波进行一个自由基样品的电子顺磁测定,吸收峰出现的磁感应强度是多少?解:由于自由基中自由电子g值为2.0023,可得:【6.29】当分别用和进行质子
核磁共振实验,磁感应强度各应为多少?解:【6.30】解释在法中,化学位移的产生原因和定义。解:按照式,对于同一种原子核,若固定磁感应强度,则共振频率是一定的。但实际情况并非完全如此。同一种核,由于所处的化学环境不同,核磁共振频率(或吸收峰的位置)有所变化,此即化学位移。核的化学位移定义式为:式中和分别是使参比核和核产生磁共振跃迁吸收的外磁感应强度。定义式也可写作:式中和分别为核和参比核的共振频率。化学位移的单位为ppm。产生化学位移的原因是由于核周围的电子对外加磁场的屏蔽作用。核周围的电子在外磁场的作用下,产生了一个大小与外磁场成正比而方向与外磁场相反的微弱的感应磁场—,使核实际感受到的有效磁感应强度为有效为屏蔽常数。同一种核在分子中所处的环境不同,就不同,有效不同,因而所产生的核磁共振频率不同,即吸收峰位置不同,亦即产生了化学位移。影响化学位移的因素很多,也很复杂。了解这些因素是根据化学位移推测分子结构的基础。【6.31】耦合常数以表示,而也可用表示。对于磁感应强度为的谱仪,化学位移,相当于产生多少赫[兹]的化学位移?解:即相当于产生60Hz的化学位移。
7晶体的点阵结构和晶体的性质【7.1】若平面周期性结构系按下列单位并置重复堆砌而成,请画出它们的点阵素单位,并写出每个素单位中白圈和黑圈的数目。解:用实线画出素单位示于图8.1(a)。各素单位黑点数和圈数列于下表:图8.1(a)号数1234567黑点数目1111024圈数目1112313【7.2】层状石墨分子中键长为142,试根据它的结构画出层型石墨分子的原子分布图,画出二维六方素晶胞,用对称元素的图示记号标明晶胞中存在的全部六重轴,并计算每一个晶胞的面积、晶胞中包含的原子数和键数。解:石墨层型分子结构示于图8.2(a),晶胞示于图8.2(b),在晶胞中六重轴位置示于图8.2(c),图中数字单位为pm。
图8.2石墨层型分子的结构由图(a)可见,在层型石墨分子结构中,六元环中心具有六重轴对称性,而每个C原子则具有六重反轴对称性。晶胞边长a和b可按下式计算:晶胞面积可按下式计算;晶胞中有2个C原子,3个C-CN键。【7.3】画出层状石墨分子的点阵素单位及石墨晶体的空间点阵素单位(参照图8.1.4),分别说明它们的结构基元。解:按上题可得层型石墨分子的晶胞结构,示于图8.3(a),它的点阵素单位示于图8.3(b),结构基元中含2个C原子。石墨晶体的晶胞示于图8.3(c),点阵单位示于图8.3(d)。结构基元中含4个C原子。图8.3石墨的结构【7.4】有一型晶体,晶胞中和的坐标分别为和。指明该晶体的结构基元。解:不论该晶体属于哪一个晶系,均为简单的空间点阵,结构基元为AB。【7.5】下表给出由射线衍射法测得一些链型高分子的周期。请根据原子的立体化学,画出这些聚合物的一维结构;找出他们的结构基元;画出相应的直线点阵;比较这些聚合物链周期大小,并解释原因。高分子化学式链周期聚乙烯252聚乙烯醇252
聚氯乙烯510聚偏二氯乙烯470解:依次画出这些高分子的结构于下:在聚乙烯,聚乙烯醇和聚氯乙烯分子中,C原子以杂化轨道成键,呈四面体构型,C-C键长154pm,为,全部C原子都处在同一平面上,呈伸展的构象。重复周期长度前两个为252pm,这数值正好等于:聚氯乙烯因Cl原子的范德华半径为184pm,需要交错排列,因而它的周期接近252pm的2倍。聚偏二氯乙烯因为同一个C原子上连接了2个Cl原子,必须改变-C-C-C-键的伸展构象,利用单键可旋转的性质,改变扭角,分子中的C原子不在一个平面上,如图所示。这时因碳链扭曲而使周期长度缩短至470pm。高分子立体结构结构基元聚乙烯聚乙烯醇聚氯乙烯
聚偏二氯乙烯【7.6】有一组点,周期地分布于空间,其平行六面体单位如右下图所示,问这一组点是否构成一点阵?是够构成一点阵结构?请画出能够概括这一组点的周期性的点阵及其素单位。解:不能将这一组点中的每一个点都作为点阵点,因为它不符合点阵的要求,所以这一组点不能构成一点阵。但这组点是按平行六面体单位周期地排布于空间,它构成一点阵结构。能概括这组点的点阵素单位如图8.6(b)。图8.6【7.7】列表比较晶体结构和分子结构的对称元素和对称操作。晶体结构比分子结构增加了哪几类对称元素和对称操作?晶体结构的对称元素和对称操作受到哪些限制?原因是什么?解:分子对称性晶体对称性(1)旋转操作——旋转轴(2)反映操作——镜面(3)反演操作——对称中心(4)旋转反演操作——反轴(5)平行操作——点阵(6)螺旋旋转操作——螺旋轴
(7)反映滑移操作——滑移面由表可见,晶体结构比分子结构增加了(5)—(7)3类对称元素和对称操作。晶体结构因为是点阵结构,其对称元素和对称操作要受到点阵制约,对称轴轴次为1,2,3,4,6。螺旋轴和滑移面中的滑移量只能为点阵结构所允许的几种数值。【7.8】根据点阵的性质作图证明晶体中不可能存在的五重对称轴。解:若有五重轴,由该轴联系的5个点阵点的分布如图8.8。连接AB矢量,将它平移到E,矢量一端为点阵点E,另一端没有点阵点,不合点阵的定义,所以晶体的点阵结构不可能存在五重对称轴。图8.8【7.9】分别写出晶体中可能存在的独立的宏观对称元素和微观对称元素,并说明它们之间的关系。解:宏观对称元素有;。微观对称元素有:点阵。微观对称元素比宏观对称元素多相应轴次的螺旋轴和相同方向的滑移面,而且通过平移操作其数目是无限的。【7.10】晶体的宏观对称操作集合可构成多少个晶体学点群?这些点群分属于多少个晶系?这些晶系共有多少种空间点阵型式?晶体的微观对称操作的集合可构成多少个空间群?这些空间群分属于多少个点群?解:32个晶体学点群,7个晶系,14种空间点阵型式,230个空间群,这些空间群分属于32个点群。【7.11】从某晶体中找到、、和等对称元素,则该晶体所属的晶系和点群各是什么?解:六方晶系,因为。点群是。【7.12】六方晶体可按六方柱体(八面体)结合而成,但为什么六方晶胞不能划分六方柱体?解:晶胞一定是平行六面体,它的不相平行的3条边分别和3
个单位平移矢量平行。六方柱体不符合这个条件。【7.13】按下图堆砌而成的结构为什么不是晶体中晶胞并列排列的结构?解:晶胞并置排列时,晶胞顶点为8个晶胞所共有。对于二维结构,晶胞顶点应为4个晶胞共有,才能保证晶胞顶点上的点有着相同的周围环境。今将团中不同位置标上A,B如图8.13b所示,若每个矩形代表一个结构基元,由于A点和B点的周围环境不同(A点上方没有连接线、B点下方没有连接线),上图的矩形不是品胞。晶胞可选连接A点的虚线所成的单位,形成由晶胞并置排列的结构,如图8.13b所示。图8.13a图8.13b【7.14】已知金刚石立方晶胞的晶胞参数。写出其中碳原子的分数坐标,并计算键长和晶体密度。解:金刚石中碳原子分数坐标为:。C-C键长可由及两个原子的距离求出;因为立方金刚石密度【7.15】四方晶系的金红石晶体结构中,晶胞参数,
;原子分数坐标为:,。计算值相同的键长。解:z值相同的Ti-O键是Ti和O之间的键,其键长为:【7.16】许多由有机分子堆积成的晶体属于单斜晶系,其空间群记号为,说明该记号中各符号的意义。利用图8.3.2中空间群对称元素的分布。推出晶胞中和原子(0.15,0.25,0.10)属同一等效点系的其他3个原子的坐标,并作图表示。解:在空间群记号中,为点群Schonflies记号,为该点群的第5号空间群,“—”记号是空间群的国际记号,P为简单点阵,对单斜晶系平行b轴有螺旋轴,垂直b轴有c滑移面。该空间群对称元素分布如下:b轴从纸面向上1(0.15,0.25,0.10);3(0.15,0.25,0.60);2(0.85,0.75,0.40);4(0.85,0.75,0.90)图8.16【7.17】写出在3个坐标轴上的截距分别为-2a,-3b和-3c的点阵面的指标;写出指标为(321)的点阵面在3个坐标轴上的截距之比。解:点阵面指标为三个轴上截数倒数的互质整数之比,即,点阵面指标为或。指标为的点阵面在三个轴上的截距之比为:2a:3b:6c。【7.18】标出下面点阵结构的晶体指标,,,,,。每组面话出3条相邻的直线表示。
解:图8.18【7.19】金属镍的立方晶胞参数,试求,,。解:立方晶系的衍射指标hkl和衍射面间距的关系为:故:【7.20】在直径为的相机中,用射线拍金属铜的粉末图。从图上量得8对粉末线的值为:44.0,51.4,75.4,90.4,95.6,117.4,137.0,145.6。试计算下表各栏数值,求出晶胞参数,确定晶体点阵型式。序号解:由L求可按下式:由求可用第1条线的值去除各线的值,然后乘一个合适的整数使之都接近整数值。由Bragg公式以及立方晶系的可得:按上述公式计算所得结果列于表8.20。表8.20
序号144.022.00.1401110.04666251.425.70.1882000.04700375.437.70.3742200.04675490.445.20.5033110.04573595.647.80.5492220.045756117.458.70.7304000.045627137.068.50.8663310.045578145.672.80.9134200.04565取号线的的值求平均值得:将代入,得:从衍射指标符合全为奇数或全为偶数的规律,得空间点阵型式为面心立方。【7.21】已知,,,用拍金属钽的粉末图,所得各粉末线的值列下表。试判断钽所属晶系、点阵型式,将上述粉末线指标化,求出晶胞参数。序号射线序号射线10.1126570.7631220.2223880.8705430.3315590.8756340.44018100.9782650.54825110.9833560.65649解:由解8.20体可知,对立方晶系:用第1号衍射线的值遍除各线,即可得到的比值。再根据此比值加以调整,使之成为合理的整数,即可求出衍射指标。从而进一步求得所需数值如表8.21。表8.21序号用1号遍除因出现7,以2倍之10.1126512110324.920.2223824200327.030.3315536211327.040.4401848220328.7
50.54825510310329.360.65849612222329.670.76312714312330.280.87054816400330.390.87563816400330.0100.97826918411330.5110.98335918411330.3因不可能有7,故乘以2,都得到合理的整数,根据此整数即得衍射指标如表所示。因能用立方晶系的关系式指标化全部数据,所以晶体应属于立方晶系。而所得指标全为偶数,故为体心点阵型式。再用下一公式计算晶胞参数:从第1号至第7号值用,第8号和第10号用,第9号和第11号用,计算所得数据列于表中。利用粉末法求晶胞参数,高角度比较可靠,可以作的图,外推至,求得;也可以用最后两条线求平均值,得:【7.22】什么是晶体衍射的两个要素?它们与晶体结构(例如晶胞的两要素)有何对应关系?写出能够阐明这些对应关系的表达式,并指出式中各符号的意思。晶体衍射的两要素在射线粉末衍射图上有何反映?解:晶体衍射的两个要素是:衍射方向和衍射强度,它们和晶胞的两要素相对应。衍射方向和晶胞参数相对应,衍射强度和晶胞中原子坐标参数相对应,前者可用Laue方程表达,后者可用结构因子表达:Laue方程:反映了晶胞大小和空间取向;和反映了衍射X射线和入射X射线的方向;式中为衍射指标,为X射线波长。衍射强度和结构因子成正比,而结构因子和晶胞中原子种类(用原子散射因子表示)及其坐标参数有关;粉末衍射图上衍射角(或)即衍射方向,衍射强度由计算器或感光胶片记录下来。
【7.23】写出方程的两种表达形式,说明与,与之间的关系以及衍射角随衍射级数的变化。解:Bragg方程的两种表达形式为:式中()为点阵面指标,3个数互质;而为衍射指标,3个数不要求互质,可以有公因子n,如123,246,369等。为点阵面间距;为衍射面间距,它和衍射指标中的公因子n有关:。按前一公式,对于同一族点阵面()可以有n个不同级别的衍射,即相邻两个面之间的波程差可为…,,而相应的衍射角为,…。【7.24】为什么用射线粉末法测定晶胞参数时常用高角度数据(有时还根据高角度数据外推至),而测定超细晶粒的结构时要用低角度数据(小角散射)?解:按晶面间距的相对误差公式可见.随着值增大,值变小,测量衍射角的偏差对晶面间距或晶胞参数的影响减小,故用高角度数据。小晶粒衍射线变宽,利用求粒径的公式:超细晶粒值很小,衍射角增大时,变小,宽化(即)增加。故要用低角度数据。另外,原子的散射因子随的增大而减小,细晶粒衍射能力已很弱了。为了不使衍射能力降低,应在小角度(值小)下收集数据。【7.25】用射线衍射法测定的晶体结构,衍射100和200哪个强度大?为什么?解:200比100大,其原因可从图8.25中看出。图8.25示出CsCl立方晶胞投影图,。在衍射100中,和相差半个波长,强度互相抵消减弱;在衍射200中,和相差1个波长,互相加强。图8.25【7.26】用射线测得某晶体的衍射图,从中量得以下数据,试查PDF卡片,鉴定此晶体可能是什么。
27.331.845.553.956.666.375.518100805212020解:利用PDF卡片鉴定晶体时,需先把衍射角数据换算成值()如下:()27.331.845.553.956.666.375.5326.7281.4199.4170.1162.6141.0125.918100805212020按这组值查表,得知它为NaCl晶体。【7.27】金属铝属立方晶系,用射线摄取333衍射,,由此计算晶胞参数。解:立方晶系和的关系为:由求得为:【7.28】分子既可形成单斜硫,也可形成正交硫。用射线衍射法(射线)测得某正交硫晶体的晶胞参数,,。已知该硫磺的密度为,的相对原子质量为32。(a)计算每个晶胞中分子的数目;(b)计算224衍射线的角;(c)写出气相中分子的全部独立的对称元素。解:(a)按求晶胞中分子数Z的公式,得:(b)按正交晶系公式:代入有关数据,得:
(c)分子属于点群,独立的对称元素有:。【7.29】硅的晶体结构和金刚石相似。下测得其立方晶胞参数,密度为,的相对原子质量为28.0854,计算常数。解;按求Avogadro数的公式,得:【7.30】已知某立方晶系晶体,其密度为,相对分子质量为234。用射线在直径粉末相机中拍粉末图,从中量得衍射220的衍射线间距为,求晶胞参数及晶胞中分子数。解:用下面公式由L值可求得值:【7.31】已知晶体立方晶胞参数,实验测得衍射111的衍射角,求实验所用射线的波长。解:【7.32】核糖核酸酶—蛋白质晶体的晶体学数据如下:晶胞体积,晶胞中分子数6,晶体密度。如蛋白质在晶体中占68%
(质量),计算该蛋白质相对分子质量。解:【7.33】晶体具有型结构,晶体密度为,的相对原子质量和的相对原子质量分别为40.08和32.06。试回答下列问题:(a)指出100.110.111.200.210.211.220.222衍射中哪些是允许的?(b)计算晶胞参数;(c)计算辐射的最小可观测角。解:(a)NaCl型结构的点阵型式为面心立方,允许存在的衍射中三个数应为全奇或全偶,即111,200,220,222出现。(b)为求晶胞参数,先求晶胞体积V:(c)最小可观测的衍射为111。【7.34】微晶是乙烯,丙烯聚合催化剂的活性组分。用射线粉末法(线)测定其平均晶粒度时所得数据如下表所示,请有公式(8.4.23)估算该微晶大小。0010.401.31000.551.5解:利用求粒径的公式得001衍射:弧度100衍射:弧度
【7.35】冰为立方晶系晶体,晶胞参数,,晶胞中含,括弧内为原子分数坐标(0,0,0;0,0,0.375;2/3,1/3,1/2;2/3,1/3,0.875),请根据此计算或说明:(a)计算冰的密度;(b)计算氢键键长;(c)冰的点阵式是什么?结构单元包含哪些内容?解:(a)密度(b)坐标为(0,0,0)和(0,0,0.375)的两个O原子间的距离即为氢键键长r:(c)冰的点阵形式是简单六方点阵(hP),整个晶胞包含的内容即4H2O为结构基元。【7.36】某晶体型衍射中系统消光,试说明在什么方向有什么样的滑移面?滑移量是多少?解:在和b轴(或y轴)垂直的方向有c滑移面,滑移量为c/2。【7.37】某金属氧化物属立方晶系,晶体密度为,用射线粉末法(线)测得各衍射线相应的衍射角分别为:,,,,,,,,请根据此计算或说明:(a)确定该金属氧化物晶体的点阵型式;(b)计算晶胞参数和一个晶胞中的结构基元数;(c)计算金属原子的相对原子质量。解:本题可仿照8.20,8.21,8.26题将数据处理列表如下:序号118.50.31730.100713111221.50.36650.13431.3344200331.20.51800.26842.6658220437.40.60740.36893.66311311
539.40.63470.40294.00112222647.10.73250.53665.32916400754.90.81810.66946.64720420(a)晶体衍射全奇或全偶,面心立方点阵。(b)在面心立方晶胞中,一个晶胞对应4个点阵点,即包含4个结构基元。(c)按公式,MO的相对化学式量为40.24,M的相对原子质量为:,该原子应为Mg。【7.38】根绝8.3.2节中第三个离子给出的信息说明或计算:(a)氟硅酸脲晶体所属的点群;(b)该晶体所属的空间点阵型式;(a)该晶体的宏观对称元素及特征对称元素;(b)该晶体的密度。解:与本题有关的信息为:晶系:四方空间群:晶胞参数:根据上述信息,可得:(a)点群:(b)空间点阵形式:简单四方点阵(c)宏观对称元素:特征对称元素:(d)根据化学式,得:【7.39】丙氨酸与氯铂酸钾反应,形成的晶体(见右下式)属正交晶系,且已知:,,;晶胞中包含2个分子,空间群为,一般等效点系数目为4,即每一不对称单位相当于半个分子,。试由此说明该分子在晶体中的构型和点群,并写出结构式。
解:因不对称单位相当于半个分子,分子只能坐在二重轴上(该二重轴和b轴平行)。二重轴通过Pt原子(因晶胞中只含有2个Pt),分子呈反式构型(Pt原子按平面四方形成键,2个Cl原子处于对位位置,才能保证有二重轴)。分子的点群为。分子的结构式为:【7.40】二水合草酸晶体所属的空间群为,试写出下列衍射的系统消光条件:(a),(b),(c),(d),(e)。解:(a),无系统消光,因系简单点阵P。(b),无系统消光,因单斜晶系对称面只和b轴垂直。(c),出现十=奇数系统消光.因为有滑移面和b轴垂直。(d),出现=奇数系统消光,这是n滑移面派生的,不是平行轴有螺旋轴。(e),出现=奇数系统消光,因平行b轴有螺旋轴。8金属的结构和性质【8.1】半径为的圆球堆积成正四面体空隙,试作图计算该四面体的边长和高、中心到顶点距离、中心距离地面的高度、中心到两顶点连县的夹角以及中心到球面的最短距离。解:4个等径圆球作紧密堆积的情形示于图9.1(a)和(b),图9.1(c)示出堆积所形成的正四面体空隙。该正四面体的顶点即球心位置,边长为圆球半径的2倍。
图9.1由图和正四面体的立体几何知识可知:边长AB=2R高中心到顶点的距离:中心到底边的高度:中心到两顶点连线的夹角为:中心到球面的最短距离本题的计算结果很重要。由此结果可知,半径为R的等径圆球最密堆积结构中四面体空隙所能容纳的小球的最大半径为0.225R。而0.225正是典型的二元离子晶体中正离子的配位多面体为正四面体时正、负离子半径比的下限。此题的结果也是了解hcp结构中晶胞参数的基础(见习题9.04)。【8.2】半径为的圆球堆积成正八面体空隙,计算中心到顶点的距离。解:正八面体空隙由6个等径圆球密堆积而成,其顶点即圆球的球心,其棱长即圆球的直径。空隙的实际体积小于八面体体积。图9.2中三图分别示出球的堆积情况及所形成的正八面体空隙。图9.2
由图(c)知,八面体空隙中心到顶点的距离为:而八面体空隙中心到球面的最短距离为:此即半径为R的等径圆球最密堆积形成的正八面体空隙所能容纳的小球的最大半径。0.414是典型的二元离子晶体中正离子的配位多面体为正八面体时的下限值。【8.3】半径为的圆球围成正三角形空隙,计算中心到顶点的距离。解:由图9.3可见,三角形空隙中心到顶点(球心)的距离为:图9.3三角形空隙中心到球面的距离为:此即半径为R的圆球作紧密堆积形成的三角形空隙所能容纳的小球的最大半径,0.155是“三角形离子配位多面体”中的下限值。【8.4】半径为的圆球堆积成结构,计算简单立方晶胞参数和的数值。解:图9.4示出A3型结构的—个简单六方晶胞。该晶胞中有两个圆球、4个正四面体空隙和两个正八面体空隙。由图可见,两个正四面体空隙共用一个顶点,正四面体高的两倍即晶胞参数c,而正四面体的棱长即为晶胞参数或。根据9.01题的结果,可得:图9.4【8.5】证明半径为的圆球所作的体心立方堆积中,八面体空隙只能容纳半径为的小球,四面体空隙可容纳半径为的小球。
证明:等径圆球体心立方堆积结构的晶胞示于图9.5(a)和(b)。由图9.5(a)可见,八面体空隙中心分别分布在晶胞的面心和棱心上。因此,每个晶胞中6个八面体空隙。而每个晶胞中含2个圆球,所以每个球平均摊到3个八面体空隙。这些八面体空隙是沿着一个轴被压扁了的变形八面体,长轴为,短轴为(是晶胞参数)。(圆球,八面体空隙中心,四面体空隙中心)图9.5八面体空隙所能容纳的小球的最大半径即从空隙中心(沿短轴)到球面的距离,该距离为。体心立方堆积是一种非最密堆积,圆球只在轴方向上互相接触,因而。代入,得。由图9.5(b)可见,四面体空隙中心分布在立方晶胞的面上,每个面有4个四面体中心,因此每个晶胞有12个四面体空隙。而每个晶胞有2个球,所以每个球平均摊到6个四面体空隙。这些四面体空隙也是变形的,两条长棱皆为,4条短棱皆为。四面体空隙所能容纳的小球的最大半径等于从四面体空隙中心到顶点的距离减去球的半径R。而从空隙中心到顶点的距离为,所以小球的最大半径为【8.6】计算等径圆球密置单层中平均每个球所摊到的三角形空隙数目及二维堆积密度。解:图9.6示出等径圆球密置单层的—部分。图9.6由图可见,每个球(如A)周围有6个三角形空隙,而每个三角形空隙由3
个球围成,所以每个球平均摊到个三角形空隙。也可按图中画出的平行四边形单位计算。该单位只包含一个球(截面)和2个三角形空隙,即每个球摊到2个三角形空隙。设等径圆球的半径为R,则图中平行四边形单位的边长为2R。所以二维堆积系数为:【8.7】指出型和型等径圆球密置单层的方向是什么?解:A1型等径团球密堆积中,密置层的方向与轴垂直,即与(111)面平行。A3型等径圆球密堆积中,密置层的方向与六重轴垂直,即与(001)面平行。下面将通过两种密堆积型式划分出来的晶胞进一步说明密置层的方向。A1型密堆积可划分出如图9.7(a)所示的立方面心晶胞。在该晶胞中,由虚线连接的圆球所处的平面即密置层面,该层面垂直于立方晶胞的体对角线即轴。每一晶胞有4条体对角线,即在4个方向上都有轴的对称性。因此,与这4个方向垂直的层面都是密置层。图9.7A3型密堆积可划分出如图9.7(b)所示的六方晶胞。球A和球B所在的堆积层都是密置层.这些层面平行于(001)晶面,即垂直于c轴,而c轴平行于六重轴。【8.8】请按下面(a)~(c)总结、及型金属晶体的结构特征。(a)原子密置层的堆积方式、重复周期(型除外)、原子的配位数及配位情况。(b)空隙的种类和大小、空隙中心的位置及平均每个原子摊到的空隙数目。(c)原子的堆积系数、所属晶系、晶胞中原子的坐标参数、晶胞参数与原子半径的关系以及空间点阵型式等。解:(a)A1,A2和A3型金属晶体中原子的堆积方式分别为立方最密堆积(ccp)、体心立方密堆积(bcp)相六方最密堆积(hcp)。A1型堆积中密堆积层的重复方式为ABCABCABC…,三层为一重复周期,A3型堆积中密堆积层的重复方式为ABABAB…,两层为一重复周期。Al和A3型堆积中原子的配位数皆为12,而A2型堆积中原子的配位数为8—14,在A1型和A3型堆积中,中心原子与所有配位原子都接触.同层6个,上下两层各3个。所不同的是,A1型堆积中,上下两层配位原子沿轴的投影相差呈轴的对称性,而A3型堆积中,上下两层配位原子沿c轴的投影互相重合。在A2型堆积中,8个近距离(与中心原子相距为
)配位原子处在立方晶胞的顶点上,6个远距离(与中心原子相距为)配位原子处在相邻品胞的体心上。(b)A1型堆积和A3型堆积都有两种空隙,即四面体空隙和八面体空隙。四面体空隙可容纳半径为的小原子.八面体空隙可容纳半径为的小原子(R为堆积原子的半径)。在这两种堆积中,每个原子平均摊到两个四面体空隙和1个八面体空隙。差别在于,两种堆积中空隙的分布不同。在A1型堆积中,四面体空隙的中心在立方面心晶胞的体对角线上,到晶胞顶点的距离为。八面体空隙的中心分别处在晶胞的体心和棱心上。在A3型堆积中,四面体空隙中心的坐标参数分别为。而八面体空隙中心的坐标参数分别为。A2型堆积中有变形八面体空隙、变形四面体空隙和三角形空隙(亦可视为变形三方双锥空隙)。八面体空隙和四面体空隙在空间上是重复利用的。八面体空隙中心在体心立方晶胞的面心和棱心上。每个原子平均摊到3个八面体空隙,该空隙可容纳的小原子的最大半径为。四面体空隙中心处在晶胞的面上。每个原子平均摊到6个四面体空隙,该空隙可容纳的小原子的最大半径为。三角形空隙实际上是上述两种多面体空隙的连接面,算起来,每个原子摊到12个三角形空隙。(c)金属的结构形式A1A2A3原子的堆积系数74.05%68.02%74.05%所属晶系立方立方六方晶胞形式面心立方体心立方六方晶胞中原子的坐标参数晶胞参数与原子半径的关系点阵形式面心立方体心立方简单六方综上所述,A1,A2和A3型结构是金属单质的三种典型结构形式。它们具有共性,也有差异。尽管A2型结构与A1型结构同属立方晶体,但A2型结构是非最密堆积,堆积系数小,且空隙数目多,形状不规则,分布复杂。搞清这些空隙的情况对于实际工作很重要。A1型和A3型结构都是最密堆积结构,它们的配位数、球与空隙的比例以及堆积系数都相同。差别是它们的对称性和周期性不同。A3型结构属六方晶系,可划分出包含两个原子的六方晶胞。其密置层方向与c轴垂直。而A1型结构的对称性比A3型结构的对称性高,它属立方晶系,可划分出包含4个原子的面心立方晶胞,密置层与晶胞体对角线垂直。A1型结构将原子密置层中轴所包含的轴对称性保留了下来。另外,A3型结构可抽象出简单六方点阵,而A1型结构可抽象出面心立方点阵。【8.9】画出等径圆球密置双层图及相应的点阵素单位,指明结构基元。解:等径圆球的密置双层示于图9.9
。仔细观察和分子便发现,作周期性重复的最基本的结构单位包括2个圆球,即2个圆球构成一个结构基元。这两个球分布在两个密置层中,如球A和球B。图9.9密置双层本身是个三锥结构,但由它抽取出来的点阵却为平面点阵。即密置双层仍为二维点阵结构。图中画出平面点阵的素单位,该单位是平面六方单位,其形状与密置单层的点阵素单位一样,每个单位也只包含1个点阵点,但它代表2个球。等径圆球密置双层是两个密置层作最密堆积所得到的唯一的一种堆积方式。在密置双层结构中,圆球之间形成两种空隙,即四面体空隙和八面体空隙。前者由3个相邻的A球和1个B球或3个相邻的B球和1个A球构成。后者则由3个相邻的A球和3个相邻的B球构成。球数四面体空隙数八面体空隙数=【8.10】金属铜属于型结构,试计算(111)、(110)和(100)等面上铜原子的堆积系数。解:参照金属铜的面心立方晶胞,画出3个晶面上原子的分布情况如下(图中未示出原子的接触情况):(111)面是密置面,面上的所有原子作紧密排列。该面还是的铜原子的堆积系数等于三角形单位中球的总最大截面积除以三角形的面积。三角形单位中包含两个半径为R的球,所以该面上原子的堆积系数为:【8.11】金属铂为型结构,立方晶胞参数,的相对原子质量为195.0,试求金属铂的密度及原子半径。解:因为金属铂属于A1型结构,所以每个立方晶胞中有4个原子。因而其密度为:A1型结构中原子在立方晶胞的面对角线方向上互相接触,因此晶胞参数和原子半径R的关系为,所以:
【8.12】硅的结构和金刚石相同,的共价半径为117,求硅的晶胞参数,晶胞体积和晶胞密度。解:硅的立方晶胞中有8个硅原子,它们的坐标参数与金刚石立方晶胞中碳原子的坐标参数相同。硅的共价半径和晶胞参数的关系可通过晶胞对角线的长度推导出来。设硅的共价半径为,晶胞参数为,则根据硅原子的坐标参数可知,体对角线的长度为。而体对角线的长度又等于,因而有,所以:晶胞体积为:晶体密度为:金刚石、硅和灰锡等单质的结构属立方金刚石型(A4型),这是一种空旷的结构型式,原子的空间占有率只有34.01%。【8.13】已知金属钛为六方最密堆积结构,钛原子半径为,试计算理想的六方晶胞参数及晶体密度。解:晶胞参数为:晶体密度为:【8.14】铝为面心立方结构,密度为,试计算它的晶胞参数和原子半径。用射线摄取衍射图,33衍射线的衍射角是多少?解:铝为面心立方结构,因而一个晶胞中有4个原子。由此可得铝的摩尔质量M、晶胞参数,晶体密度D及Avogadro常数之间的关系为:,所以,晶胞参数:
面心立方结构中晶胞参数与原子半径R的关系为,因此,铝的原子半径为:根据Bragg方程得:将立方晶系面间距,晶胞参数和衍射指标间的关系代入,得:【8.15】金属纳为体心立方结构,,计算:(a)的原子半径;(b)金属钠的理论密度;(a)(110)的间距。解:(a)金属钠为体心立方结构,原子在晶胞体对角线方向上互相接触,由此推得原子半径和晶胞参数的关系为:代入数据得:(b)每个晶胞中含两个钠原子,因此,金属钠的理论密度为:(c)【8.16】金属钽为体心立方结构,,试求:(a)的原子半径;(b)金属钽的理论密度(的相对原子质量为181);(c)(110)面的间距(d)若用的射线,衍射指标为220的衍射角的数值是多少?解:(a)钽原子的半径为:(b)金属钽的理论密度为:
(c)(110)点阵面的间距为:(d)根据Bragg方程得:【8.17】金属镁属型结构,镁的原子半径为。(a)指出镁晶体所属的空间点阵型式及微观特征对称元素;(b)写出晶胞中原子的分数坐标;(c)若原子符合硬球堆积规律,计算金属美的摩尔体积;(d)求值。解:(a)镁晶体的空间点阵型式为简单六方。两个镁原子为一结构基元,或者说一个六方晶胞即为一结构基元。这与铜、钠、钽等金属晶体中一个原子即为一结构基元的情况不同。这要从结构基元和点阵的定义来理解。结构基元是晶体结构中作周期性重复的最基本的单位,它必须满足三个条件,即每个结构基元的化学组成相同、空间结构相同,若忽略晶体的表面效应,它们的周围环境也相同。若以每个镁原子作为结构基元抽出一个点,这些点不满足点阵的定义,即不能按连接任意2个镁原子的矢量进行平移而使整个结构复原。镁晶体的微观特征对称元素为和。(b)晶胞中原子的分数坐标为:。(c)一个晶胞的体积为,而晶体相当于个晶胞,故镁晶体的摩尔体积为:也可按下述思路计算:镁原子的真实体积为,而在镁晶体中原子的堆积系数为0.7405,故镁晶体的摩尔体积为:(d),对于A3型结构,,故镁晶体002衍射面的面间距为:
用六方晶系的面间距公式计算,所得结果相同。【8.18】是面心立方金属,晶胞参数,用辐射()拍粉末图,列出可能出现的铺线的衍射指标及其衍射角的数值。解:对于点阵型式属于面心立方的晶体,可能出现的衍射指标的平方和为3,4,8,11,12,16,19,20,24等。但在本题给定的实验条件下:当时,,这是不允许的。因此,只能为3,4和8,即只能出现111,200和220衍射。相应的衍射角为:【8.19】已知金属为型结构,原子间接触距离为,试计算:(a)的密度及的立方晶胞参数;(b)画出(100)、(110)、(111)面上原子的排布方式。解:(a)由于金属Ni为A1型结构,因而原子在立方晶胞的面对角线方向上互相接触。由此可求得晶胞参数:晶胞中有4个Ni原子,因而晶体密度为:(b)【8.20】金属锂晶体属立方晶系,(100)点阵面的面间距为,晶体密度为,从晶胞中包含的原子数目判断该晶体属何种点阵型式?(的相对原子质量为6.941)。
解:金属锂的立方晶胞参数为:设每个晶胞中锂原子数为,则:立方晶系晶体的点阵形式有简单立方、体心立方和面心立方三种,而对立方晶系的金属晶体,可能的点阵形式只有面心立方和体心立方两种。若为前者,则一个晶胞中应至少有4个原子。由此可知,金属锂晶体属于体心立方点阵。【8.21】灰锡为金刚石型结构,晶胞中包含8个原子,晶胞参数写出晶胞中8个原子的分数坐标;算出的原子半径;灰锡的密度为,求饿相对原子质量;白锡属四方晶系,,,晶胞中含有4个原子,通过计算说明由白锡转变为灰锡,体积是膨胀了,还是收缩了?白锡中间最短距离为,试对比灰锡数据,估计哪一种锡的配位数高?解:(a)晶胞中8个锡原子的分数坐标分别为:(b)灰锡的原子半径为:(c)设锡的摩尔质量为M,灰锡的密度为,晶胞中原子数为,则:即锡的相对原子质量为118.3。(d)由题意,白锡的密度为:可见,由白锡转变为灰锡,密度减小,即体积膨胀了。(e)灰锡中Sn-Sn间最短距离为:小于白锡中Sn-Sn间最短距离,由此可推断,白锡中原子的配位数高。
【8.22】有一黄铜合金含75%,25%(质量),晶体的密度为。晶体属立方面心点阵结构,晶胞中含4个原子。的相对原子质量63.5,65.4。(a)求算和所占的原子百分数;(b)每个晶胞中含合金的质量是多少克?(c)晶胞体积多大?(d)统计原子的原子半径多大?解:(a)设合金中铜的原子分数(即摩尔分数)为,则锌的原子分数(即摩尔分数)为,由题意知,解之得:所以,该黄铜合金中,Cu和Zn的摩尔分数分别为75.5%和24.5%。(b)每个晶胞中含合金的质量为:(c)晶胞的体积等于晶胞中所含合金的质量除以合金的密度,即:(d)由晶胞的体积可求出晶胞参数:由于该合金属立方面心点阵结构,因而统计原子在晶胞面对角线方向上相互接触,由此可推得统计原子半径为:【8.23】无序结构属立方晶系,晶胞参数。若合金结构有(a)变为(c)时,晶胞大小看作不变,请回答;(a)无序结构的点阵型式和结构单元;(b)有序结构的点阵型式、结构单元、和原子分数坐标;(c)用波长的射线拍粉末图,计算上述两种结构可能在粉末图中出现的衍射线的最小衍射角的数值。
解:(a)无序结构的点阵型式为面心立方,结构基元为,即一个统计原子。(b)有序结构的点阵型式为简单四方,结构基元为CuAu,上述所示的立方晶胞[图9.23(b)]可进一步划分成两个简单四方晶胞,相当于两个结构基元。取[图9.23(b)]中面对角线的1/2为新的简单四方晶胞的轴和轴,而轴按[图9.23(b)]不变,在新的简单四方晶胞中原子分数坐标为:(c)无序结构的点阵型式为面心立方,它的最小衍射角指标应为111,因此最小衍射角为:有序结构属四方晶系,其面间距公式为:根据Bragg方程,最小衍射角对应于最大衍射面间距,即对应于最小衍射指标平方和。最小衍射指标平方和为1。因此。符合条件的衍射可能为100,010和001。但有序结构的点阵型式为简单四方,,因此符合条件的衍射只有001。最小衍射角可按下式计算:【8.24】和分别属于体心立方堆积(bcp)和面心立方堆积(ccp)两种晶型。前者的原子半径为,后者的原子半径为/(a)对:①下列“衍射指标”中哪些不出现?110,200,210,211,220,221,310,222,321,,521。②计算最小角对应的衍射面间距;③写出使晶胞中两种位置的原子重合的对称元素的名称、记号和方位。(b)对:①指出密置层的方向;
①拖把该密置层中所形成的三角形空隙看作具体的结构,支持该结构的结构单元;②计算二维堆积密;③请计算两种铁的密度之比。解:(1)(a)体心的衍射指标要求指标之和为偶数,即偶数。所以210,221两个衍射不可能出现。(b)最小角度的衍射指标为110。半径为r的原子进行体心密堆积,。(c)晶胞中两种位置上Fe原子的坐标为(Ⅰ)和轴平行,坐标为的轴。(Ⅱ)和面平行,坐标为1/4的n滑移面。均可使晶胞中的两个Fe原子重合。(2)(a)密置层和(111)面平行。(b)密置层的结构基元为1个Fe原子,即其素晶胞包含1个Fe原子。晶胞中含三角形空隙2个,即结构基元为1个Fe原子和2个三角形空隙。(c)密置层的二维堆积密度为:原子所占面积/六方素晶胞的面积=(d)若面心立方堆积以下标F表示,体心堆积以下标I表示,则:【8.25】某金属晶体属于结构,原子半径为:(a)计算;(b)画出该警惕的晶胞沿特征对称元素的投影图,在图上标出特征对称元素的位置并给出名称(亦可用符号表示);(c)画出该晶体的多面体空隙中心沿特征对称元素的投影图(可分别用和表示八面体和四面体),画出由和构成的二维点阵结构的点阵素单位,指出结构单元。解:(a)(b)该晶体属六方晶系,特征对称元素为六重对称轴,包括和轴。六方晶胞沿六重轴的投影图及特征对称元素的位置分别示于图9.25(a)和9.25(b)。原子旁标明的0,等数字表示它在轴(或z轴)上的分数坐标位置。
(c)hcp晶体结构中存在四面体空隙(以黑球表示其中心位置)和八面体空隙(以白球表示其中心位置),如图9.25所示。图中多面体空隙的位置是相对图9.25(a)所示的结构,标明的数字是c轴的分数坐标,结构基元是4个四面体空隙和2个八面体空隙。9离子化合物的结构化学【9.1】的晶体结构属型,最短距离为。(a)利用公式计算点阵能(b)原子的第二电子亲和能不能直接在气相中测定,试利用下列数据及(1)中得到的点阵能数据,按循环计算。解:
(a)(b)为便于书写,在下列Bron-Haber循环中略去了个物理量的单位——。【9.2】写出下列型晶体点阵能大小的次序及依据的原理。解:晶体点阵能的计算公式可写为:由于题中所论金属同属NaCl型,因而它们的Madelung常数A相同,而Born指数m差别也不大,所以点阵能大小主要取决于。将所论警惕分为3组:ScN;CaO,SrO,BaO;NaBr,KBr。第二组中3个氧化物的正、负离子的电价都相同,但离子半径从Ca2+到Ba2+依次增大,因而键长从CaO到BaO依次增大,所以点阵能绝对值从CaO到BaO依次减小。根据同样的道理,第三组中两个溴化物点阵能的绝对值大小次序为NaBrKBr。ScN和CaO相比,前者的键长大于后者,但差别不是很大,而前者的电价却比后者大很多,因而前者的点阵能绝对值比后者大。BaO和NaBr相比,前者电价大而键长小,因而其点阵能绝对值大于后者。综上所述,6种晶体点阵能大小次序为:ScNCaOSrOBaONaBrKBr【9.3】已知离子半径:,,,,若立方晶系和晶体均服从离子晶体的结构规则,请判断这两种晶体的正、负离子的配位数,配位多面体型式,负离子的堆积方式,晶体的结构型式。解:由已知数据计算出两种晶体的正、负离子的半径比
,根据半径比即可判断正离子的配位数CN+、配位多面体的形式和负离子的堆积方式。由正离子的配位数和晶体的组成即可判断负离子的配位数CN-(CN-=CN+×正离子数/负离子数)。根据上述结果和已知的若干简单离子晶体的结构特征即可判断CaS和CsBr的结构型式。兹将结果列于下表:r+/r-CN+CN-配位多面体形式负离子堆积方式结构型式CaS0.53866正八面体立方最密堆积NaCl型CsBr0.93388立方体简单立方堆积CsCl型【9.4】已知和离子半径分别为115和,若碘化银结构完全遵循离子晶体结构规律,的配位数应为多少?实际上在常温下的结构中,的配位数应为多少?为什么?解:按题中所给出的数据,Ag+和I-的离子半径之比为115pm/220pm=0.523。若AgI的结构完全遵循离子晶体的结构规律,则Ag+的配位数应该为6,配位多面体应该为八面体。但实际上,在室温下AgI晶体中Ag+的配位数为4,配位多面体为四面体。其原因在于离子的极化引起了键型的变异,从而导致了结构型式的改变。Ag+的半径较小且价层轨道中含有d电子,因而极化能力较强,而I-的半径较大,极化率较大即容易被极化。因此,AgI晶体中存在着较大程度的离子间极化,这使得AgI晶体产生了一系列有别于其他AgX晶体的结构效应。离子的极化作用,导致电子云变形,使正、负离子间在静电作用的基础上增加了一份额外的相互作用,引起键型变异。就AgX晶体而言,从AgF到AgI,键型由离子键逐渐向共价键过度。事实上,AgI已经以共价键为主。键能和点阵能增加,键长缩短。AgI晶体中Ag——I键键长为281pm,已经接近Ag和I的共价半径之和286pm。离子的极化不仅影响化学键的性质,而且也影响晶体的结构型式。它往往引起离子的配位数降低,配位多面体偏离对称性较高的正多面体,使晶体从对称性较高的结构型式向对称性较低的结构型式(有时甚至有层型、链型或岛型)过度。AgF,AgCl和AgBr晶体都属于NaCl型,而AgI属于ZnS型。在AgI晶体中,Ag+的配位数不是6而是下降为4,配位多面体不是八面体而是四面体。实际上,本题中所给出的离子半径数据是配位数为6时的数据。【9.5】晶体为简单立方点阵结构,晶胞中包含1个和1个,晶胞参数。(a)若热运动呈球形,试画出晶胞结构示意图;(b)已知半径为,求球形的半径;(c)计算晶体密度;(d)计算平面点阵族(110)相邻两点阵面的间距;(e)用射线进行衍射,计算衍射指标330的衍射角值;(f)若不因热运动而转动,为有序分布,请讨论晶体所属的点群。解:(a)晶胞结构示于图10.5(a)。
(a)设球形和Cl-的半径分别为和,由于两离子在晶胞对角线方向上接触,因而有:(b)晶体的密度为:(d)(110)点阵面的面间距为:(e)代入已知数据得:也可根据直接有(d)中已经算出的求出(这里),代入,进而求出。(f)若把看成球形离子,则NH4Cl晶体属点群,若不因热运动而转动,则不能简单地把它看作球形离子。此时4个H原子按四面体方向有序的分布在立方晶胞的体对角线上[见图10.5(b)],NH4Cl晶体不再具有轴和对称中心等对称元素,只保留了3个,4个和6个。因此,其对称性降低,不再属于点群而属于点群。
【9.6】具有型结构。已知立方晶胞参数,半径为,推算负离子的半径,根据反应阐明的酸碱性。解:由于NaH具有NaCl型结构,因而Na+的半径,H-的半径及晶胞参数有如下关系:NaH水解生成H2和NaOH,说明H-接受质子的能力比OH-强,即NaH的碱性比NaOH的碱性还强。【9.7】第三周期元素氟化物的熔点从开始下降(见下表),试从结构观点予以分析,说明。化合物熔点/99312611291-90-83-50.5解:NaF和MgF2都是典型的离子晶体.分属于NaCl型和金红石型。A1F3晶体中虽然由于Al3+的价态较高半径较小而存在着一定程度的离子极化,但它仍属于离子晶体。晶体中正、负离子间有较强的静电作用,故三种晶体的熔点都较高。虽然三种离子晶体分属于不同的结构型式,Madelung常数有差别,但影响它们点阵能大小的主要因素是离子的电价和离子键的长度。从NaF到A1F3,正离子的电价逐渐增高而半径逐渐减小,因而点阵能逐渐增大,致使晶体的熔点逐渐升高。随着正离子电价的进一步升高和半径的进一步减小,极化能力进一步增强。从而使化合物的键型和构型都发生了变化。从SiF4开始的三个氯化物已不是离子化合物了。原子间靠共价键结合形成分子,分子间靠范德华力结合形成晶体。由于范德华力比离子键弱得多,因而这3个氟化物的熔点大大降低。从SiF4到SF6熔点逐渐略有升高,是因为分子间作用力(主要是色散力)略有增大所致。【9.8】经射线分析鉴定,某一离子晶体属于立方晶体,其晶胞参数。晶胞中顶点位置为所占,体心位置为所占,所有棱心位置为所占。请据此回答或计算:(a)用分数坐标表达诸离子在晶胞中的位置;(b)写出此晶体的化学式;
(a)指出晶体的点阵型式、结构单元和点群;(b)指出的氧配位数与的氧配位数;(c)计算两种正离子半径值(半径为140);(d)检验此晶体是否符合电价规则,判断此晶体中是否存在分立的络离子基团;(e)和联合组成哪种型式的堆积?(f)的配位情况怎样?解:(a)Ti4+:0,0,0Ba2+:O2-:(b)一个晶胞中的Ba2+数为1,Ti4+数为,O2-数为。所以晶体的化学组成为BaTiO3[由(a)中各离子分数坐标的组数也可以知道一个晶胞中各种离子的数目]。(c)晶体的点阵型式为简单立方,一个晶胞即一个结构基元,晶体属于点群。(d)Ti4+的氧配位数为6,Ba2+的氧配位数为12。(e)在晶胞的棱上,Ti4+和O2-互相接触,因而Ba2+和O2-在高度为且平行于立方晶胞的面对角线方向上互相接触,因而Ba2+的半径为:(f)Ti——O键的静电键强度为,Ba——O键的静电键强度为。O2-周围全部静电键强度之和为,等于O2-的电价(绝对值)。所以BaTiO3晶体符合电价规律。晶体不存在分离的络离子基团。(g)Ba2+和O2-在BaTiO3立方晶胞中联合组成立方最密堆积,只是两种离子的半径不同而已。(h)实际上,在(f)中已经表明:O2-的钛配位数为2,O2-的钡配位数为4。【9.9】具有六方型结构的晶体,其六方晶胞参数为,;已知原子的分数坐标和原子的分数坐标。请回答或计算下列问题;(a)按比例清楚地画出这个六方晶胞;(b)晶胞中含有几个;(c)画出点阵式,说明每个点阵点代表什么?(d)作什么型式的堆积。填在什么空隙中?(e)计算键键长。解:(a)SiC六方晶胞的轴比,Si原子和C原子的共价半径分别为113pm和77pm,参照这些数据和原子的坐标参数,画出SiC的六方晶胞如图
10.9a。(a)一个晶胞含有的C原子数为(顶点原子)+1(晶胞内原子)=2,Si原子数为(棱上原子)+1(晶胞内原子)=2。所以一个SiC六方晶胞中含2个SiC。(b)点阵型式为简单六方(见图10.9b),每个点阵代表2个SiC,即2个SiC为1个结构基元。(c)Si原子作六方最密堆积,C原子填在由Si原子围成的四面体空隙中。Si原子数与四面体空隙数之比为1:2(见习题9.08),而C原子数与Si原子数之比为1:1,所以C原子数与四面体空隙数之比为1:2,即C原子只占据50%的空隙。(d)由(a)中的晶胞图可见,Si—C键键长为:【9.10】说明硅酸盐结构的共同特征。解:硅酸盐结构的基本单位是四面体。这些四面体互相公用顶点连接成各种各样的结构形式。四面体每个顶点上的至多只能为两个四面体共用,符合Pauling电价规则。一般说来,Si原子处在四面体的中心,键长、键角的平均值为:。由于A13+的大小和Si4+相近,Al3+可以或多或少、无序或有序地置换硅酸盐中的Si4+,形成硅铝酸盐。此时Al原子处在四面体中,和Si一起组成硅铝氧骨干。Al3+置换Si4+后,骨架中带有一定负电荷,需要骨架外引入若干正离子以补偿电荷,其中包括—部分处在配位八面体中的Al3+。在硅铝酸盐中,[(Si,A1)O4]只共顶点连接,而且2个Si—O—Al的能量低于Al—O—Al和Si—O—Si能量的和。四面体的连接方式决定于硅铝氧骨干的结构型式,而硅铝氧骨干的结构型式又决定了硅铝酸盐的类型。根据硅铝氧骨干的结构型式,可将硅铝酸盐分为分立型、链型、层型和骨架型。在硅铝酸盐中.硅铝氧骨干外的金属离子容易被其他金属离子置换,置换后骨干的结构变化不大,但对硅铝酸盐的性质影响很大。这一点对于分子筛的交换反应尤其重要。【9.11】为什么能部分置换硅酸盐中的硅?置换后对硅酸盐组成有何影响?解:从离子半径分析,Al3+的Pauling离子半径为50pm,Si4+为4lpm.O2-为140pm。
A13+和O2-与Si4+和O2-的都处在0.225-0.414的范围.应形成四面体配位结构。两种正离子电价分别为+3和+4价,都比较高,用A13+置换Si4+,不会引起结构上的大变化。实际上Si—O键以共价性为主,Si用sp3杂化轨道和O原子成键;A1一O键也以共价性为主,成键情况也相似。所以在硅酸盐中,铝能部分地置换硅。铝置换硅后,为了保持硅酸船的电中性.必须引进其他正离子,如Na+,K+,Ca2+和Mg2+等,共同组成硅铝酸盐。这在组成上可以有很大的可变性.形成多种多样的硅酸盐。【9.12】说明离子晶体结构的规则的内容。解:离子晶体结构的Pauling规则包括以下三方面内容:(1)关于离子配位多面体性质的规则:在正离子周围形成了负离子配位多面体。正、负离子间的距离取决于正、负离子的半径之和,正离子的配位数和配位多面体型式则取决于正、负离子的半径比。几种主要的配位多面体、正离子的配位数以及相应的正、负离子半径比的最小值列于表10.12。配位多面体配位数(r+/r-)最小值三角形30.155四面体40.225八面体60.414立方体80.732立方八面体121.000(2)关于一个多面体顶点为几个多面体公用的规则,又称作电价规则。该规则指出:在一个稳定的离子化合物结构中,每一负离子的电价等于或近乎等于从邻近正离子至该负离子的各静电键强度的总和,即:式中为负离子的电价,为正离子的电价,为正离子的配位数,为静电键强度。电价规则规定了公用同一配位多面体顶点的多面体数目,或者说解决了一个负离子与几个正离子相连的问题。因此,根据电价规则可判断在晶体中是否存在分立的络离子基团(见10.08题)。这对于分析多元离子晶体的结构很有帮助,因为在多元离子晶体中一个负离子可与若干个种类不同的正离子相连。根据电价规则,可为二元离子晶体建立正、负离子的配位数比与电价比间的关系。而根据电荷平衡原理,电价比与组成比成反比,因此,配位数比、电价比、组成比三者之间的关系就沟通了。这对于由正、负离子的半径比推求负离子的配位数,以及根据负离子的堆积方式和化合物的组成,推求正离子占据多面体空隙的分类大有帮助(见10.20题和10.21题)。三者的关系如下:式中和分别是正、负离子的配位数,和分别是正、负离子的电价,和分别是正、负离子的数目。(3)关于离子配位多面体共用顶点、棱边和面的规则:在离子晶体中,配位多面体共边连接和共面连接会使结构的稳定性降低。正离子的价态越高、配位数越小,这一效应就越显著。离子晶体结构稳定性降低主要是由正离子间的库仑斥力引起。当正离子的配位多面体共边连接时,正离子之间的距离缩短,斥力增大。导致晶体结构稳定性降低。当配位多面体共面连接时,正离子间的距离更短,斥力更大,晶体结构更不稳定。对价态较高的正离子来说尤其如此。
将这一规则的含义引伸,可得到如下推论:在含有几种正离子的晶体中,价态高而配位数小的正离子,趋向于彼此间不共用多面体的几何元素。Pauling规则在阐明离子晶体的结构和性能中起重要作用,特别是电价规则。但它是个定性规则,近年来提出的键价法,用原子间的距离和经验参数定量地计算晶体中每个原子的键价,用以解释和预测复杂晶体的结构和性能,发展了Pauling的电价规则。【9.13】回答下列有关型分子筛的问题:(a)写出,,,型分子筛的化学组成表达式及其用途;(b)最大孔窗由几个和几个原子围成?(c)简述筛分分子的机理。解:(a)分子筛是一种天然或人工合成的泡沸石型硅铝酸盐晶体。已发现的天然沸石约有40余种,主要是丝光沸石、斜发沸石、方沸石和钙十字沸石等。人工合成的沸石计有100余种,其中A型、X型、Y型和ZSM型分子筛已在工业生产和科学研究中发挥着重要作用。人工合成的A型、X型和Y型等分子筛的化学组成可用通式表示。由该通式可见,A13+和Si4+的数目之和为O2-数的一半,这表明这几类分子筛都具有骨架型结构。在一般情况下,A13+数比Si4+数小。若Al3+数超过Si4+数,则会在结构中出现四面体直接相连的情况.由于Al—O静电键强度小于Si—O静电键度,这会削弱骨架强度。通常,为使分子筛热稳定性好、耐酸性强,总是希望硅铝比高些。化学通式中的M是骨架外的金属离子。为保持分子筛呈电中性,若M是一价离子,则r=p,即在骨架中引入一个A13+代替Si4+,则在骨架外就引入一个—价正离子。若M为二价离子,则r=p/2,等等。A型分子筛主要有3种,即3A,4A和5A型分子筛。4A分子筛是A型分子筛钠盐,属予立方晶系,晶胞参数=2464pm,晶胞的组成为。若不考虑A13+和Si4+位置的差别,则可划分出体积只有原晶胞体积1/8(即晶胞参数只有原晶胞参数的1/2)、组成为的“假”晶胞。这种A型分子筛的有效孔径[见(b)题]约,故称为4A分子筛或NaA分子筛,若用K+代替Na+,由于K+的半径比Na+的半径大,分子筛的有效孔径减小至左右,称为3A型分子筛或KA型分子筛。其化学组成为。当用Ca2+取代Na+时,由于Ca2+的电价是Na+的2倍,因而Ca2+的数目是被其取代的Na+数目的一半。而Ca2+的半径和Na+的半径相近,它优先占据六元环的位置。当晶胞中约有2/3的Na+被取代时,八元环不再为骨架外的离子所占,这使分子筛八元环的有效孔径增大至约5,称为5A分子筛或CaA型分子筛,其典型组成为。
如前所述,分子筛已在工业生产和科学研究中发挥着重要作用。5A分子筛可用于石油脱蜡,使油品凝固点降低,分离出的正烷烃可作为洗涤剂原料。它还可用于气体或液体的深度干燥及气体的纯化。也可用来分离甲烷、乙烷和丙烷。4A分子筛是制备5A分子筛和3A分子筛的原料,它可用于气体和液体的深度干燥相纯化。3A分子筛用于深度干燥乙烯和丙烯等气体。分子筛对水的吸附能力很强,吸附容量很大,可将空气中水的含量从4000ppm降至10ppm。此外,A型分子筛不潮解、不膨胀、不腐蚀、不污染、可再生,是理想的吸附剂、干燥剂和分离剂,某些A型分子筛还可作为一些化学反应的催化剂。(b)将一正八面体分别沿着垂直于轴的方向削去顶角,所得到的多面体称为立方八面体。削去6个顶点得到6个四边形,而原来的8个三角形都变成了六边形,所以立方八面体是一个十四面体,有24个顶点、36条棱。可看作由立方体和八面体围聚而成。在分子筛结构中,硅(铝)氧四面体通过顶点上的O2-互相连接形成环,环上的四面体再通过顶点上的O2-互相连接形成三维骨架。在骨架中形成了许许多多面体空穴,常称为“笼”。A型分子筛就是由立方八面体笼、笼和立方体笼构成的。立方八面体笼又称为笼或方钠石笼。其几何结构特征可用上述的立方八面体模拟。笼的平均有效直径为660pm,有效体积约。将笼放在立方体的8个顶点上,笼和笼通过立方体相连,则8个笼相连后形成一个笼,此即A型分子筛的结构[见图l0.13(a)]。笼是一个二十六面体,由12个四元环、8个六元环和6个八元环组成,共有48个顶点、72条棱。A型分子筛的最大窗口是八元环,由8个硅(铝)氧四面体构成。八元环包含8个硅(铝)离子和8个氧离子。该八元环的有效孔径约为420pm。若把环看成正多边形,则八元环的直径可按图10.13(b)估算。所以八元环的直径为:(c)如前所述,8个笼通过立方体互相连接形成笼。它是A
型分子筛最大的空穴,平均有效直径为1140pm,有效体积为。(d)脱水后的分子筛具有空旷的骨架型结构,在结构中有许多孔径均匀的通道和排列整齐、内表面很大的空穴。孔径大小数量级与一般分子相当,它只允许直径比孔径小的分子进入,直径比孔径大的分子被拒之门外,从而将大小、形状不同的分子分开,起筛分分子的作用,故而得名。【9.14】已知氧化铁(富氏铁)为氯化钠型结构,在实际晶体中,由于存在缺陷,。今有一批氧化铁,测得其密度为,用射线测得其面心立方晶胞衍射指标为200的衍射角。(的相对原子质量为58.70)(a)计算的立方晶胞参数;(b)算出值,写出标明的价态的化学式;(c)在晶体中,的堆积方式怎样?在此堆积中占据哪种空隙?占有率(即占有百分数)是多少?(d)在晶体中,间最短距离是多少?解:(a)(b)(c)设0.92铁中的摩尔数为,则的摩尔数为,根据正负离子电荷平衡原理可得:即和的摩尔数分别为0.76和0.16,它们在总铁中的摩尔百分数分别为:(d)富氏体氧化铁的化学式为;【9.15】NiO晶体为NaCl型结构,将它在氧气中加热,部分Ni2+将氧化为Ni3+,成为NixO(x<1)。今有一批NixO,测得其密度为6.47g·cm-3,用波长λ=154pm的x射线通过粉木法测得立方晶胞111衍射指标的θ=18.71°(sinθ=0.3208)。Ni的相对原子质量为58.70。(a)计算NixO的立方晶胞参数;
(b)算出x值、写出标明Ni的价态的化学式;(c)在NixO晶体中,O2-的堆积方式怎样?Ni在此堆积中占据哪些空隙?占有率(即占有分数)是多少?(d)在NixO晶体中,Ni-Ni间最短距离是多少?解:(a)由题可得的立方晶胞参数为:(b)因为晶体为NaCl型结构,可得摩尔质量M:而摩尔质量又可表示为:由此解得:设0.92镍中的摩尔数为,则的摩尔数为,根据正负离子电荷平衡原理可得:所以该氧化镍晶体的化学式为:(c)晶体既为NaCl型结构,则O2-的堆积方式与NaCl晶体中Cl-的堆积方式相同,即为立方最密堆积。镍离子占据由O2-围成的八面体空隙。而镍离子的占有率为92%。(d)镍离子分布在立方晶胞的体心和棱心上,Ni—Ni间的最短距离即体心上和任一棱心上2个镍离子间的距离,它等于:Ni—Ni间的最短距离也等于处在交于同一顶点的2条棱中心上的2个镍离子间的距离,即:【9.16】从晶体结构出发,考虑下列问题:(a)除去其中全部,剩余是何种结构型式?(b)沿垂直三重轴方向抽去一层,保留一层,是何种结构型式?解:离子晶体的结构可理解为在静电力作用下的非等径圆球的密堆积结构。即半径较大的负离子作某种型式的密堆积,半径较小的正离子按一定比例填充在由负离子围成的多面体空隙中。(a)在NaCl晶体结构中,Na+占据由Cl—围成的正八面体空隙,占据该类空隙的比率为1
。若把结构中的Na+全部除去,则剩余的Cl—按立方最密堆积;同样,若把结构中的Cl—全部除去,则剩余的Na+构成的结构型式也是立方最密堆积。可由图10.16得到说明。图10.16是在NaCl晶体的立方复晶胞的基础上画出来的,图中的大圆圈代表Cl—,小圆圈代表Na+。交汇于顶点M的3条棱中心上的Na+所处的密置层为A,交汇于顶点N的3条棱中心上的Na+所处的密置层为C,而在其他6条棱中心和体心上的Na+所处的密置层为B。这些密置层都垂直于图中所示的轴,它们沿着轴的重复方式为…ABCABC…,即除去Cl—后Na+按立方最密堆积。图10.16(b)若沿垂直于三重抽方向抽去一层Na+,保留一层Na+,则形成的结构为CdCl2。这是一种层型结构,层型分子沿垂直于层的方向堆积。Cl—仍按立方最密堆积,正离子填入八面体空隙中。若用A,B,C代表Cl—,用a,b,c代表正离子,则重复周期可写为。【9.17】属立方晶系晶体,,原子分数坐标为;(a)若把放在晶胞原点,请重新标出原子分数坐标;(b)说明和的配位数和配位型式;(c)晶体属于哪个点群?解:(a)Ag:。即把原来各组分数坐标分别减去。O:。即把原来各组分数坐标分别加上。(b)Ag原子的配位数为2,配位型式为直线型。O原子的配位数为4,配位型式为四面体。(c)Ag2O晶体属点群。【9.18】一种高温超导体的晶体属正交晶系。空间群为;晶胞参数,,,晶胞中原子坐标参数如下表所示:
原子1/21/21/21/21/20.1844000000.355401/201/200.378801/20.3771000.1579试按比例画出晶胞大小及晶胞中原子的分布,并和立方晶系的结构(10.8题)对比,指出有哪些异同。解:根据题中所给数据,画出晶体的晶胞示意图如图10.18。图10.18虽然晶体属于正交晶系,但是其结构可从立方晶系的晶体结构出发加以理解。立方晶体属于钙钛矿(CaTiO3)型结构(见10.08题),这种结构型式可看作氧化物超导材料晶体结构的基本单元。这些单元通过不同的堆叠方式组合成多种型式的氧化物超导相的晶体结构。由于存在着原子的空隙、置换以及位移等因素,氧化物超导体的结构与钙钛矿型结构有许多差异,下面以晶体和立方BaTiO3晶体为例作一简要说明。立方BaTiO3晶体和
晶体的周期性和对称性都不同。前者属于立方晶系,空间群为,后者属于正交晶系,空间群为。两种晶体中离子的配位数及配位型式也不同。在立方BaTiO3晶体中,Ti4+的氧配位数为6,配位多面体为正八面体;Ba2+的氧配位数为12。在晶体中,Ba2+的氧配位数为10;Y3+的氧配位数为8,配位多面体呈四方柱形;Cu2+的氧配位数为5,配位多面体为四方锥,Cu3+的氧配位数为4,配位多面体呈平面四方形。此外,两种晶体中O2—的配位情况、晶胞大小以及晶体的密度等也不同。氧化物高温超导体是结构比较复杂的一类化合物。其超导性主要决定于下面的结构特征:(1)氧化物超导体均含有混合价态的正离子。例如,在晶体中,既有Cu2+,也有Cu3+。根据正、负电荷平衡原理,假定Ba2+和Y3+不变价,则当x=0时,Cu2+和Cu3+的数量比为2:1;当x=0.2时,Cu2+和Cu3+的数量比为4:1。(2)一般地,氧化物高温超导体中金属和氧之间的化学键中有较强的共价键成分,这种较强的共价键可提供具有金属性的能带。(3)正如的晶体结构示意图所表明的,在含Cu氧化物超导体中,常形成组成为CuO2的网格层,层中Cu—O—Cu近似直线连接。网格层的存在对超导性起重要作用。对组成为(式中B为Bi或Tl,A为Ba或Sr)的一类超导体,连续堆叠的CuO2网格层的数目N愈大,则临界温度愈高。(4)在制备含Cu的氧化物超导材料时,常掺杂某些正离子,如Ba2+,Y3+,La3+等,其作用可能是促CuO2进网格层的形成,增加Cu—O键的共价性,并增加高氧化态的稳定性。【9.19】(黄铁矿)的晶体结构与的晶体结构相似:和的中心分别处在与和相当的位置上。实验测得的密度为,射线在产生第一个衍射。试由这些数据计算常数。解:依题意,FeS2(黄铁矿)晶体的结构与NaCl晶体的结构相似,因而每个立方晶胞中含4个Fe原子和8个S原子;空间点阵型式为面心立方,第一个衍射指标为111。将Bragg方程和立方晶系间距公式联立,得该FeS2晶体的晶胞参数为:根据晶体的密度D,摩尔质量M,晶胞参数及晶胞中的“分子数”Z,即可求出Avogadro数:【9.20】在晶体中,作型密堆积。若按和的离子半径分别为和计算,则应该占据什么空隙?占据空隙的分数是多少?占据空隙的方式有多少种?解:离子半径是一个重要的结构参数:在二元离子晶体中,正、负离子的半径和决定了离子键长度;而正、负离子的半径比决定了正离子的配位数和配位多面体型式。在晶体中,Cl-堆积成正四面体和正八面体两种空隙。根据所给数据,Ti3+和Cl—的半径比为,介于0.414和0.732之间,所以Ti3+
应占据正八面体空隙。由于Cl—作A3型堆积,因而Cl—的数目与正八面体空隙的数目之比为1:1,Ti3只占据1/3的正八面体空隙。三氯化钛是烯烃聚合反应中著名的Ziegler—Natta催化剂的主要组分。它有等几种变体,这几种变体的结构不同,在催化反应中的行为也有差异。晶体属于六方晶系,每个晶胞中含2个Ti3+和6个Cl—。由上可知,Ti3+的配位数为6,根据二元离子晶体中配位数比与组成比成反比的规律可知,Cl—的配位数为2。沿着c轴方向形成链型分子,即链分子的伸展方向与由Cl—形成的密置层垂直。但由于沿着c轴重复方式简单,因而重复周期较小。解:(a)C60分子堆积成的立方最密堆积结构沿四重轴方向的投影图见图10.21。四面体空隙中心的分数坐标为:。八面体空隙中心的分数坐标为:。(b)首先,由晶体结构参数求出C60分子的半径R。由hcp结构的晶胞参数求得:也可由ccp结构的晶胞参数求R,结果稍有差别。由C60分子堆积成的两种最密堆积结构中,四面体空隙和八面体空隙都是相同的。四面体空隙所能容纳的小球的最大半径为:八面体空隙所能容纳的小球的最大半径为:(c)K3C60可视为二元离子晶体,但题中并未给出K+的半径值,因此无法根据半径比判断K+所占多面体空隙的类型。可从结构中的一些简单数量关系推引出结论。一个K3C60晶胞中共有12个多面体空隙,其中4个八面体空隙(其中心分别在晶胞的体心和棱心上)、8个四面体空隙(其中心的分数坐标为等)。而一个晶胞中含4个C60分子,因此,多面体空隙数与C60分子数之比为3:1。从晶体的化学式知,K+数与C60分子数之亦为3:1。因此,K+数与多面体空隙数之比为1:1,此即意味着K3C60晶体中所有的四面体空隙和八面体空隙皆被K+占据,即K+占据空隙的百分数为100%。【9.21】由于生成条件不同,球形分子可堆积成不同的晶体结构,如立方最密堆积和六方最密堆积结构。前者的晶胞参数;后者的晶胞参数。(a)画出的结构沿四重轴方向的投影图;并用分数坐标示出分子间多面体空隙中心的位置(每类多面体空隙中心只写一组坐标即可)。(b)在的和结构中,各种多面体空隙理论上能容纳的“小球”的最大半径是多少?(c)
分子还可形成非最密堆积结构,使某些碱金属离子填入多面体空隙,从而制得超导体材料。在所形成的立方面心晶胞中,占据什么多面体空隙?占据空隙的百分数为多少?解:(a)由该分子筛所属的晶系和空间群的记号可知,它属于点群,空间点阵型式为面心立方。(b)根据该分子筛晶体所属的点群,可知其宏观对称元素有:3个C4轴、4个C3轴、6个C2轴、6个、3个和对称中心i。根据该分子筛晶体所属的晶系,可知其特征对称元素为4个按立方晶胞体对角线取向的C3轴。图10.21(c)硅铝比是指分子筛晶体中SiO2/Al2O3的比值。硅铝比高的分子筛热稳定性好。Y型分子筛的硅铝比较高,一般在3.0-5.0之间。按题中所给的晶胞组成计算,该Y型分子筛的硅铝比为136/28。(d)依题意,可得该Y型分子筛晶体的密度D、晶胞参数、“晶胞式量”(此处不妨视为晶体的摩尔质量)M以及Avogadro常数之间的关系如下:去掉单位即“晶胞式量”,而晶胞式量又可表示为:所以即该Y型分子筛的一个晶胞中含有262个结晶水。【9.22】型分子筛属于立方晶系,空间群为,其晶胞参数为,晶胞组成为。(a)说明该分子筛晶体所属的点群空间点阵型式;(b)说明该分子筛晶体的宏观对称元素和特征对称元素;(c)计算硅铝比;(d)已知该分子筛的密度为,求晶胞中结晶水的数目。解:(1)和(2)的计算如表10.23。由表所得为全奇或全偶,属立方面心点阵型式。表10.23
29.6014.800.25540.0653311134.3017.150.29490.08695420049.2924.650.41710.17395822058.5629.280.48900.23921131161.3930.690.51050.26061222272.2836.140.58950.34781640082.5041.250.65930.43472042092.5146.2550.72240.521924422113.0456.520.83410.695732440#将第一条线的值除以3,得0.0218。这栏目的数值即相当于衍射指标的平方和。(3)晶胞参数可用高角度的3条线计算、平均而得。440:422:420:的平均值为。(4)即晶胞中含有4个。(5)该晶体点群为:空间群国际记号为:(6),该纳米颗粒(立方体)边长为。设表面层厚度为的直径,即表面原子占总原子数的百分比为:【9.23】晶体属于立方晶系。用射线粉末法测得各衍射线值如下:(a)通过计算,确定该晶体的空间点阵型式;(b)通过计算,将各衍射线指标化;(c)计算该晶体正当晶胞参数;(d)测得该晶体的密度为,请计算一个晶胞中的离子数;(e)发现该晶体在和方向上都有镜面,而在方向有
轴,请写出该晶体点群的熊夫利记号和空间群国际记号;(a)若某纳米颗粒形状为立方体,边长为晶胞边长的10倍,请计算其表面原子占总原子数的百分比。解:(1)和(2)的计算如表10.23。由表所得为全奇或全偶,属立方面心点阵型式。表10.2329.6014.800.25540.0653311134.3017.150.29490.08695420049.2924.650.41710.17395822058.5629.280.48900.23921131161.3930.690.51050.26061222272.2836.140.58950.34781640082.5041.250.65930.43472042092.5146.2550.72240.521924422113.0456.520.83410.695732440#将第一条线的值除以3,得0.0218。这栏目的数值即相当于衍射指标的平方和。(3)晶胞参数可用高角度的3条线计算、平均而得。440:422:420:的平均值为。(4)即晶胞中含有4个。(5)该晶体点群为:空间群国际记号为:(6),该纳米颗粒(立方体)边长为。设表面层厚度为的直径,即表面原子占总原子数的百分比为:【9.24】由,和组成的三元离子晶体的结构可看作和一起有序地进行立方最密堆积。该晶体晶胞的顶点位置被占据,体心位置被占据,面心位置被
占据:(a)画出晶胞,写出各离子的坐标参数;(b)写出该晶体的化学式;(c)写出该晶体的空间点阵型式;(d)以位置为晶胞顶点,写出该各离子的分数坐标;(e)判断该晶体中是否存在离子的络离子,简述理由。解:(a)晶胞如图10.24(a)所示。(b)CaTiO3(c)简单立方(d)晶胞如图10.24(b)所示。(e)不存分离的络离子。因为O2-的电价(绝对值)恰好等于它周围全部静电键强度之和。即:10次级键及超分子结构化学【10.1】在硫酸盐和硼酸盐中,和的构型分别为正四面体和平面正三角形,键和键的键长平均值分别为和,试计算和键的键价以及原子和原子的键价和。解:将查得的值和B值数据代入计算价键的公式。:S原子的键价和为。此值和S原子的氧化态6相近。:B原子的键价和为。此值和B原子的原子价3相近。
【10.2】(弯曲形)、(三角锥形)和(四面体形)离子中,键的平均键长值分别为,和,试分别计算其键价及键价和。解::中Cl原子键价和为和氧化态为3相近。:中Cl原子的键价和为和氧化态为5相近。:中Cl原子的键价和为和氧化态为7相近。【10.3】试计算下列化合物已标明键长值的键键价。说明稀有气体原子在不同条件下和其他原子形成化学键的情况。按(7.1.3)式计算键时值为,,,值为。(a)XeF2(直线形):Xe-F200pm(b):(c):(d):(e):平面五角形的离子中解:(a):(b):
:(c):(d):(e):Xe和F的范德华半径和为216pm+147pm=363pm。上述化学键中成键两原子间的键距均短于范德华半径和。Xe原子既可以和F,O,C等原子成共价键,也可形成次级键。【10.4】具有型的晶体结构,试根据表7.1.1的数据估算键的键长及的半径[按的离子半径为,和的离子半径和即为的键长计算]。解:CaO中是+2价离子,周围有6个距离相等的,按键价和规则,每个键的键价(S)为(2/6)=0.333。查表得键的,代入得:的离子半径为237.4pm-140pm=97.4pm【10.5】具有型结构,试根据表7.1.1数据估算离子半径。解:查表得和结合时,值为。B值为,代入(1)式得:间键距的离子半径为【10.6】试说明氢键的本事及其形成的条件。解:在氢键中,当H原子以共价键和X结合时,由于X的电负性高,尖电子偏向X,H原子带部分正电荷,当和有孤对电子而电负性强的Y原子接触,彼此间的静电吸引作用使之结合而成氢键。对于若干强氢键如、
则以形成三中心四电子的共价键为主。氢键的形成条件是X,Y都是强电负性原子,一般不小于。【10.7】怎样知道液态水中仍保留一定的氢键?怎样解释水在时密度最大?解:从能量看,冰的升华热高达。融化热为。冰中分子间的结合力大部分是氢键力,冰融化为水后,氢键结合力依然存在。从Raman光谱等数据也证明水中仍保持一定的氢键。冰的结构中,每个分子均和周围4个分子按四面体方式形成氢键,因此它具有空旷的低密度的结构,冰的密度比水低,冰变为水密度增加,氢键破坏的多,谜底增加得多,另一方面温度升高热膨胀又使密度降低,两种相反因素导致水有密度最大的温度,至于出现在4℃则由水的性质决定。【10.8】下表给出时几种物质的粘度(单位:),试说明为什么会有这样的大小次序。物质丙酮苯粘度0.340.911.311.3332.8解:物质粘度的大小决定于分子间的作用力:中每个分子可形成4个氢键;和则平均可形成2个氢键:苯和丙酮不能生成氢键。所以分子间作用力最强、黏度最大;和次之,这两者相差不多。苯因有离域键,色散力大,粘度大于丙酮。【10.9】水和乙醚的表面能分别为72.8和17.1,说明存在如此大差异的原因。解:水中分子间存在氢键,分子间作用力大。乙醚()分子间不能形成氢键,作用力仅是较微弱的范德华力,故表现在表面能上有较大差异。【10.10】举例说迷什么是配位水、骨架水、结构水和结晶水。为什么硫化物和磷化物一般不存在结晶水?解:以晶体为例,该晶体中每个离子周围有4个提供孤对电子和的杂化轨道形成4个配键。晶体中的这种水称为配位水。晶体中有1个分子不和金属离子配位,只通过氢键和其他基团结合,这种分子称结构水。骨架水是指水作为构建晶体的主要组分组成骨架。例如气体水合物
中,水分子通过氢键组成具有多面体孔穴的骨架,将客体小分子包含在其中。结晶水是指晶态水合物中存在的水,或是指除冰以外在晶体中和其他组分一起存在的水。结晶水除上述配位水、结构水和骨架水等组成确定的结晶水以外,还包括层间水、沸石水和蛋白质晶体中连续分布的水等组成不确定的结晶水。硫化物和磷化物中因为S和P原子的电负性较低,分别为2.6和2.2,和H相似(2.3),不能形成、、和等型式氢键,一般不存在结晶水。【10.11】根据晶体结构测定数据,间除3个较短的强键呈三角形分布外,还有3个弱键和3个非常弱的键。它们的键长(以为单位)如下:195,195,206;250,250,256;375,378,378。解:按(2)式查得计算键价的和N值,Sb(3)…F(-1)的值为,计算所得各键键价及键价和如下:键长/pm195195206250256256375378378键价0.700.700.580.280.260.260.060.060.06键价和:2.96键价和为2.96接近于中Sb的原子价。【10.12】什么是绝对构型?画出型甘油酸的立体结构式。解:绝对构型是指手性分子中各个基团在空间排列的真实结构。绝对构型是和相对构型相比较而提出的概念,当还未能确定所指的手性分子是R型或S型之前,这种构型称为相对构型,确定后的真实构型称为绝对构型。R型甘油酸的立体结构如图7.12。图7.2【10.13】已知乙酸、丙酸、丁酸、戊酸的密度分别为1.409,0.993,0.959和0.939。试根据表7.5.1所列原子基团的体积增量数据,计算分子的堆积系数。讨论它们的变化规律,解释其原因。解:查表得原子基团体积增量为:,,乙酸丙酸丁酸戊酸化学式
摩尔质量/607488102密度/1.0490.9930.9590.939摩尔体积/57.274.591.8108.6基团体积增量和/28.138.448.658.8堆积系数0.490.520.530.54由上述计算可见,随着碳氢链的增长,堆积系数加大,这和间能形成氢键,缩短分子间距离有关。即在分子中占的比例较大时,堆积系数较小。【10.14】邻位和对位硝基苯酚20℃时在水中的溶解度之比为0.39,在苯中为1.93,请由氢键说明其差异的原因。解:溶质在溶剂中的溶解性,可用“相似相溶”原理表达。这一经验原理指出:结构相似的物质易于互溶,结构相差较大的物质不能互溶。“结构”二字的含义有:一是指物质结合在一起所依靠的化学键或分子间结合力的形式,二是指分子、离子和原子的相对大小及离子的电价。溶解过程总是熵增加的。因此溶质在溶剂中的溶解性在很大程度上决定于溶解过程的焓变。若较小,自由焓减少,则溶质易溶解于溶剂;若增大,超过了,使,则溶解不能进行。邻硝基苯酚可形成分子内氢键,极性减弱,与水(极性溶剂)分子间的作用力小。而且,停止不能与水分子形成氢键。相反,它分散到水中会破坏水本身的氢键,使增大,能量上不利。因此,邻硝基苯酚在水中的溶解度很小,而在非极性的苯中溶解度较大。对硝基苯酚不能形成分子内氢键,极性较大,并能与水形成氢键,使溶解过程的较小,自由焓减少,因而在水中的溶解度较大,而在苯中的溶解度较小。【10.15】乙醚分子量比丙酮大,但沸点(34.6℃)比丙酮沸点(56.5℃)低;乙醇分子量更小,但沸点(78.5℃)更高。试分别解释其原因。解:物质沸点的高低是其汽化过程中焓变和熵变的综合结果,其中焓变起决定作用。而焓变又决定于分子间作用能的大小,归根结底决定于分子的结构。分子量只是影响分子间作用能大小的因素之一。丙酮与乙醚相比,虽然分子量小,但由于分子内有易于变形的键,极化率大,分子间作用能大,因而沸点高。而乙醇由于形成分子间氢键,作用能更大,因而沸点更高(乙醚,丙酮和乙醇的摩尔汽化热分别为26.0,30.2和39.4)【10.16】请根据分子中原子的共价半径和范德华半径估算分子的形状和大小。解:原子CONH
共价半径/pm7532范氏半径/pm172140150120电负性()2.553.443.042.20#共价双键半径若不考虑尿素分子的共轭效应,按正常的单、双键计算键长,则得各共价键的键长如下:C-NC=ON-H第一套键长/pm152127107第二套键长/pm14711999实测键长/pm133126105其中第一套数据是用同核键键键长的计算方法(键长等于两原子共价半径之和)得到的。第二套数据是按异核键键长的计算方法(键长等于两原子共价半径之和减去两元素电负性之差的9倍)得到的。可见,两套计算数据中有的与实测数据较吻合,有的则差别较大。根据实测键参数和范氏半径画出尿素分子的形状如图7.16。【10.17】环氧乙烷中含少量水,试画出它们的分子模型,估计最小分子直径,并判断能否用3A型分子筛(孔径3.3A)作为环氧乙烷的干燥剂?4A和5A型(孔径分别为4A和5A)又如何?解:原子CHO共价半径/pm773273范氏半径/pm172120140电负性()2.552.203.44用上列数据,按同(异)核键键长的计算方法得有关键长数据如下:O-HC-OC-CC-H键长/pm93.8102154105.9这些计算值与实验测定值有的接近有的则差别较大。图7.17所示的分子形状是按实测键参数和范氏半径画出来的。
由图可见,水分子和环氧乙烷分子的最小直径分别约为320pm和440pm。因此,水分子能够进入3A分子筛的孔道而环氧乙烷分子不能。所以,3A分子筛对环氧乙烷有干燥作用。但由于水分子的最小直径与3A分子筛的孔径相差很小,因而脱水效果不会太好。用4A分子筛干燥环氧乙烷效果很好,因为4A分子筛的孔道只允许水分子进入,而将环氧乙烷分子拒之门外。5A分子筛的孔径和环氧乙烷分子的最小直径非常接近,有可能也吸附环氧乙烷,因此不宜用作环氧乙烷的干燥剂。环氧乙烷是最重要的一个环氧化合物,是以乙烯为原料的第三大产品,仅次于聚乙烯和苯乙烯。它是重要的石油化工原料及有机和精细化工的中间体。主要用来生产乙二醇、非离子表面活性剂等产品。工业上环氧乙烷是用乙烯和空气催化氧化(以银/多孔载体为催化剂)制得的。实验室中则常用有机过酸(如CH3CO3H等)氧化乙烯来制备。水是平衡混合产物的组分之一,需要除去,简便而又经济的除水方法是使用4A分子筛脱水。所以,本题所涉及的是一个实际问题,从沟通结构——性能——应用这一渠道来说也是很有意义的。【10.18】试根据苯分子的构型和液态水中和冰中分子的堆积系数。解:苯环中心到C原子距离为140pm。C-H100pm,H原子范德华半径120pm。分子直径C原子范德华半径170pm。苯环厚度340pm。【10.19】计算水分子的体积以及液态水中和冰中分子的堆积系数。解:根据7.17所列数据。O原子所占体积和2个H原子所占体积
一个分子的体积为液态水中一个分子占据的体积为:(由摩尔体积/NA得到)冰中一个分子占据的体积为:(由摩尔体积/NA得到)所以液态水中的堆积系数为冰中的堆积系数为【10.20】举例说明什么是分子识别。解:分子识别是指一种接受体分子的特殊部位具有某些基团或空间结构,正适合另一种底物分子的基团或空间结构相结合,体现出锁和钥匙的原理。当这两种分子相遇时,好像彼此相识,互相选择对方,形成次级键结合在一起,使体系趋于稳定。例如三环纪杂冠醚分子形成孔穴的大小和四面体配位点的分布,正适合于和形成4个N—H…N氢键以及供居留。【10.21】疏水效应为什么能降低体系能量、增高熵值?解:疏水效应是指水溶液中的疏水组分或基团倾向于和水疏远,疏水组分相互结合,或是被水充满而内壁带有疏水基团的空腔.当遇上疏水组分或基团时,疏水组分要进入空腔,排挤出水分子而和空腔内壁的疏水基团结合。疏水效应一方面要减少水和疏水基团问相互接触的机会,而增加水和水之间互相通过氢键结合.降低体系的能量;另一方面,滞留在空腔内相对有序的水被排挤出来,增加了自由活动的水,熵增加。'
您可能关注的文档
- 《经济博弈论》课后答案、补充习题答案.doc
- 《经济地理学 第二版》课后思考题答案.doc
- 《经济地理学》第二版课后思考题答案.doc
- 《经济地理学》课后思考题答案.doc
- 《经济学基础》习题试卷与答案.doc
- 《经济学基础》各讲习题及参考答案(简).doc
- 《经济应用数学—概率论与数理统计》马统一的习题1一5答案.doc
- 《结构力学》课后习题答案文治国版 重庆大学出版社.pdf
- 《结构化学》(1-5章)习题答案.doc
- 《绝密文档!!!》电梯练习题(附答案).doc
- 《统计学(专业版)》2012-习题集-解答-陈正伟.doc
- 《统计学》(第四版)学习指导书以及课后习题答案.doc
- 《统计学》(贾俊平,第五版)分章习题及答案.doc
- 《统计学》2011-12-习题集-解答-定稿-打印.doc
- 《统计学》习题集及答案.doc
- 《统计学》课后习题答案.doc
- 《统计学》课程的教学教案.doc
- 《统计学》课程的教学教案_3.doc
相关文档
- 施工规范CECS140-2002给水排水工程埋地管芯缠丝预应力混凝土管和预应力钢筒混凝土管管道结构设计规程
- 施工规范CECS141-2002给水排水工程埋地钢管管道结构设计规程
- 施工规范CECS142-2002给水排水工程埋地铸铁管管道结构设计规程
- 施工规范CECS143-2002给水排水工程埋地预制混凝土圆形管管道结构设计规程
- 施工规范CECS145-2002给水排水工程埋地矩形管管道结构设计规程
- 施工规范CECS190-2005给水排水工程埋地玻璃纤维增强塑料夹砂管管道结构设计规程
- cecs 140:2002 给水排水工程埋地管芯缠丝预应力混凝土管和预应力钢筒混凝土管管道结构设计规程(含条文说明)
- cecs 141:2002 给水排水工程埋地钢管管道结构设计规程 条文说明
- cecs 140:2002 给水排水工程埋地管芯缠丝预应力混凝土管和预应力钢筒混凝土管管道结构设计规程 条文说明
- cecs 142:2002 给水排水工程埋地铸铁管管道结构设计规程 条文说明