- 7.45 MB
- 2022-04-22 11:35:25 发布
- 1、本文档共5页,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报电话:19940600175。
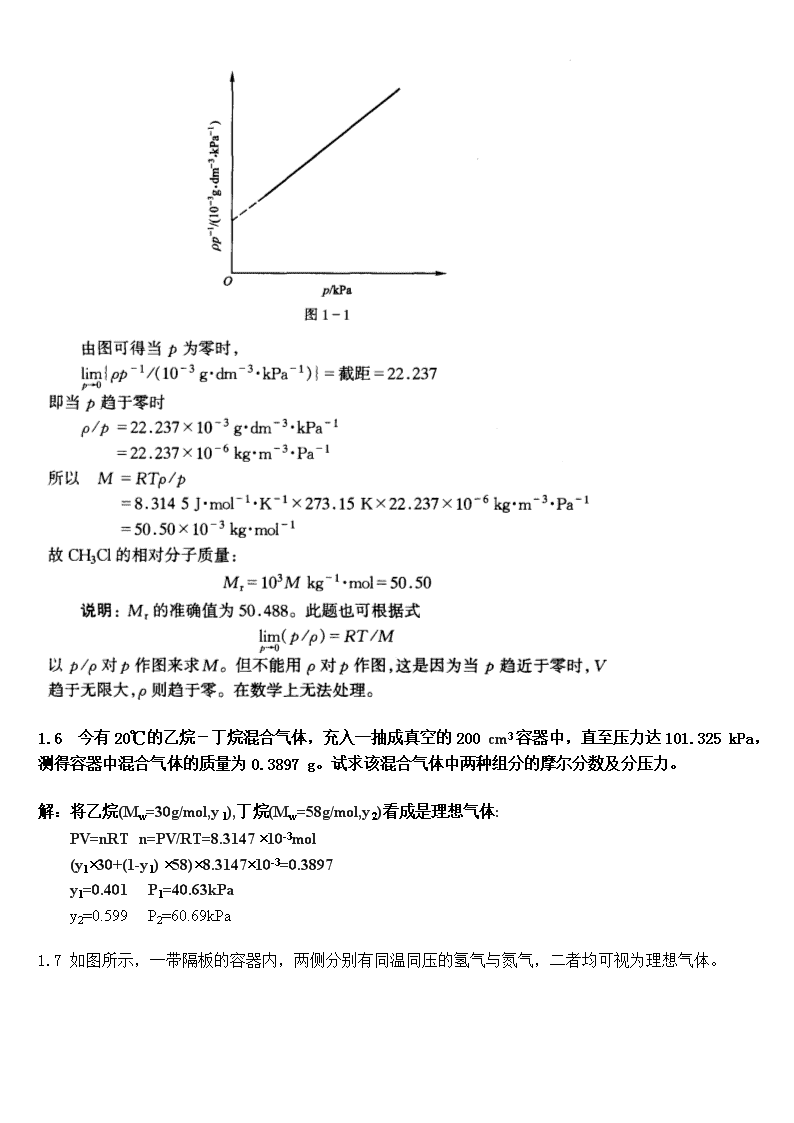
'第一章 气体的pVT性质1.1 物质的体膨胀系数 与等温压缩率的定义如下 试推出理想气体的,与压力、温度的关系。 解:根据理想气体方程 1.20℃,101.325kPa的条件常称为气体的标准状况,试求甲烷在标准状况下的密度。解:将甲烷(Mw=16.042g/mol)看成理想气体:PV=nRT,PV=mRT/Mw甲烷在标准状况下的密度为=m/V=PMw/RT =101.325´16.042/8.3145´273.15(kg/m3) =0.716kg/m3 1.3一抽成真空的球形容器,质量为25.0000g充以4℃水之后,总质量为125.0000g。若改充以25℃,13.33kPa的某碳氢化合物气体,则总质量为25.0163g。试估算该气体的摩尔质量。水的密度1g·cm3计算。解:球形容器的体积为V=(125-25)g/1g.cm-3=100cm3将某碳氢化合物看成理想气体:PV=nRT,PV=mRT/MwMw=mRT/PV=(25.0163-25.0000)×8.314×298.15/(13330×100×10-6)Mw=30.31(g/mol)1.4两个容积均为V的玻璃球泡之间用细管连结,泡内密封着标准状态下的空气。若将其中的一个球加热到100℃,另一个球则维持0℃,忽略连接细管中气体体积,试求该容器内空气的压力。 解:由题给条件知,(1)系统物质总量恒定;(2)两球中压力维持相同。 标准状态:
因此,1.50℃时氯甲烷(CH3Cl)气体的密度ρ随压力的变化如下。试作图,用外推法求氯甲烷的相对分子质量。
1.6今有20℃的乙烷-丁烷混合气体,充入一抽成真空的200cm3容器中,直至压力达101.325kPa,测得容器中混合气体的质量为0.3897g。试求该混合气体中两种组分的摩尔分数及分压力。解:将乙烷(Mw=30g/mol,y1),丁烷(Mw=58g/mol,y2)看成是理想气体:PV=nRT n=PV/RT=8.3147´10-3mol(y1´30+(1-y1)´58)´8.3147´10-3=0.3897y1=0.401 P1=40.63kPay2=0.599 P2=60.69kPa1.7如图所示,一带隔板的容器内,两侧分别有同温同压的氢气与氮气,二者均可视为理想气体。
(1) 保持容器内温度恒定时抽去隔板,且隔板本身的体积可忽略不计,试 求两种气体混合后的压力。(2) 隔板抽取前后,H2及N2的摩尔体积是否相同?(3) 隔板抽取后,混合气体中H2及N2的分压立之比以及它们的分体积各为若干?解:(1)等温混合后 即在上述条件下混合,系统的压力认为。 (2)混合气体中某组分的摩尔体积怎样定义? (3)根据分体积的定义 对于分压 1.8
1.9室温下一高压釜内有常压的空气,为进行实验时确保安全,采用同样温度的纯氮进行置换,步骤如下:向釜内通氮气直到4倍于空气的压力,尔后将釜内混合气体排出直至恢复常压。重复三次。求釜内最后排气至恢复常压时其中气体含氧的摩尔分数。 解:分析:每次通氮气后至排气恢复至常压p,混合气体的摩尔分数不变。 设第一次充氮气前,系统中氧的摩尔分数为,充氮气后,系统中氧的摩尔分数为,则,。重复上面的过程,第n次充氮气后,系统的摩尔分数为 , 因此 。1.10 25℃时饱和了水蒸气的湿乙炔气体(即该混合气体中水蒸气分压力为同温度下水的饱和蒸气压)总压力为138.7kPa,于恒定总压下冷却到10℃,使部分水蒸气凝结为水。试求每摩尔干乙炔气在该冷却过程中凝结出水的物质的量。已知25℃及10℃时水的饱和蒸气压分别为3.17kPa及1.23kPa。 解:该过程图示如下
设系统为理想气体混合物,则 1.11有某温度下的2dm3湿空气,其压力为101.325kPa,相对湿度为60%。设空气中O2与N2的体积分数分别为0.21与0.79,求水蒸气、O2与N2的分体积。已知该温度下水的饱和蒸汽压为20.55kPa(相对湿度即该温度下水蒸气的分压与水的饱和蒸汽压之比)。1.12一密闭刚性容器中充满了空气,并有少量的水。但容器于300K条件下大平衡时,容器内压力为101.325kPa。若把该容器移至373.15K的沸水中,试求容器中到达新的平衡时应有的压力。设容器中始终有水存在,且可忽略水的任何体积变化。300K时水的饱和蒸气压为3.567kPa。 解:将气相看作理想气体,在300K时空气的分压为 由于体积不变(忽略水的任何体积变化),373.15K时空气的分压为 由于容器中始终有水存在,在373.15K时,水的饱和蒸气压为101.325kPa,系统中水蒸气的分压为101.325kPa,所以系统的总压
1.13CO2气体在40℃时的摩尔体积为0.381dm3·mol-1。设CO2为范德华气体,试求其压力,并比较与实验值5066.3kPa的相对误差。1.14今有0℃,40.530kPa的N2气体,分别用理想气体状态方程及vanderWaals方程计算其摩尔体积。实验值为。 解:用理想气体状态方程计算 用vanderWaals计算,查表得知,对于N2气(附录七) ,用MatLabfzero函数求得该方程的解为 也可以用直接迭代法,,取初值 ,迭代十次结果1.15试由波义尔温度TB的定义式,证明范德华气体的TB可表示为TB=a/(bR)
式中a,b为范德华常数。1.16把25℃的氧气充入40dm3的氧气钢瓶中,压力达202.7×102kPa。试用普遍化压缩因子图求钢瓶中氧气的质量。解:氧气的TC=-118.57℃,PC=5.043MPa氧气的Tr=298.15/(273.15-118.57)=1.93,Pr=20.27/5.043=4.02Z=0.95PV=ZnRT n=PV/ZRT=202.7×105×40×10-3/(8.314×298.15)/0.95=344.3(mol)氧气的质量m=344.3×32/1000=11(kg)第二章 热力学第一定律2.1 1mol水蒸气(H2O,g)在100℃,101.325kPa下全部凝结成液态水。求过程的功。假设:相对于水蒸气的体积,液态水的体积可以忽略不计。解:n=1mol 恒温恒压相变过程,水蒸气可看作理想气体,W=-pambΔV=-p(Vl-Vg)≈pVg=nRT=3.102kJ
2.2 始态为25℃,200kPa的5mol某理想气体,经途径a,b两不同途径到达相同的末态。途经a先经绝热膨胀到 -28.47℃,100kPa,步骤的功;再恒容加热到压力200kPa的末态,步骤的热。途径b为恒压加热过程。求途径b的及。 解:先确定系统的始、末态 对于途径b,其功为 根据热力学第一定律 2.3某理想气体Cv,m=1.5R。今有该气体5mol在恒容下温度升高50℃。求过程的W,Q,ΔH和ΔU。解:理想气体恒容升温过程 n=5mol CV,m=3/2RQV=ΔU=nCV,mΔT=5×1.5R×50=3.118kJW=0ΔH=ΔU+nRΔT=nCp,mΔT=n(CV,m+R)ΔT=5×2.5R×50=5.196kJ2.42mol某理想气体,Cp,m=7/2R。由始态100kPa,50dm3,先恒容加热使压力升高至200kPa,再恒压冷却使体积缩小至25dm3。求整个过程的W,Q,ΔH和ΔU。解:过程图示如下
由于,则,对有理想气体和只是温度的函数 该途径只涉及恒容和恒压过程,因此计算功是方便的 根据热力学第一定律 2.51mol某理想气体于27℃、101.325kPa的始态下,现受某恒定外压恒温压缩至平衡态,再恒容升温至97.0℃、250.00kPa。求过程的W、Q、△U、△H。已知气体的CV,m=20.92J·K·mol-1。2.6
2.7 容积为0.1m3的恒容密闭容器中有一绝热隔板,其两侧分别为0℃,4mol的Ar(g)及150℃,2mol的Cu(s)。现将隔板撤掉,整个系统达到热平衡,求末态温度t及过程的。已知:Ar(g)和Cu(s)的摩尔定压热容分别为及,且假设均不随温度而变。 解:图示如下 假设:绝热壁与铜块紧密接触,且铜块的体积随温度的变化可忽略不计 则该过程可看作恒容过程,因此
假设气体可看作理想气体,,则 2.8 单原子理想气体A与双原子理想气体B的混合物共5mol,摩尔分数,始态温度,压力。今该混合气体绝热反抗恒外压膨胀到平衡态。求末态温度及过程的。 解:过程图示如下 分析:因为是绝热过程,过程热力学能的变化等于系统与环境间以功的形势所交换的能量。因此, 单原子分子,双原子分子 由于对理想气体U和H均只是温度的函数,所以
2.9 在一带活塞的绝热容器中有一绝热隔板,隔板的两侧分别为2mol,0℃的单原子理想气体A及5mol,100℃的双原子理想气体B,两气体的压力均为100kPa。活塞外的压力维持在100kPa不变。今将容器内的隔板撤去,使两种气体混合达到平衡态。求末态的温度T及过程的。 解:过程图示如下 假定将绝热隔板换为导热隔板,达热平衡后,再移去隔板使其混合,则 由于外压恒定,求功是方便的
由于汽缸为绝热,因此 2.10 已知水(H2O,l)在100℃的饱和蒸气压,在此温度、压力下水的摩尔蒸发焓。求在在100℃,101.325kPa下使1kg水蒸气全部凝结成液体水时的。设水蒸气适用理想气体状态方程式。 解:该过程为可逆相变 2.11已知水(H2O,l)在100℃的饱和蒸气压ps=101.325kPa,在此温度、压力下水的摩尔蒸发焓。试分别求算下列两过程的W,Q,ΔU和ΔH。(水蒸气可按理想气体处理)(1)在100℃,101.325kPa条件下,1kg水蒸发为水蒸气(2)在恒定100℃的真空容器中,1kg水全部蒸发为水蒸气,并且水蒸气压力恰好为101.325kPa。解:(1)题给过程的始末态和过程特性如下: n=m/M=1kg/18.015g·mol-1=55.509mol 题给相变焓数据的温度与上述相变过程温度一致,直接应用公式计算n(ΔvapHm)=2257kJW=-pambΔV=-p(Vg-Vl)≈-pVg=-ngRT=-172.2kJΔU=Qp+W=2084.79kJ(2)真空容器中W=0kJ
2.12 已知 100kPa下冰的熔点为0℃,此时冰的比熔化焓热 J·g-1. 水和冰的平均定压热容分别为及。今在绝热容器内向1kg50℃的水中投入 0.8kg 温度 -20℃的冰。求: (1)末态的温度。 (2)末态水和冰的质量。 解:1kg50℃的水降温致0℃ 时放热 0.8kg-20℃的冰升温致0℃时所吸热 完全融化则需热 因此,只有部分冰熔化。所以系统末态的温度为0℃。设有g的冰熔化,则有 系统冰和水的质量分别为
2.13100kPa下,冰(H2O,s)的熔点为0℃。在此条件下冰的摩尔融化热。已知在-10℃~0℃范围内过冷水(H2O,l)和冰的摩尔定压热容分别为 和。求在常压及-10℃下过冷水结冰的摩尔凝固焓。 解:过程图示如下 平衡相变点,因此 2.14已知水(H2O,l)在100℃的摩尔蒸发焓,水和水蒸气在25~100℃范围间的平均摩尔定压热容分别为和求在25℃时水的摩尔蒸发焓。解:由已知温度的相变焓求未知温度的相变焓,常压下对气体摩尔焓的影响通常可以忽略,可直接应用p68公式(2.7.4)2.1525℃下,密闭恒容的容器中有10g固体奈C10H8(s)在过量的O2(g)中完全燃烧成CO2(g)和H2O(l)。过程放热401.727kJ。求 (1) (2)的;
(3)的; 解:(1)C10H8的分子量M =128.174,反应进程。 (2)。 (3)2.16 应用附录中有关物资在25℃的标准摩尔生成焓的数据,计算下列反应在25℃时的及。 (1) (2) (3) 解:查表知 NH3(g)NO(g)H2O(g)H2O(l)-46.1190.25-241.818-285.830 NO2(g)HNO3(l)Fe2O3(s)CO(g)33.18-174.10-824.2-110.525 (1) (2) (3)2.17 应用附录中有关物资的热化学数据,计算 25℃时反应
的标准摩尔反应焓,要求:(1) 应用25℃的标准摩尔生成焓数据;(2) 应用25℃的标准摩尔燃烧焓数据。解:查表知Compound000因此,由标准摩尔生成焓由标准摩尔燃烧焓2.18
2.19 已知25℃甲酸甲脂(HCOOCH3,l)的标准摩尔燃烧焓为,甲酸(HCOOH,l)、甲醇(CH3OH,l)、水(H2O,l)及二氧化碳(CO2,g)的标准摩尔生成焓分别为、、及。应用这些数据求25℃时下列反应的标准摩尔反应焓。
解:显然要求出甲酸甲脂(HCOOCH3,l)的标准摩尔生成焓 2.20
2.21 甲烷与过量50%的空气混合,为使恒压燃烧的最高温度能达到2000℃,求燃烧前混合气体应预热到多少摄氏度。物资的标准摩尔生成焓数据见附录。空气组成按,计算。各物资的平均摩尔定压热容分别为:;;;;。 解:燃烧为恒压绝热过程。化学反应式 设计途径如下
在下甲烷燃烧的摩尔反应热为,则 可由表出(Kirchhoff公式) 设甲烷的物质量为1mol,则,,, 最后得到
2.22
2.23某双原子理想气体1mol从始态350K,200kPa经过如下五个不同过程达到各自的平衡态,求各过程的功W。(1) 恒温下可逆膨胀到50kPa;(2) 恒温反抗50kPa恒外压不可逆膨胀;(3) 绝热可逆膨胀到50kPa;(4) 绝热反抗50kPa恒外压不可逆膨胀。(5)恒温向真空膨胀到50kPa解:双原子理想气体 n=5mol; CV,m=(5/2)R ; Cp,m=(7/2)R 5)W=0kJ2.245mol双原子气体从始态300K,200kPa,先恒温可逆膨胀到压力为50kPa,在绝热可逆压缩到末态压力200kPa。求末态温度T及整个过程的及。
解:过程图示如下 要确定,只需对第二步应用绝热状态方程 ,对双原子气体 因此 由于理想气体的U和H只是温度的函数, 整个过程由于第二步为绝热,计算热是方便的。而第一步为恒温可逆 2.25 求证在理想气体p-V 图上任一点处,绝热可逆线的斜率的绝对值大于恒温可逆线的绝对值。
证明:根据理想气体绝热方程, 得,因此 。因此绝热线在处的斜率为 恒温线在处的斜率为 。由于,因此绝热可逆线的斜率的绝对值大于恒温可逆线的绝对值。第三章 热力学第二定律3.1 卡诺热机在的高温热源和的低温热源间工作。求(1) 热机效率;(2) 当向环境作功时,系统从高温热源吸收的热及向低温热源放出的热。解:卡诺热机的效率为
根据定义 3.3 高温热源温度,低温热源。今有120kJ的热直接从高温热源传给低温热源,求此过程的。 解:将热源看作无限大,因此,传热过程对热源来说是可逆过程 3.4 已知氮(N2,g)的摩尔定压热容与温度的函数关系为 将始态为300K,100kPa下1mol的N2(g)置于1000K的热源中,求下列过程(1)经恒压过程;(2)经恒容过程达到平衡态时的。
解:在恒压的情况下 在恒容情况下,将氮(N2,g)看作理想气体 将代替上面各式中的,即可求得所需各量 3.5 始态为,的某双原子理想气体1mol,经下列不同途径变化到,的末态。求各步骤及途径的。(1) 恒温可逆膨胀;(2) 先恒容冷却至使压力降至100kPa,再恒压加热至;(3) 先绝热可逆膨胀到使压力降至100kPa,再恒压加热至。解:(1)对理想气体恒温可逆膨胀,DU =0,因此
(2) 先计算恒容冷却至使压力降至100kPa,系统的温度T: (3) 同理,先绝热可逆膨胀到使压力降至100kPa时系统的温度T: 根据理想气体绝热过程状态方程, 各热力学量计算如下 3.61mol理想气体在T=300K下,从始态100kPa经历下列过程达到各自的平衡态。求各过程的Q、△S、△Siso。(1)可逆膨胀至末态压力50kPa;(2)反抗恒定外压50kPa不可逆膨胀至平衡态;
(3)向真空自由膨胀至原体积的2倍。3.7 2mol双原子理想气体从始态300K,50dm3,先恒容加热至400K,再恒压加热至体积增大到100dm3,求整个过程的。 解:过程图示如下 先求出末态的温度 因此,
两个重要公式对理想气体 3.85mol单原子理想气体,从始态300K,50kPa先绝热可逆压缩至100kPa,再恒压冷却至体积为85dm3的末态。求整个过程的Q,W,△U,△H及△S。
3.9始态300K,1MPa的单原子理想气体2mol,反抗0.2MPa的恒定外压绝热不可逆膨胀至平衡态。求过程的解: 3.10 常压下将100g,27℃的水与200g,72℃的水在绝热容器中混合,求最终水温t及过程的熵变。已知水的比定压热容。 解:过程图解如下
3.11 绝热恒容容器中有一绝热耐压隔板,隔板一侧为2mol的200K,50dm3的单原子理想气体A,另一侧为3mol的400K,100dm3的双原子理想气体B。今将容器中的绝热隔板撤去,气体A与气体B混合达到平衡。求过程的。 解:过程图示如下 系统的末态温度T可求解如下 系统的熵变
注:对理想气体,一种组分的存在不影响另外组分。即A和B的末态体积均为容器的体积。3.12 绝热恒容容器中有一绝热耐压隔板,隔板两侧均为N2(g)。一侧容积50dm3,内有200K的N2(g)2mol;另一侧容积为75dm3, 内有500K的N2(g)4mol;N2(g)可认为理想气体。今将容器中的绝热隔板撤去,使系统达到平衡态。求过程的。 解:过程图示如下 同上题,末态温度T确定如下 经过第一步变化,两部分的体积和为
即,除了隔板外,状态2与末态相同,因此 3.13 甲醇()在101.325KPa下的沸点(正常沸点)为,在此条件下的摩尔蒸发焓,求在上述温度、压力条件下,1Kg液态甲醇全部成为甲醇蒸汽时。解: 3.15 常压下冰的熔点为0℃,比熔化焓,水和冰的比定压热熔分别为cp(H2O,l)=4.184J·g-1·K-1,cp(H2O,s)=2.000J·g-1·K-1。系统的始态为一绝热容器中的1kg,25℃的水及0.5kg,-10℃的冰。求系统达到平衡后,过程的。
3.16 将装有0.1mol乙醚(C2H5)2O(l)的小玻璃瓶放入容积为10dm3的恒容密闭的真空容器中,并在35.51℃的恒温槽中恒温。35.51℃为在101.325kPa下乙醚的沸点。已知在此条件下乙醚的摩尔蒸发焓。今将小玻璃瓶打破,乙醚蒸发至平衡态。求(1) 乙醚蒸气的压力;(2) 过程的。解:将乙醚蒸气看作理想气体,由于恒温 各状态函数的变化计算如下
忽略液态乙醚的体积 3.173.18 O2(g)的摩尔定压热容与温度的函数关系为 已知25℃下O2(g)的标准摩尔熵。求O2(g)
在 100℃,50kPa下的摩尔规定熵值。解:由公式知 3.19 已知25℃时液态水的标准摩尔生成吉布斯函 ,水在25℃时的饱和蒸气压。求25℃时水 蒸气的标准摩尔生成吉布斯函数。 解:恒温下 对凝聚相恒温过程,因此 3.20 100℃的恒温槽中有一带有活塞的导热圆筒,筒中为2molN2(g)及装与小玻璃瓶中的3molH2O(l)。环境的压力即系统的压力维持120kPa不变。今将小玻璃瓶打碎,液态水蒸发至平衡态。求过程的。 已知:水在100℃时的饱和蒸气压为,在此条件下水 的摩尔蒸发焓。
解:将气相看作理想气体。系统终态H2O(g)的摩尔分数为3/5=0.6,因此 H2O(g)的分压为 3.21 已知100℃水的饱和蒸气压为101.325kPa,此条件下水的摩尔蒸发焓。在置于100℃恒温槽中的容积为100dm3的密闭容器中,有压力120kPa的过饱和蒸气。此状态为亚稳态。今过饱和蒸气失稳,部分凝结成液态水达到热力学稳定的平衡态。求过程的。 解:凝结蒸气的物质量为 热力学各量计算如下
3.22 已知在100kPa下水的凝固点为0℃,在-5℃,过冷水的比凝固焓,过冷水和冰的饱和蒸气压分别为,。今在100kPa下,有-5℃1kg的过冷水变为同样温度、压力下的冰,设计可逆途径,分别按可逆途径计算过程的及。 解:设计可逆途径如下 第二步、第四步为可逆相变,,第一步、第五步为凝
聚相的恒温变压过程,,因此 该类题也可以用化学势来作, 对于凝聚相,通常压力下,可认为化学势不随压力改变,即 因此,3.23 化学反应如下: (1) 利用附录中各物质的数据,求上述反应在25℃时的;(2) 利用附录中各物质的数据,计算上述反应在25℃时的;(3) 25℃,若始态CH4(g)和H2(g)的分压均为150kPa,末态CO(g)和H2(g)的分压均为50kPa,求反应的。解:(1)
(2) (3)设立以下途径
3.28 已知水在77℃是的饱和蒸气压为41.891kPa。水在101.325kPa下的正常沸点为100℃。求 (1)下面表示水的蒸气压与温度关系的方程式中的A和B值。 (2)在此温度范围内水的摩尔蒸发焓。 (3)在多大压力下水的沸点为105℃。 解:(1)将两个点带入方程得 (2)根据Clausius-Clapeyron方程 (3) 3.29 水(H2O)和氯仿(CHCl3)在101.325kPa下的正常沸点分别为100℃和61.5℃,摩尔蒸发焓分别为和。求两液体具有相同饱和蒸气压时的温度。 解:根据Clausius-Clapeyron方程 设它们具有相同蒸气压时的温度为T,则
3.24 求证: (2) 对理想气体 证明: 对理想气体, 3.25 证明: (1) (2)对理想气体 证明:
对于理想气体, 3.26 求证: (1) (2)对vanderWaals气体,且为定值时,绝热可逆过程方程式为 证明: 对于绝热可逆过程 dS =0,因此
就vanderWaals气体而言 积分该式 3.27 证明(1) 焦耳-汤姆逊系数 (2) 对理想气体证明: 对理想气体
第四章 多组分系统热力学4.1 有溶剂A与溶质B形成一定组成的溶液。此溶液中B的浓度为cB,质量摩尔浓度为bB,此溶液的密度为。以MA,MB分别代表溶剂和溶质的摩尔质量,若溶液的组成用B的摩尔分数xB表示时,试导出xB与cB,xB与bB之间的关系。 解:根据各组成表示的定义 4.2 在25℃,1kg水(A)中溶有醋酸(B),当醋酸的质量摩尔浓度bB介于和之间时,溶液的总体积。求:(1) 把水(A)和醋酸(B)的偏摩尔体积分别表示成bB的函数关系。(2) 时水和醋酸的偏摩尔体积。解:根据定义
当时 4.3 60℃时甲醇的饱和蒸气压是84.4kPa,乙醇的饱和蒸气压是47.0kPa。二者可形成理想液态混合物。若混合物的组成为二者的质量分数各50%,求60℃时此混合物的平衡蒸气组成,以摩尔分数表示。 解:质量分数与摩尔分数的关系为 求得甲醇的摩尔分数为 根据Raoult定律
4.4 80℃是纯苯的蒸气压为100kPa,纯甲苯的蒸气压为38.7kPa。两液体可形成理想液态混合物。若有苯-甲苯的气-液平衡混合物,80℃时气相中苯的摩尔分数,求液相的组成。 解:根据Raoult定律 4.5 H2,N2与100g水在40℃时处于平衡,平衡总压为105.4kPa。平衡气体经干燥后的组成分数。假设可以认为溶液的水蒸气压等于纯水的蒸气压,即40℃时的7.33kPa。已知40℃时H2,N2在水中的Henry系数分别为7.61GPa及10.5GPa,求40℃时水中溶解H2,N2在的质量。 解:假设(1)H2,N2在水中的溶解符合Henry定律;(2)气相可看作理想气体。在此假设下
4.6已知20℃时,压力为101.325kPa的CO2(g)在1kg水中可溶解1.7g,40℃时同样压力的CO2(g)在1kg水中可溶解1.0g。如果用只能承受202.65kPa的瓶子充装溶有CO2(g)的饮料,则在20℃条件下充装时,CO2的最大压力为多少才能保证此瓶装饮料可以在40℃条件下安全存放。设CO2溶质服从亨利定律。4.7 A,B两液体能形成理想液态混合物。已知在温度t时纯A的饱和蒸气压,纯B的饱和蒸气压。(1) 在温度t下,于气缸中将组成为的A,B混合气体恒温缓慢压缩,求凝结出第一滴微小液滴时系统的总压及该液滴的组成(以摩尔分数表示)为多少?(2) 若将A,B两液体混合,并使此混合物在100kPa,温度t下开始沸腾,求该液态混合物的组成及沸腾时饱和蒸气的组成(摩尔分数)。解:1. 由于形成理想液态混合物,每个组分均符合Raoult定律;2. 凝结出第 一滴微小液滴时气相组成不变。因此在温度t 混合物在100kPa,温度t下开始沸腾,要求 4.8 液体B与液体C可形成理想液态混合物。在常压及25℃下,向总量n =10mol,组成xC =0.4的B,C液态混合物中加入14mol的纯液体C,形成新的混合物。求过程的ΔG,ΔS。 解:理想液态混合物中组分B的化学势为 因此,
新混合物的组成为 所以: 4.9 液体B和液体C可形成理想液态混合物。在25℃下,向无限大量组成xC =0.4的混合物中加入5mol的纯液体C。 求过程的ΔG,ΔS。解:由于是向无限大量的溶液中加入有限量的纯B,可以认为溶液的组 成不变,因此 4.10 25℃时0.1molNH3溶于1dm3三氯甲烷中,此溶液NH3的蒸气分压为4.433kPa,同温度时0.1molNH3溶于1dm3水中,NH3的蒸气分压为0.887kPa。求NH3在水与三氯甲烷中的分配系数 解:NH3在水与三氯甲烷中分配达到平衡时
而溶质的化学势 因此, 当溶液中的NH3和气相中的NH3达平衡时 由于 因此, 4.11 20℃某有机酸在水和乙醚中的分配系数为0.4。今有该有机酸5g溶于100cm3水中形成的溶液。(1) 若用40cm3乙醚一次萃取(所用乙醚已事先被水饱和,因此萃取时不会有水溶于乙醚),求水中还剩下多少有机酸?(2) 将40cm3乙醚分为两份,每次用20cm3乙醚萃取,连续萃取两次,问水中还剩下多少有机酸?解:设有机酸的分子量为M;分配平衡时,水中的有机酸还剩m克
根据Nernst分配定律 用同样体积的乙醚萃取n次,则有 (1) 用40cm3乙醚萃取一次 (2) 每次用20cm3乙醚萃取,连续萃取两次 4.12 在某一温度下,将碘溶解于CCl4中。当碘的摩尔分数在0.01~0.04范围内时,此溶液符合稀溶液规律。今测得平衡时气相中碘的蒸气压与液相中碘的摩尔分数之间的两组数据如下: 1.63816.720.030.5 求是溶液中碘的活度及活度系数。解:溶液中碘的化学势表达式为
气相中碘的化学势表达式为(假设理想气体行为) 平衡时 因此, 由于在0.01~0.04范围内时,此溶液符合稀溶液规律,则 4.14 10g葡萄糖(C6H12O6)溶于400g乙醇中,溶液的沸点较纯乙醇的上升0.1428℃。另外有2g有机物质溶于100g乙醇中,此溶液的沸点则上升0.1250℃。求此有机物质的相对分子质量。 解:10g葡萄糖(C6H12O)溶于400g乙醇中 2g有机物质溶于100g乙醇中 4.15 在100g苯中加入13.76g联苯(C6H5C6H5),所形成溶液的沸点为82.4℃。已知纯苯的沸点为80.1℃。
求:(1)苯的沸点升高系数;(2)苯的摩尔蒸发焓。 解: 4.16 已知0℃,101.325kPa时,O2在水中的溶解度为;N2在水中的溶解度为。试计算被101.325kPa,体积分数 ,的空气所饱和了的水的凝固点较纯水的降低了多少? 解:为101.325kPa的空气所饱和了的水中溶解的O2和N2的物质两分别为 查表知水的凝固点降低系数为,因此 4.17 已知樟脑(C10H16O)的凝固点降低系数为。(1)某一溶质相对分子质量为210,溶于樟脑形成质量分数为5%的溶液,求凝固点降低多少?(2)另一溶质相对分子质量为9000,溶于樟脑形成质量分数为5%的溶液,求凝固点降低多少? 解:容易导出质量分数和质量摩尔浓度间的关系 因此,
4.18 现有蔗糖(C12H22O11)溶于水形成某一浓度的稀溶液,其凝固点为-0.200℃,计算此溶液在25℃时的蒸气压。已知水的,纯水在25℃时的蒸气压为。 解:首先计算蔗糖的质量摩尔浓度 由4.6知,质量摩尔浓度和摩尔分数有以下关系 假设溶剂服从Raoult定律,则此溶液在25℃时的蒸气压 4.19 在25℃时,10g某溶剂溶于1dm3溶剂中,测出该溶剂的渗透压为 ,确定该溶质的相对分子质量。 解:溶剂的渗透压表示为 4.20 在20℃下将68.4g蔗糖(C12H22O11)溶于1kg的水中。求(1) 此溶液的蒸气压。(2) 此溶液的渗透压。
已知20℃下此溶液的密度为。纯水的饱和蒸气压。解:溶液的蒸气压、渗透压分别为 4.21 人的血液(可视为水溶液)在101.325kPa下于-0.56℃凝固。已知水的。求:(1) 血液在37℃时的渗透压;(2) 在同温度下,1dm3蔗糖(C12H22O11)水溶液中需含有多少克蔗糖才能与血液有相同的渗透压。解:根据已知条件 稀水溶液条件下,因此 稀水溶液时,渗透压与溶质的性质无关, 第五章 化学平衡5.1 已知四氧化二氮的分解反应 在298.15K时,。试判断在此温度及下列条件下,反
应进行的方向。(1) N2O4(100kPa),NO2(1000kPa);(2) N2O4(1000kPa),NO2(100kPa);(3) N2O4(300kPa),NO2(200kPa);解:由Jp进行判断 5.2
5.3 已知同一温度,两反应方程及其标准平衡常数如下: 求下列反应的。 解:所给反应 =2x(2)–(1),因此
5.4 在一个抽空的恒容容器中引入氯和二氧化硫,若它们之间没有发生反应,则在375.3K时的分压分别为47.836kPa和44.786kPa。将容器保持在375.3K,经一定时间后,总压力减少至86.096kPa,且维持不变。求下列反应的。 解:反应各组分物料衡算如下 因此, 5.6 五氯化磷分解反应 在200℃时的,计算: (1)200℃,200kPa下PCl5的解离度。 (2)摩尔比为1:5的PCl5与Cl2的混合物,在200℃,101.325kPa下,求 达到化学平衡时PCl5的解离度。 解:(1)设200℃,200kPa下五氯化磷的解离度为a,则
(2)设混合物的物质量为n, 五氯化磷的解离度为a,则平衡时 因此, 整理得到, 将各数据代入,则 5.7 在994K,使纯氢气慢慢地通过过量的CoO(s),则氧化物部分地被还原为Co(s)。出来的平衡气体中氢的体积分数。在同一温度,若用CO还原CoO(s),平衡后气体中一氧化碳的体积分数。求等物质的量的一氧化碳和水蒸气的混合物在994K下,通过适当催化剂进行反应,其平衡转化率为多少? 解:两还原反应的化学计量式分别为
一氧化碳与水蒸气的反应 显然,(3)=(2)–(1),因此 设一氧化碳和水蒸气的物质的量分别为n,平衡转化率为a,则 因此, 5.8 在真空的容器中放入固态的NH4HS,于25℃下分解为NH3(g)与H2S(g),平衡时容器内的压力为66.66kPa。(1) 当放入NH4HS时容器内已有39.99kPa的H2S(g),求平衡时容器中的压力。(2) 容器内原有6.666kPa的NH3(g),问需加多大压力的H2S,才能形成NH4HS解:反应的化学计量式如下 由题给条件,25℃下
5.11已知298.15K,CO(g)和CH3OH(g)的分别为-110.525kJ·mol-1及
5.12已知25℃时AgCl(s)、水溶液中Ag+、Cl-的分别为-109.789kJ/mol、77.107kJ/mol和-131.22kJ/mol。求25℃下AgCl(s)在水溶液中的标准溶度积及溶解度s。解:
5.13体积为1dm3的抽空密闭容器中放有0.03458molN2O4(g),发生如下分解反应:50℃时分解反应的平衡总压为130.0KPa。已知25℃时N2O4(g)和NO2(g)的分别为9.16kJ/mol和33.18kJ/mol。设反应的=0(1)计算50℃时N2O4(g)的解离度及分解反应的(2)计算100℃反应的
5.15100℃时下列反应的Kθ=8.1×10-9,=125.6J·mol·K-1。计算:(1)100℃,总压为200kPa时,COCl2解离度;(2)100℃下上述反应的;(3)总压为200kPa,COCl2解离度0.1%时的温度。设=0。解:(1)设COCl2解离度为x起始时1mol00平衡时1-xxx5.17反应在不同温度下的平衡总压如下表t/℃30507090100110p/kPa0.8273.99915.9055.2397.47167.0设反应的与温度无关。求(1)上述反应的;(2)lg(p/kPa)与T的函数关系式;(3)NaHCO3的分解温度。解:(1)
3.2993.0952.9142.7542.6802.610ln(p/kPa)-0.1901.3862.7664.0124.5805.118以lnp对1/T×103作图,应得一直线lnp0(3)NaHCO3(s)分解温度在p=101.325kPa时为
5.18已知下列数据:
5.19工业上用乙基脱氢制苯乙烯如反应在900K下进行,其1.51。试分别计算在下述情况下,乙苯的平衡转化率。(1)反应压力为100kPa;(2)反应压力为10kPa;(3)反应压力为100kPa,且加入水蒸气使原料气中水蒸气与乙苯的物质的量之比为10:1。.
5.20
5.21在600℃、100kPa时下列反应达到平衡5.22(1)应用路易斯-兰德尔规则及逸度因子图, 求250℃,20.265MPa下,合成甲醇反应CO(g)+2H2(g)=CH3OH(g)的KΨ;(2)已知250℃时上述反应的=25.899kJ/mol,求此反应的;(3)化学计量比的原料气,在上述条件下达平衡时,求混合物中甲醇的摩尔分数。
第六章 相平衡6.1 指出下列平衡系统中的组分数C,相数P及自由度F。(1) I2(s)与其蒸气成平衡;(2) MgCO3(s)与其分解产物MgO(s)和CO2(g)成平衡;(3) NH4Cl(s)放入一抽空的容器中,并与其分解产物NH3(g)和HCl(g)成平衡;(4) 任意量的NH3(g)和H2S(g)与NH4HS(s)成平衡。(5) 过量的NH4HCO3(s)与其分解产物NH3(g)、H2O(g)和CO2(g)成平衡;(6) I2作为溶质在两不互溶液体H2O和CCl4中达到分配平衡(凝聚系统)。解: (1)C =1, P =2, F = C – P +2=1–2+2=1. (2)C =3–1=2, P =3, F = C –P +2=2–3+2=1. (3)C =3–1–1=1, P =2, F = C – P +2=1–2+2=1. (4)C =3–1=2, P =2, F = C – P +2=2–2+2=2.(5)C =4–3=1, P =2, F = C – P +2=1–2+2=1. (6)C =3, P =2, F = C – P +1=3–2+1=2.6.3 已知液体甲苯(A)和液体苯(B)在90℃时的饱和蒸气压分别为= 和。两者可形成理想液态混合物。今有系统组成为的甲苯-苯混合物5mol,在90℃下成气-液两相平衡,若气相组成为求:
(1) 平衡时液相组成及系统的压力p。(2) 平衡时气、液两相的物质的量解:(1)对于理想液态混合物,每个组分服从Raoult定律,因此 (2)系统代表点,根据杠杆原理 6.5 已知甲苯、苯在90℃下纯液体的饱和蒸气压分别为54.22kPa和136.12kPa。两者可形成理想液态混合物。取200.0g甲苯和200.0g苯置于带活塞的导热容器中,始态为一定压力下90℃液态混合物。在恒温90℃下逐渐降低压力,问(1) 压力降到多少时,开始产生气相,此气相的组成如何?(2) 压力降到多少时,液相开始消失,最后一滴液相的组成如何?(3) 压力为92.00kPa时,系统内气-液两相平衡,两相的组成如何?两相的物质的量各位多少?解:原始溶液的组成为 (1)刚开始出现气相时,可认为液相的组成不变,因此
(2)只剩最后一滴液体时,可认为气相的组成等于原始溶液的组成 (3)根据(2)的结果 由杠杆原理知, 6.6 101.325kPa下水(A)-醋酸(B)系统的气-液平衡数据如下。100102.1104.4107.5113.8118.100.3000.5000.7000.9001.00000.1850.3740.5750.8331.000
(1) 画出气-液平衡的温度-组成图。(2) 从图上找出组成为的气相的泡点。(3) 从图上找出组成为的液相的露点。(4) 105.0℃时气-液平衡两相的组成是多少?(5) 9kg水与30kg醋酸组成的系统在105.0℃达到平衡时,气-液两相的质量各位多少?解:(1)气-液平衡的温度-组成图为 (2)的气相的泡点为110.3℃。 (3)的液相的露点为112.7℃。 (4)105.0℃时气-液平衡两相的组成,。 (5)系统代表点
6.7 已知水-苯酚系统在30℃液-液平衡时共轭溶液的组成为:L1(苯酚溶于水),8.75%;L2(水溶于苯酚),69.9%。(1) 在30℃,100g苯酚和200g水形成的系统达液-液平衡时,两液相的质量各为多少?(2) 在上述系统中若再加入100g苯酚,又达到相平衡时,两液相的质量各变到多少? 解:(1)系统代表点,根据杠杆原理 (2) 系统代表点 6.8 水-异丁醇系统液相部分互溶。在101.325kPa下,系统的共沸点为89.7℃。气(G)、液(L1)、液(L2)三相平衡时的组成依次为:70.0%;8.7%;85.0%。今由350g水和150g异丁醇形成的系统在101.325kPa压力下由室温加热,问:(1) 温度刚要达到共沸点时,系统处于相平衡时存在哪些相?其质量各为多少?(2) 当温度由共沸点刚有上升趋势时,系统处于相平衡时存在哪些相?其质量各为多少? 解:相图见图(6.7.2)。(1)温度刚要达到共沸点时系统中尚无气相存在,
只存在两个共轭液相。系统代表点为。根据杠 杆原理 (2)当温度由共沸点刚有上升趋势时,L2消失,气相和L1共存,因此 6.9恒压下二组分液态部分互溶系统气-液平衡的温度-组成图如附图,指出四个区域平衡的相及自由度数。解:各相区已标于图上。 l1,BinA. l2,AinB.自由度:四个区域从上到下2121
6.10 为了将含非挥发性杂质的甲苯提纯,在86.0kPa压力下用水蒸气蒸馏。已知:在此压力下该系统的共沸点为80℃,80℃时水的饱和蒸气压为47.3kPa。试求:(1) 气相的组成(含甲苯的摩尔分数);(2) 欲蒸出100kg纯甲苯,需要消耗水蒸气多少千克?解:沸腾时系统的压力为86.0kPa,因此 消耗水蒸气的量 6.11 A–B二组分液态部分互溶系统的液-固平衡相图如附图,试指出各个相区的相平衡关系,各条线所代表的意义,以及三相线所代表的相平衡关系。 解:单项区, 1:A和B的混合溶液 l。 二相区: 2, l1 + l2; 3, l2 +B(s); 4, l1 +A(s) 5, l1 +B(s); 6, A(s)+B(s) 三项线: MNO, IJK, LJ, 凝固点降低(A),JM, 凝固点降低(B),NV, 凝固点降低(B) MUN, 溶解度曲线。
6.12 固态完全互溶、具有最高熔点的A-B二组分凝聚系统相图如附图。指出各相区的相平衡关系、各条线的意义并绘出状态点为a,b的样品的冷却曲线。 解:单项区:1 (A+B, 液态溶液, l) 4 (A+B, 固态溶液, s) 二相区: 2 (l1 + s1), 3 (l2 + s2) 上方曲线,液相线,表示开始有固溶体产生;下方曲线,固相线,表 示液态溶液开始消失。 冷却曲线如图所示6.13低温时固态部分互溶、高温时固态完全互溶且具有最低熔点的A-B二组分凝聚系统相图如附图。指出各相区的稳定相及各条线所代表的意义。1区为液态溶液,单相区;2区为固态溶液(固溶体),此区域内A、B可互溶解成一相;3区是液态溶液与固溶体α两相平衡区;4区是液态溶液与固溶体β两相平衡区;5区是固溶体α与固溶体β两相平衡区;最上边的一条曲线是液相组成线,也是A、B相互溶解度随温度变化曲线;中间的abc线是固态溶液组成线,表示不同温度下与液相平衡时固态溶液的组成;下面的def线是A(s)、B(s)的相互溶解度曲线,表示不同温度下固溶体α与固溶体β两相平衡时固溶体α与固溶体β的组成。6.15二组分凝聚系统相图如附图。(1)指出各相区稳定存在时的相;三相线上的相平衡关系;(2)绘出图中状态点为a,b,c三个样品的冷却曲线,并注明各阶段时的相变化。
解:(1)各相区相态如下表相区相态相区相态1溶液L6溶液L+固溶体β2固溶体α7溶液L+固溶体γ3固溶体β8固溶体α+固溶体β4固溶体γ9固溶体α+固溶体γ5溶液L+固溶体α水平线def为溶液L、固溶体β、固溶体γ三相平衡,自由度数为0.在此线上有如下平衡存在:L(组成为wd)+γ(s,组成为wf)β(s,组成为we)水平线ghk为溶液L、固溶体α、固溶体β三相平衡,自由度数为0.在此线上有如下平衡存在:L(组成为wh)α(s,组成为wg)+β(s,组成为wk)(2)状态a、b、c的三个样品的步冷曲线如下图:6.16A-B二组分凝聚系统相图如附图。指出各相区的稳定相,三相线上的相平衡关系。解:各相区的稳定相如图所示。
解:各相区的相态如下表所示相区相态相区相态1溶液L5溶液L1+溶液L22固溶体α6溶液L2+固溶体β3固溶体β7溶液L2+固溶体α4溶液L1+固溶体α8固溶体α+固溶体β6.18A-B二元凝聚系统相图如附图。标出图中各相区的稳定相,并指出图中的三相线及三相平衡关系。解:各相区的稳定相如右图。def,ghi为三相线三相平衡关系:def:l+βDCghi:α+C(s)Dl6.19附图中二组分凝聚系统相图内各相区的平衡相,指出三相线的相平衡关系。解:各相区的平衡相如下图所示。
三相线的相平衡关系:abc: C2(s)+B(s)Dldef: l+C2(s)DC1(s)ghi:α+C1(s)Dl第七章电化学7.1 用铂电极电解溶液。通过的电流为20A,经过15min后,问:(1)在阴极上能析出多少质量的?(2)在的27 ℃,100kPa下的? 解:电极反应为 电极反应的反应进度为 因此: 7.2用Pb(s)电极电解Pb(NO3)2溶液,已知溶液浓度为每1g水中含有Pb(NO3)21.66×10-2g。
7.3 用银电极电解溶液。通电一定时间后,测知在阴极上析出的,并知阴极区溶液中的总量减少了。求溶液中的和。解:解该类问题主要依据电极区的物料守恒(溶液是电中性的)。显然阴极区溶液中的总量的改变等于阴极析出银的量与从阳极迁移来的银的量之差: 7.4 已知25 ℃时溶液的电导率为。一电导池中充以此溶液,在25 ℃时测得其电阻为。在同一电导池中装入同样体积的质量浓度为的溶液,测得电阻为。计算(1)电导池系数;(2)溶液的电导率;(3)溶液的摩尔电导率。 解:(1)电导池系数为 (2)溶液的电导率 (3)溶液的摩尔电导率 7.5 25 ℃时将电导率为的溶液装入一电导池中,测得其电阻为。在同一电导池中装入的溶液,测得电阻为。利用表7.3.2中的数据计算的解离度及解离常熟。
解:查表知无限稀释摩尔电导率为 因此, 7.7 已知25 ℃时水的离子积,、和的分别等于,和。求25 ℃时纯水的电导率。 解:水的无限稀释摩尔电导率为 纯水的电导率 7.10 电池电动势与温度的关系为 (1)写出电池反应;(2)计算25 ℃时该反应的以及电池恒温可逆放电时该反应过程的。 解:(1)电池反应为
(2)25 ℃时 因此, 7.20 在电池中,进行如下两个电池反应: 应用表7.7.1的数据计算两个电池反应的。 解:电池的电动势与电池反应的计量式无关,因此 7.13 写出下列各电池的电池反应。应用表7.7.1的数据计算25 ℃时各电池的电动势、各电池反应的摩尔Gibbs函数变及标准平衡常数,并指明的电池反应能否自发进行。
解:(1)电池反应 根据Nernst方程 (2)电池反应 (3)电池反应
7.14 应用表7.4.1的数据计算下列电池在25 ℃时的电动势。 解:该电池为浓差电池,电池反应为 查表知, 7.15 电池在25 ℃时电动势为,试计算HCl溶液中HCl 的平均离子活度因子。 解:该电池的电池反应为 根据Nernst方程
7.16 应用德拜-休克尔极限公式计算25 ℃时溶液中、和。 解:离子强度 7.17 浓差电池,其中,已知在两液体接界处Cd2+离子的迁移数的平均值为。1.写出电池反应;2.计算25ºC 时液体接界电势E(液界)及电池电动势E。解:电池反应 由7.7.6式
电池电动势 7.18 为了确定亚汞离子在水溶液中是以Hg+ 还是以形式存在,涉及了如下电池测得在18ºC 时的E =29mV,求亚汞离子的形式。 解:设硝酸亚汞的存在形式为,则电池反应为 电池电动势为 作为估算,可以取, 。
所以硝酸亚汞的存在形式为。7.19 电池在25 ℃时测得电池电动势,试计算待测溶液的pH。 解:电极及电池反应为 查表知(表7.8.1),在所给条件下甘汞电极的电极电势为,则: 7.21 将下列反应设计成原电池,并应用表7.7.1的数据计算25ºC时电池反应的 解:(1)
(2) (3)7.24 (1)试利用水的摩尔生成Gibbs函数计算在25ºC于氢-氧燃料电池中进行下列反应时电池的电动势。已知,,计算25ºC时上述电池电动势的温度系数。 (2)应用表7.7.1的数据计算上述电池的电动势。 解:(1)查表知,因此,
(2)设计电池 7.25 已知25ºC时,。试计算应25ºC时电极的标准电极电势。 解:上述各电极的电极反应分别为 显然,,因此, 7.26 已知25ºC时AgBr的溶度积,,。试计算25ºC时 (1)银-溴化银电极的标准电极电势; (2)的标准生成吉布斯函数。
解:(1)设计电池,电池反应为 根据Nernst方程 沉淀反应平衡时,所以 (2)设计电池,电池反应为 该反应为的生成反应, 7.27 25ºC时用铂电极电解的。 (1)计算理论分解电压;(2)若两电极面积均为,电解液电阻为,和的超电势与电流密度的关系分别为 问当通过的电流为1mA时,外加电压为若干。
解:(1)电解溶液将形成电池,该电池的电动势1.229V即为的理论分解电压。 (2)计算得到和的超电势分别为电解质溶液电压降:10-3 x100=0.1V因此外加电压为:第八章界面现象8.1(1)常见的亚稳状态有哪些?为什么会产生亚稳状态?如何防止亚稳状态的产生?(2)在一个封闭的钟罩内,有大小不等的两个球形液滴,问长时间恒温放置后,会出现什么现象?(3)下雨时,雨滴落在水面上形成一个大气泡,试说明气泡的形状及其理由。(4)物理吸附与化学吸附最本质的区别为什么?(5)在一定温度、压力下,为什么物理吸附都是放热过程?解:(1)常见的亚稳定状态有:过饱和蒸气,过冷液体,过热液体,过饱和溶液等。原因:由于新相的生成时,其粒径极小,其比表面能较高,体系不可能自发地向能量较高的方向进行,除非体系本身的能量较高或外界干扰,因此,新相的生成是较困难。防止亚稳状态产生的方法:提供新相生成的“晶种”或外界扰动或提高体系本身的能量等法。(2)根据开尔文公式,液滴越小,其饱和蒸气压越高。因此,小液滴逐渐变小直至消失,大液滴逐渐变大。(3)该气泡近为球形(如不考虑水压影响,应为球形)。根据表面张力意义或附加压力公式,只有当表面作用力完全对称时,表面最为稳定。球形表面的作用力是完全对称的。(4)作用力的本质不同。物理吸附是范德华力,而化学吸附是化学键力。(5)物理吸附过程相当于气体凝结过程,此时气体的热运动能减小,体系熵减小。8.2在293.15K及101.325kPa半径为1×10-3m的汞滴分散成半径为1×10-9m的小汞滴,试求此过程系统的表面吉布斯函数变为其若干?已知293.15K汞的表面张力为0.470N×m-1解:小汞滴表面积为:分散成小小汞滴的个数为:
8.38.4解:(1)若使液面不上升,那么管中再加的压力应该等于平液面产生的附加压力即若不加任何压力,平衡后毛细管内液面升高的高度产生的压力应该等于上述管中增加的压力,即,那么8.6解:设普通CaCO3固体的分解压力为p,粉末CaCO3固体的分解压力为pr,根据开尔文公式得所以8.7解:毛细管中润湿角为θ油-水界面张力γ1与玻璃-水界面之间夹角γ21。如果水面上是空气,则毛细管内水上升的高度h基本上是由弯曲液面下附加压力引起的。但是当空气被油置换后,则毛细管内高度h,除弯曲液面下附加压力造成水的上升外,还要考虑毛细管外油产生的压力而令水柱产生的高度。就是说附加压力产生的水柱高度要低于h,即
其中,,R为弯曲液面的曲率半径,r为毛细管半径,将上述式子带入(1)中可8.8解:将题给方程两边取自然对数,得①与是线性关系。将题给数据取自然对数并列表如下。将表中数据按式①进行线性拟合并作图,得②-0.32520.26770.54411.06401.36892.01862.3127
2.32232.68782.85073.16553.34643.73533.9140将②与①对比,得n=0.603=2.5226k=12.58.9解:朗谬尔吸附等温式为(2))同样的方式带入公式即可得到结果:73.58dm3·kg-18.11在291.15K的恒温条件下,用骨炭从含醋酸的水溶液中吸附醋酸,在不同平衡条件下,每千克骨炭对醋酸的吸附量na与醋酸的平衡浓度c的数据如下:将上述数据关系用朗谬尔吸附等温式表示,并求出式中的常数。解:朗谬尔吸附等温式可以表示为以对作图,从直线的截距和斜率求得b和。注:作图必须符合规范,必须在坐标纸上用铅笔绘制,有图名、坐标名、坐标单位等。
8.13293.15K时,水的表面张力为72.75mN·m-1,汞的表面张力为486.5mN·m-1,而汞和水的界面张力为375mN·m-1,请判断:(1)水能否在汞的表面上我铺展开?(2)汞能否在水的表面上铺展开?8.15
(3)第九章化学动力学
9.1 反应为一级气相反应,320ºC时。问在320ºC加热90min的分解分数为若干?解:根据一级反应速率方程的积分式 答:的分解分数为11.2%9.2 某一级反应的半衰期为10min。求1h后剩余A的分数。解:同上题,答:还剩余A1.56%。9.3 某一级反应,反应进行10min后,反应物反应掉30%。问反应掉50%需多少时间? 解:根据一级反应速率方程的积分式 答:反应掉50%需时19.4min。9.4 25ºC时,酸催化蔗糖转化反应 的动力学数据如下(蔗糖的初始浓度c0为1.0023mol·dm-3,时刻t的浓度为c)030609013018000.10010.19460.27700.37260.4676
使用作图法证明此反应为一级反应。求算速率常数及半衰期;问蔗糖转化95%需时若干?解:数据标为03060901301801.00230.90220.80770.72530.62970.53470 -0.1052-0.2159-0.3235-0.4648-0.6283利用Powell-plotmethod判断该反应为一级反应,拟合公式 蔗糖转化95%需时9.5对于一级反应,使证明转化率达到87.5%所需时间为转化率达到50%所需时间的3倍。对于二级反应又应为多少? 解:转化率定义为,对于一级反应,
对于二级反应,9.6偶氮甲烷分解反应 为一级反应。287ºC时,一密闭容器中初始压力为21.332kPa,1000s后总压为22.732kPa,求。 解:设在t时刻的分压为p,1000s后,对密闭容器中的气相反应,可以用分压表示组成:9.7某一级反应,初始速率为,1h后速率为。求和初始浓度。 解:一级反应的速率方程
9.8现在的天然铀矿中。已知的蜕变反应的速率常数为,的蜕变反应的速率常数为。问在20亿年()前,等于多少?(a是时间单位年的符号。) 解:根据速率常数的单位知和的蜕变反应为一级反应,9.10某二级反应,两种反应物的初始浓度皆为,经10min后反应掉25%,求 。 解:由于A和B的计量系数和初始浓度相同,因此在反应过程中,令,由速率方程的积分式的9.11 某气相反应为二级反应,在恒温恒容下的总压p数据如下。求。0100200400¥
41.33034.39731.19727.33120.665 解:设在时刻t,A(g)的分压为,, ,因此01002004000.02420.03640.04750.0750,。9.12溶液反应 的速率方程为 20ºC,反应开始时只有两反应物,其初始浓度依次为,,反应20h后,测得,求k。
解:题给条件下,在时刻t有,因此积分得到 9.13 NO与进行如下反应: 在一定温度下,某密闭容器中等摩尔比的NO与混合物在不同初压下的半衰期如下:50.045.438.432.426.995102140176224 求反应的总级数。 解:在题设条件下,,速率方程可写作 ,根据半衰期和初始浓度间的关系 处理数据如下3.21893.12242.95492.78502.59904.55394.62504.94165.17055.4116
,总反应级数为2.5级。9.14在500ºC及初压为101.325kPa时,某碳氢化合物的气相分解反应的半衰期为2s。若初压降为10.133kPa,则半衰期增加为20s。求速率常数。 解:根据所给数据,反应的半衰期与初压成反比,该反应为2级反应。 9.17某溶液中反应,开始时反应物A与B的物质的量相等,没有产物C。1h后A的转化率为75%,问2h后A尚有多少未反应?假设: (1)对A为一级,对B为零级; (2)对A、B皆为1级。 解:用a 表示A的转化率。对于(1),反应的速率方程为 对(2),由于A与B的初始浓度相同,速率方程为
9.18反应的速率方程为,25ºC时。(1) 若初始溶度,,求。(2) 若将反应物A与B的挥发性固体装入密闭容器中,已知25ºC时A和B的饱和蒸气压分别为10kPa和2kPa,问25ºC时0.5mol A转化为产物需多长时间?解:在(1)的情况下,,速率方程化为在(2)的情况下,假设A和B的固体足够多,则在反应过程中气相中A和B的浓度不变,既反应速率不变,因此9.19反应在开始阶段约为级反应。910K时速率常数为,若乙烷促使压力为(1)13.332kPa,(2)39.996kPa,求初始速率。 解: (1)
(2)9.20 65ºC时气相分解的速率常数为,活化能为,求80ºC时的k及。 解:根据Arrhenius公式 根据k的单位,该反应为一级反应 9.21双光气分解反应为一级反应。将一定量双光气迅速引入一个280ºC的容器中,751s后测得系统的压力为2.710kPa;经过长时间反应完了后系统压力为4.008kPa。305ºC时重复试验,经 320s系统压力为2.838kPa;反应完了后系统压力为3.554kPa。求活化能。 解:根据反应计量式,设活化能不随温度变化 9.22反应中,在25ºC时分别为和,在35ºC时二者皆增为2倍。试求: (1)25ºC时的平衡常数。 (2)正、逆反应的活化能及反应热。
解:(1)(2) 9.23在80% 的乙醇溶液中,1-chloro-1-methylcycloheptane的水解为一级反应。测得不同温度t下列于下表,求活化能和指前因子A。0253545 解:由Arrhenius公式,,处理数据如下3.66103.35403.24523.1432-11.4547-8.0503-6.9118-5.8362
9.24 在气相中,异丙烯基稀丙基醚(A)异构化为稀丙基丙酮(B)是一级反应。其速率常数k于热力学温度T的关系为 150ºC时,由101.325kPa的A开始,到B的分压达到40.023kPa,需多长时间。 解:在150ºC时,速率常数为 9.27 某反应由相同初始浓度开始到转化率达20%所需时间,在40ºC时为15min,60ºC时为3min。试计算此反应的活化能。 解:根据Arrhenius公式 由于对于任意级数的化学反应,如果初始浓度和转化率相同,则 ,因此 9.28 溶液中某光化学活性卤化物的消旋作用如下: 在正、逆方向上皆为一级反应,且两速率常数相等。若原始反应物为纯的右旋物质,速率常数为,试求:(1) 转化10%所需时间;(2) 24h后的转化率。解:速率方程为
该方程的解为 (2)9.29 对行一级反应为。 (1)达到的时间为半衰期,试证; (2)若初始速率为每分钟消耗A0.2%,平衡时有80%的A转化为B,求。 证:对行一级反应速率方程的积分形式为(2),因此
9.31 对于两平行反应: 若总反应的活化能为E,试证明: 证明:设两反应均为n级反应,且指前因子相同,则反应速率方程为 上式对T求导数 9.33 若反应有如下机理,求各机理以表示的速率常数。 (1) (2) (3) 解:(1)应用控制步骤近似法,
(2)(4) 应用控制步骤近似法,反应的速率等于第一步的速率,而AB的生成速率为总反应速率的2倍:9.34 气相反应的机理为 试证: 证:应用稳态近似法
9.36 已知质量为m的气体分子的平均速率为 求证同类分子间A对于A的平均相对速率。 证:根据分子运动论,气体分子A与B的平均相对速率为 9.37 利用上题结果试证同类分子A与A间的碰撞数为 证:对于同类分子
9.38 利用上题结果试证:气体双分子反应的速率方程(设概率因子P =1)为 证:设该反应的活化能为,则 9.39 乙醛气相分解为二级反应。活化能为,乙醛分子直径为。 (1)试计算101.325kPa、800K下的分子碰撞数。 (2)计算800K时以乙醛浓度变化表示的速率常数k。 解:(1)根据38题的结果 (2)由39题的结果知
9.40 计算每摩尔波长为85nm的光子所具有的能量。 9.41 在波长为214nm的光照射下,发生下列反应: 当吸收光的强度,照射39.38min后,测得 。求量子效率。 解:生成的量等于反应掉的量 9.42 计算900ºC时,在Au表面的催化下分解经2.5h后N2O的压力,已知N2O的初压为46.66kPa。计算转化率达95%所需时间。已知该温度下。 解:根据速率常数的单位知,该反应为一级反应 9.43 1100K时在W上的分解数据如下:的初压35.3317.337.73半衰期7.63.71.7 试证明此反应为零级反应,求平均k。证:对数据的分析可以看出,半衰期与初始压力成正比,则正是零级反应的特征。
分别为 速率常数的平均值 。第十章胶体化学 10.110.210.310.4
10.510.610.7
10.810.9
10.1010.11
10.1210.13
10.1410.15
胶粒带正电荷10.16
'
您可能关注的文档
- 物流学概论 章节习题及答案.doc
- 物流法律法规各章节练习与答案.doc
- 物理上册答案.doc
- 物理化学 习题答案.doc
- 物理化学习题解答(中药).doc
- 物理化学习题详细答案.pdf
- 物理化学化习题答案.doc
- 物理化学各章复习题 附答案.doc
- 物理化学第五版课后习题答案.doc
- 物理化学课后习题解答.doc
- 物理学习题解答-第三版-祝之光.doc
- 物理学习题解答-第三版-祝之光.pdf
- 物理学习题解答-第三版-祝之光111.doc
- 三版_刘克哲_课后答案(1~16章).pdf
- 物理学简明教程马文蔚第1至7章课后习题答案详解.doc
- 物理必修1练习题含答案.doc
- 玄武区历史双向细目表(八上09、7).doc
- 王万生《计算机组成原理实用教程》课后习题答案.pdf
相关文档
- 施工规范CECS140-2002给水排水工程埋地管芯缠丝预应力混凝土管和预应力钢筒混凝土管管道结构设计规程
- 施工规范CECS141-2002给水排水工程埋地钢管管道结构设计规程
- 施工规范CECS142-2002给水排水工程埋地铸铁管管道结构设计规程
- 施工规范CECS143-2002给水排水工程埋地预制混凝土圆形管管道结构设计规程
- 施工规范CECS145-2002给水排水工程埋地矩形管管道结构设计规程
- 施工规范CECS190-2005给水排水工程埋地玻璃纤维增强塑料夹砂管管道结构设计规程
- cecs 140:2002 给水排水工程埋地管芯缠丝预应力混凝土管和预应力钢筒混凝土管管道结构设计规程(含条文说明)
- cecs 141:2002 给水排水工程埋地钢管管道结构设计规程 条文说明
- cecs 140:2002 给水排水工程埋地管芯缠丝预应力混凝土管和预应力钢筒混凝土管管道结构设计规程 条文说明
- cecs 142:2002 给水排水工程埋地铸铁管管道结构设计规程 条文说明