- 136.00 KB
- 2022-04-22 11:26:26 发布
- 1、本文档共5页,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报电话:19940600175。
' 《无机化学》第6版张天蓝主编课后习题答案第一章原子结构 1、υ=DE/h=(2.034´10-18J)/(6.626´10-34J×s)=3.070´1015/s; l=hc/DE=(6.626´10-34J×s´2.998´108m/s)/(2.034´10-18J)=9.766´10-8m 2、Dυ³h/2pmDx=(6.626´10-34kg×m2/s)/(2´3.14´9.11´10-31kg´1´10-10m)=1.16´106m/s。其中1J=1(kg×m2)/s2,h=6.626´10-34(kg×m2)/s 3、(1)l=h/p=h/mυ=(6.626´10-34kg×m2/s)/(0.010kg´1.0´103m/s)=6.626´10-35m,此波长太小,可忽略;(2)Dυ≈h/4pmDυ=(6.626´10-34kg×m2/s)/(4´3.14´0.010kg´1.0´10-3m/s)=5.27´10-30m,如此小的位置不确定完全可以忽略,即能准确测定。 4、He+只有1个电子,与H原子一样,轨道的能量只由主量子数决定,因此3s与3p轨道能量相等。而在多电子原子中,由于存在电子的屏蔽效应,轨道的能量由n和l决定,故Ar+中的3s与3p轨道能量不相等。 5、代表n=3、l=2、m=0,即3dz2轨道。 6、(1)不合理,因为l只能小于n;(2)不合理,因为l=0时m只能等于0;(3)不合理,因为l只能取小于n的值;(4)合理 7、(1)≥3;(2)4≥l≥1;(3)m=0 8、14Si:1s22s22p63s23p2,或[Ne]3s23p2;23V:1s22s22p63s23p63d34s2,或[Ar]3d34s2;40Zr:1s22s22p63s23p63d104s24p64d25s2,或[Kr]4d25s2;42Mo: 1s22s22p63s23p63d104s24p64d55s1,或[Kr]4d55s1;79Au:1s22s22p63s23p63d104s24p64d104f145s25p65d106s1,或[Xe]4f145d106s1;
9、3s2:第三周期、IIA族、s区,最高氧化值为II;4s24p1:第四周期、IIIA族、p区,最高氧化值为III;3d54s2:第四周期、VIIB族、d区,最高氧化值为VII;4d105s2:第五周期、IIB族、ds区,最高氧化值为II; 10、(1)33元素核外电子组态:1s22s22p63s23p63d104s24p3或[Ar]3d10s24p3,失去3个电子生成离子的核外电子组态为:1s22s22p63s23p63d104s2或[Ar]3d104s2,属第四周期,VA族;(2)47元素核外电子组态:1s22s22p63s23p63d104s24p64d05s1或[Kr]4d105s1,失去1个电子生成离子的核外电子组态为:1s22s22p63s23p63d104s24p64d10或[Kr]4d10,属第五周期,IB族;(3)53元素核外电子组态:1s22s22p63s23p63d104s24p64d105s25p5或[Kr]4d105s25p5,得到1个电子生成离子的核外电子组态为:1s22s22p63s23p63d104s24p64d105s25p6或[Kr]4d105s25p6,属第五周期,VIIA族。 11、根据电子填充顺序,72元素的电子组态为:1s22s22p63s23p63d104s24p64d104f145s25p65d26s2,或[Xe]4f145d26s2;其中最外层电子的主量子数n=6,属第6能级组,在第6周期,电子最后填入5d轨道,是副族元素,属IVB族,d区元素,其价电子为5d26s2,用4个量子数表示为:5、2、0、+1/2;5、2、1、+1/2;6、0、0、+1/2;6、0、0、-1/2; 12、(1)Br比I的电负性大;(2)S比Si的电离能大;(3)S-比S的电子亲和能大。 13、1s22s22p63s23p63d104s24p64d104f145s25p65d105f145g186s26p66d106f147s17d108s28p5,第8周期,VIIA族,p区。 14、最外层6个电子,次外层18个电子(3s23p63d10);它位于第4周期、VIA族、p区;其基态原子的未成对电子数为2。
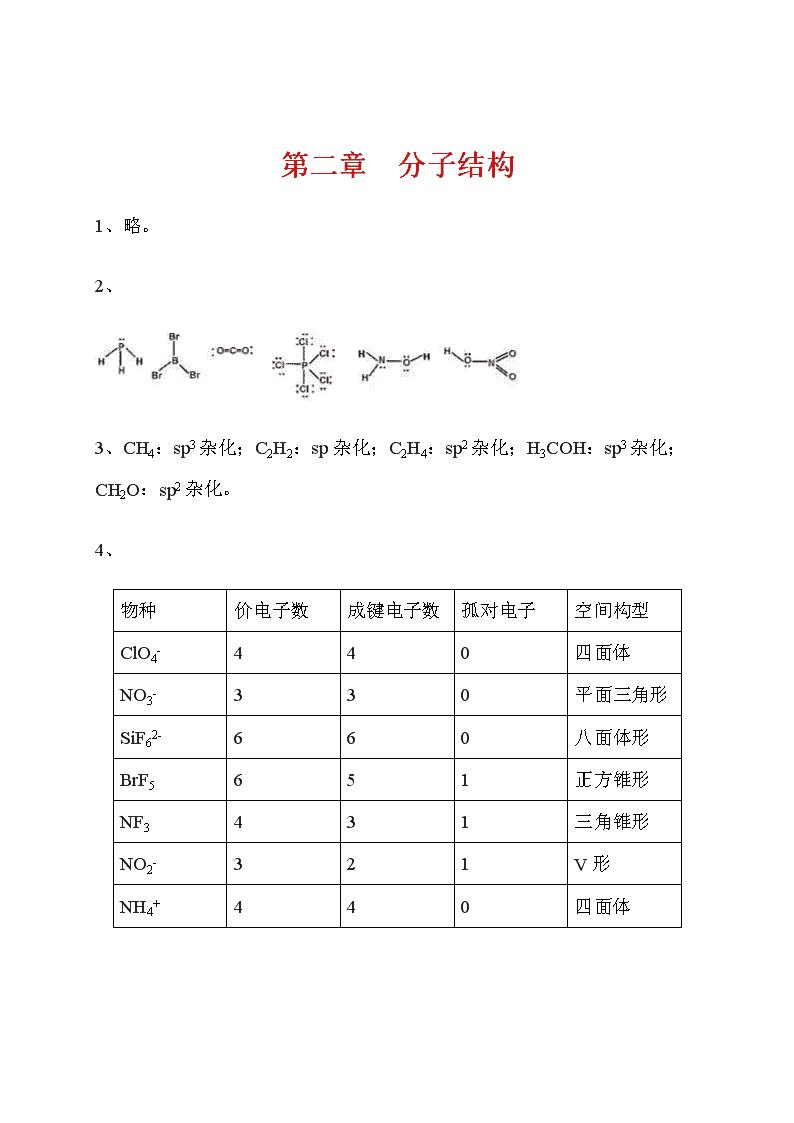
第二章分子结构1、略。2、3、CH4:sp3杂化;C2H2:sp杂化;C2H4:sp2杂化;H3COH:sp3杂化;CH2O:sp2杂化。4、物种价电子数成键电子数孤对电子空间构型ClO4-440四面体NO3-330平面三角形SiF62-660八面体形BrF5651正方锥形NF3431三角锥形NO2-321V形NH4+440四面体
5、根据电负性的差距越大,所形成的化学键的极性越大可以进行判断:(1)极性NaCl>MgCl2>AlCl3>SiCl4>PCl5;(2)LiFHCl>HBr>HI。6、略。7、(1)C原子的价层电子组态为2s22p5,得到4个电子或失去4个电子才能形成稳定的电子层结构,但得失4个电子是十分困难的,故很难形成离子键。(2)AlBr3为共价化合物,熔融时以分子形式存在,故导电性能差。AlBr3溶于水后,在极性水分子的作用下发生电离,生成Al3+和Br-,故水溶液能导电。(3)邻羟基苯甲酸的羟基和羧基相邻,主要形成分子内氢键。而对羟基苯甲酸的羟基和羧基相互背离,不能形成分子内氢键,但能形成分子间氢键,分子间氢键使分子间的作用力增大,导致对羟基苯甲酸的熔点高于邻羟基苯甲酸。(4)根据VSEPR理论,BeF2分子中心原子Be的价层电子对数为2,为直线型分子。SF2分子中心原子S的价层电子对数为4,轨道构型为四面体,但因有2对孤对电子,故SF2的分子构型为V型。(5)P元素有3s、3p和3d轨道,价层电子组态为3s23p3,与Cl原子化合时,可采用sp3不等性杂化与3个Cl原子生成PCl3分子,也可以采用sp3d杂化与5个Cl原子生成PCl5分子;N元素只有2s和2p轨道,价电子组态为2s22p3,只能采用sp3不等性杂化,有3个未成对电子与3个Cl原子生成NCl3分子。(6)用分子轨道理论解释(略)。
(7)H2S分子中存在取向力、诱导力和色散力,而H2O分子中除了存在取向力、诱导力和色散力外,还有分子间氢键,导致分子间作用力较大,沸点较高。故是H2O液体,而H2S是液体。(8)用极化理论进行解释(略)。(9)CO分子为碳氧三键,成键时氧原子多提供一对电子,抵消了C、O间由于电负性差距而产生的偶极矩,故CO分子的偶极矩很小;CO2分子的碳氧键虽为极性键,但其分子为对称的直线型分子,故偶极矩为零。(10)BF3分子为对称的平面三角形构型,虽B-F键为极性键,但其分子偶极矩仍为零。NF3分子为不对称的三角锥型构型,且N-F键为极性键,正负电荷中心不重合,故分子的偶极矩不为零。8、(1)色散力。(2)取向力、诱导力、色散力、氢键。(3)取向力、诱导力、色散力。(4)诱导力、色散力。(5)取向力、诱导力、色散力。9、(1)H2<Ne<CO<HF。H2、Ne为非极性分子,分子间只存在色散力,色散力随分子量增大而增大,因此Ne的分子间作用力大于H2分子间作用力。CO分子为极性分子,分子间存在着取向力、诱导力、色散力,其分子量又比Ne大,分子间色散力大于Ne。HF分子间除存在取向力、诱导力、色散力以外,还存在分子间氢键。(2)CF4<CCl4<CB4<CI4。CF4、CCl4、CB4和CI4均为非极性分子,分子间只存在色散力,色散力随分子量增大而增大,因此沸点依次升高。10、略。
第三章溶解与沉淀1、(1)离子积和溶度积的表达式均是所有产物浓度的系数次方之积比上所有反应物浓度的系数次方之积。但离子积表示的是任意溶液,是个变量,而溶度积表示的是饱和溶液,是个常量。(2)AgBr在AgNO3溶液中的溶解度很小,是因为同离子效应;而在KNO3溶液中的溶解度增大,是因为盐效应。2、PbI2:Kspθ=[Pb2+][I-]2;AgBr:Kspθ=[Ag+][Br-];Ba3(PO4)2:Kspθ=[Ba2+]3[CO32-]2;Fe(OH)3:Kspθ=[Fe3+][OH-]3;Ag2S:Kspθ=[Ag+]2[S2-];3、BaSO4设的溶解度为S,则S(BaSO4)=[Kspθ(BaSO4)]1/2=[1.08´10-10]1/2=1.08´10-5(mol/L)=1.08´10-5´233(g/L)=2.33´10-3(g/L)。4、先将PbI2的溶解度转化为以mol/L为单位,即S(PbI2)=[6.22´10-2´10]/461=1.35´10-3(mol/L),假设其全部电离,则:Kspθ(PbI2)=[Pb2+][I-]2=S´(2S)2=4S3=9.8´10-95、AB2的溶解度为S=(2.4´10-3)/80=3´10-5(mol/L),则Kspθ(AB2)=4S3=4´(3´10-5)3=1.08´10-136、混合后:c(Ag+)=10/30´1.0´10-4=1/3´10-4(mol/L),c(CrO42-)=20/30´2.0´10-4=4/3´10-4(mol/L),则Q(AgCrO4)=c(Ag+)2´c(CrO42-)=(1/3´10-4)2´(4/3´10-4)=1.48´10-13Kspθ,故有沉淀生成。若混合后稀释至500ml,则溶液中的Ca2+和CO32-浓度分别为:c(Ca2+)=(20´1.0´10-4)/500=4´10-6mol/L,c(CO32-)=(30´5.0´10-4)/500=3´10-5mol/L,离子积Q=c(Ca2+)´c(CO32-)=4´10-6´3´10-5=1.2´10-10CH3COOH>NH4+>H2O2、HS-+H2O=S2-+H3O+,Ka=[H3O+][S2-]/[HS-];HS-+H2O=H2S+OH-,Kb=[H3O+][H2S]/[HS-];H2O+H2O=H3O++OH-,Ka=[H3O+][OH-]=KW
;H3O++H2O=H3O++H2O,Ka=[OH-]/[OH-]=1;[Zn(H2O)6]2++H2O=H3O++[Zn(H2O)5(OH)]+,Ka=[Zn(H2O)5(OH)+][H3O+]/[Zn(H2O)62+];OH->S2->[Zn(H2O)5(OH)]+>H2O3、因为[H3O+][OH-]=KW=1.0´10-14,所以[OH-]=KW/[H3O+]=1.0´10-14/1.0´10-5=1.0´10-9mol/L4、已知pKa(HCO3-)=10.32,pKa(HPO42-)=12.36,因酸性HCO3->HPO42-,故碱性CO32-H2O,故乙酸在液氨中的酸性更强。6、质子传递平衡式为:NH3+H2O=NH4++OH-,且c=1.00mol/L,查表知Ka(NH4+)=5.62´10-10,则Ka(NH3)=1.78´10-5,由于c´Kb(NH3)>10KW,且c/Kb(NH3)>100,故用最简式求pH值。即[OH-]=[cKb]1/2=[1.00´1.78´10-5]1/2=4.22´10-3,即pH=14-pOH=11.63。7、(1)质子传递平衡式为:NH4++H2O=NH3+H3O+,且c=0.10mol/L,查表知Ka(NH4+)=5.62´10-10。由于c´Ka(NH4+)>10KW,且c/Ka(NH4+)>100,故用最简式求pH值。即[H+]=[cka]1/2=[0.10´5.62´10-10]1/2=7.5´10-6,即pH=5.12。(2)CH3NH2+H2O=CH3NH3++OH-,且c=1.0mol/L,查表知Kb(CH3NH2)=4.38´10-4。由于c´Kb(CH3NH2)>10KW,且c/Kb(CH3NH2)>100,故用最简式求pH值。即[OH-]=[ckb]1/2=[0.10´4.38´10-4]1/2=2.1´10-2,即pH=14-pOH=14.00-1.68=12.32。(3)F-+H2O=HF+OH-,且c=0.30mol/L,查表知Kb(F-)=5.62´10-4。由于c´Kb(F-)>10KW,且c/Kb(F-)>100,故用最简式求pH值。即[OH-]=[ckb]1/2=[0.30´5.62´10-4]1/2=2.3´10-6,即pH==14-pOH=8.36。
8、c=0.030mol/L,查表知Ka[Al(H2O)]3+=1.3´10-5。由于c´Ka[Al(H2O)]3+>10KW,且c/Ka[Al(H2O)]3+>100,故用最简式求pH值。即[OH-]=[cka]1/2=[0.030´1.3´10-5]1/2=1.3´10-5,即pH==3.21。9、已知乙酰水杨酸的摩尔质量为180,故其物质的量浓度c=(0.65/180)´(1/0.24)=1.5´10-2mol/L,且查表知其Ka=3.3´10-4。由于c´Ka>10KW,而c/Ka=45<100,故用半近似法计算溶液的pH值。即[H+]=[-c+(c2+4Ka)1/2]/2={-3.3´10-4+[(3.3´10-4)2+4´3.3´10-4´1.5´10-2]1/2}/2=2.066´10-3,即pH=2.68。10、本题为两性溶液(略)11、已知Ka(NH4+)=5.6´10-10,NH4Cl的分子量为53.5,故c(NH4+)=(1.1/53.5)´(1/0.10)=0.20mol/L,而c(NH3×H2O)=0.20mol/L,故根据缓冲溶液公式可知:pH=pKa+lg[c(NH3×H2O)/[c(NH4+)]=-lg(5.6´10-10)+lg(0.20/0.20)=9.25;加入0.20L水后,缓冲比(NH3×H2O)/[c(NH4+)不变,故溶液的pH仍为9.25。12、(1)比较酸常数可知,以HNO2计算pH,忽略HCN的贡献。(2)通过平衡式计算。(略)13、查表知H3PO4的Ka2=6.2×10-8,故pKa2=7.21,由[H2PO4-]和[HPO42-]组成的缓冲溶液,根据缓冲溶pH值计算公式可知,pH=pKa2+lg[HPO42-]/[H2PO4-],即7.40=7.21+lg[HPO42-]/[H2PO4-],则[HPO42-]/[H2PO4-]=1.55。14、此题首先要分析所得溶液的成分。(1)溶液为一元弱酸。c´Ka>10KW,且c/Ka>100,故[H+]=[cka]1/2=[1.0´1.75´10-5]1/2=4.2´10-2,即pH=1.38。(2)为NaAc的一元弱碱溶液。Kb=KW/Ka=10-14/(1.75´10-5)=5.71´10-10,c=0.50mol/L,因c´Kb>10KW,且c/Kb>100,故[OH-]=[ckb]1/2=[0.5´5.71´10-10]1/2=1.69´10-5
,即pH=14-pOH=14-4.77=9.23。(3)为缓冲溶液。混合后,c(Ac-)=c(HAc)=0.25mol/L,故pH=pKa+lg[Ac-]/[HAc]=-lg(1.75´10-5)+lg1=4.76。(4)此为NaAc和NaOH的混合溶液,溶液pH用强碱NaOH计算,忽略弱碱Ac-的贡献,混合后c(NaOH)=0.005mol/L,即pOH=-lg0.005=-2.30,故pH=14-2.30=11.70(5)此为缓冲溶液。混合后c(NaOH)=0.005mol/L,该NaOH会立即与HAc反应,导致最终溶液中的c(HAc)=0.25´1.0/1.01-0.005=0.245,而c(Ac-)=0.25´1.0/1.01+0.005=0.255,根据缓冲溶液pH计算公式可知:pH=pKa+lg[Ac-]/[HAc]=-lg(1.75´10-5)+lg(0.255/0.245)=4.78。15、由pH=pKa2+lg[VB/(V-VB)]可知,7.40=7.21+lg[VB/(1-VB)],解得VB=0.62L,VA=1-0.62=0.38L。16、根据平衡HA+H2O=H3O++A-,平衡时c(HA)=c-x=c(1-α),c(H3O+)=x=cα,c(A-)=x=cα,采用最简式求Ka,即Ka=cα2=0.100´(3.7´10-2)2=1.4´10-4,计算结果反过来验证可知c/Ka>100,表明可以用最简式计算。17、Ka=1.75´10-5,根据平衡HA+H2O=H3O++A-,平衡时c(HA)=c-x≈c,c(H3O+)=x,c(A-)=x,故Ka=x2/(c-x)≈x2/c,即c=x2/Ka=(10-2.378)/(1.75´10-5)=(1.75´10-5)/(1.75´10-5)=1.0;要使pH值等于3.00,乙酸的浓度应为:c2=x2/Ka=(10-3.00)2/(1.75´10-5)=(1.00´10-6)/(1.75´10-5)=0.0574,根据c1v1=c2v2可知,v2=c1v1/c2=1.00´0.200/0.0574=1.75L,故所需水的体积应为1.75-0.1=1.65L。
18、查表知Ksp=5.5´10-6。设Ca(OH)2饱和溶液的溶解度为x,则根据沉淀溶解平衡式可知,Ksp=[Ca2+][OH-]2=x×(2x)2,x=(Ksp/4)1/3=1.1´10-2,则[OH-]=2x=2.2´10-2,pH=14-pOH=12.3419、略。第五章氧化还原1、(1)系数依次为:2,5,14,5,5,2,7;(2)系数依次为:10,6,11,5,6,22;(3)系数依次为:3,2,2,1,4;(4)系数依次为:3,6,5,1,3;(5)系数依次为:1,2,3,1,2,2。2、(1)正极:2H++2e-=H2,负极:H2+2OH-=H2O+2e-,电池:H++OH-=H2O;(2)正极:Ag++e-=Ag,负极:Ag+I-=AgI+e-,电池:Ag++I-=AgI;(3)正极:Cu2++Cl-+e-=CuCl,负极:Cu+=Cu2++e-,电池:Cu++Cl-=CuCl;(4)正极:Cu2++2e-=Cu,负极:Cu+4NH3=Cu(NH3)42++2e-,电池:Cu++4NH3=Cu(4NH3)42+3、(1)(-)ZnêZn2+(c1)êêH+(c2)êH2(p)êPt(+)(2)(-)HgêHg2Cl2êCl-(c1)êêFe3+(c2),Fe2+(c3)êPt(+)(3)(-)PbêPbSO4êSO42-(c1)êêPb2+(c2)êPb(+)(4)(-)AgêAg(NH3)2+(c1),NH3(c2)êêAg+(c3)êAg(+)4、(1)Eθ(Ag+/Ag)=0.7991V;Eθ(Cu2+/Cu)=0.340V;Eθ<0,反应不能自发进行。(2)Eθ(I2/I-)=0.5355V;Eθ(Sn4+/Sn2+)=0.154V;Eθ<0,反应不能自发进行。(3)Eθ(O2/H2O)=1.229V;Eθ(Fe3+/Fe2+)=0.771V;Eθ>0,反应可自发进行。(4)Eθ(S/S2-)=-0.407V;Eθ(SO32-/S)=-0.59V;Eθ>0,反应可自发进行。
5、(1)正极:Cu2++2e-=Cu;Eθ(Cu2+/Cu)=0.340V;负极:Ni=Ni2++2e-;Eθ(Ni2+/Ni)=-0.257V;电池:Cu2++Ni=Cu+Ni2+Eθ=Eθ(Cu2+/Cu)-Eθ(Ni2+/Ni)=0.340-(-0.257)=0.597(V)DGθm=-nFEθ=-2´96500´0.597/1000=-115(KJ/mol)(2)正极:Cl2+2e-=2Cl-;Eθ(Cl2/Cl-)=1396V;负极:Fe=Fe2++2e-;Eθ(Fe2+/Fe)=-0.44V;电池:Cl2+Fe=Fe2++2Cl-Eθ=Eθ(Cl2/Cl-)-Eθ(Fe2+Fe)=1.396-(-0.44)=1.8(V)DGθm=-nFEθ=-2´96500´1.8/1000=-3.5´102(KJ/mol)6、反应(1)lgK1θ=1[0.7991-0.771]/0.0592,得K1θ=2.98;反应(2)lgK2θ=5[1.5-1.087]/0.0592,得K2θ=7.6´1034。7、设计电池:(-)AgêAg2C2O4(s)êC2O42-(1mol/L)êêAg+(1mol/L)êAg(+),电池反应为:2Ag+C2O42-=Ag2C2O4(n=2),lgKθ=lg(1/Ksp)=2[0.7991-Eθ(Ag2C2O4/Ag)]/0.0592,得Eθ(Ag2C2O4/Ag)=0.466V。8、(1)标准状态时,Eθ(MnO2/Mn2+)=1.23V,Eθ(Cl2/Cl-)=1.396V,Eθ<0,反应不能自发进行;(2)用浓盐酸时,c(Cl-)=c(H+)=12mol/L,令p(Cl2)=pθ=100kPa,c(Mn2+)=1.00mol/L,则:E(MnO2/Mn2+)=1.23+[0.0592lg(124/1.00)]/2=1.36V,E(Cl2/Cl-)=1.396+[0.0592lg(1/124)]/2=1.33V,E(MnO2/Mn2+)>E(Cl2/Cl-),故反应能自发进行。9、对于氢电极,E(H+/H2)=0.0000+{0.0592lg[c2(H+)/(pH2/pθ)]}/2,当p(H2)=100kPa=pθ,cθ=1mol/L时:E(H+/H2)=-0.0592pH,
令参比电极的电极电势为ER,则有(1)ER+0.0592´9.18=0.418,(2)ER+0.0592pH=0.312,联立(1)(2)方程组可解得pH=7.39。10、E={Eθ(B2+/B)+[0.0592lgc(B2+)]/2}-{Eθ(A2+/A)+[0.0592lgc(A2+)]/2},当c(A2+)=c(B2+)时,E=Eθ=0.360V,c(A2+)=0.100mol/L,c(B2+)=1.00´10-4mol/L带入上式得:E=0.360+[0.0592lg(1.00´10-4)/0.100]/2=0.271V。11、正极:氯化银电极,Eθ(AgCl/Ag)=0.2223V;负极:氢电极。当Eθ(H+/H2)=-0.0000V,[p(H2)=100kPa=pθ,cθ=1mol/L时:E(H+/H2)=-0.0592pH,则0.568=0.2223-(-0.0592pH);pH=5.84,假设c/Ka>100,[H+]=(cKa)1/2,计算可得一元弱酸HA的Ka=4.2´10-12。12、将两电极组成原电池,平衡时,原电池的电动势等于零。即:Eθ(Cu2+/Cu)+0.0592lg([Cu2+]/[Cu+])=Eθ(Cu2+/CuI)+0.0592lg([I-][Cu2+]),Eθ(Cu2+/Cu)-Eθ(Cu2+/CuI)=0.0592lg{[I-][Cu2+][Cu+]/[Cu2+]},即0.159-0.86=0.0592lgKsp,得Ksp=1.4´1012。13、反应为Cd2++Fe⇆Cd+Fe2+:Kθ=[Fe2+]/[Cd2+];lgKθ=2[(-0.403)-(-044)]/0.0592,得Kθ=18。14、(1)电池符号位(-)AgêAgIêI-(1mol/L)êêAg+(1mol/L)êAg(+);(2)正极:Ag++e-óAg,负极:Ag++I-=AgI+e-,电池:Ag++I-=AgI;(3)Eθ=Eθ(Ag+/Ag)-Eθ(AgI/Ag)=0.7991-(-0.152)=0.951(V);(4)略;(5)lgKθ=lg(1/Ksp)=nEθ/0.0592,得Ksp=8.6´10-17。15、氢电极:Eθ(H+/H2)=-0.0592pH,[p(H2)=100kPa=pθ,cθ=1mol/L],则Eθ(H+/H2)=-0.0592pH-(-0.7626)=0.46,得pH=5.11。16、反应Ag++Zn=2Ag+Zn2+中,平衡时c(Ag+)=x,c(Zn2+)=0.350-0.5x,lgKθ=lg([Zn2+]/[Ag+]2)=2´[0.7991-(-0.7626)]/0.0592,得Kθ=5.76´1052
,因为Kθ非常大,则[Zn2+]=0.350-0.50x≈0.350,(0.350-0.50x)/x2=Kθ=5.76´1052,x=(Ag+)=2.47´10-27(mol/L)。17、由题设反应可知反应转移的电子数n=6,Kθ=[A2+]3/[B3+]2=(5.00´10-3)/(2.00´10-2)=3.13´10-4;Eθ=0.0592lgKθ/n=0.0592lg(3.13´10-4)/6=-0.0346(V);DrGmθ=20.0(KJ/mol)。第六章配位化合物1、(1)二氯化六氨合钴(II),6,N;(2)二氯化一氯×五氨合钴(III),6,N、Cl-;(3)二硫氰酸根×二(三苯基磷)合钯(II),4,S、P;(4)二异硫氰酸根×二(三苯基磷)合钯(II),4,N、P;(5)二(硫代硫酸根)合银(I)离子,2,S;(6)二氯化四氨×二水合镍(II),6,N、O2、(1)[Co(NO2)3(NH3)3](2)[CoCl2(NH3)3(H2O)]Cl(3)[PtCl2(OH)2(NH3)2](4)K2[PtCl6]3、略4、略5、略6、(1)右;(2)左;(3)右;(4)右;(5)右。7、这些Lewis碱的软度由小到大的顺序为:Cl-<NH3<Br-<S2O32-<I-<CN-<S2-。根据硬软酸碱规则,软酸Ag+与上述系列中较软的碱结合的产物更稳定。Ag++Cl-=AgCl(s)+NO3-、AgCl(s)+2NH3=[Ag(NH3)2]++Cl-、Ag(NH3)2++Br-=AgBr(s)+2NH3、AgBr(s)+2S2O32-=Ag(S2O3)23--+Br-、Ag(S2O3)23-+I-=AgI(s)+2S2O32-、AgI(s)+2CN-=Ag(CN)2-+I-
2Ag(CN)2-+S2-=Ag2S(s)+4CN-8、略。9、溶液中最少应加入CN-的浓度为5.0×10-3mol/L。10、设AgI在2.0mol/L氨水中的溶解度为S,AgI(s)+2NH3=[Ag(NH3)2]++I-,平衡时浓度分别为[NH3]=2-2S,[Ag(NH3)2+]=[I-]=S,更加多重平衡规则,有K=KSPKS={[Ag(NH3)2+][I-]}/[NH3]2=S2/(2-2S)2,则S≈(22KSPKS)1/2=4´8.52´10-17´1.6´107=7.38´10-5(mol/L),故AgI在2.0mol/L氨水中的溶解度为7.38×10-5mol/L。11、Cu(NH3)42+的稳定常数为3.29×1012。12、因为Eθ(Co3+/Co2+)>>Eθ(O2/H2O),所以电势高的电对Co3+/Co2+的氧化态Co3+可以氧化电势低的电对O2/H2O的还原态H2O,Co3+可以把H2O氧化成O2。配合物的生成改变了电对的电极电势:Eθ{[Co(NH3)6]3+/[Co(NH3)6]2+}=Eθ(Co3+/Co2+)-RTln{Ks[Co(NH3)6]3+/Ks[Co(NH3)6]2+}/nF=1.92-1.78=0.14(V)。因为在碱性水溶液中Eθ{[Co(NH3)6]3+/[Co(NH3)6]2+}<Eθ(O2/OH-),所以[Co(NH3)6]3+不能把OH-氧化成O2,O2却可以把[Co(NH3)6]2+氧化成[Co(NH3)6]3+。13、利用电极电势数据判断氧化还原反应自发进行的思路是:电势高的电对的氧化态可以氧化电势低的电对的还原态。(1)Eθ(Cu+/Cu)>>Eθ(Cu2+/Cu+),因为电势高的电对Cu+/Cu的氧化态Cu+可以氧化电势低的电对Cu2+/Cu+的还原态Cu+,所以歧化反应可以发生。(2)由电极反应的Nernst方程得Eθ{[Cu(NH3)2]+/Cu}=Eθ(Cu+/Cu)-RTlnKs{[Cu(NH3)2]+}/nF=0.522-0.051=-0.12(V),Eθ{[Cu(NH3)4]2+/[Cu(NH3)2]+}=
Eθ(Cu2+/Cu+)-RTlnKs{Cu(NH3)4}2+/Ks{Cu(NH3)2+}/nF=0.153-0.146=7.05×10-3(V),Eθ{[Cu(NH3)2]+/Cu}<Eθ(Cu+/Cu),因为电势低的电对[Cu(NH3)2]+/Cu的氧化态[Cu(NH3)2]+不能氧化电势高的电对[Cu(NH3)4]2+/[Cu(NH3)2]+的还原态[Cu(NH3)2]+,所以歧化反应不能发生。第七章s区元素1、(1)碱金属过氧化物作供氧剂时所依据的反应原理是它们可与CO2作用生成碳酸盐并放出O2。2Na2O2+2CO2=2Na2CO3+O2。主要优点是在供氧的同时又可作为CO2的吸收剂,同时,碱金属过氧化物为固体,无毒,未潮解时无腐蚀性,便于携带。其缺点是碱金属过氧化物易吸潮而分解,且潮解后生成的氢氧化物具有强腐蚀性。Na2O2+2H2O=H2O2+2NaOH,2H2O2=O2+2H2O。(2)苛性钠可与空气中的CO2反应生成Na2CO3。配制不含Na2CO3杂质的NaOH溶液的方法是:先制备NaOH饱和溶液,密闭静置,使Na2CO3沉淀析出,取上层清液,用煮沸后冷却的新鲜蒸馏水稀释至所需浓度。但NaOH溶液要现配现用且在使用前需进行标定。(3)玻璃的主要成分为SiO2(酸性氧化物),可与所盛放的强碱溶液反应生成具有粘性的多聚硅酸盐,使玻璃瓶塞腐蚀并与瓶口粘在一起。
(4)Li与Mg、Be与Al分别位于周期表的对角线上,具有很多相似的性质,称为对角线规则。对角线规则是一经验规则,可从离子极化的角度进行说明(见教材),简而言之,它们的离子势相近,极化能力相近,从而性质相似。锂和铍的次外层为2电子构型,与次外层具有8电子构型的本族元素相比,2电子构型对核电荷的屏蔽作用较弱,元素的有效核电荷增强,原子半径减小,其离子的极化力强。因此,锂和铍的化合物共价性显著,其氢氧化物的碱性和溶解性,以及其盐类的性质也与本族元素显著不同。2、(1)锂的电极电势是低于钠,理论上还原性大于钠,但实际在它们与水反应时,由于锂的熔点高,与水反应时的热量不足以使锂熔化成液体,分散性差,造成锂的反应活性降低;此外,氢氧化锂的溶解度小,覆盖在金属表面,阻碍了反应的进行,从而使实际的反应剧烈程度小于钠。(2)略。(3)略。(4)略。(5)BaCO3和BaSO4溶于HAc的平衡常数分别为K1=(K2a,HAcKsp,BaCO3)/(Ka1,H2CO3Ka2,H2CO3)和K2=(K2a,HAcKsp,BaSO4)/(Ka1,H2SO4Ka2,H2SO4),虽然BaCO3的Ksp只比BaSO4的Ksp大约20倍,但HAc的酸性强于H2CO3而弱于H2SO4,K1>>1而K2<<1,所以BaCO3能溶于HAc,而BaSO4则不能溶于HAc。因BaSO4能与浓H2SO4生成Ba(HSO4)2而溶于H2SO4(其溶解反应的平衡常数也大于1)。(6)虽然Ba2+有毒,但硫酸钡的溶解度极小(KSP,BaSO4=1.08×10-10),同时钡餐制剂中还加入Na2SO4,产生同离子效应,更加降低了游离的Ba2+,对人体并不产生危害。3、(1)、2Na+2NH3=2NaNH2+H2↑,在液氨中还存在:Na+xNH3=Na+(NH3)y+e-(NH3)x-y,(2)、3Mg+N2=Mg3N2(3)、Na2O2+2H2O=H2O2+2NaOH(4)、4KO2+2CO2=2K2CO3+3O2(5)、MgCl2×6H2O=Mg(OH)2+2HCl+4H2O(6)、BaO2+H2SO4(稀)=BaSO4+H2O2
4、A、加HCl。大理石(CaCO3)有CO2气体生成,使澄清的石灰水变浑浊,而石膏(CaSO4)无现象;B、加HCl。纯碱(Na2CO3)有CO2气体生成,使澄清的石灰水变浑浊,而烧碱(NaOH)无现象;C、加热。石灰(CaO)无现象,而消石灰(Ca(OH)2)容器内壁有水珠生成。D、先加水,泻盐(MgSO4)变为溶液,然后加NaOH,生成Mg(OH)2的白色沉淀,最后加镁试剂,生成蓝色沉淀。而重晶石(BaSO4)不溶于水。5、(1)、分别取固体加水,能溶于水的有Na2CO3、KOH、CaCl2或BaCl2,不溶于水的是MgO和CaCO3;(2)、向不溶的试剂中分别加入稀盐酸,出现无色气体(能使石灰水变浑浊)的是CaCO3,仅溶解的是MgO(可加入NaOH,再加入镁试剂看是否出现蓝色沉淀进行验证);(3)、在溶于水的四种试剂中,加入稀盐酸,出现无色气体(能使石灰水变浑浊)的是Na2CO3,无反应的是KOH、CaCl2或BaCl2;(4)、向无反应的三种试剂中加入稀硫酸,出现白色沉淀的是BaCl2,无现象的是KOH或CaCl2;(5)、分别另取少了无沉淀的试剂,溶于水,加入(NH4)2C2O4,产生沉淀的是CaCl2,无沉淀的是KOH。(以上是其中一组方法,识别方法有多种)6、(1)、向所有离子溶液中加入(NH4)2SO4,产生白色沉淀的为BaSO4,该沉淀继续加HAc不溶解,表示有Ba2+;无沉淀的为Na+、Mg2+、Ca2+,继续向无沉淀的试剂中加入HAc和(NH4)2C2O4,有CaC2O4白色沉淀的表示有Ca2+,剩余的Na+、Mg2+试剂可加入氨水和(NH4)2CO3,有Mg2(OH)2CO3白色沉淀生成,且该沉淀加HAc和NaOH,镁试剂,有蓝色沉淀生成,表示有Mg2+;最后剩余的Na+,可加入Hac和Zn(Ac)2(UO2)3(Ac)6,有黄色沉淀生成,表示有Na+。
第八章d区、ds区和f区元素1、(1)3Zn+Cr2O72-+14H+=3Zn2++2Cr3++7H2OZn+2Cr3+=Zn2++2Cr2+4Cr2++O2+4H+=4Cr3++2H2O(2)2BaCrO4+16HCl(浓)=2CrCl3+3Cl2+2BaCl2+8H2O(3)Cr2O72-+H2O=2Cr2O42-+2H+Cr2O42-+Pb2+=PbCrO4(黄色)(4)2Mn(OH)2+O2=2MnO(OH)2(褐色)(5)3K2MnO4+2H2SO4=2KMnO4(紫红色)+MnO2↓(棕色)+2K2SO4+2H2O (6)2Fe3++3CO32-+3H2O=2Fe(OH)3↓+3CO2↑2、(1)KMnO4溶液在光的催化作用下可发生分解:4KMnO4+2H2O=4MnO2↓+3O2↑+4OH-;(2)略;(3)KMnO4固体与浓硫酸混合时会生成Mn2O7(高锰酸酐),其氧化性极强,遇热或遇有机物时会发生燃烧或爆炸;(4)先加入过量的NaOH,有沉淀的(Fe(OH)3)是Fe3+;剩余的两种溶液继续加入NH3-NH4Cl,生成沉淀(Al(OH)3)的是Al3+,仍是溶液(Co(NH3)63+)的为Co3+。(5)查表知Eθ(Fe3+/Fe2+)=0.771V、Eθ(I2/I-)=0.5355V,在溶液中Fe3+与I-会发生氧化还原反应,只能得到Fe2+和单质碘:2Fe3++2I-=2Fe2++I2。(6)略;(7)Fe2+在溶液中易发生水解,所以FeSO4需配制在稀硫酸中以便抑制水解;此外,Fe2+还原性强,易被空气中的氧气氧化,所以需加铁钉抗氧化;(8)略;(9)略;(10)略。3、略。4、(1)K2Cr2O7+5H2S+4H2SO4=Cr2(SO4)3+3S↓+7H2O+K2SO4;
(2)2CrCl3+16NaOH+3Br2=2Na2CrO4+6NaBr+6NaCl+8H2O;(3)K2Cr2O7+H2SO4=2CrO3↓+K2SO4+H2O;(4)MnO2+4HCl(浓)=MnCl2+Cl2+2H2O;(5)2KMnO4+6KI+4H2O=2MnO2+3I2+8KOH;(6)2KMnO4+Ns2SO4+2NaOH=2Na2MnO4++K2SO4+H2O;(7)2Fe(OH)3+3KClO+4KOH=2K2FeO4+3KCl+5H2O;(8)2Ni(OH)2+Br2+2NaOH=Ni(OH)3+2NaBr;(9)Co2O3+6HCl=2CoCl2+Cl2+3H2O;(10)3CuS+8HNO3(浓)=3Cu(NO3)2+3S↓+2NO+4H2O;(11)略;(12)略;(13)略;(14)略。5、(A)、MnO2;(B)、MnSO4;(C)、O2;(D)、Mn(OH)2;(E)、MnO(OH)2;(F)、K2MnO4;(G)KMnO46略;7略;8、首先加氨水,有沉淀的为MnO(OH)2和Fe(OH)3,无沉淀的为CrO42-和Cu(NH3)42+;然后向无沉淀组中通入H2S,有黑色沉淀CuS的表示Cu2+,无沉淀的再加入Pb2+生成黄色PbCrO4沉淀的表示有Cr3+;对另一组有沉淀的,则加入HCl并加入,转变为Mn2+和Fe3+,分别然后加入HAc和(NH4)2S,生成黑色FeS沉淀,继续加入HCl后转变为Fe3+,并与KSCN显血红色的为Fe3+,另一个加HAc和(NH4)2S后生成Mn2+,再加入HNO3和NaBiO3则生成MnO4-的紫红色表示为Mn2+。(2)略。'
您可能关注的文档
- 《数据与计算机通信》课后习题答案.pdf
- 《数据仓库与数据挖掘》(陈志泊)——习题答案.doc
- 《数据库管理系统》课后习题参考答案2.doc
- 《数据库系统原理及应用》习题集及参考答案.doc
- 《数据库系统概论》第四版课后习题答案.doc
- 《数据库系统概论》试题与答案(1).doc
- 《数据结构》(C语言版)习题答案.doc
- 《新编进出口贸易实务》(第3版)课后习题参考答案.doc
- 《新编预算会计(第八版)》练习题参考答案.doc
- 《无机化学》第6版张天蓝主编课后习题答案.doc
- 《无机材料物理性能》课后习题答案.docx
- 《普通心理学》课后习题+答案.doc
- 《普通逻辑学》练习题答案(第一版).doc
- 《普通逻辑学》综合练习题及其答案.doc
- 《本科自考02333软件工程课后习题答案-2011版 王立福》完整版.doc
- 《本科自考02333软件工程课后习题答案-2011版》完整版.doc
- 《机械制造基础》习题集参考答案.doc
- 《机械设计》考试复习题(2010)(答案).doc
相关文档
- 施工规范CECS140-2002给水排水工程埋地管芯缠丝预应力混凝土管和预应力钢筒混凝土管管道结构设计规程
- 施工规范CECS141-2002给水排水工程埋地钢管管道结构设计规程
- 施工规范CECS142-2002给水排水工程埋地铸铁管管道结构设计规程
- 施工规范CECS143-2002给水排水工程埋地预制混凝土圆形管管道结构设计规程
- 施工规范CECS145-2002给水排水工程埋地矩形管管道结构设计规程
- 施工规范CECS190-2005给水排水工程埋地玻璃纤维增强塑料夹砂管管道结构设计规程
- cecs 140:2002 给水排水工程埋地管芯缠丝预应力混凝土管和预应力钢筒混凝土管管道结构设计规程(含条文说明)
- cecs 141:2002 给水排水工程埋地钢管管道结构设计规程 条文说明
- cecs 140:2002 给水排水工程埋地管芯缠丝预应力混凝土管和预应力钢筒混凝土管管道结构设计规程 条文说明
- cecs 142:2002 给水排水工程埋地铸铁管管道结构设计规程 条文说明