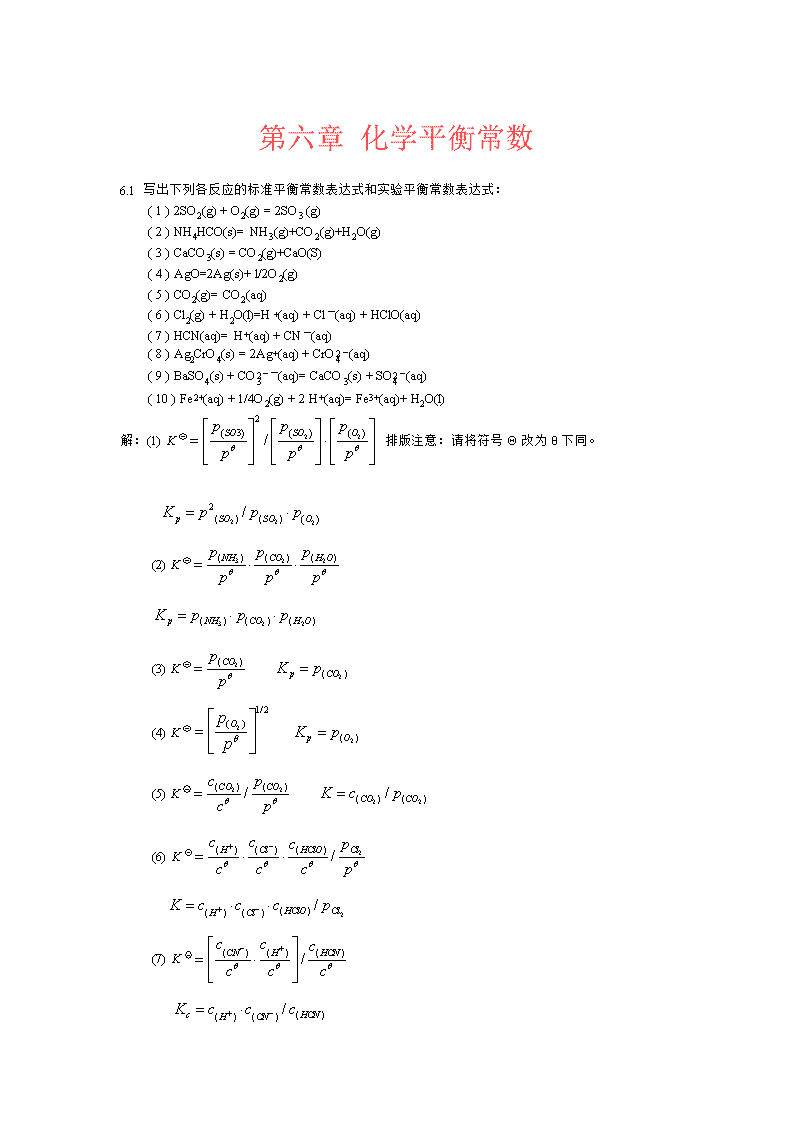- 359.00 KB
- 2022-04-22 11:22:57 发布
- 1、本文档共5页,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报电话:19940600175。
'第六章化学平衡常数6.1写出下列各反应的标准平衡常数表达式和实验平衡常数表达式:(1)2SO2(g)+O2(g)=2SO3(g)(2)NH4HCO(s)=NH3(g)+CO2(g)+H2O(g)(3)CaCO3(s)=CO2(g)+CaO(S)(4)AgO=2Ag(s)+l/2O2(g)(5)CO2(g)=CO2(aq)(6)Cl2(g)+H2O(l)=H+(aq)+Cl-(aq)+HClO(aq)(7)HCN(aq)=H+(aq)+CN-(aq)(8)Ag2CrO4(s)=2Ag+(aq)+CrO42-(aq)(9)BaSO4(s)+CO32--(aq)=CaCO3(s)+SO42-(aq)(10)Fe2+(aq)+1/4O2(g)+2H+(aq)=Fe3+(aq)+H2O(l)解:(1)K排版注意:请将符号Θ改为θ下同。(2)K(3)K(4)K(5)K(6)K(7)K
(8)K(9)K(10)KK实验评注:除非固体为混合物而且活度系数不等于1,在化学平衡中又会发生变化,否则在平衡常数表达式中没有固体。6.2已知反应ICl(g)=l/2I2(g)+l/2Cl2(g)在25℃时的平衡常数为K=2.2×10-3试计算下列反应的平衡常数:(1)ICl(g)=l/2I2(g)+l/2Cl2(g)(2)l/2I2(g)+l/2Cl2(g)=Cl(g)解:(1)K’=(K)2=(2.2×10-3)2=4.8×10-6(2)K’=(K)-1=(2.2×10-3)-1=4.5×1026.3下列反应的Kp和Kc之间存在什么关系?(1)4H2(g)+Fe3O4(s)=3Fe(s)+4H2O(g)(2)N2(g)+3H2(g)=2NH2(g)(3)N2O4=2NO2解:根据6.4实验测得合成氨反应在500℃的平衡浓度分别为:[H2]=1.15mol·dm-3,[N2]=0.75mol·dm-3,[NH3]=0.261mol·dm-3求标准平衡常数K、浓度平衡常数Kc以及分别用Pa为气体的压力单位和用bar为气体的压力单位的平衡常数Kp解:根据p=cRT同理:
答:标准平街常数K为1.48×10-5浓度平衡常数为戈为1.45×10-11Pa-2,压力平街常数1.45×10-11Pa-2或1.45×10-5bar-2.评注:此题的计算结果表明,以101325Pa为标准压力的标准平衡常数与以Pa或bar为单位的压力平衡常数在数值上是不同的;以Pa为单位的压力平衡常数和以bar为单位的压力平衡常该在数值上也是不同的若取1bar为标准压力.则标准平衡常数将与以bar为单位的压力平衡常数在纯数上是相同的,但前者的量纲与后者的量纲不同。6.5已知HCN=H++CN-K1=4.9×10-10NH3+H2O=NH4++OH-K2=1.8×10-5.求反应NH3+HCN=NH4++CN-的平衡常数Kθ。解:答:反应平衡常数K为0.882.6.6反应CO(g)+H2O(g)=CO2(g)+H2(g)在749K时的平衡常数K=2.6.设(l)反应起始时CO和H2O的浓度都为lmol·dm-3。(没有生成物,下同);(2)起始时CO和H2O的摩尔比为1:3,求CO的平衡转化率。用计算结果来说明勒沙特列原理。解:(l)CO(g)+H2O(g)=CO2(g)+H2(g)起始浓度(mol·L-1):1100平衡浓度(mol·L-1):(1-x)(1-x)xx解得,x=0.62故CO的平衡转化率=(2)(l)CO(g)+H2O(g)=CO2(g)+H2(g)起始浓度(mol·L-1):1300平衡浓度(mol·L-1):(1-3x)(1-x)xx
解得,x=0.86这时CO的平衡转化率=答:(l)反应起始CO和H2O的浓度都为lmol·dm-3时,转化率为62%:(2)CO和H2O的摩尔比由1;1变为1:3,相当于增加反应物的浓度,平衡向增加生成物浓度方向移动。评注:对于气相平衡,标准平衡常数应按气体的压力求得,但对于本压的反应,反应前后气体的总量是不变的,有Kc=Kp的关系式,因此,可直接按平衡浓度求取K.6.7将SO3固体置于一反应器内,加热使SO3气化并令其分解,测得温度为900K,总压为pθ时,气体混合物的密度为p=0.925g/dm-3,求SO3的(平衡)解离度α.解:PV=nRT→PM=ρRT气体混合物的平均分子量M=Ρrt/P=0.925g·dm-3·8.314dm3·KPa·mol-1·900K/101.325Kpa=68.3g·mol-1SO3→SO2+O2起始浓度(mol·dm-3):100平衡浓度(mol·dm-3):(1-x)xx平均分子量解得,x=0.342故答:SO3的(平衡)解离度是34.2%。6.8已知反应N2O4(g)=2NO2(g)在308K下的标准平衡常数K为0.32.求反应系统的总压p和2p.N2O4的解离度及其比。用计算结果说明勒沙特列原理。解:当总压为p时,……………………①……②由①、②可得:又由
现设N2O4的起始浓度为xmol·L-1,平衡时有amol·L-1.的N2O4转化为NO2N2O4NO2起始浓度(mol·L-1):x0平衡浓度(mol·L-1):(x-a)2a由此可得:x-a=0.023.2a=0.017解得,x=0.031,a=0.0084同理,当总压为2p.时,可算出解离度为50.6%,方法同上.答:系统总压为p时,N2O4的解离度为27.1%:当总压为2p时,解离度为50.6%;其比是1.38.这是一个体积增大的反应,根据勒沙特列原理,压力增大体积减少时,平衡会向体积增大的方向移动,结果N2O4的解离度变大.6.9为使Ag2O在常温下分解,真空泵需将氧的分压降至多大?解:查表知:ΔfGm(Ag2O)=-11.2kJ•mol-1ΔrGm=0-0-(-11.2kJ•mol-1)=11.2kJ•mol-1-11.2×103J•mol-18.314J•mol-1•K-1•298.15K-ΔrGmRTeK=exp[]e=exp[]=0.0109即,解得,=12Pa答:12Pa是氧化银分解反应在常温下达到平衡时氧气的分压(即“平衡分压”),因此,需将氧的分压降至12Pa以下,氧化银在常温下才会分解。6.10求10-5Pa的高真空中分解CuO的最低温度.解:CuO=Cu+1/2O2ΔrHm=Σ[νBSm]=[0+0-(-157.3)]kJ•mol-1ΔrSm=Σ[νBSm]=[33.15+205.138-42.3)]J•mol-1•K-1=93.419J•mol-1•K-1pO2py设最低分解温度为T,这时ΔrGm为0,因此ΔrGm(T)=ΔrGm(T)+RTlnJ=ΔrHm-TΔrSm+RTln=0157.3×103J•mol-1-T×93.419J•mol-1•K-1+T×8.314J•mol-1•K-1ln(10-5/105)=0解得,T=832K答:10-5Pa的真空中分解CuO的最低温度是832K。
评注:此题未明确氧化铜分解是得到铜还是氧化亚铜,此题解按分解得到铜。氧化铜分解是分步的,第一步是分解为氧化亚铜,因此,全面的解应当同时解出分解为氧化亚铜的最低温度,解法与本题解类似,读者可自行得解。6.11对比NH4HCO3,在总压为p和各组分气体均为p时分解温度的差别.哪一种情况符合试管内该物质分解的实际情况?解:NH4HCO3(S)=NH3(g)+CO2(g)+H2O(g)ΔrHm=Σ[νBSm]=[-46.11-24.818-393.509-(-849.352)]kJ•mol-1=384.952kJ•mol-1ΔrSm=Σ[νBSm]=213.74+188.825+192.45-129.92=474.10J•mol-1•K-1(1)总压为p时,设分解温度为TlΔrGm(T)=ΔrGm(T)+RTlnJ=0384.91×103J•mol-1-T×474.10J•mol-1•K-1+T1×8.314J•mol-1•K-1ln(py/py)=0解得,Tl=768K(2)各气体的分压均为p时,设分解温度为T2ΔG=ΔH-T2ΔS=384.915×103J•mol-1-T2×8.314J•mol-1•K-1=0T2=812K答:总压为p时,分解温度是768K,各种分气体分压均为pθ时分解温度为812K总压为pθ时符合实际情况,因为试管口的环境压力为p。(注:NH4HCO3,的ΔfHm,ΔfSm查于《物理化学手册》,上海科学技术出版社:)评注:在许多教科书里,热力学分解温度通常是按反应的标准自由能变化∆Gθ=0求取的.但对于分解产生多种气体的反应,每种气体的压力都等于标准压力的情形显然是不现实的,除非分解是在加压(压力等于各气体的标准压力之和)情况下而不是在常压下进行的。本题的计算结果告所我们,诸如碳酸氢氨等分解产生多种气体的反应的热分解温度事实上会低于按通常定义的“热力学分解温度”计算得到的数值,而且,分解产生的气体的种类越多,分解温度比“热力学分解温度”计算的数值低得越多。本题计算结果表明碳酸氢氨的分解温度的两种计算己有超过6%的差别,己不可忽视.附带可指出,如果固体物质在加热过程中还发生晶相的变化,而计算时忽略了这种变化引起的热力学函数的改变,还会造成计算的偏差《有的固体的晶相变化引起的热力学函数的改变可以在手册中查到》。此外,事实上热力学函数∆Hθ和∆Sθ还都是温度的函数,本教材假设它们的数值不随温度改变,因而本题的计算也忽略了这种变化.考虑这种变化,计算结果才可能更符合实际。有关∆Hθ和∆Sθ温度变化的计算需在后续的物理化学课程中才会讨论。6.12在693K和723K下氧化汞分解为汞蒸气和氧的平衡总压分别为5.16×104和1.8×105Pa,求在该温度区域内分解反应的标准摩尔焓和标准摩尔熵变。解:HgO=Hg+1/2O2693K时,总=3.44×104Pa;=1/3总=1.72×104PaΔrGm(693K)=RTlnK=-8.314J•mol-1•K-1•693K×ln0.14=11.32kJ•mol-1
同理在723K时,可得ΔrGm(723K)=5.16kJ•mol-1ΔrGm(T)=ΔrHm-TΔrSm11.3kJ•mol-1=ΔrHm-693KΔrSm5.16=ΔrHm-723KΔrSm解得.ΔrHm=153.62kJ•mol-1ΔrSm=205.3kJ•mol-1•K-1,答:该温度区域内分解反应标准摩尔焓是153.62kJ∙mol-1,标准摩尔熵是205.3kJ•mol-1•K-1,评注:氧化汞有黄色和红色两种,在热力学性质上并无差别.6.13查阅热力学函数表估算二氧化硫与氧气反应生成三氧化硫的反应在400、600和800℃下的平衡常数.由400℃至600℃和600℃至800℃都是200℃的温差,该反应的平衡常数的变化是否相同?若不同,又如何解释其差异?解:SO2+1/2O2=SO3ΔrHm=-[395.72-(-296.83)]kJ•mol-1=-98.89kJ•mol-1ΔrSm=[256.76-205.138×1/2-248.22]J•mol-1•K-1,=-94.03J•mol-1•K-1,ΔrHm-TΔrSmRT-ΔrGmRTeK=exp[]e=exp[]同理,K(873K)=9.9;K(1173K )=0.3答:400℃、600℃和800℃时的平衡常数分别是578、9.9、和0.3.该反应平衡常数的变化不相同。K-T曲线是一条对数曲线,因此随着温度升高,平衡常数K的变化率变小。6.14雷雨导致空气中的氮气和氧气化合为NO是自然界中氮的固定的主要反应之一。经热力学计算得知,在2033K和3000K下该反应达平衡时系统中NO的体积分数分别为0.8%和4.5%,试问(1)该反应是吸热反应还是放热反应(2)计算2033K时的平衡常数。解:N2+O2=2NO0.82(100-0.8/2)2K(2033K)==2.4×10-4K2K1ΔrHm(298K)R4.52(1.00-4.5/2)2K(2033K)==8.9×10-3ΔrHm(298K)8.314J•mol-1•K-18.9×10-32.4×10-4∵ln≈[1/T1-1/T2]∴ln≈×[1/T1-1/T2]解得:ΔrHm=185.26kJ•mol-1﹥0
答:(l)该反应是吸热反应:(2)2033K时的平衡常数是2.4×10-4.6.15下面各种改变将对反应2SO2(g)+O2(g)=2SO3(g)(∆rHmθ=198kJ/mol)的平衡分压有何影响?A、将反应容器的体积加倍。B、保持体积而增加反应的温度。C、加多氧最。D、保持反应容器的体积而加入氩气。答:A、减少;B、增大;C、增大;D、不变。6.16下面的反应在一个1升的容器里,在298K下达成平衡:C(石墨)+O2(g)=CO3(g)∆rHmθ=-393kJ/mol以下各种措施对氧气的平衡分压有何形响?A、增加石墨的量。B、增加CO2气体的量。C、增加氧气的量。D、降低反应的温度。E、加入催化剂。解:A、不变;B、增大;C、增大;D、减少;E、不变。6.17PCl5(g)分解成PCl3(g)和Cl2(g)的反应是一个吸热反应。以’下各种措施对五氧化磷的解离率有何影响?A、压缩气体混合物。B、增加气体混合物的体积。C、降低温度。D、保持混合气体的体积不变的前提下向气体混合物添加氯气。答:A、减少;B、增大;C、减少;D、减少。6.18在200℃下的体积为V的容器里,下面的吸热反应达成平衡态:NH4HS(g)=NH3(g)+H2S(g)通过以下各种措施,反应再达到平衡态时,NH3的分压跟原来的分压相比,有何变化?A、增加氨气。B、增加硫化氢气体。C、增加NH4HS固体。D、增加温度。E、加入氩气以增加体系的总压。F、把反应容器的体积增加到2片答:A、增大;B、减少;C、不变;D、增大;E、不变;F、不变。6.19已知氯气在饱和食盐水里的溶解度小于在纯水里的溶解度。试从平衡移动的原理加以解释。解:氯气在水中溶解存在以下平衡:饱和食盐水中含有大量氯离子,相当于增加生成物的浓度,平衡向反应物方向移动,故这时氯气的溶解度比在纯水里的少。
6.20实验测得氯气溶于水后约有三分之一的Cl2发生歧化转化为盐酸和次氯酸,求该反应的平衡常数。293K下氯气在水中的溶解度为0.09mol·dm-3。解:答:该反应的平衡常数是4.5×10-4。评注:计算式中溶解于水的氯气的浓度为0.06mol·dm-3,是平衡浓度,不应忘记代入平衡常数表达式的浓度都是平衡浓度。此题的逆运算,即已知平衡常数求氯在水中歧化的百分率,计算起来要复杂得多,是一个多次方程,可用叠代法。6.21自然界里氮的固定的主要途径之一是在闪电的作用下,氮气与氧气反应生成NO,然后NO和氧气继续反应生成NO2.后者与水反应,生成硝酸.热力学研究证明,在通常条件下氮气和氧气的反应的转化率要低于闪电条件下的转化率(在催化剂存在下,克服动力学的障碍,氮气和氧气在常温下也能反应的话)。问:氮气和氧气的反应是吸热反应还是放热反应?闪电造成的气体体积膨胀对反应的平衡转化率有何影响?解:设通常条件下的温度为T1,平衡常数为Kl,闪电条件下的温度为T2.平衡常数为K2。T2-T1T2T1K2K1ΔrHm(298K)R根据ln≈[]∵T2﹥T1,K2﹥K1,∴ΔrHm﹥0,反应吸热。可以写出总反应这是一个气体体积减少的反应,根据勒沙特列原理,气体体积膨胀会使平衡转化率增大。6.22超音速飞机在平流层飞行放出的燃烧尾气中的NO会通过下列反应破坏该层大气层里的保护我们免受阳光中的短波紫外线辐射伤害的臭氧:NO(g)+O3(g)=NO2(g)+O2(g)a,如果已知298K和1atm下NO、NO2和O3的生成自由能分别为+86.7、+51.8、+163.6kJ/mol.求上面的反应的Kp和Kcb.假定反应在298K下发生前,高层大气里的NO、O3和O2的浓度分别为2×10-9、1×10-9、2×10-3mol·dm-3,N2的浓度为零,试计算O3的平衡浓度。c.计算达到平衡时O3被NO破坏的百分数。附注:实际上上述反应的速度不很大,反应并不易达到平衡转化率。解:a.ΔrGm=(51.8-86.7-163.6)kJ•mol-1=-198.5kJ•mol-1
-ΔrGmRTeK=exp[]198.5×103J•mol-18.314J•mol-1•K-1×298.15Ke=exp[]=6.24×1034∴KC=6.24×1034KP=KC(RT)Σν=KC=6.24×1034)(∵Σν=0)b.设平衡时O3的浓度为[O3],则参加反应的O3为1×10-9-[O3],根据反应方程式的计量关系.平衡时NO的浓度为2×10-3-(1×10-9-[O3])=1×10-9+[O3];NO2的浓度是1×10-9-[O3]而O2的浓度远大于NO、O3的浓度,故反应前后可视认的浓度不变.解得,=3.21×10-3.c.平衡时O3被NO破坏的百分数=(1×10-9-3.21×10-38/1×10-9)×100%≈100%此反应的平衡常数十分大,幸好此反应的速率不很大,反应不易达到平衡转化率,否则高层大气的O3将被破坏殆尽。6.23通过热力学的研究求得反应:CO(g)+1/2O2(g)=CO2(g)在1600℃下的Kc约为1×104经测定汽车的尾气里的CO和CO2气体的浓度分别为4.0×10-5和4.0×10-4mol·dm-3.若在汽车的排气管上增加一个1600℃的补燃器,并使其中的氧气的浓度始终保持4.0×10-4mol·dm-3,求CO的平衡浓度和补燃转化率。解:设有xmol·dm-3的CO转化为CO2CO(g)+1/2O2(g)=CO2(g)起始浓度(mol·dm-3):4.0×10-54.0×10-44.0×10-4平衡浓度(mol·dm-3):4.0×10-5x4.0×10-44.0×10-4-x,解得,x=3.8×10-5CO的平衡浓度=2×10-5mol·dm-3,转化率=答:CO的平衡浓度是2×10-5mol·dm-3,补燃转化率是95%.6.24在23题的系统里,同时发生反应:SO2(g)+1/2O2(g)=SO3(g)Kc=20经测定,汽车的尾气原有SO2气体的浓度为2×10-4问SO2的平衡浓度。解:设有xmol·dm-3的SO2转化为SO3,SO2(g)+1/2O2(g)=SO3(g)
起始浓度(mol·dm-3)2×10-44×10-40平衡浓度(mol·dm-3)2×10-4-x4×10-4x解得,x=5.7×10-5mol·dm-3答:SO3的平衡浓度为5.7×10-5mol·dm-3。6.25汽车的尾气里有NO气体,它是汽车内燃机燃烧的高温引起的氮气和氧气的反应:N2(g)+O2(g)=2NO(g)Kc=0.10(2000℃时)在一个2L的容器里进行实验,起始时,氮气和氧气的浓度分别为0.81mol·dm-3求达到平衡时NO气体的浓度。解:设有xmol·dm-3,的N2转化为NON2(g)+O2(g)=2NO(g)起始浓度(mol·dm-3)0.810.810平衡浓度(mol·dm-3)0.81-x0.81-xx解得x=0.11答:NO的浓度为0.11mol·L-1。6.26实验指出无水三氯化铝在热力学标准压力下的以下各温度时测定的密度为:T(℃)200600800d(g·mL-l)6.8×10-32.65×10-31.51×10-3A.求三氯化铝在200℃和800℃时的分子式。B.求600℃下的平衡物种。C.求600℃下个物种的平衡分压。D.求600℃的Kc和Kp。解:A.pV=nRT→M=ρRT/p200℃时,M=6.8g∙dm-3×0.08206dm3∙atm∙mol-1∙K-1×473K/1atm=264g∙mol-1故分子式为Al2Cl6800℃时,M=1.51g∙dm-3×0.08206dm3∙atm∙mol-1∙K-1×1073K/1atm=134g∙mol-1故分子式为AlCl3B.同理,600℃时,=189.8g∙mol-1设AlCl3的摩尔分数为x,则Al2Cl6的摩尔分数为1-x133.5x+267(1-x)=189.8解得,x=0.578答:600℃时,AlCl3占57%,Al2Cl6占42%.C.AlCl3的平衡分压是0.578atm(58.6KPa)Al2Cl6的平衡分压0.422atm(42.7KPa)。D.2AlCl3Al2Cl6
答:600℃时的Kc为0.018L∙mol-1,Kp为1.25×10-5Pa·'
您可能关注的文档
- 化工热力学课后习题答案.doc
- 化工热力学课后作业答案(学生版).doc
- 化工设备机械基础习题和答案.docx
- 化工设备机械基础课后答案.doc
- 北京交通大学远程与继续教育《概率论与数理统计》课后习题答案.doc
- 北京电大《职业生涯规划》复习题.doc
- 北京邮电大学 考前打印《宽带IP网络》综合练习题答案2.doc
- 北京邮电大学远程教育和函授教育 《英语》综合练习题与答案.pdf
- 北师大《无机化学》第四版习题答案11.doc
- 北师大版无机化学习题答案(上、下册).doc
- 北师大版无机化学习题答案(上册).doc
- 北师大版生物八年级下册全套试题(附答案).doc
- 北理工《C语言程序设计教程(第二版)》李凤霞主编李书涛主审版课后习题答案.pdf
- 北航数学规划基础答案2016最新.pdf
- 北邮《微机原理与接口技术》周峰参考答案.pdf
- 医学心理学题库.doc
- 医学物理学习题解答(第3版).doc
- 医学生必看《细胞生物学》习题及解答02.doc.doc
相关文档
- 施工规范CECS140-2002给水排水工程埋地管芯缠丝预应力混凝土管和预应力钢筒混凝土管管道结构设计规程
- 施工规范CECS141-2002给水排水工程埋地钢管管道结构设计规程
- 施工规范CECS142-2002给水排水工程埋地铸铁管管道结构设计规程
- 施工规范CECS143-2002给水排水工程埋地预制混凝土圆形管管道结构设计规程
- 施工规范CECS145-2002给水排水工程埋地矩形管管道结构设计规程
- 施工规范CECS190-2005给水排水工程埋地玻璃纤维增强塑料夹砂管管道结构设计规程
- cecs 140:2002 给水排水工程埋地管芯缠丝预应力混凝土管和预应力钢筒混凝土管管道结构设计规程(含条文说明)
- cecs 141:2002 给水排水工程埋地钢管管道结构设计规程 条文说明
- cecs 140:2002 给水排水工程埋地管芯缠丝预应力混凝土管和预应力钢筒混凝土管管道结构设计规程 条文说明
- cecs 142:2002 给水排水工程埋地铸铁管管道结构设计规程 条文说明