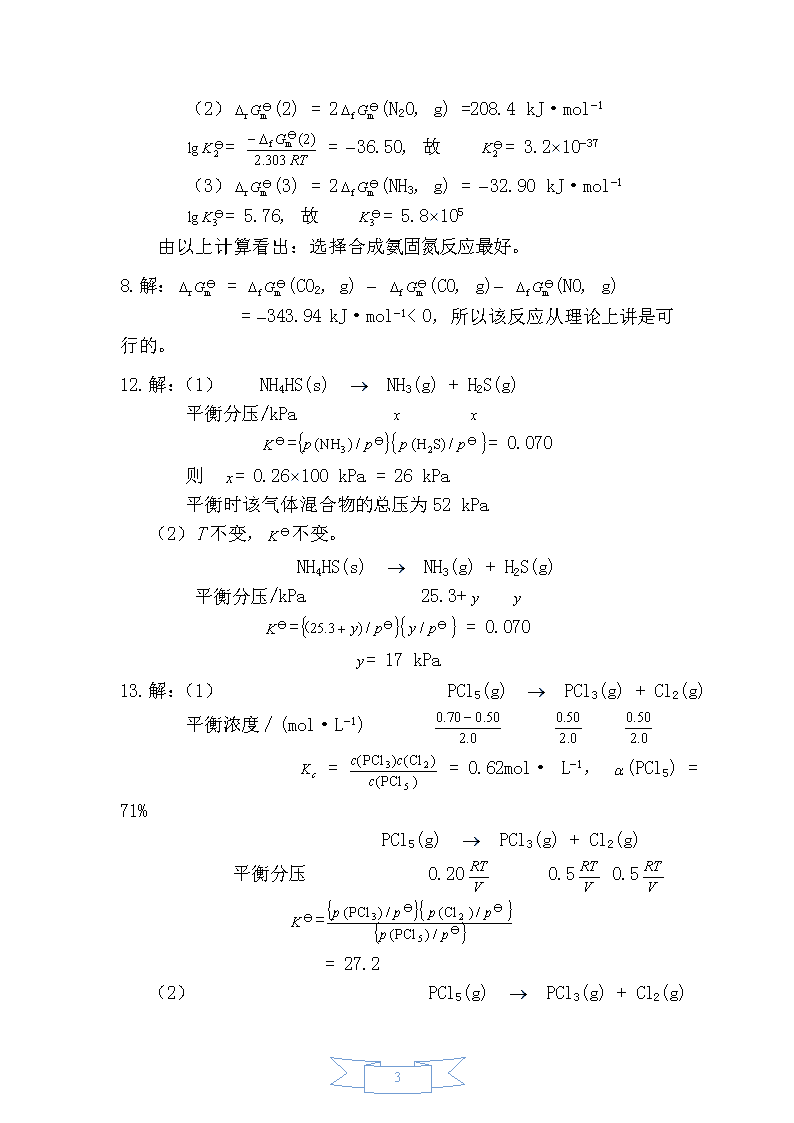- 531.00 KB
- 2022-04-22 11:36:37 发布
- 1、本文档共5页,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报电话:19940600175。
'《无机化学第四版》复习资料制作人:姚永超第1章化学反应中的质量关系和能量关系习题参考答案(P-23)9.解:U=Qp-pV=0.771kJ10.解:(1)V1=38.310-3m3=38.3L(2)T2==320K(3)-W=-(-pDV)=-502J(4)DU=Q+W=-758J(5)DH=Qp=-1260J12.解:=Qp=-89.5kJ=-DnRT=-96.9kJ13.解:(1)C(s)+O2(g)→CO2(g)=(CO2,g)=-393.509kJ·mol-1CO2(g)+C(s)→CO(g)=86.229kJ·mol-1CO(g)+Fe2O3(s)→Fe(s)+CO2(g)=-8.3kJ·mol-1各反应之和=-315.6kJ·mol-1。(2)总反应方程式为C(s)+O2(g)+Fe2O3(s)→CO2(g)+Fe(s)=-315.5kJ·mol-1由上看出:(1)与(2)计算结果基本相等。所以可得出如下结论:反应的热效应只与反应的始、终态有关,而与反应的途径无关。15.解:(1)Qp===4(Al2O3,s)-3(Fe3O4,s)=-3347.6kJ·mol-115
(2)Q=-4141kJ·mol-118.解:CH4(g)+2O2(g)→CO2(g)+2H2O(l)=(CO2,g)+2(H2O,l)-(CH4,g)=-890.36kJ·mo-1Qp=-3.69´104kJ第2章化学反应的方向、速率和限度习题参考答案(P-57)3.解:=-70.81kJ·mol-1;=-43.2J·mol-1·K-1;=-43.9kJ·mol-1(2)由以上计算可知:(298.15K)=-70.81kJ·mol-1;(298.15K)=-43.2J·mol-1·K-1=-T·≤0T≥=1639K4.解:(1)=== (2)===(3)===(4)===7.解:(1)(l)=2(NO,g)=173.1kJ·mol-1==-30.32,故=4.8´10-3115
(2)(2)=2(N2O,g)=208.4kJ·mol-1==-36.50,故=3.2´10-37(3)(3)=2(NH3,g)=-32.90kJ·mol-1=5.76,故=5.8´105由以上计算看出:选择合成氨固氮反应最好。8.解:=(CO2,g)-(CO,g)-(NO,g)=-343.94kJ·mol-1<0,所以该反应从理论上讲是可行的。12.解:(1)NH4HS(s)®NH3(g)+H2S(g)平衡分压/kPa==0.070则=0.26´100kPa=26kPa平衡时该气体混合物的总压为52kPa(2)T不变,不变。NH4HS(s)®NH3(g)+H2S(g)平衡分压/kPa25.3+==0.070=17kPa13.解:(1)PCl5(g)®PCl3(g)+Cl2(g)平衡浓度/(mol·L-1)==0.62mol·L-1,(PCl5)=71%PCl5(g)®PCl3(g)+Cl2(g)平衡分压0.200.50.5==27.2(2)PCl5(g)®PCl3(g)+Cl2(g)15
新平衡浓度/(mol·L-1)0.10+0.25-0.25+=mol·L-1=0.62mol·L-1(T不变,不变)=0.01mol·L-1,(PCl5)=68%(3)PCl5(g)®PCl3(g)+Cl2(g)平衡浓度/(mol·L-1)0.050+==0.62mol·L-1=0.24mol·L-1,(PCl5)=68%比较(2)、(3)结果,说明最终浓度及转化率只与始、终态有关,与加入过程无关。15.解:(1)α(CO)=61.5%;(2)α(CO)=86.5%;(3)说明增加反应物中某一物质浓度可提高另一物质的转化率;增加反应物浓度,平衡向生成物方向移动。16.解:2NO(g)+O2(g)2NO2(g)平衡分压/kPa101-79.2=21.8286-79.2/2=24679.2(673K)==5.36=,(673K)=-9.39kJ·mol-1第3章酸碱反应和沉淀反应习题参考答案(P-84)2.解:(1)pH=1.00c(H+)=0.10mol·L-1pH=2.00c(H+)=0.010mol·L-1等体积混合后:c(H+)=(0.10mol·L-1+0.010mol·L-1)/2=0.055mol·L-1pH=-lgc(H+)=1.26(2)pH=2.00c(H+)=0.010mol·L-1pH=13.00pOH=14.00-13.00=1.00,c(OH-)=0.10mol·L-115
等体积混合后:酸碱中和后:H++OH-→H2Oc(OH-)=0.045mol·L-1pH=12.657.解:(1)设NH4Cl水解产生的H+为xmol·L-1,则NH4++H2ONH3·H2O+H+c平/(mol·L-1)0.010-xxxx=2.4×10-6,pH=5.62(2)设NaCN水解生成的H+为x’mol·L-1,则CN-+H2OHCN+OH-c平/(mol·L-1)0.10-x’x’x’x`=1.3×10-3,pH=11.119.解:(1)设CaF2在纯水中的溶解度(s)为xmol·L-1。因为CaF2为难溶强电解质,且基本上不水解,所以在CaF2饱和溶液中:CaF2(s)Ca2++2F-c平/(mol·L-1)x2x{c(Ca2+)}·{c(F-)}2=Kspθ(CaF2)x=1.1×10-3(2)设CaF2在1.0×10-2mol·L-1NaF溶液中的溶解度(s)为ymol·L-1。CaF2(s)Ca2++2F-c平/(mol·L-1)y2y+1.0×10-2{c(Ca2+)}·{c(F-)}2=Kspθ(CaF2)y(2y+1.0×10-2)2=5.2×10-9y=5.2×10-515
(3)设CaF2在1.0×10-2mol·L-1CaCl2溶液中的溶解度(s)为zmol·L-1。CaF2(s)Ca2++2F-c平/(mol·L-1)1.0×10-2+z2z{c(Ca2+)}·{c(F-)}2=Kspθ(CaF2)(z+1.0×10-2)(2z)2=5.2×10-9z=3.6×10-47.解:溶液混合后有关物质的浓度为:HA+OH-A-+H2Oc/(mol·L-1)设c(H+)=xmol·L-1,则弱酸HA,弱酸根A-及氢离子H+的平衡浓度表示为:HAA-+H+c平/(mol·L-1)xpH=5.00=-lgx,x=1.00×10-5mol·L-1代入弱酸HA的解离平衡常数表示式:(近似计算)10.解:(1)由题意可知:c(Mg2+)=0.050mol·L-1当c(Mg2+)·{c(OH-)}2>Kspθ(Mg(OH)2)时开始有Mg(OH)2沉淀出。(2){c(Al3+)}·{c(OH-)}3=4.0×10-22>Kspθ(Al(OH)3),15
所以还有Al3+可被沉淀出。c(Fe3+)}·{c(OH-)}3=2.0×10-22>Kspθ(Fe(OH)3),所以还有Fe3+可被沉淀出。11.解:Cd2++Ca(OH)2Ca2++Cd(OH)2↓Cd(OH)2(s)Cd2++2OH-Kspθ=7.2×10-15若使c(Cd2+)<0.10mg·L-1==8.9×10-7mol·L-1pH>(14.00-pOH)=10.012.解:(1)混合后:c(Mn2+)=0.0010mol·L-1c(NH3·H2O)=0.050mol·L-1设OH-浓度为xmol·L-1NH3·H2ONH4++OH-c平/(mol·L-1)0.050-xxxx2=9.0×10-7,即{c(OH-)}2=9.0×10-7{c(Mn2+)}·{c(OH-)}2=9.0×10-10>Kspθ(Mn(OH)2)=1.9×10-13所以能生成Mn(OH)2沉淀。(2)已知(NH4)2SO4的相对分子质量为132.15c((NH4)2SO4)=mol·L-1=0.25mol·L-1c(NH4-)=0.50mol·L-1设OH-浓度为xmol·L-1NH3·H2ONH4++OH-c平/(mol·L-1)0.050-x0.50+xxx=1.8×10-6c(OH-)=1.8×10-6mol·L-115
{c(Mn2+)}·{c(OH-)}2=3.2×10-15<Kspθ(Mn(OH)2),所以不能生成Mn(OH)2沉淀。13.解:使BaSO4沉淀所需Ag2SO4沉淀所需故BaSO4先沉淀。当Ag+开始沉淀时,c(Ba2+)<<10-5mol·L-1故此时Ba2+已沉淀完全。即可用加入Na2SO4方法分离Ba2+和Ag+。15.解:(1)Pb(OH)2、Cr(OH)3开始析出所需c(OH-)的最低为因为c1(OH-)>>c2(OH-),所以Cr(OH)3先沉淀。(2)Cr(OH)3沉淀完全时所需OH-最低浓度为Pb(OH)2不沉出所容许的OH-最高浓度为c(OH-)<2.2×10-7mol·L-1即c(OH-)应控制在(4.0×10-9mol·L-1~2.2×10-7)mol·L-1pHmin=5.60pHmax=7.34所以若要分离这两种离子,溶液的pH应控制在5.60~7.34之间。15
第4章氧化还原反应习题参考答案(P-120)2.解:(1)3Cu+8HNO3(稀)→3Cu(NO3)2+2NO↑+4H2O(2)4Zn+5H2SO4(浓)→4ZnSO4+H2S↑+4H2O(3)KClO3+6FeSO4+3H2SO4→KCl+3Fe2(SO4)3+3H2O(4)3Cu2S+22HNO3→6Cu(NO3)2+3H2SO4+10NO↑+8H2O3.解:(1)12I-2e→I2+)1H2O2+2H++2e→2H2O2I+H2O2+2H+→I2+2H2O(2)1Cr2O+14H++6e→2Cr3++7H2O+)3H2S-2e→S+2H+Cr2O+3H2S+8H+→2Cr3++3S↓+7H2O(3)1ClO+6H++6e→Cl-+3H2O+)6Fe2+-e→Fe3+ClO+6Fe2++6H+→Cl-+6Fe3+3H2O(4)1/2Cl2+2e→2Cl-+)1/2Cl2+4OH-2e→2ClO-+2H2OCl2+2OH→Cl-+ClO-+H2O(5)1Zn+4OH-2e→[Zn(OH)4]2-+)1ClO-+H2O+2e→Cl-+2OH15
Zn+ClO-+2OH+H2O→[Zn(OH)4]2-+Cl-(6)2MnO+e→MnO+)1SO+OH-2e→SO+H2O2MnO+SO+2OH→2MnO+SO+H2O4.解:(1)(-)Pt,I2(s)∣I(c1)‖Cl-(c2)∣Cl2(P),Pt(+)(2)(-)Pt∣Fe2+,Fe3+(c3)‖MnO(c3),Mn2+(c4),H+(c5)∣Pt(+)(3)(-)Zn∣ZnSO4(c1)‖CdSO4(c2)∣Cd(+)8.解:(1)E(MnO4-/Mn2+)>E(Fe3+/Fe2+),该反应能自发向右进行。(2)原电池的电池符号:(-)Pt|Fe2+(1mol•L-1),Fe3+(1mol•L-1)‖MnO4-(1mol•L-1),Mn2+(1mol•L-1),H+(10.0mol•L-1)︱Pt(+)E(MnO4-/Mn2+)=E(MnO4-/Mn2+)+lg=1.51V+lg(10.0)8=1.60VE=E(MnO4-/Mn2+)−E(Fe3+/Fe2+)=0.83V(3)lgK=Z′{E(MnO4-/Mn2+)-E(Fe3+/Fe2+)}/0.0592V=62.5K=3.2×10628.解:E(Ag+/Ag)=E(Ag+/Ag)+0.0592Vlg{c(Ag+/c)}=0.6807VE(Zn2+/Zn)=E(Zn2+/Zn)+0.0592V/2lg{c(Zn)/c}=-0.7922VE=E(Ag+/Ag)-E(Zn2+/Zn)=1.4729V15
=52.8K=6.3×105211.解:c(Ag+)=0.040mol·L-112.解:(1)E(Cu2+/Cu)=E(Cu2+/Cu)+lg{c(Cu2+)/c}=+0.33V(2)c(Cu2+)=Ksp(CuS)/(S2-)=6.3c10-36mol·L-1E(Cu2+/Cu)=-0.70V(3)E(H+/H2)=E(H+/H2)+lg=-0.0592V(4)OH-+H+→H2Oc/(mol·L-1)0.10.1刚好完全中和,所以c(H+)=1.0×10-7mol·L-1E(H+/H2)=-0.41V(5)加入的NaOAc与HCl刚好完全反应生成0.10mol·L-1的HOAcHOAcH++OAc-平衡浓度c/(mol/L)0.10-xxxK(HOAc)=x2/(0.10-x)=1.8×10-5x=0.0013mol·L-1E(H+/H2)=-0.17V16.解:(1)E(Ag+/Ag)=E(Ag+/Ag)+0.0592V×lg{c(Ag+)/c}=+0.74VE(Zn2+/Zn)=E(Zn2+/Zn)+(0.0592V/2)×lg{c(Zn2+)/c}=-0.78VE=E(Ag+/Ag)-E(Zn2+/Zn)=+1.5V(2)lgK=z′{E(Ag+/Ag)-E(Zn2+/Zn)}/0.0592V,K=5.76×1052E=E(Ag+/Ag)-E(Zn2+/Zn)=+1.5617VΔrG=-z′FE=-3.014×102kJ·mol-115
(3)达平衡时,c(Ag+)=xmol·L-12Ag++Zn2Ag+Zn2+平衡时浓度c/(mol·L-1)x0.30+(0.10-x)/2K=x=2.5×10-27,c(Ag+)=2.5×10-27mol·L-117.解:(1)E(MnO42-/MnO2)={3E(MnO4-/MnO2)-E(MnO4-/MnO42-)}/2=+2.27VE(MnO2/Mn3+)={2E(MnO2/Mn2+)-E(Mn3+/Mn2+)}/1=+1.0V(2)MnO42-,Mn3+。(3)是Mn2+。反应式为Mn+2H+→Mn2++H218.解:(1)E(Cr2O72-/Cr2+)=0.91V;E(Cr3+/Cr2+)=-0.74V;(2)Cr3+,Cr2+均不歧化,Cr3+较稳定,Cr2+极不稳定。第5章原子结构与元素周期性习题参考答案(P-146)1.解:(1)n≥3正整数;(2)l=1;(3)ms=+½(或-½);(4)m=0。2.解:(1)不符合能量最低原理;(2)不符合能量最低原理和洪德规则;(3)不符合洪德规则;(4)不符合泡利不相容原理;(5)正确。3.解:(1)2px、2py、2pz为等价轨道;15
(2)第四电子层共有四个亚层,最多能容纳32个电子。亚层轨道数容纳电子数s12p36d510f714325.解:(1)[Rn]5f146d107s27p2,第7周期,ⅣA族元素,与Pb的性质最相似。(2)[Rn]5f146d107s27p6,原子序数为118。8.解:元素周期族最高氧化数价层电子构型电子分布式原子序数甲3ⅡA+23s2[Ne]3s212乙6ⅦB+75d56s2[Xe]4f145d56s275丙4ⅣA+44s24p2[Ar]3d104s24p232丁5ⅡB+24d105s2[Kr]4d105s24811.解:元素代号元素符号周期族价层电子构型ANa三ⅠA3s1BMg三ⅡA3s2CAl三ⅢA3s23p1DBr四ⅦA4s24p5EI五ⅦA5s25p5GF二ⅦA2s22p5MMn四ⅦB3d54s2第6章分子的结构与性质习题参考答案(P-190)15
4.解:HClOBBr3C2H2σσσσσσσππσ8.解:分子或离子中心离子杂化类型分子或离子的几何构型BBr3等性sp2平面正三角形PH3不等性sp3三角锥形H2S不等性sp3V形SiCl4等性sp3正四面体形CO2等性sp直线形等性sp3正四面体形13.解:非极性分子:Ne、Br2、CS2、CCl4、BF3;极性分子:HF、NO、H2S、CHCl3、NF3。14.解:(1)色散力;(2)色散力、诱导力;(3)色散力、诱导力、取向力。第8章配位化合物(习题参考答案)(P-246)1.解:配离子形成体配体配位原子配位数[Cr(NH3)6]3+Cr3+NH3N6-[Co(H2O)6]2+Co2+--H2OO-6-[Al(OH)4]―Al3+OH―O-4[Fe(OH)2(H2O)4]+Fe2+-OH―、-H2O-O-6[PtCl5(NH3)]―Pt4+-Cl―、NH3--Cl、N6-15
2.解:配合物名称配离子电荷形成体氧化数[Cu(NH3)4][PtCl4]四氯合铂(Ⅱ)酸四氨合铜(Ⅱ)+2、―2+2、+2Cu[SiF6]六氟合硅(Ⅳ)酸铜―2+4K3[Cr(CN)6]六氟合铬(Ⅲ)酸钾―3+3[Zn(OH)(H2O)3]NO3硝酸一羟基·三水合锌(Ⅱ)+1+2[CoCl2(NH3)3(H2O)]Cl一氯化二氯·三氨·一水合钴(Ⅲ)+1+3[PtCl2(en)]二氯·一乙二胺合铂(Ⅱ)0+215'
您可能关注的文档
- 大气污染控制工程课后习题答案.doc
- 大气污染控制工程课后答案郝吉明.doc
- 大气污染控制工程课后题答案.doc
- 大气污染控制工程郝吉明第三版课后答案郝吉明.doc
- 大物(第四版)-祝之光-课后习题解答.doc
- 大物》第二版 毛峰 ch12课后习题及答案.pdf
- 大连交通大学《数据库原理及应用》刘金玲版(56课时)习题参考答案.doc
- 大连理工大学《工程制图》习题集答案.pdf
- 大连理工大学《汽车构造》试题及答案(共八套).doc
- 天津大学《反应工程》(第二版)课后习题答案(2014年修改).doc
- 天津大学第五版有机化学答案.doc
- 天津大学高等教育出版社第五版《物理化学》课后习题答案第七章.doc
- 天津大学高等教育出版社第五版《物理化学》课后习题答案第五章.doc
- 天津市领导干部网上学法用法课后习题(含答案).docx
- 央企班组长作业题及答案.docx
- 奥本海姆《信号与系统(第二版)》习题参考答案.doc
- 奥本海默《信号与系统》第二版习题答案(英文版)(上).pdf
- 奥鹏《平面数字图像设计》练习题 练习题参考答案.doc
相关文档
- 施工规范CECS140-2002给水排水工程埋地管芯缠丝预应力混凝土管和预应力钢筒混凝土管管道结构设计规程
- 施工规范CECS141-2002给水排水工程埋地钢管管道结构设计规程
- 施工规范CECS142-2002给水排水工程埋地铸铁管管道结构设计规程
- 施工规范CECS143-2002给水排水工程埋地预制混凝土圆形管管道结构设计规程
- 施工规范CECS145-2002给水排水工程埋地矩形管管道结构设计规程
- 施工规范CECS190-2005给水排水工程埋地玻璃纤维增强塑料夹砂管管道结构设计规程
- cecs 140:2002 给水排水工程埋地管芯缠丝预应力混凝土管和预应力钢筒混凝土管管道结构设计规程(含条文说明)
- cecs 141:2002 给水排水工程埋地钢管管道结构设计规程 条文说明
- cecs 140:2002 给水排水工程埋地管芯缠丝预应力混凝土管和预应力钢筒混凝土管管道结构设计规程 条文说明
- cecs 142:2002 给水排水工程埋地铸铁管管道结构设计规程 条文说明