- 3.28 MB
- 2022-04-22 11:36:41 发布
- 1、本文档共5页,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报电话:19940600175。
'第一章习题(一)用简单的文字解释下列术语:(1)有机化合物:碳氢化合物及其衍生物。(2)键能:形成共价鍵时体系所放出的能量。(3)极性键:成鍵原子的电负性相差为0.5~1.6时所形成的共价鍵。(4)官能团:决定有机化合物的主要性质的原子或原子团。(5)实验式:能够反映有机化合物元素组成的相对比例的化学式。(6)构造式:能够反映有机化合物中原子或原子团相互连接顺序的化学式。(7)均裂:共价鍵断裂时,两个成鍵电子均匀地分配给两个成鍵原子或原子团,形成两个自由基。(8)异裂:共价鍵断裂时,两个成鍵电子完成被某一个成鍵原子或原子团占有,形成正、负离子。(9)sp2杂化:由1个s轨道和2个p轨道进行线性组合,形成的3个能量介于s轨道和p轨道之间的、能量完全相同的新的原子轨道。sp2杂化轨道的形状也不同于s轨道或p轨道,而是“一头大,一头小”的形状,这种形状更有利于形成σ键。(10)诱导效应:由于成键原子的电负性不同而引起的电子云的转移。诱导效应只能通过σ键传递,并且随着碳链增长,诱导效应迅速减弱。(11)氢键:由氢原子在两个电负性很强的原子之间形成“桥梁”而导致的类似化学键的分子间或分子内作用力。氢键具有饱和性和方向性,但作用力比化学键小得多,一般为20~30kJ/mol。(12)Lewis酸:能够接受的电子的分子或离子。(二)下列化合物的化学键如果都为共价键,而且外层价电子都达到稳定的电子层结构,同时原子之间可以共用一对以上的电子,试写出化合物可能的Lewis结构式。(1)(2)(3)(4)(5)(6)CH2O解:分别以“○”表示氢原子核外电子,以“●”表示碳原子核外电子,以“★”表示氧原子核外电子,以“△”表示氮原子核外电子,题给各化合物的Lewis结构式如下:(1)(2)(3)
(4)(5)(6)(三)试判断下列化合物是否为极性分子。(1)HBr是(2)I2否(3)CCl4否(4)CH2Cl2是(5)CH3OH是(6)CH3OCH是(四)根据键能数据,乙烷分子()在受热裂解时,哪种键首先断裂?为什么?这个过程是吸热还是放热?解:乙烷分子受热裂解时,首先断鍵;因为鍵能:。这个过程是一个吸热过程。(五)H2O的键角为105°,试问水分子的氧原子用什么类型的原子轨道与氢原子形成等价的单键?解:105°与109.5°比较接近,说明水分子中的氧原子采取不等性sp3杂化。所以氧采用sp3杂化轨道与氢原子成键。(六)正丁醇(CH3CH2CH2CH2OH)的沸点(117℃)比它的同分异构体乙醚(CH3CH2OCH2CH3)的沸点(34.5℃)高得多,但两者在水中的溶解度均为8g/100g水,试解释之。解:正丁醇分子之间可以形成分子间氢键,而乙醚分子之间不能形成氢键,所以正丁醇的的沸点远高于乙醚。但二者均可水分子形成氢键,所以它们在水中都有一定的溶解度(8g/100g水)。(七)矿物油(相对分子质量较大的烃的混合物)能溶于正己烷,但不溶于乙酸或水。试解释之。解:矿物油是非极性分子,而水和乙醇都是极性分子。根据“相似相溶”的原则,非极性的矿物油在极性溶剂中不可能有好的溶解度。(八)下列各反应均可看成是酸碱的反应,试注明哪些化合物是酸?哪些化合物是碱?(1)(2)
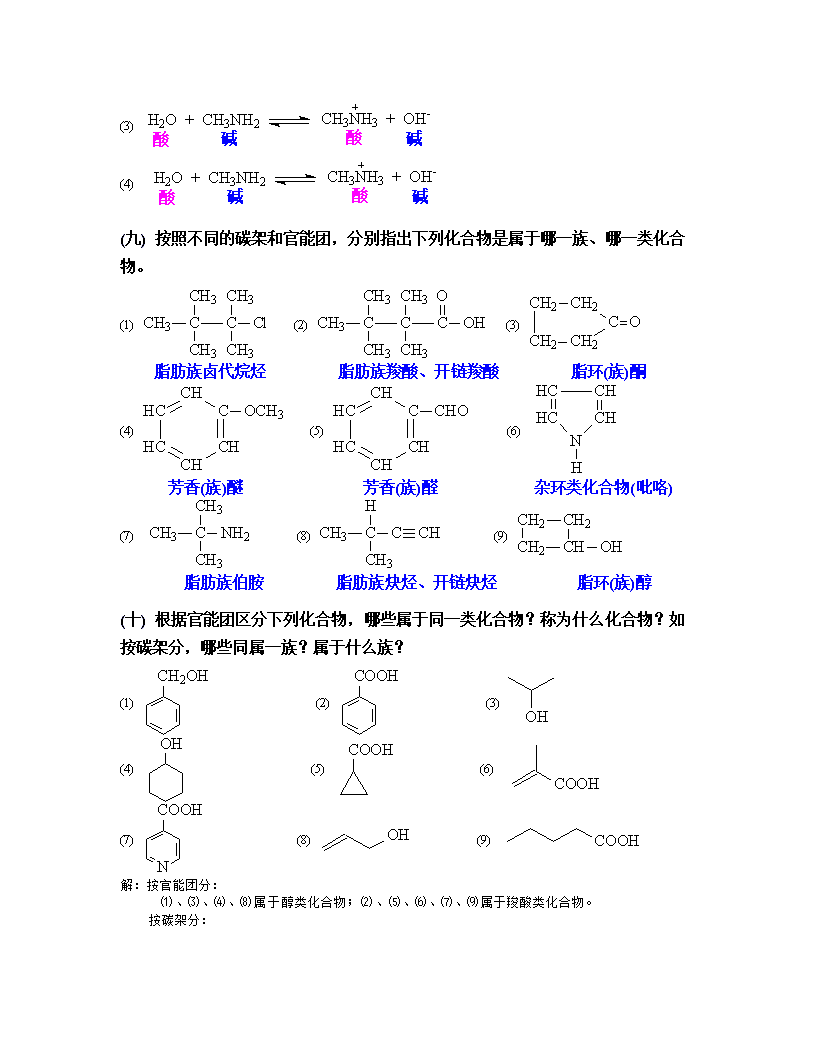
(3)(4)(九)按照不同的碳架和官能团,分别指出下列化合物是属于哪一族、哪一类化合物。(1)(2)(3)脂肪族卤代烷烃脂肪族羧酸、开链羧酸脂环(族)酮(4)(5)(6)芳香(族)醚芳香(族)醛杂环类化合物(吡咯)(7)(8)(9)脂肪族伯胺脂肪族炔烃、开链炔烃脂环(族)醇(十)根据官能团区分下列化合物,哪些属于同一类化合物?称为什么化合物?如按碳架分,哪些同属一族?属于什么族?(1)(2)(3)(4)(5)(6)(7)(8)(9)解:按官能团分:⑴、⑶、⑷、⑻属于醇类化合物;⑵、⑸、⑹、⑺、⑼属于羧酸类化合物。按碳架分:
⑴、⑵属于芳香族;⑷、⑸属于脂环族;⑶、⑹、⑻、⑼属于脂肪族;⑺属于杂环类化合物。(十一)一种醇经元素定量分析,得知C=70.4%,H=13.9%,试计算并写出实验式。解:碳和氢的含量加起来只有84.3%,说明该化合物含氧,即O=15.7%。∴该化合物的实验式为C6H14O。(十二)某碳氢化合物元素定量分析的数据为:C=92.1%,H=7.9%;经测定相对分子质量为78。试写出该化合物的分子式。解:∴该化合物的分子式为C6H6。第二章饱和烃习题(一)用系统命名法命名下列各化合物,并指出这些化合物中的伯、仲、叔、季碳原子。(1)(2)3-甲基-3-乙基庚烷2,3-二甲基-3-乙基戊烷(3)(4)2,5-二甲基-3,4-二乙基己烷1,1-二甲基-4-异丙基环癸烷(5)(6)乙基环丙烷2-环丙基丁烷
(7)(8)1,7-二甲基-4-异丙基双环[4.4.0]癸烷2-甲基螺[3.5]壬烷(9)(10)5-异丁基螺[2.4]庚烷新戊基(11)(12)2-甲基环丙基2-己基or(1-甲基)戊基(二)写出相当于下列名称的各化合物的构造式,如其名称与系统命名原则不符,予以改正。(1)2,3-二甲基-2-乙基丁烷(2)1,5,5-三甲基-3-乙基己烷(3)2-叔丁基-4,5-二甲基己烷2,3,3-三甲基戊烷2,2-二甲基-4-乙基庚烷2,2,3,5,6-五甲基庚烷(4)甲基乙基异丙基甲烷(5)丁基环丙烷(6)1-丁基-3-甲基环己烷2,3-二甲基戊烷1-环丙基丁烷1-甲基-3-丁基环己烷
(三)以C2与C3的σ键为旋转轴,试分别画出2,3-二甲基丁烷和2,2,3,3-四甲基丁烷的典型构象式,并指出哪一个为其最稳定的构象式。解:2,3-二甲基丁烷的典型构象式共有四种:2,2,3,3-四甲基丁烷的典型构象式共有两种:(四)将下列的投影式改为透视式,透视式改为投影式。(1)(2)
(3)(4)(5)(五)用透视式可以画出三种CH3-CFCl2的交叉式构象:它们是不是CH3-CFCl2的三种不同的构象式?用Newman投影式表示并验证所得结论是否正确。解:它们是CH3-CFCl2的同一种构象——交叉式构象!从下列Newman投影式可以看出:将(I)整体按顺时针方向旋转60º可得到(II),旋转120º可得到(III)。同理,将(II)整体旋转也可得到(I)、(III),将(III)整体旋转也可得到(I)、(II)。
(六)试指出下列化合物中,哪些所代表的是相同的化合物而只是构象表示式之不同,哪些是不同的化合物。(1)(2)(3)(4)(5)(6)解:⑴、⑵、⑶、⑷、⑸是同一化合物:2,3-二甲基-2-氯丁烷;⑹是另一种化合物:2,2-二甲基-3-氯丁烷。(七)如果将船型和椅型均考虑在环己烷的构象中,试问甲基环己烷有几个构象异构体?其中哪一个最稳定?哪一个最不稳定?为什么?解:按照题意,甲基环己烷共有6个构象异构体:(A)(B)(C)(D)(E)(F)其中最稳定的是(A)。因为(A)为椅式构象,且甲基在e键取代,使所有原子或原子团都处于交叉式构象;
最不稳定的是(C)。除了船底碳之间具有重叠式构象外,两个船头碳上的甲基与氢也具有较大的非键张力。(八)不参阅物理常数表,试推测下列化合物沸点高低的一般顺序。(1)(A)正庚烷(B)正己烷(C)2-甲基戊烷(D)2,2-二甲基丁烷(E)正癸烷解:沸点由高到低的顺序是:正癸烷>正庚烷>正己烷>2-甲基戊烷>2,2-二甲基丁烷(2)(A)丙烷(B)环丙烷(C)正丁烷(D)环丁烷(E)环戊烷(F)环己烷(G)正己烷(H)正戊烷解:沸点由高到低的顺序是:F>G>E>H>D>C>B>A(3)(A)甲基环戊烷(B)甲基环己烷(C)环己烷(D)环庚烷解:沸点由高到低的顺序是:D>B>C>A(九)已知烷烃的分子式为C5H12,根据氯化反应产物的不同,试推测各烷烃的构造,并写出其构造式。(1)一元氯代产物只能有一种(2)一元氯代产物可以有三种(3)一元氯代产物可以有四种(4)二元氯代产物只可能有两种解:(1)(2)(3)(4)(十)已知环烷烃的分子式为C5H10,根据氯化反应产物的不同,试推测各环烷烃的构造式。(1)一元氯代产物只有一种(2)一元氯代产物可以有三种
解:(1)(2)(十一)等物质的量的乙烷和新戊烷的混合物与少量的氯反应,得到的乙基氯和新戊基氯的摩尔比是1∶2.3。试比较乙烷和新戊烷中伯氢的相当活性。解:设乙烷中伯氢的活性为1,新戊烷中伯氢的活性为x,则有:∴新戊烷中伯氢的活性是乙烷中伯氢活性的1.15倍。(十二)在光照下,2,2,4-三甲基戊烷分别与氯和溴进行一取代反应,其最多的一取代物分别是哪一种?通过这一结果说明什么问题?并根据这一结果预测异丁烷一氟代的主要产物。解:2,2,4-三甲基戊烷的构造式为:氯代时最多的一氯代物为;溴代时最多的一溴代物为这一结果说明自由基溴代的选择性高于氯代。即溴代时,产物主要取决于氢原子的活性;而氯代时,既与氢原子的活性有关,也与各种氢原子的个数有关。根据这一结果预测,异丁烷一氟代的主要产物为:FCH2CH2CH3
(十三)将下列的自由基按稳定性大小排列成序。⑴⑵⑶⑷解:自由基的稳定性顺序为:⑶>⑷>⑵>⑴(十四)在光照下,甲基环戊烷与溴发生一溴化反应,写出一溴代的主要产物及其反应机理。解:反应机理:引发:增长:……终止:(十五)在光照下,烷烃与二氧化硫和氯气反应,烷烃分子中的氢原子被氯磺酰基取代,生成烷基磺酰氯:
此反应称为氯磺酰化反应,亦称Reed反应。工业上常用此反应由高级烷烃生产烷基磺酰氯和烷基磺酸钠(R-SO2ONa)(它们都是合成洗涤剂的原料)。此反应与烷烃氯化反应相似,也是按自由基取代机理进行的。试参考烷烃卤化的反应机理,写出烷烃(用R-H表示)氯磺酰化的反应机理。解:引发:增长:……终止:……第三章不饱和烃习题用系统命名法命名下列各化合物:(1)(2)对称甲基异丙基乙烯3-甲基-2-乙基-1-丁烯4-甲基-2-戊烯(3)(4)2,2,5-三甲基-3-己炔3-异丁基-4-己烯-1-炔
(一)用Z,E-标记法命名下列各化合物:(1)↓↑(2)↑↑(E)-2,3-二氯-2-丁烯(Z)-2-甲基-1-氟-1-氯-1-丁烯(3)↑↑(4)↑↑(Z)-1-氟-1-氯-2-溴-2-碘乙烯(Z)-3-异基-2-己烯(二)写出下列化合物的构造式,检查其命名是否正确,如有错误予以改正,并写出正确的系统名称。(1)顺-2-甲基-3-戊烯(2)反-1-丁烯顺-4-甲基-3-戊烯1-丁烯(无顺反异构)(3)1-溴异丁烯(4)(E)-3-乙基-3-戊烯2-甲基-1-溴丙烯3-乙基-2-戊烯(无顺反异构)(三)完成下列反应式:解:红色括号中为各小题所要求填充的内容。(1)(2)
(3)(4)(硼氢化反应的特点:顺加、反马、不重排)(5)(6)(硼氢化反应的特点:顺加、反马、不重排)(7)(8)(9)(10)(11)
(12)(13)(14)(五)用简便的化学方法鉴别下列各组化合物:(1)解:(2)解:(六)在下列各组化合物中,哪一个比较稳定?为什么?(1)(A),(B)解:(B)中甲基与异丙基的空间拥挤程度较小,更加稳定。(2)(A),(B)解:(A)中甲基与碳-碳双键有较好的σ-π超共轭,故(A)比较稳定。(3)(A),(B),(C)解:(C)的环张力较小,较稳定。(4)(A),(B)
解:(A)的环张力较小,较稳定。(5)(A),(B),(C)解:(C)最稳定。(6)(A),(B)解:(A)的环张力很大,所以(B)较稳定。(七)将下列各组活性中间体按稳定性由大到小排列成序:(1)(2)解:(1)C>A>B(2)B>C>A(八)下列第一个碳正离子均倾向于重排成更稳定的碳正离子,试写出其重排后碳正离子的结构。(1)(2)(3)(4)解:题给碳正离子可经重排形成下列碳正离子:(1)(2)(3)(4)(九)在聚丙烯生产中,常用己烷或庚烷作溶剂,但要求溶剂中不能有不饱和烃。如何检验溶剂中有无不饱和烃杂质?若有,如何除去?解:可用Br2/CCl4或者KMnO4/H2O检验溶剂中有无不饱和烃杂质。若有,可用浓硫酸洗去不饱和烃。(十)写出下列各反应的机理:(1) 解:
(2) 解:(3) 解:该反应为自由基加成反应:引发:增长:……终止:略。(4)
解:(箭头所指方向为电子云的流动方向!)(十一)预测下列反应的主要产物,并说明理由。解:(1)双键中的碳原子采取sp2杂化,其电子云的s成分小于采取sp杂化的叁键碳,离核更远,流动性更大,更容易做为一个电子源。所以,亲电加成反应活性:>(2)解释:在进行催化加氢时,首先是H2及不饱和键被吸附在催化剂的活性中心上,而且,叁键的吸附速度大于双键。所以,催化加氢的反应活性:叁键>双键。(3)解释:叁键碳采取sp杂化,其电子云中的s成分更大,离核更近,导致其可以发生亲核加成。而双键碳采取sp2杂化,其电子云离核更远,不能发生亲核加成。(4)解释:双键上电子云密度更大,更有利于氧化反应的发生。(5)解释:氧化反应总是在电子云密度较大处。
(6)解释:重排,C+稳定性:3°C+>2°C+(十二)写出下列反应物的构造式:(1)(2)(3)(4)(5)(6)(十三)根据下列反应中各化合物的酸碱性,试判断每个反应能否发生?(pKa的近似值:ROH为16,NH3为34,RC≡CH为25,H2O为15.7)(1)所以,该反应能够发生。(2)
所以,该反应不能发生。(3)所以,该反应不能发生。(4)所以,该反应不能发生。(十四)给出下列反应的试剂和反应条件:(1)1-戊炔→戊烷解:(2)3-己炔→顺-3-己烯解:(3)2–戊炔→反-2-戊烯解:(4)解:(十五)完成下列转变(不限一步):(1)解:(2)解:(3)
解:(4)解:(十六)由指定原料合成下列各化合物(常用试剂任选):(1)由1-丁烯合成2-丁醇解:(2)由1-己烯合成1-己醇解:(3)解:(4)由乙炔合成3-己炔解:(5)由1-己炔合成正己醛 解:(6)由乙炔和丙炔合成丙基乙烯基醚解:
(十七)解释下列事实:(1)1-丁炔、1-丁烯、丁烷的偶极矩依次减小,为什么?解:电负性:>>键的极性:>>分子的极性:1-丁炔>1-丁烯>丁烷(即:1-丁炔、1-丁烯、丁烷的偶极矩依次减小)(2)普通烯烃的顺式和反式异构体的能量差为4.18kJ•mol-1,但4,4-二甲基-2-戊烯顺式和反式的能量差为15.9kJ•mol-1,为什么?解:顺-4,4-二甲基-2-戊烯反-4,4-二甲基-2-戊烯由于叔丁基的体积大,空间效应强,导致在顺-4,4-二甲基-2-戊烯中,叔丁基与甲基处于双键同侧,空间障碍特别大,能量更高。(3)乙炔中的键比相应乙烯、乙烷中的键键能增大、键长缩短,但酸性却增强了,为什么?解:炔烃分子中的叁键碳采取sp杂化。与sp2、sp3杂化碳相比,sp杂化s成分更多,电子云离核更近,受核的束缚更强,电负性更大。由于sp杂化碳的电子云离核更近,使乙炔中的键键能增大、键长缩短;由于sp杂化碳的电负性更大,使中的电子云更偏向碳原子一边,导致乙炔分子中氢原子更容易以H+的形式掉下来,酸性增强。(4)炔烃不但可以加一分子卤素,而且可以加两分子卤素,但却比烯烃加卤素困难,反应速率也小,为什么?解:烯烃、炔烃与卤素的加成反应是亲电加成,不饱和键上的电子云密度越大,越有利于亲电加成。由于炔烃中的叁键碳采取sp杂化,电负性较大。所以,炔烃与卤素加成时,比烯烃加卤素困难,反应速率也小于烯烃。
(5)与亲电试剂Br2、Cl2、HCl的加成反应,烯烃比炔烃活泼。然而当炔烃用这些试剂处理时,反应却很容易停止在烯烃阶段,生成卤代烯烃,需要更强烈的条件才能进行第二步加成。这是否相互矛盾,为什么?解:不矛盾。烯烃与Br2、Cl2、HCl的加成反应都是亲电加成。由于双键碳的电负性小于叁键碳,导致双键上的π电子受核的束缚程度更小,流动性更大,更有利于亲电加成反应。所以,与亲电试剂Br2、Cl2、HCl的加成反应,烯烃比炔烃活泼而、都是吸电子基,它们的引入,导致双键上电子云密度降低,不利于亲电加成反应的进行。所以,当炔烃用亲电试剂Br2、Cl2、HCl处理时,反应却很容易停止在烯烃阶段,生成卤代烯烃,需要更强烈的条件才能进行第二步加成(6)在硝酸钠的水溶液中,溴对乙烯的加成,不仅生成1,2-二溴乙烷,而且还产生硝酸-β-溴代乙酯(BrCH2CH2ONO2),怎样解释这样的反应结果?试写出各步反应式。解:溴与乙烯的加成是亲电加成反应,首先生成活性中间体——环状溴翁正离子。后者可与硝酸根负离子结合得到硝酸-β-溴代乙酯(BrCH2CH2ONO2):(7)(CH3)3CCH=CH2在酸催化下加水,不仅生成产物(A),而且生成(B),但不生成(C)。试解释为什么。解:该实验现象与烯烃酸催化下的水合反应机理有关:
(2°C+)(3°C+)与(C)相关的C+为(1°C+),能量高,不稳定,因此产物(C)不易生成。(8)丙烯聚合反应,无论是酸催化还是自由基引发聚合,都是按头尾相接的方式,生成甲基交替排列的整齐聚合物,为什么?解:以自由基聚合为例。若按头尾相接的方式,生成甲基交替排列的整齐聚合物,则与之相关的自由基都是二级自由基:二级自由基二级自由基二级自由基头尾相接、甲基交替排列的整齐聚合物反之,则会生成稳定性较差的一级自由基:二级自由基一级自由基丙烯在酸催化下进行聚合反应,其活性中间体为碳正离子,其稳定性顺序同样为:
三级>二级>一级碳正离子。(十八)化合物(A)的分子式为C4H8,它能使溴溶液褪色,但不能使稀的高锰酸钾溶液褪色。1mol(A)与1molHBr作用生成(B),(B)也可以从(A)的同分异构体(C)与HBr作用得到。(C)能使溴溶液褪色,也能使稀和酸性高锰酸钾溶液褪色。试推测(A)、(B)和(C)的构造式。并写出各步反应式。解:(A)(B)(C)或反应式略。(十九)分子式为C4H6的三个异构体(A)、(B)、(C),可以发生如下的化学反应:(1)三个异构体都能与溴反应,但在常温下对等物质的量的试样,与(B)和(C)反应的溴量是(A)的2倍;(2)三者都能HCl发生反应,而(B)和(C)在Hg2+催化下与HCl作用得到的是同一产物;(3)(B)和(C)能迅速地与含HgSO4的硫酸溶液作用,得到分子式为C4H8O的化合物;(4)(B)能与硝酸银的溶液反应生成白色沉淀。试写出化合物(A)、(B)和(C)的构造式,并写出有关的反应式。解:(A)(B)(C)有关的反应式略。
(二十)某化合物(A)的分子式为C7H14,经酸性高锰酸钾溶液氧化后生成两个化合物(B)和(C)。(A)经臭氧化而后还原水解也得相同产物(B)和(C)。试写出(A)的构造式。解:(二十一)卤代烃C5H11Br(A)与氢氧化钠的乙醇溶液作用,生成分子式为C5H10的化合物(B)。(B)用高锰酸钾的酸性水溶液氧化可得到一个酮(C)和一个羧酸(D)。而(B)与溴化氢作用得到的产物是(A)的异构体(E)。试写出(A)、(B)、(C)、(D)和(E)的构造式及各步反应式。解:各步反应式:
(二十二)化合物C7H15Br经强碱处理后,得到三种烯烃(C7H14)的混合物(A)、(B)和(C)。这三种烯烃经催化加氢后均生成2-甲基己烷。(A)与B2H6作用并经碱性过氧化氢处理后生成醇(D)。(B)和(C)经同样反应,得到(D)和另一异构醇(E)。写出(A)~(E)的结构式。再用什么方法可以确证你的推断?解:C7H15Br的结构为:(A)~(E)的结构式:将(A)、(B)、(C)分别经臭氧化-还原水解后,测定氧化产物的结构,也可推断(A)、(B)、(C)的结构:(二十三)有(A)和(B)两个化合物,它们互为构造异构体,都能使溴的四氯化碳溶液褪色。(A)与Ag(NH3)2NO3反应生成白色沉淀,用KMnO4溶液氧化生成丙酸(CH3CH2COOH)和二氧化碳;(B)不与Ag(NH3)2NO3反应,而用KMnO4溶液氧化只生成一种羧酸。试写出(A)和(B)的构造式及各步反应式。解:
各步反应式:(二十四)某化合物的分子式为C6H10。能与两分子溴加成而不能与氧化亚铜的氨溶液起反应。在汞盐的硫酸溶液存在下,能与水反应得到4-甲基-2-戊酮和2-甲基-3-戊酮的混合物。试写出C6H10的构造式。解:(二十五)某化合物(A),分子式为C5H8,在液氨中与金属钠作用后,再与1-溴丙烷作用,生成分子式为C8H14的化合物(B)。用高锰酸钾氧化(B)得到分子式C4H8O2为的两种不同的羧酸(C)和(D)。(A)在硫酸汞存在下与稀硫酸作用,可得到分子式为C5H10O的酮(E)。试写出(A)~(E)的构造式及各步反应式。解:各步反应式:
第四章二烯烃和共轭体系习题(一)用系统命名法命名下列化合物:(1)(2)4-甲基-1,3-戊二烯2-甲基-2,3-戊二烯(3)(4)2-甲基-1,3,5-己三烯(3Z)-1,3-戊二烯(二)下列化合物有无顺反异构现象:若有,写出其顺反异构体并用Z,E-命名法命名。解:(1)无;(2)有;(3E)-1,3-戊二烯,(3Z)-1,3-戊二烯;(3)有;(3Z,5Z)-3,5-辛二烯,(3Z,5E)-3,5-辛二烯,(3E,5E)-3,5-辛二烯;(4)有;(3E)-1,3,5-己三烯,(3Z)-1,3,5-己三烯;(5)无(三)完成下列反应式:解:红色括号中为各小题所要求填充的内容。(1)
(2)(3)(4)(5)(6)(7)(8)(9)(10)(四)给出下列化合物或离子的极限结构式,并指出哪个贡献最大?(2)(3)(4)(5)(6)
解:(1)贡献最大(非电荷分离)(2)结构相似,二者贡献一样大(3)结构相似,二者贡献一样大(4)各共振结构式结构相似,能量相同,对真实结构的贡献相同。(5)贡献最大(与电负性预计相同)(6)贡献最大(共价键最多)(五)化合物和同相比,前者C=C双键的电子云密度降低,而后者C=C双键的电子云密度升高。试用共振论解之。解:的真实结构可用共振论表示如下:其中(II)对真实结构的贡献就是使C=C双键带部分正电荷,电子云密度降低。的真实结构可用共振论表示如下:其中(II)对真实结构的贡献就是使C=C双键带部分负电荷,电子云密度升高。
(六)解释下列反应:(1)(2)解:(1)(2)……(七)某二烯烃与一分子溴反应生成2,5-二溴-3-己烯,该二烯烃若经臭氧化再还原分解则生成两分子乙醛和一分子乙二醛(O=CH-CH=O)。试写出该二烯烃的构造式及各步反应式。解:该二烯烃的构造式为:2,4-己二烯各步反应式略。(八)3-甲基-1,3-丁二烯与一分子氯化氢加成,只生成3-甲基-3-氯-1-丁烯和3-甲基-1-氯-2-丁烯,而没有2-甲基-3-氯-1-丁烯和3-甲基-1-氯-2-丁烯。试简单解释之,并写出可能的反应机理。解:由于C+稳定性:所以,只有与相关的产物生成:
(九)分子式为C7H10的某开链烃(A),可发生下列反应:(A)经催化加氢可生成3-乙基戊烷;(A)与硝酸银氨溶液反应可产生白色沉淀;(A)在Pd/BaSO4催化下吸收1molH2生成化合物(B),(B)能与顺丁烯二酸酐反应生成化合物(C)。试写出(A)、(B)、(C)的构造式。解:(十)下列各组化合物分别与HBr进行亲电加成反应,哪个更容易?试按反应活性大小排列顺序。,,,1,3-丁二烯,2-丁烯,2-丁炔解:(1)反应活性顺序:>>>(考虑C+稳定性!)(2)反应活性顺序为:1,3-丁二烯>2-丁烯>2-丁炔(考虑C+稳定性!)(十一)下列两组化合物分别与1,3-丁二烯[(1)组]或顺丁烯二酸酐[(2)组]进行Diels-Alder反应,试将其按反应活性由大到小排列成序。(A)(B)(C)
(A)(B)(C)解:反应活性:(1)B>C>A; (2)A>B>C(C难以形成s-顺式构型,不反应)(十二)试用简单的化学方法鉴别下列各组化合物:(1)己烷,1-己烯,1-己炔,2,4-己二烯(2)庚烷,1-庚炔,1,3-庚二烯,1,5-庚二烯解:(1)(2)(十三)选用适当原料,通过Diels-Alder反应合成下列化合物。(3)(4)(5)(6)解:(1)
(2)(3)(4)(5)(6)(十四)三个化合物(A)、(B)和(C),其分子式均为C5H8,都可以使溴的四氯化碳溶液褪色,在催化下加氢都得到戊烷。(A)与氯化亚铜碱性氨溶液作用生成棕红色沉淀,(B)和(C)则不反应。(C)可以顺丁烯二酸酐反应生成固体沉淀物,(A)和(B)则不能。试写出(A)、(B)和(C)可能的构造式。解:(A)(B)or(C)
(十五)1,2-丁二烯聚合时,除生成高分子聚合物外,还有一种二聚体生成。该二聚体可以发生如下的反应:(1)还原后可以生成乙基环己烷;(2)溴化时可以加上两分子溴;(3)氧化时可以生成β-羧基己二酸根据以上事实,试推测该二聚体的构造式,并写出各步反应式。解:该二聚体的构造式为:各步反应式略。第五章芳烃芳香性(一)写出分子式为C9H12的单环芳烃的所有同分异构体并命名。解:(二)命名下列化合物:(1)(2)(3)
(4)(5)(6)(7)(8)(9)解:(1)3-对甲苯基戊烷(2)(Z)-1-苯基-2-丁烯(3)4-硝基-2-氯甲苯(4)1,4-二甲基萘(5)8-氯-1-萘甲酸(6)1-甲基蒽(7)2-甲基-4-氯苯胺(8)3-甲基-4羟基苯乙酮(9)4-羟基-5-溴-1,3-苯二磺酸(三)完成下列各反应式:解:红色括号中为各小题所要求填充的内容。(1)(2)(3)(4)(5)(6)(7)(8)(9)
(10)(11)(12)(13)(14)(15)(16)(四)用化学方法区别下列各组化合物:(1)环己烷、环己烯和苯(2)苯和1,3,5-己三烯解:(1)(2)
(五)写出下列各反应的机理:(1)解:(2)解:(3)http://www.baidu.com/解:(4)(六)己知硝基苯(Ph—NO2)进行亲电取代反应时,其活性比苯小,—NO2是第二类定位基。试部亚硝基苯(Ph—NO)进行亲电取代反应时,其活性比苯大还是小?—NO是第几类定位基?解:由于氧和氮的电负性均大于碳,在亚硝基苯中存在下列电动去的转移:
所以亚硝基苯(Ph—NO)进行亲电取代反应时,其活性比苯小,—NO是第二类定位基。(七)写出下列各化合物一次硝化的主要产物:解:蓝色箭头指向为硝基将要进入的位置:(1)(2)(3)(4)(5)(6)(7)(8)(9)(10)(11)(12)(13)(14)(15)(16)(17)(18)讨论:
A.(10)的一元硝化产物为而不是,因为与前者相关的σ-络合物中正电荷分散程度更大,反应活化能更低:http://www.baidu.com/B.(13)的一元硝化产物为而不是,是因为前者的空间障碍小,热力学稳定。(八)利用什么二取代苯,经亲电取代反应制备纯的下列化合物?(1)(2)(3)(4)解:可用下列二取代苯分别制备题给的各化合物:(1)(2)(3)(4)(九)将下列各组化合物,按其进行硝化反应的难易次序排列:(1)苯、间二甲苯、甲苯 (2)乙酰苯胺、苯乙酮、氯苯解:(1) 间二甲苯>甲苯>苯 解释:苯环上甲基越多,对苯环致活作用越强,越易进行硝化反应。
(2)乙酰苯胺>氯苯>苯乙酮解释:连有致活基团的苯环较连有致钝集团的苯环易进行硝化反应。对苯环起致活作用的基团为:—NH2,—NHCOCH3且致活作用依次减小。对苯环起致钝作用基团为:—Cl,—COCH3且致钝作用依次增强。(十)比较下列各组化合物进行一元溴化反应的相对速率,按由大到小排列。(1)甲苯、苯甲酸、苯、溴苯、硝基苯(2)对二甲苯、对苯二甲酸、甲苯、对甲基苯甲酸、间二甲苯解:(1)一元溴化相对速率:甲苯>苯>溴苯>苯甲酸>硝基苯解释:致活基团为—CH3;致钝集团为—Br,—COOH,—NO2,且致钝作用依次增强。(2)间二甲苯>对二甲苯>甲苯>对甲基苯甲酸>对苯二甲酸解释:—CH3对苯环有活化作用且连接越多活化作用越强。两个甲基处于间位的致活效应有协同效应,强于处于对位的致活效应;—COOH有致钝作用。(十一)在硝化反应中,甲苯、苄基溴、苄基氯和苄基氟除主要的到邻和对位硝基衍生物外,也得到间位硝基衍生物,其含量分别为3%、7%、14%和18%。试解释之。解:这是-F、-Cl、-Br的吸电子效应与苄基中―CH2―的给电子效应共同作用的结果。电负性:F>Cl>Br>H邻、对位电子云密度:甲苯>苄基溴>苄基氯>苄基氟新引入硝基上邻、对位比例:甲苯>苄基溴>苄基氯>苄基氟新引入硝基上间位比例:甲苯<苄基溴<苄基氯<苄基氟(十二)在硝化反应中,硝基苯、苯基硝基甲烷、2-苯基-1-硝基乙烷所得间位异构体的量分别为93%、67%和13%。为什么?解:硝基是强的吸电子基(-I、-C),它使苯环上电子云密度大大降低,新引入基上间位。(十三)甲苯中的甲基是邻对位定位基,然而三氟甲苯中的三氟甲基是间位定位基。试解释之。解:由于氟的电负性特别大,导致F3C-是吸电子基,对苯环只有吸电子效应,而无供电子效应,具有间位定位效应。
(十四)在AlCl3催化下苯与过量氯甲烷作用在0℃时产物为1,2,4-三甲苯,而在100℃时反应,产物却是1,3,5-三甲苯。为什么?解:前者是动力学控制反应,生成1,2,4-三甲苯时反应的活化能较低;后者是热力学控制反应,得到的1,3,5-三甲苯空间障碍小,更加稳定。(十五)在室温下,甲苯与浓硫酸作用,生成约95%的邻和对甲苯磺酸的混合物。但在150~200℃较长时间反应,则生成间位(主要产物)和对位的混合物。试解释之。(提示:间甲苯磺酸是最稳定的异构体。)解:高温条件下反应,有利于热力学稳定的产物(间甲苯磺酸)生成。(十六)将下列化合物按酸性由大到小排列成序:(1)(2)(3)(4)(5)解:(3)>(1)>(5)>(2)>(4)各化合物失去H+后得到的碳负离子稳定性顺序为:(3)>(1)>(5)>(2)>(4)。碳负离子越稳定,H+越易离去,化合物酸性越强。(十七)下列反应有无错误?若有,请予以改正。(1)解:错。右边苯环由于硝基的引入而致钝,第二个硝基应该进入电子云密度较大的、左边的苯环,且进入亚甲基的对位。(2)解:错。FCH2CH2CH2+在反应中要重排,形成更加稳定的2º或3º碳正离子,产物会异构化。即主要产物应该是:若用BF3作催化剂,主要产物为应为
(3)解:错。①硝基是致钝基,硝基苯不会发生傅-克酰基化反应;②用Zn-Hg/HCl还原间硝基苯乙酮时,不仅羰基还原为亚甲基,而且还会将硝基还原为氨基。(4)解:错。CH2=CHCl分子中-Cl和C=C形成多电子p—π共轭体系,使C—Cl具有部分双键性质,不易断裂。所以该反应的产物是PhCH(Cl)CH3。(十八)用苯、甲苯或萘等有机化合物为主要原料合成下列各化合物:(1)对硝基苯甲酸(2)邻硝基苯甲酸(3)对硝基氯苯(4)4-硝基-2,6二溴甲苯(5)(6)(7)(8)(9)(10)解:(1)(2)(3)
(4)(5)(6)(7)(8)(9)(10)
(十九)乙酰苯胺(C6H5NHCOCH3)溴化时,主要得到2-和4-溴乙酰苯胺,但2,6-二甲基乙酰苯胺溴化时,则主要得到3溴乙酰苯胺,为什么?(P180)解:乙酰苯胺溴化时,溴原子引入2-或4-所形成的活性中间体σ-络合物的稳定性大于上3-时:2,6-二甲基乙酰苯胺溴化时,溴原子引入3-所形成的活性中间体σ-络合物的稳定性更强:
(二十)四溴邻苯二甲酸酐是一种阻燃剂。它作为反应型阻燃剂,主要用于聚乙烯、聚丙烯、聚苯乙烯和ABS树脂等。试分别由萘、邻二甲苯及必要的试剂合成之。解:(二十一)某烃的实验式为CH,相对分子质量为208,强氧化得苯甲酸,臭氧化分解产物得苯乙醛,试推测该烃的结构。解:由实验式及相对分子质量知,该烃的分子式为C16H16,不饱和度为9,故该烃分子中可能含有2个苯环和一个双键。由氧化产物知,该烃的结构为:(二十二)某芳香烃分子式为C9H12,用重铬酸钾氧化后,可得一种二元酸。将原来的芳香烃进行硝化,所得一元硝基化合物有两种。写出该芳香烃的构造式和各步反应式。解:C9H12的构造式为:各步反应式:(C)的一对对映体:
(二十三)某不饱和烃(A)的分子式为C9H8,(A)能和氯化亚铜氨溶液反应生成红色沉淀。(A)催化加氢得到化合物C9H12(B),将(B)用酸性重铬酸钾氧化得到酸性化合物C8H6O4(C),(C)加热得到化合物C8H4O3(D)。.若将(A)和丁二烯作用,则得到另一个不饱和化合物(E),(E)催化脱氢得到2-甲基联苯。试写出(A)~(E)的构造式及各步反应式。解:各步反应式略。(二十四)按照Huckel规则,判断下列各化合物或离子是否具有芳香性。(1)(2)(3)环壬四烯负离子(4)(5)(6)(7)(8)解:(1)、(3)、(6)、(8)有芳香性。(1)、(3)、(8)中的π电子数分别为:6、10、6,符合Huckel规则,有芳香性;(6)分子中的3个苯环(π电子数为6)及环丙烯正离子(π电子数为2)都有芳香性,所以整个分子也有芳香性;(2)、(4)、(7)中的π电子数分别为:8、12、4,不符合Huckel规则,没有芳香性;(5)分子中有一个C是sp3杂化,整个分子不是环状的离域体系,也没有芳香性。(二十五)下列各烃经铂重整会生成那些芳烃?(1)正庚烷(2)2,5-二甲基乙烷解:(1)(2)
第六章立体化学(一)在氯丁烷和氯戊烷的所有异构体中,哪些有手性碳原子?解:氯丁烷有四种构造异构体,其中2-氯丁烷中有手性碳:氯戊烷有八种构造异构体,其中2-氯戊烷(C2*),2-甲基-1-氯丁烷(C2*),2-甲基-3-氯丁烷(C3*)有手性碳原子:(二)各写出一个能满足下列条件的开链化合物:(1)具有手性碳原子的炔烃C6H10;(2)具有手性碳原子的羧酸C5H10O2(羧酸的通式是CnH2n+1COOH)。解:(1)(2)(三)相对分子质量最低而有旋光性的烷烃是哪些?用Fischer投影式表明它们的构型。解:和
和(四)是一个具有旋光性的不饱和烃,加氢后生成相应的饱和烃。不饱和烃是什么?生成的饱和烃有无旋光性?解:不饱和烃是或,生成的饱和烃无旋光性。(五)比较左旋仲丁醇和右旋仲丁醇的下列各项:(1)沸点(2)熔点(3)相对密度(4)比旋光度(5)折射率(6)溶解度(7)构型解:(1)、(2)、(3)、(5)、(6)相同;(4)大小相同,方向相反;(7)构型互为对映异构体。(六)下列Fischer投影式中,哪个是同乳酸一样的?(1)(2)(3)(4)解:(1)、(3)、(4)和题中所给的乳酸相同,均为R-型;(2)为S-型。提示:①在Fischer投影式中,任意两个基团对调,构型改变,对调两次,构型复原;任意三个基团轮换,构型不变。②在Fischer投影式中,如果最小的基团在竖键上,其余三个基团从大到小的顺序为顺时针时,手性碳的构型为R-型,反之,为S-型;如果最小的基团在横键上,其余三个基团从大到小的顺序为顺时针时,手性碳的构型为S-型,反之,为R-型;
(七)Fischer投影式是R型还是S型?下列各结构式,哪些同上面这个投影式是同一化合物?(1)(2)(3)(4)解:S-型。(2)、(3)、(4)和它是同一化合物。(八)把3-甲基戊烷进行氯化,写出所有可能得到的一氯代物。哪几对是对映体?哪些是非对映体?哪些异构体不是手性分子?解:3-甲基戊烷进行氯化,可以得到四种一氯代物。其中:3-甲基-1-氯戊烷有一对对映体:3-甲基-2-氯戊烷有两对对映体:(1)(2)(3)(4)(1)和(2)是对映体,(3)和(4)是对映体;(1)和(3)、(2)和(3)、(1)和(4)、(2)和(4)、是非对映体。
(九)将10g化合物溶于100ml甲醇中,在25℃时用10cm长的盛液管在旋光仪中观察到旋光度为+2.30°。在同样情况下改用5cm长的盛液管时,其旋光度为+1.15°。计算该化合物的比旋光度。第二次观察说明什么问题?解:第二次观察说明,第一次观察到的α是+2.30°,而不是-357.7°。(十)(1)写出3-甲基-1-戊炔分别与下列试剂反应的产物。(A)Br2,CCl4(B)H2,Lindlar催化剂(C)H2O,H2SO4,HgSO4(D)HCl(1mol)(E)NaNH2,CH3I(2)如果反应物是有旋光性的,哪些产物有旋光性?(3)哪些产物同反应物的手性中心有同样的构型关系?(4)如果反应物是左旋的,能否预测哪个产物也是左旋的?解:(1)(A)(B)(C)(D)(E)(2)以上各产物都有旋光性。(3)全部都有同样的构型关系。(4)都不能预测。
(十一)下列化合物各有多少立体异构体存在?(1)(2)(3)解:(1)四种:(2)八种;(3)八种(十二)根据给出的四个立体异构体的Fischer投影式,回答下列问题:(1)(Ⅱ)和(Ⅲ)是否是对映体?(2)(Ⅰ)和(Ⅳ)是否是对映体?(3)(Ⅱ)和(Ⅳ)是否是对映体?(4)(Ⅰ)和(Ⅱ)的沸点是否相同?(5)(Ⅰ)和(Ⅲ)的沸点是否相同?(6)把这四种立体异构体等量混合,混合物有无旋光性?解:(1)Yes(2)No(3)No(4)Yes(5)No(6)No,四种立体异构体等量混合物无旋光性
(十三)预测有多少立体异构体,指出哪些是对映体、非对映体和顺反异构体。解:有四种立体异构体:(A)(B)(C)(D)(A)和(C),(B)和(D)是对映异构体;(A)和(D)或(B),(B)和(C)或(A)是非对映异构体;(A)和(B),(C)和(D)是顺反异构体。(十四)写出CH3CH=CHCH(OH)CH3的四个立体异构体的透视式。指出在这些异构体中哪两组是对映体?哪几组是非对映体?哪两组是顺反异构体?解:分子中有两处可产生构型异,一处为双键,可产生顺反异构,另一处为手性碳,可产生旋光异构。其中:(I)和(II)、(II)和(IV)是对映体;(I)和(III)、(I)和(IV)、(II)和(III)、(II)和(IV)是非对映体;(I)和(III)、(II)和(IV)是顺反异构体。
(十五)环戊烯与溴进行加成反应,预期将得到什么产物?产品是否有旋光性?是左旋体、右旋体、外消旋体,还是内消旋体?解:(十六)某烃分子式为C10H14,有一个手性碳原子,氧化生成苯甲酸。试写出其结构式。解:C10H14的结构式为:(十七)用高锰酸钾处理顺-2-丁烯,生成一个熔点为32℃的邻二醇,处理反-2-丁烯,生成熔点为19℃的邻二醇。它们都无旋光性,但19℃的邻二醇可拆分为两个旋光度相等、方向相反的邻二醇。试写出它们的结构式、标出构型以及相应的反应式。解:
(十八)某化合物(A)的分子式为C6H10,具有光学活性。可与碱性硝酸银的氨溶液反应生成白色沉淀。若以Pt为催化剂催化氢化,则(A)转变C6H14(B),(B)无光学活性。试推测(A)和(B)的结构式。解:(A)(B)(十九)化合物C8H12-(A),具有光学活性。(A)在Pt催化下加氢生成C8H18(B),(B)无光学活性。(A)在部分毒化的钯催化剂催化下,小心加氢得到产物C8H14(C),(C)具有光学活性。试写出(A)、(B)和(C)的结构式。(提示:两个基团构造相同但构型不同,属于不同基团。)解:(A)(B)(C)第六章立体化学(一)在氯丁烷和氯戊烷的所有异构体中,哪些有手性碳原子?解:氯丁烷有四种构造异构体,其中2-氯丁烷中有手性碳:氯戊烷有八种构造异构体,其中2-氯戊烷(C2*),2-甲基-1-氯丁烷(C2*),2-甲基-3-氯丁烷(C3*)有手性碳原子:
(二)各写出一个能满足下列条件的开链化合物:(1)具有手性碳原子的炔烃C6H10;(2)具有手性碳原子的羧酸C5H10O2(羧酸的通式是CnH2n+1COOH)。解:(1)(2)(三)相对分子质量最低而有旋光性的烷烃是哪些?用Fischer投影式表明它们的构型。解:和和(四)是一个具有旋光性的不饱和烃,加氢后生成相应的饱和烃。不饱和烃是什么?生成的饱和烃有无旋光性?解:不饱和烃是或,生成的饱和烃无旋光性。(五)比较左旋仲丁醇和右旋仲丁醇的下列各项:(1)沸点(2)熔点(3)相对密度(4)比旋光度(5)折射率(6)溶解度(7)构型解:(1)、(2)、(3)、(5)、(6)相同;
(4)大小相同,方向相反;(7)构型互为对映异构体。(六)下列Fischer投影式中,哪个是同乳酸一样的?(1)(2)(3)(4)解:(1)、(3)、(4)和题中所给的乳酸相同,均为R-型;(2)为S-型。提示:①在Fischer投影式中,任意两个基团对调,构型改变,对调两次,构型复原;任意三个基团轮换,构型不变。②在Fischer投影式中,如果最小的基团在竖键上,其余三个基团从大到小的顺序为顺时针时,手性碳的构型为R-型,反之,为S-型;如果最小的基团在横键上,其余三个基团从大到小的顺序为顺时针时,手性碳的构型为S-型,反之,为R-型;(七)Fischer投影式是R型还是S型?下列各结构式,哪些同上面这个投影式是同一化合物?(1)(2)(3)(4)解:S-型。(2)、(3)、(4)和它是同一化合物。(八)把3-甲基戊烷进行氯化,写出所有可能得到的一氯代物。哪几对是对映体?哪些是非对映体?哪些异构体不是手性分子?解:3-甲基戊烷进行氯化,可以得到四种一氯代物。其中:3-甲基-1-氯戊烷有一对对映体:
3-甲基-2-氯戊烷有两对对映体:(1)(2)(3)(4)(1)和(2)是对映体,(3)和(4)是对映体;(1)和(3)、(2)和(3)、(1)和(4)、(2)和(4)、是非对映体。(九)将10g化合物溶于100ml甲醇中,在25℃时用10cm长的盛液管在旋光仪中观察到旋光度为+2.30°。在同样情况下改用5cm长的盛液管时,其旋光度为+1.15°。计算该化合物的比旋光度。第二次观察说明什么问题?解:第二次观察说明,第一次观察到的α是+2.30°,而不是-357.7°。(十)(1)写出3-甲基-1-戊炔分别与下列试剂反应的产物。(A)Br2,CCl4(B)H2,Lindlar催化剂(C)H2O,H2SO4,HgSO4(D)HCl(1mol)(E)NaNH2,CH3I
(2)如果反应物是有旋光性的,哪些产物有旋光性?(3)哪些产物同反应物的手性中心有同样的构型关系?(4)如果反应物是左旋的,能否预测哪个产物也是左旋的?解:(1)(A)(B)(C)(D)(E)(2)以上各产物都有旋光性。(3)全部都有同样的构型关系。(4)都不能预测。(十一)下列化合物各有多少立体异构体存在?(1)(2)(3)解:(1)四种:(2)八种;(3)八种
(十二)根据给出的四个立体异构体的Fischer投影式,回答下列问题:(1)(Ⅱ)和(Ⅲ)是否是对映体?(2)(Ⅰ)和(Ⅳ)是否是对映体?(3)(Ⅱ)和(Ⅳ)是否是对映体?(4)(Ⅰ)和(Ⅱ)的沸点是否相同?(5)(Ⅰ)和(Ⅲ)的沸点是否相同?(6)把这四种立体异构体等量混合,混合物有无旋光性?解:(1)Yes(2)No(3)No(4)Yes(5)No(6)No,四种立体异构体等量混合物无旋光性(十三)预测有多少立体异构体,指出哪些是对映体、非对映体和顺反异构体。解:有四种立体异构体:(A)(B)(C)(D)(A)和(C),(B)和(D)是对映异构体;(A)和(D)或(B),(B)和(C)或(A)是非对映异构体;(A)和(B),(C)和(D)是顺反异构体。
(十四)写出CH3CH=CHCH(OH)CH3的四个立体异构体的透视式。指出在这些异构体中哪两组是对映体?哪几组是非对映体?哪两组是顺反异构体?解:分子中有两处可产生构型异,一处为双键,可产生顺反异构,另一处为手性碳,可产生旋光异构。其中:(I)和(II)、(II)和(IV)是对映体;(I)和(III)、(I)和(IV)、(II)和(III)、(II)和(IV)是非对映体;(I)和(III)、(II)和(IV)是顺反异构体。(十五)环戊烯与溴进行加成反应,预期将得到什么产物?产品是否有旋光性?是左旋体、右旋体、外消旋体,还是内消旋体?解:(十六)某烃分子式为C10H14,有一个手性碳原子,氧化生成苯甲酸。试写出其结构式。解:C10H14的结构式为:
(十七)用高锰酸钾处理顺-2-丁烯,生成一个熔点为32℃的邻二醇,处理反-2-丁烯,生成熔点为19℃的邻二醇。它们都无旋光性,但19℃的邻二醇可拆分为两个旋光度相等、方向相反的邻二醇。试写出它们的结构式、标出构型以及相应的反应式。解:(十八)某化合物(A)的分子式为C6H10,具有光学活性。可与碱性硝酸银的氨溶液反应生成白色沉淀。若以Pt为催化剂催化氢化,则(A)转变C6H14(B),(B)无光学活性。试推测(A)和(B)的结构式。解:(A)(B)(十九)化合物C8H12-(A),具有光学活性。(A)在Pt催化下加氢生成C8H18(B),(B)无光学活性。(A)在部分毒化的钯催化剂催化下,小心加氢得到产物C8H14(C),(C)具有光学活性。试写出(A)、(B)和(C)的结构式。(提示:两个基团构造相同但构型不同,属于不同基团。)解:(A)(B)
(C)第七章卤代烃相转移催化反应(一)写出下列分子式所代表的所有同分异构体,并用系统命名法命名。(1)C5H11Cl(并指出1°,2°,3°卤代烷)(2)C4H8Br2(3)C8H10Cl解:(1)C5H11Cl共有8个同分异构体:(2)C4H8Br2共有9个同分异构体:
(3)C8H10Cl共有14个同分异构体:
(二)用系统命名法命名下列化合物。(1)(2)(3)(4)(5)(6)(三) 1,2-二氯乙烯的(Z)-和(E)-异构体,哪一个熔点较高?哪一个沸点较高?为什么?解:熔点:沸点:原因:顺式异构体具有弱极性,分子间偶极-偶极相互作用力增加,故沸点高;而反式异构体比顺式异构体分子的对称性好,它在晶格中的排列比顺式异构体紧密,故熔点较高。(四)比较下列各组化合物的偶极矩大小。
(2)解:(1)(A)>(B)>(D)>(C)(C)为对称烯烃,偶极矩为0(2)(B)>(C)>(A)。(五)写出1-溴丁烷与下列化合物反应所得到的主要有机物。解:(六)完成下列反应式:解:红色括号中为各小题所要求填充的内容。(1)(2)
(3)(4)(5)(6)(7)解释:(8)(9)(10)(11)
(12)(13)(14)(15)(16)(七)在下列每一对反应中,预测哪一个更快,为什么?(1)解:B>A。I-的离去能力大于Cl-。
(2)解:B>A。中β-C上空间障碍大,反应速度慢。(3)解:A>B。C+稳定性:CH3CH=CHCH2+ > CH2=CHCH2CH2+(4)(A)(B)解:A>B 。反应A的C+具有特殊的稳定性:(5)解:A>B。亲核性:SH->OH-。(6)(A)(B)解:B>A。极性非质子溶剂有利于SN2。(P263)(八)将下列各组化合物按照对指定试剂的反映活性从大到小排列成序。(1)在2%AgNO3-乙醇溶液中反应:
(A)1-溴丁烷(B)1-氯丁烷(C)1-碘丁烷(C)>(A)>(B)(1)在NaI-丙酮溶液中反应:(A)3-溴丙烯(B)溴乙烯(C)1-溴乙烷(D)2-溴丁烷(A)>(C)>(D)>(B)(2)在KOH-醇溶液中反应:(A)>(B)>(C)(九)用化学方法区别下列化合物(1)解(2)解:(3)(A)(B)(C)解:
(1)1-氯丁烷,1-碘丁烷,己烷,环己烯解:(5)(A)2-氯丙烯(B)3-氯丙烯(C)苄基氯(D)间氯甲苯(E)氯代环己烷解:(十)完成下列转变[(2)、(3)题的其它有机原料可任选]:(1)解:(2)解:
或:(3)解:(4)解:(5)解:(6)解:(十一)在下列各组化合物中,选择能满足各题具体要求者,并说明理由。(1)下列哪一个化合物与KOH醇溶液反应,释放出F-?(A)(B)解:(B)。-NO2的吸电子共轭效应使对位氟的活性大增。
(1)下列哪一个化合物在乙醇水溶液中放置,能形成酸性溶液?(A)(B)解:(A)。苄基型C-X键活性远远大于苯基型(苄基型C+具有特殊的稳定性)。(2)下列哪一个与KNH2在液氨中反应,生成两种产物?(A)(B)(C)解:(B)。(十二)由1-溴丙烷制备下列化合物:(1)异丙醇解:(2)1,1,2,2-四溴丙烷
解:(3)2-溴丙烯解:由(2)题得到的(4)2-己炔解:[参见(2)](5)2-溴-2-碘丙烷解:[参见(2)](十三)由指定原料合成:(1)解:(2)解:(3)解:
(4)解:(十四)由苯和/或甲苯为原料合成下列化合物(其他试剂任选):(1)解:(2)解:
或者:(3)解:(4)解:
(十五)4-三氟甲基-2,6-二硝基-N,N-二丙基苯胺(又称氟乐灵,trifluralinB)是一种低毒除草剂,适用于大豆除草,是用于莠草长出之前使用的除草剂,即在莠草长出之前喷洒,待莠草种子发芽穿过土层过程中被吸收。试由对三氟甲基氯合成之(其它试剂任选)。氟乐灵的构造式如下:解:(十六) 1,2-二(五溴苯基)乙烷(又称十溴二苯乙烷)是一种新型溴系列阻燃剂,其性能与十溴二苯醚相似,但其阻燃性、耐热性和稳定性好。与十溴二苯醚不同,十溴二苯乙烷高温分解时不产生二恶英致癌物及毒性物质,现被广泛用来代替十溴二苯醚,在树脂、橡胶、塑料和纤维等中用作阻燃剂。试由下列指定原料(无机原料任选)合成之:(1)由苯和乙烯合成;(2)由甲苯合成。解:(1)由苯和乙烯合成:(1)由甲苯合成:
(十七)回答下列问题:(1)CH3Br和C2H5Br在含水乙醇溶液中进行碱性水解时,若增加水的含量则反应速率明显下降,而(CH3)3CCl在乙醇溶液中进行水解时,如含水量增加,则反应速率明显上升。为什么?解:CH3Br和C2H5Br是伯卤代烷,进行碱性水解按SN2机理进行。增加水的含量,可使溶剂的极性增大,不利于SN2;(CH3)3CCl是叔卤代烷,水解按SN1机理进行。,增加水的含量,使溶剂的极性增大,有利于SN1;(2)无论实验条件如何,新戊基卤[(CH3)3CCH2X]的亲核取代反应速率都慢,为什么?解:(CH3)3CCH2X在进行SN1反应时,C-X键断裂得到不稳定的1ºC+:(CH3)3CC+H2,所以SN1反应速度很慢;(CH3)3CCH2X在进行SN2反应时,α-C上有空间障碍特别大的叔丁基,不利于亲核试剂从背面进攻α-C,所以SN2速度也很慢。(3)1-氯-2-丁烯(I)和3-氯-1-丁烯(II)分别与浓的乙醇钠的乙醇溶液反应,(I)只生成(III),(II)只生成(IV),但分别在乙醇溶液中加热,则无论(I)还是(II)均得到(III)和(IV)的混合物。为什么?解:在浓的乙醇钠的乙醇溶液中,反应均按SN2机理进行,无C+,无重排;
在乙醇溶液中加热,反应是按照SN1机理进行的,有C+,有重排:(4)在含少量水的甲酸(HCOOH)中对几种烯丙基氯进行溶剂分解时,测得如下相对速率:试解释以下事实:(III)中的甲基实际上起着轻微的钝化作用,(II)和(IV)中的甲基则起着强烈的活化作用。解:几种烯丙基氯在含少量水的甲酸(HCOOH)中的溶剂解反应教都是按照SN1机理进行的。各自对应的C+为:稳定性:(II)’>(IV)’>(I)’>(III)’(5)将下列亲核试剂按其在SN2反应中的亲核性由大到小排列,并简述理由。解:亲核性:(B)>(C)>(A)原因:三种亲核试剂的中心原子均是氧,故其亲核性顺序与碱性一致。
(6)1-氯丁烷与NaOH生成正丁醇的反应,往往加入少量的KI作催化剂。试解释KI的催化作用。解:I-是一个强的亲核试剂和好的离去基团:亲核性:I->OH-;离去能力:I->Cl-(7)仲卤代烷水解时,一般是按SN1及SN2两种机理进行,若使反应按SN1机理进行可采取什么措施?解:增加水的含量,减少碱的浓度。(8)写出苏型和赤型1,2-二苯基-1-氯丙烷分别与C2H5ONa-C2H5OH反应的产物。根据所得结果,你能得出什么结论?解:1,2-二苯基-1-氯丙烷的构造:苏型的反应:赤型的反应:以上的结果说明,E2反应的立体化学是离去基团与β-H处于反式共平面。
(9)顺-和反-1-叔丁基-4-氯环己烷分别与热的氢氧化钠乙醇溶液反应(E2机理),哪一个较快?解:顺式较快。因为其过渡态能量较低:(10)间溴茴香醚和邻溴茴香醚分别在液氨中用NaNH2处理,均得到同一产物—间氨基茴香醚,为什么?解:因为二者可生成相同的苯炔中间体:(十八)某化合物分子式为C5H12(A),(A)在其同分异构体中熔点和沸点差距最小,(A)的一溴代物只有一种(B)。(B)进行SN1或SN2反应都很慢,但在Ag+的作用下,可以生成Saytaeff烯烃(C)。写出化合物(A)、(B)、和(C)的构造式。解:
(十九)化合物(A)与Br2-CCl4溶液作用生成一个三溴化合物(B),(A)很容易与NaOH水溶液作用,生成两种同分异构的醇(C)和(D),(A)与KOH-C2H5OH溶液作用,生成一种共轭二烯烃(E)。将(E)臭氧化、锌粉水解后生成乙二醛(OHC-CHO)和4-氧代戊醛(OHCCH2CH2COCH3)。试推导(A)~(E)的构造。解:(二十)某化合物C9H11Br(A)经硝化反应只生成分子式为C9H10NO2Br的两种异构体(B)和(C)。(B)和(C)中的溴原子很活泼,易与NaOH水溶液作用,分别生成分子式为C9H11NO3互为异构体的醇(D)和(E)。(B)和(C)也容易与NaOH的醇溶液作用,分别生成分子式为C9H9NO2互为异构体的(F)和(G)。(F)和(G)均能使KMnO4水溶液或溴水褪色,氧化后均生成分子式为C8H5NO6的化合物(H)。试写出(A)~(H)的构造式。解:
(二十一)用立体表达式写出下列反应的机理,并解释立体化学问题。解:两步反应均按SN2机理进行,中心碳原子发生两次构型翻转,最终仍保持R-型。(二十二)写出下列反应的机理:解:
(二十三)将对氯甲苯和NaOH水溶液加热到340℃,生成等量的对甲苯酚和邻甲苯酚。试写出其反应机理。解:(二十四)2,4,6-三氯苯基-4’-硝基苯基醚又称除草醚,是一种毒性很低的除草剂。用于防治水稻田中稗草等一年生杂草,也可防除油菜、白菜地中的禾本科杂草。其制备的反应式如下,试写出其反应机理。解:
第八章 波谱一、分子式为C2H4O的化合物(A)和(B),(A)的紫外光谱在λmax=290nm(κ=15)处有弱吸收;而(B)在210以上无吸收峰。试推断两种化合物的结构。解:(A)的结构为:(B)的结构为:二、用红外光谱鉴别下列化合物:(1)解:(A)C–H伸缩振动(νC–H):低于3000cm-1;无双键的伸缩振动(νC=C)及双键的面外弯曲振动(γC=C)吸收。(B)C–H伸缩振动(νC–H):3010cm-1、~2980cm-1均有峰;双键绅缩振动(νC=C):~1640cm-1;双键面外弯曲振动(γC=C):~990cm-1,910cm-1。(2)解:(A)双键面外弯曲振动(γC=C):~680cm-1。(B)双键面外弯曲振动(γC=C):~970cm-1。(3)解:(A)无~3300cm-1(ν≡C–H)、2120cm-1(νC≡H)及~680cm-1(δ≡C–H)峰;(B)有~3300cm-1(ν≡C–H)、2120cm-1(νC≡H)及~680cm-1(δ≡C–H)峰。(4)解:(A)有~1600、1500、1580、1460cm-1苯环特征呼吸振动;(B)无~1600、1500、1580、1460cm-1苯环特征呼吸振动;三、指出以下红外光谱图中的官能团。(1)(2)
四、用1H-NMR谱鉴别下列化合物:(1)(A)(CH3)2C=C(CH3)2(B)(CH3CH2)2C=CH2解:(A)一种质子。出一个单峰(12H)。(B)三种质子。出三组峰:δ~0.9(3H,三重峰),δ~2.0(2H,四重峰),δ~5.28(2H)。(2)(A)ClCH2OCH3(B)ClCH2CH2OH解:(A)两种质子,出两组单峰。(B)三种质子,两组三重峰,一组单峰。(3)(A)BrCH2CH2Br(B)CH3CHBr2解:(A)四个质子完全等价,出一个单峰;(B)两种质子,出一组双重峰(3H)和一组四重峰(1H)。(4)(A)CH3CCl2CH2Cl(B)CH3CHClCHCl2解:(A)两种质子,出两组单峰。(B)三种质子,出三组峰。五、化合物的分子式为C4H8Br2,其1HNMR谱如下,试推断该化合物的结构。(六)下列化合物的1H-NMR谱中都只有一个单峰,写出它们的结构式:序号分子式及波谱数据结构式(1)C8H18,δ=0.9(2)C5H10,δ=1.5(3)C8H8,δ=5.8
(4)C12H18,δ=2.2(5)C4H9Br,δ=1.8(6)C2H4Cl2,δ=3.7(7)C2H3Cl3,δ=2.7(8)C5H8Cl4,δ=3.7(七)在碘甲烷的质谱中,m/z=142和m/z=143两个峰是什么离子产生的峰?各叫什么峰?而m/z=143的峰的相对强度为m/z=142的1.1%,怎么解释?解:m/z=142为产生的峰,叫分子离子峰;m/z=143为产生的峰,叫分子离子的同位素峰;m/z=143的峰的相对强度为m/z=142的1.1%是由于13C同位素的天然丰度为12C的~1.1%。第九章醇和酚习题(一)写出2-丁醇与下列试剂作用的产物:(1)H2SO4,加热(2)HBr(3)Na(4)Cu,加热(5)K2Cr2O7+H2SO4解:(1)(2)(3)(4)(5)(二)完成下列反应式:(1)
(2)(3)(4)(三)区别下列化合物:(1)乙醇和正丁醇(2)仲丁醇和异丁醇(3)1,4-丁二醇和2,3-丁二醇(4)对甲苯酚和苯甲醇解:(1)(2)(3)(4)(四)用化学方法分离2,4,6-三甲基苯酚和2,4,6-三硝基苯酚。解:
(五)下列化合物中,哪一个具有最小的Pka值?(1)(2)(3)(4)(5)(6)解:题给六个化合物的酸性大小顺序为:(5)>(3)>(1)>(2)>(6)>(4);所以,对硝基苯酚()具有最小的pKa值。(六)完成下列反应式,并用R,S-标记法命名所得产物。(1)解:(2)解:(七)将3-戊醇转变为3-溴戊烷(用两种方法,同时无或有很少有2-溴戊烷)。解:方法一:方法二:
(八)用高碘酸分别氧化四个邻二醇,所得氧化产物为下面四种,分别写出四个邻二醇的构造式。(1)只得一个化合物CH3COCH2CH3;(2)得两个醛CH3CHO和CH3CH2CHO;(3)得一个醛HCHO和一个酮CH3COCH3;(4)只得一个含两个羰基的化合物(任举一例)or(九)用反应机理解释以下反应(1)解:(2)
解:(3)解:(4)解:
(十)2,2’-亚甲基双(4-甲基-6-叔丁基苯酚)又称抗氧剂2246,对热、氧的老化和光老化引起的龟裂具有较高的防护效能,被用作合成橡胶、聚烯烃和石油制品的抗氧剂,也可用作乙丙橡胶的相对分子质量调节剂。其构造式如下所示,试由对甲苯酚及必要的原料合成之。解:(十一)2,2-双(4-羟基-3,5-二溴苯基)丙烷又称四溴双酚A,构造式如下所示。它既是添加型也是反应型阻燃剂,可用于抗冲击聚苯乙烯、ABS树脂和酚醛树脂等。试由苯酚及必要的原料合成之。解:(十二)2,4,5-三氯苯氧乙酸又称2,4,5-T,农业上用途除草剂和生长刺激剂。它是由1,24,5-四氯苯和氯乙酸为主要原料合成的。但在生产过程中,还生成少量副产物----2,3,7,8-四氯二苯并-对二恶英(2,3,7,8-tetrachlorodibenzo-p-dioxin,缩写为2,3,7,8-TCDD),其构造式如下所示:
2,3,7,8-TCDD是二恶英类化合物中毒性最强的一种,其毒性比NaCN还大,且具有强致癌性,以及生殖毒性、内分泌毒性和免疫毒性。由于其化学稳定性强,同时具有高亲脂性和脂溶性,一旦通过食物链进入人和动物体内很难排出,是一种持续性的污染物,对人类危害极大。因此,有的国家已经控制使用2,4,5-T。试写出由1,2,4,5-四氯苯,氯乙酸及必要的原料反应,分别生成2,4,5-T和2,3,7,8-TCDD的反应式。解:(十三)化合物(A)的相对分子质量为60,含有60.0%C,13.3%H。(A)与氧化剂作用相继得到醛和酸,(A)与溴化钾和硫酸作用生成(B);(B)与NaOH乙醇溶液作用生成(C);(C)与HBr作用生成(D);(D)含有65.0%Br,水解后生成(E),而(E)是(A)的同分异构体。试写出(A)~(E)各化合物的构造式。解:(十四)化合物的分子式为C4H10O,是一个醇,其1HNMR谱图如下,试写出该化合物的构造式。
(十五)化合物(A)的分子式为C9H12O,不溶于水、稀盐酸和饱和碳酸钠溶液,但溶于稀氢氧化钠溶液。(A)不使溴水褪色。试写出(A)的构造式。解:(A)的构造式为:(十六)化合物C10H14O溶解于稀氢氧化钠溶液,但不溶解于稀的碳酸氢钠溶液。它与溴水作用生成二溴衍生物C10H12Br2O。它的红外光谱在3250cm-1和834cm-1处有吸收峰,它的质子核磁共振谱是:δ=1.3(9H)单峰,δ=4.9(1H)单峰,δ=7.6(4H)多重峰。试写出化合物C10H14O的构造式。解:C10H14O的构造式为。(C10H12Br2O)波谱数据解析:IRNMR吸收峰归属吸收峰归属3250cm-1O–H(酚)伸缩振动δ=1.3(9H)单峰叔丁基上质子的吸收峰834cm-1苯环上对二取代δ=4.9(1H)单峰酚羟基上质子的吸收峰δ=7.6(4H)多重峰苯环上质子的吸收峰第十章醚和环氧化合物习题(一)写出分子式为C5H12O的所有醚及环氧化合物,并命名之。解:甲基丁基醚甲基仲丁基醚甲基异丙基醚
甲基叔丁基醚乙基丙基醚乙基异丙基醚(二)完成下列反应式:(1)(2)(3)(4)(5)(6)(三)在3,5-二氧杂环己醇的稳定椅型构象中,羟基处在a键的位置,试解释之。解:羟基处于a键时,有利于形成具有五元环状结构的分子内氢键:或
(四)完成下列转变:(1)解:(2)解:(TM)(3)解:(4)解:
(5)解:(五)推测下列化合物A~F的结构,并注明化合物E及F的立体构型。(1)解:(2)解:(六)选择最好的方法,合成下列化合物(原料任选)。(1)(2)解:(1)用烷氧汞化-脱汞反应制备:
(2)或者:(七)完成下列反应式,并用反应机理解释之。(1)解:(1)(2)解:
(3)解:(八)一个未知物的分子式为C2H4O,它的红外光谱图中3600~3200cm-1和1800~1600cm-1处都没有峰,试问上述化合物的结构如何?解:C2H4O的不饱和度为1,而IR光谱又表明该化合物不含O-H和C=C,所以该化合物分子中有一个环。其结构为(九)化合物(A)的分子式为C6H14O,其1HNMR谱图如下,试写出其构造式。第十一章醛、酮和醌(一)写出丙醛与下列各试剂反应时生成产物的构造式。(1)NaBH4,NaOH水溶液(2)C2H5MgBr,然后加H2O(3)LiAlH4,然后加H2O(4)NaHSO3(5)NaHSO3,然后加NaCN(6)OH-,H2O(7)OH-,H2O,然后加热(8)HOCH2CH2OH,H+(9)Ag(NH3)2OH(10)NH2OH解:
(1)、(2)、(3)、(4)、(5)、(6)、(7)、(8)、(9)、(10)、(二)写出苯甲醛与上题各试剂反应时生成产物的构造式,若不反应请注明。(1)、(2)、(3)、(4)、(5)、(6)、不反应(7)、不反应(8)、(9)、(10)、(三)将下列各组化合物按其羰基的活性排列成序。(1),,,(2)解:(1)(2)(四)怎样区别下列各组化合物?(1)环己烯,环己酮,环己烯(2)2-己醇,3-己醇,环己酮(3)解:
(1)(2)(3)(五)化合物(A)的分子式C5H120,有旋光性,当它有碱性KMnO4剧烈氧化时变成没有旋光性的C5H10O(B)。化合物(B)与正丙基溴化镁作用后水解生成(C),然后能拆分出两个对映体。试问化合物(A)、(B)、(C)的结构如何?解:(A)(B)(C)(六)试以乙醛为原料制备下列化合物(无机试剂及必要的有机试剂任选):(1)(2)
解:(1)(2)(七)完成下列转变(必要的无机试剂及有机试剂任用):(1)(2)(3)(4)(5)(6)(7)(8)
(9)(10)(11)(12)(13)(14)解:(1)(2)(3)
(4)(5)(6)(7)或者:(8)(9)(10)(11)(12)
(13)(14)(八)试写出下列反应可能的机理:(1)(2)解:(1)(2)(九)指出下列加成反应产物的构型式:(1)(2)(3)(4)解:单线态Carbene与烯烃进行反应,是顺式加成,具有立体选择性,是一步完成的协同反应。所以,单线态carbene与顺-3-己烯反应时,其产物也是顺式的(内消旋体);而与反3-己烯反应时,其产物也是反式的(外消旋体)。
由于三线态Carbene是一个双自由基,它与烯烃进行反应时,是按自由基加成分两步进行,所生成的中间体有足够的时间沿着碳碳单键放置。因此,三线态carbene与顺-3-己烯及反-3-己烯反应时,得到两种异构体的混合物。(1)(2)+(3)+(4)+(十)由甲苯及必要的原料合成。解:(十一)某化合物分子式为C6H12O,能与羟氨作用生成肟,但不起银镜反应,在铂的催化下进行加氢,则得到一种醇,此醇经过脱水、臭氧化、水解等反应后,得到两种液体,其中之一能起银镜反应,但不起碘仿反应,另一种能起碘仿反应,而不能使Fehling试剂还原,试写出该化合物的构造式。解:该化合物的构造式为:(十二)有一个化合物(A),分子式是C8H140,(A)可以很快地使水褪色,可以与苯肼反应,(A)氧化生成一分子丙酮及另一化合物(B)。(B)具有酸性,同NaOCl反应则生成氯仿及一分子丁二酸。试写出(A)与(B)可能的构造式。解:(A)或(B)
(十三)化合物C10H12O2(A)不溶于NaOH溶液,能与2,4-二硝基苯肼反应,但不与Tollens试剂作用。(A)经LiAlH4还原得C10H14O2(B)。(A)和(B)都进行碘仿反应。(A)与HI作用生成C9H10O2(C),(C)能溶于NaOH溶液,但不溶于Na2CO3溶液。(C)经Clemmensen还原生成C9H12O(D);(C)经KMnO4氧化得对羟基苯甲酸。试写出(A)~(D)可能的构造式。解:(A)(B)(C)(D)(十四)化合物(A)的分子式为C6H12O3,在1710cm-1处有强吸收峰。(A)和碘的氢氧化钠溶液作用得黄色沉淀,与Tollens试剂作用无银镜产生。但(A)用稀H2SO4处理后,所生成的化合物与Tollens试剂作用有银镜产生。(A)的NMR数据如下:δ=2.1(3H,单峰);δ=2.6(2H,双峰);δ=3.2(6H,单峰);δ=4.7(1H,三重峰)。写出(A)的构造式及反应式。解:C6H12O3的结构式为:δa=2.1(3H,单峰);δb=2.6(2H,双峰);δc=4.7(1H,三重峰);δd=3.2(6H,单峰)。有关的反应式如下:(十五)根据下列两个1HNMR谱图,推测其所代表的化合物的构造式。解:化合物A:
化合物B:(十六)根据化合物A、B和C的IR谱图和1HNMR谱图,写出它们的构造式。解:化合物A吸收峰位置/cm-1峰的归属吸收峰位置/cm-1峰的归属1688νC=O(共轭)11621601、~1580、~1500苯环呼吸振动~820苯环上对二取代1259νC-O(芳香醚)
化合物B吸收峰位置/cm-1峰的归属吸收峰位置/cm-1峰的归属1670νC=O(共轭)11711590苯环呼吸振动1021νAr-O-C(芳香醚,脂肪部分)1258νAr-O-C(芳香醚,芳香部分)833苯环上对二取代化合物C
吸收峰位置/cm-1峰的归属吸收峰位置/cm-1峰的归属1689νC=O(共轭)12271450705苯环上单取代第十二章羧酸(一)命名下列化合物:(1)(2)(3)(4)(4)(6)解:(1)α-甲氧基乙酸2-甲氧基乙酸(2)3-环己烯甲酸α-环己烯甲酸(3)(E)-4-甲基-2-戊烯二酸(4)2-甲酰基-4-硝基苯甲酸(5)对氯甲酰基苯甲酸对苯二甲酸单酰氯(6)2,4-二氯苯氧乙酸
(二)写出下列化合物的构造式:(1)2,2-甲基丁酸(2)1-甲基环己基甲酸(3)软脂酸(4)2-己烯-4-炔-1,6-二酸(5)3-苯基-2-羟基苯甲酸(6)9,10-蒽醌-2-甲酸解:(1)(2)(3)(4)(5)(6)(三)试比较下列化合物的酸性大小:(1)(A)乙醇(B)乙酸(C)丙二酸(D)乙二酸(2)(A)三氯乙酸(B)氯乙酸(C)乙酸(D)羟基乙酸解:(1)酸性: > > > (2)酸性:> > > (四)用化学方法区别下列化合物:(1)(A)乙酸,(B)乙醇,(C)乙醛,(D)乙醚,(E)溴乙烷(2)(A)甲酸,(B)草酸,(C)丙二酸,(D)丁二酸,(E)反丁烯二酸解:(1)(2)
(五)完成下列反应式:解:红色括号中为各小题所要求填充的内容。(1)(2)(3)(4)(5)(6)(六)试写出在少量硫酸存在下,5-羧基己酸发生分子内酯化反应的机理。解:(七)完成下列转化:(1)
(2)(3)(4)(5)(6)(7)(8)解:(1)(2)(3)方法一:方法二:(4)
(5)(6)(7)方法一:方法二:(8)(八)用反应式表示如何把丙酸转化为下列化合物:(1)丁酸(2)乙酸(3)2-甲基-3-羟基戊酸乙酯解:(1)方法一:√方法二,采用Arndt-Eistert(阿恩特-艾司特)反应:
(2)方法一:方法二:(3)(九)由指定原料合成下列化合物,无机试剂任选。(1)由合成(2)由不超过三个碳的有机物合成(3)由乙烯合成丙烯酸(4)由乙炔和苯合成解:(1)√方法一:
方法二:(2)(3)(4)
(十)苯甲酸与乙醇在浓硫酸催化下发生酯化反应。试设计一个从反应混合物中获得纯的苯甲酸乙酯的方法(产物沸点212.4℃)。解:(十一)化合物(A),分子式为C3H5O2Cl,其NMR数据为:δ1=1.73(双峰,3H),δ2=4.47(四重峰,1H),δ3=11.2(单峰,1H)。试推测其结构。化合物A的结构式为:(十二)化合物(B)、(C)的分子式均为C4H6O4,它们均可溶于氢氧化钠溶液,与碳酸钠作用放出CO2,(B)加热失水成酸酐C4H4O3;(C)加热放出CO2生成三个碳的酸。试写出(B)和(C)的构造式。解:(B)(C)
(十三)某二元酸C8H14O4(D),受热时转化成中性化合物C7H12O(E),(E)用浓HNO3氧化生成二元酸C7H12O4(F)。(F)受热脱水成酸酐C7H12O3(G);(G)LiAlO4用还原得C8H18O2(H)。(H)能脱水生成3,4-二甲基-1,5-己二烯。试推导(D)~(H)的构造。解:(D)(E)(F)(G)(H)第十三章羧酸衍生物习题(一)命名下列化合物(1)(2)(3)(4)(5)(6)解:(1)间甲(基)苯甲酰氯(2)α-烯丙基丙二酰二氯or2-氯甲酰基-4-戊烯酰氯(3)乙(酸)丙(酸)酐(4)3-甲基邻苯二甲酸酐(5)丙酸对甲基苯甲醇酯(6)乙丙交酯(二)写出下列化合物的结构式:(1)甲基丙二酸单酰氯(2)丙酸酐(3)氯甲酸苄酯(4)顺丁烯二酰亚胺(5)乙二酰脲(6)异丁腈
解:(1)(2) (3)(4) (5) (6)(三)用化学方法区别下列各化合物:(1)乙酸(2)乙酰氯(3)乙酸乙酯(4)乙酰胺解:(四)完成下列反应:解:红色括号中为各小题所要求填充的内容。(1)(2)(3)(4)
(5)(6)(7)(8)(五)完成下列转变:(1)(2)(3)(4)(5)(6)解:(1)
(2)(3)(4)(5)(6)(六)比较下列酯类水解的活性大小。(1)(A)(B)(C)(D)(2)(A)(B)(C)(D)解:(1)水解活性:(A)>(D)>(B)>(C)酯基的邻、对位上有吸电子基(NO2―、Cl―)时,可使酯基中的酰基碳更正,更有利于酯的水解;
酯基的邻、对位上有给电子基(CH3O―)时,可使酯基中的酰基碳上电子云密度增大,不利于酯的水解;(2)水解活性:(B)>(A)>(C)>(D)酯基的邻、对位上有吸电子基(NO2―)时,可使酯基中的酰基碳更正,更有利于酯的水解;酯基的邻、对位上有给电子基(NH2―、CH3―)时,可使酯基中的酰基碳上电子云密度增大,不利于酯的水解;(七)把下列化合物按碱性强弱排列成序。(A)(B)(C)(D)(E)解:碱性由强到弱顺序:(B)>(C)>(A)>(D)>(E)由于氧的电负性较大,导致酰基是吸电子基,所以氮原子上连的酰基越多,氮原子上电子云密度越小,分子的碱性越弱;而甲基是给电子基,因此,氮原子上连的甲基越多,氮原子上电子云密度越大,分子的碱性越强。(八)按指定原料合成下列化合物,无机试剂任选。(1)由合成(2)由合成(3)以萘为原料合成邻氨基苯甲酸(4)由C4以下有机物为原料合成(5)以C3以下的羧酸衍生物为原料合成乙丙酸酐解:(1)(2)或者:
(3)(4)(5)(九)某化合物的分子式为C4H8O2,其IR和1HNMR谱数据如下。IR谱:在3000~2850cm-1,2725cm-1,1725cm-1(强),1220~1160cm-1(强),1100cm-1处有吸收峰。1HNMR谱:δ=1.29(双峰,6H),δ=5.13(七重峰,1H),δ=8.0(单峰,1H)。试推测其构造。解:C4H8O2的构造为:IRNMR吸收峰归属吸收峰归属3000~2850cm-1C―H(饱和)伸缩振动δ=8.0(单峰,1H)Ha2725cm-1C―H(醛)伸缩振动δ=5.13(七重峰,1H)Hb1725(cm-1强)C=O(醛)伸缩振动δ=1.29(双峰,6H)Hc1220~1160cm-1(强)C―O(酯)伸缩振动(反对称)1100cm-1C―O(酯)伸缩振动(对称)(十)有两个酯类化合物(A)和(B),分子式均为C4H6O2。(A)在酸性条件下水解成甲醇和另一个化合物C3H4O2(C),(C)可使Br2-CCl4溶液褪色。(B)在酸性条件下水解成一分子羧酸和化合物(D),(D)可发生碘仿反应,也可与Tollens试剂作用。试推测(A)~D)的构造。解:推测:(A)在酸性条件下水解成甲醇,说明(A)是甲醇与羧酸生成的酯;(C)可使Br2-CCl4溶液褪色,说明(C)分子中有双键,是CH2=CHCOOH;
(D)可发生碘仿反应,说明(D)分子中含有或结构片断,考虑到(B)的分子式为C4H6O2,(D)应该是CH3CHO。所以:(A)(B)(C)(D)第十四章β-二羰基化合物(一)命名下列化合物:(1)(2)(3)(4)(5)(6)(7)(8)解:(1)3-甲基-4-羟基丁酸(2)4-甲基-3-戊酮酸甲酯(3)3-氧代戊醛or3-戊酮醛(4)5-甲基-4-己烯-2-醇(5)丙二酸单酰氯or氯甲酰基乙酸(6)4-羟基-3-甲氧基苯甲醛(7)2-硝基苯甲醚(8)2-间氯苯乙醇or2-(3-氯苯基)乙醇(二)下列羧酸酯中,那些能进行酯缩合反应?写出其反应式。(1)甲酸乙酯(2)乙酸正丁酯(3)丙酸乙酯(4)2,2-二甲基丙酸乙酯(5)苯甲酸乙酯(6)苯乙酸乙酯解:(2)、(3)、(6)能进行酯缩合反应。反应式如下:(2)
(3)(6)(三)下列各对化合物,那些是互变异构体?那些是共振杂化体?(1)(2)(3)(4)解:(1)、(4)两对有氢原子核相对位置的移动,是互变异构体,(2)、(3)两对中只存在电子对的转移,而没有原子核相对位置的移动,是共振杂化体。(四)写出下列化合物分别与乙酰乙酸乙酯钠衍生物作用后的产物。(1)烯丙基溴(2)溴乙酸甲酯(3)溴丙酮(4)丙酰氯(5)1,2-二溴乙烷(6)α-溴代丁二酸二甲酯解:(1)(2)(3)(4)(5)(6)
(五)以甲醇、乙醇及无机试剂为原料,经乙酰乙酸乙酯合成下列化合物。(1)3-甲基-2-丁酮(2)2-己醇(3)α,β-二甲基丁酸(4)γ-戊酮酸(5)2,5-己二酮(6)2,4-戊二酮解:先合成乙酰乙酸乙酯(1)分析:解:(2)分析:解:正丙基溴可由所给的甲醇和乙醇变化而得:
(3)分析:解:(4)分析:解:(5)分析:解:
(6)分析:解:(此处用NaH取代醇钠,是为了避免反应中生成的醇与酰氯作用)(六)完成下列反应:解:红色括号中为各小题所要求填充的内容。(1)(2)(3)(4)(5)(6)(7)
(七)用丙二酸二乙酯法合成下列化合物:(1)(2)(3)(4)(5)(6)(1)分析:解:(2)目标化合物为1,5-二羰基化合物,可经Michael加成制得:解:(3)分析:解:(4)目标化合物是内酯,应首先制备4-羟基戊酸:
解1:或者,将4-戊酮酸还原得到4-羟基戊酸:解2:(5)目标分子可看作乙酸的二烷基取代物:解:(6)分析:
解:或者:(八)写出下列反应的机理:解:(九)完成下列转变:(1)
(2)(3)(4)(5)(6)(7)解:(1)分析:解:(2)分析:
解:(3)分析:解:(4)分析:
解:(5)分析:解:(6)分析:解:
(7)分析:解:第十五章有机含氮化合物(一)写出下列化合物的构造式或命名:(1)仲丁胺(2)1,3-丙二胺(3)溴化四正丁铵(4)对氨基-N,N-二甲苯胺(5)(6)(7)(8)(9)
解:(1) (2)(3) (4)(5)2-二甲氨基乙醇 (6)N-苄基对苯二胺(7)氢氧化三甲基(1-甲基-2-苯基乙基)铵(8)2-对氨甲基苯基乙胺(9)2-(α-萘基)乙胺(二)两种异构体(A)和(B),分子式都是C7H6N2O4,用发烟硝酸分别使它们硝化,得到同样产物。把(A)和(B)分别氧化得到两种酸,它们分别与碱石灰加热,得到同样产物为C6H4N2O4,后者用Na2S还原,则得间硝基苯胺。写出(A)和(B)的构造式及各步反应式。解:(A)(B)(三)完成下列转变:(1)丙烯异丙胺(2)正丁醇正戊胺和正丙胺(3)3,5-二溴苯甲酸3,5-二溴苯甲胺(4)乙烯1,4-丁二胺(5)乙醇,异丙醇乙基异丙基胺(6)苯,乙醇α-乙氨基乙苯解:(1)(2)制正戊胺:制正丙胺:(3)(4)(5)
(6)(四)把下列各组化合物的碱性由强到弱排列成序:(1)(A)(B)(C)(2)(A)(B)(C)(D)(3)(A)(B)(C)(D)解:(1)(A)>(C)>(B)(2)(A)>(B)>(D)>(C) (3)(D)>(C)>(A)>(B)(五)试拟一个分离环己基甲酸、三丁胺和苯酚的方法。解:(六)用化学方法区别下列各组化合物:(1)(A)(B)(C)(2)(A)(B)(C)(D)对甲基苯胺(E)N,N-二甲苯胺(3)(A)硝基苯(B)苯胺(C)N-甲基苯胺(D)N,N-二甲苯胺解:(1)
(2)(3)(七)试分别写出正丁胺、苯胺与下列化合物作用的反应式。(1)稀盐酸(2)稀硫酸(3)乙酸(4)稀溶液(5)乙酐(6)异丁酰氯(7)苯磺酰氯+(水溶液)(8)溴乙烷(9)过量的,然后加湿(10)(9)的产物加强热(11)(12)(即),0℃(13)邻苯二甲酸酐(14)氯乙酸钠解:1、与正丁胺的反应产物:(1)(2)(3)(4)(5)(6)(7)(8)(9)(10)(11)(12)
(13)(14)2、与苯胺的反应产物:(1)(2)(3)(4)(5)(6)(7)(8)(9)(10)(11)(12)(13)(14)(八)写出下列反应的最终产物:(1)(2)(3)(4)解:(1)(2)(3)(4)
(九)解释下列实验现象:解:在K2CO3存在的碱性条件下,氨基亲核性强,因此,氨基更容易被酰化。在HCl存在的酸性条件下,氨基形成-NH3+Cl-,无亲核性,此时羟基更容易被酰化。用K2CO3处理后,游离的氨基具有亲核性,可发生如下反应:(十)由指定原料合成下列化合物(其它试剂任选)。(1)由3-甲基丁醇分别制备:,和(2)由苯合成和(3)由和1,5-二溴戊烷合成解:(1)(TM)(TM)(TM)(2)(TM)
(TM)(3)(TM)(十一)由苯、甲苯或萘合成下列化合物(其它试剂任选)。(1) (2)(3) (4)(5)(6)(7)解:(1)
或者:(2)(3)
(4)(5)β-萘酚的制法:(6)
(7)(十二)2’,4,4’-三氯-2-羟基二苯醚,其分子式如下,商品名称“卫洁灵”,对病菌尤其是厌氧菌具有很强的杀伤力,被广泛用于牙膏、香皂等保洁用品中。试由苯为起始原料合成之。解:
或者:(十三)“心得安”具有抑制心脏收缩力、保护心脏及避免过渡兴奋的作用,是一种治疗心血管病的药物,其构造式如下。试由α-萘酚合成之(其它试剂任选)。
解:(十四)是合成紫外线吸收剂TinuvinP的中间体,请由邻硝基氯苯、甲苯为原料合成之(无机试剂任选)。解:(十五)脂肪族伯胺与亚硝酸钠、盐酸作用,通常的得到醇、烯、卤代烃的多种产物的混合物,合成上无实用价值,但氨基醇与亚硝酸作用可主要得到酮。例如:五元环六元环这种扩环反应在合成七~九元环状化合物时,特别有用。(1)这种扩环反应与何种重排反应相似?扩环反应的推动力是什么?
(1)试由环己酮合成环庚酮。解:(1)与频哪醇重排相似。扩环的动力是N2非常容易离去:(2)(十六)化合物(A)是一个胺,分子式为C7H9N。(A)与对甲苯磺酰氯在KOH溶液中作用,生成清亮的液体,酸化后得白色沉淀。当(A)用NaNO2和HCl在0~5℃处理后再与α-萘酚作用,生成一种深颜色的化合物(B)。(A)的IR谱表明在815cm-1处有一强的单峰。试推测(A)、(B)的构造式并写出各步反应式。解:(A)的构造式为:。IR谱在815cm-1有强峰表明有苯环上对位二取代。(B)的构造式为:相关的反应式如下:
(十七)化合物(A)的分子式为C15H17N,用对甲苯磺酰氯和KOH溶液处理后无明显变化。这个混合物酸化后得一澄清的溶液。(A)的PMR谱如下图所示。写出(A)的构造式。(十八)毒芹碱(coniine,C8H17N)是毒芹的有毒成分,毒芹碱的核磁共振谱图没有双峰。毒芹碱与2molCH3I反应,再与湿Ag2O反应,热解产生中间体C10H21N,后者进一步甲基化转变为氢氧化物,再热解生成三甲胺、1,5-辛二烯和1,4-辛二烯。试推测毒芹碱和中间体的结构。解:第十六章有机含硫、含磷含硅化合物(一)命名下列化合物:(1)(2)2,2,6-三甲基-4-庚硫醇2-硝基苯硫酚
(3)(4)异丙基环己基硫醚1,2-二甲硫基苯(5)(6)4-硝基-3-氯苯磺酸对硝基苯磺酰氯(7)(8)6-甲基-2-萘磺酸N-(4-氨基苯磺酰基)乙酰胺(二)选择正确的2-丁醇的对映体,由它通过使用对甲苯磺酸酯的方法制备(R)-2-丁硫醇,写出反应式。解:应选择(S)-2-丁醇制备(R)-2-丁硫醇:(三)给出下列反应的产物:(1)解:(2)解:(3)解:(4)解:(5)解:
(四)“芥子气”是一种高效的发泡剂,在第一次世界大战中被用于化学武器中。它可由环氧乙烷经下列步骤合成:写出各步反应式。解:(五)半胱氨酸是氨基酸的一种,其构造式如下所示:(1)它在生物氧化中生成胱氨酸(C6H12N2O4S2),试写出胱氨酸的构造式。(2)生物体中通过代谢作用,先将胱氨酸转化成半胱亚磺酸(C3H7NO4S),然后再转化成磺基丙氨酸(C3H7NO3S)。写出这些化合物的构造式。解:胱氨酸半胱亚磺酸磺基丙氨酸
(六)给出下列化合物A、B、C的构造式:(1)(2)解:(七)以2-甲基环己酮为原料,选择适当的硅试剂和其它试剂制备下列化合物:解:第十七章杂环化合物(一)写出下列化合物的构造式(1)α-呋喃甲醇(2)α,β'-二甲基噻吩(3)溴化N,N-二甲基四氢吡咯(4)2-甲基-5-乙烯基吡啶(5)2,5-二氢噻吩(6)N-甲基-2-乙基吡咯解:(1)(2)(3)(4)(5)(6)
(二)如何鉴别和提纯下列化合物?(1)区别萘、喹啉和8-羟基喹啉(2)区别吡啶和喹啉(3)除去混在苯中的少量噻吩(4)除去混在甲苯中的少量吡啶(5)除去混在吡啶中的少量六氢吡啶解:(1)8-羟基喹啉中苯环上连有—OH,易和FeCl3发生显色反应。喹啉环能被KMnO4氧化,使KMnO4褪色,萘不会发生上述反应;喹啉与萘的另一差别是喹啉有有碱性,可溶于稀酸中,而萘没有碱性,不溶解于稀酸中。(2)可从水溶液的差异区分。吡啶易溶于水,而喹啉难溶于水(喹啉较吡啶多一个疏水的苯环)。(3)噻吩的亲电取代反应比苯容易进行,在室温时同浓硫酸作用即可磺化,生成α-噻吩磺酸,后者能溶于浓硫酸;而苯在室温下较难磺化,利用该特性,可除去苯少量的噻吩。(4)①吡啶易溶于水,而甲苯不溶于水。②利用吡啶的碱性。向混合物中加入稀HCl,吡啶呈盐溶于盐酸中,与甲苯分层。(5)六氢吡啶的氮上有氢,可被磺酰化,而吡啶中的氮上无氢,不能被磺酰化。向混合物中加入对甲苯磺酰氯/NaOH溶液,六氢吡啶形成不溶于水的磺酰胺固体,经过滤可除去。(三)下列各杂环化合物哪些具有芳香性?在具有芳香性的杂环中,指出参与π体系的未共用电子对。解:有芳香性的是下列化合物,参与π体系的未共用电子对如结构式所示。(四)当用盐酸处理吡咯时,如果吡咯能生成正离子,它的结构将是怎样的?请用轨道表示。这个吡咯正离子是否具有芳香性?解:用盐酸处理吡咯时,如果吡咯能生成正离子,它的结构将应该是用轨道表示如下:由于π电子体系只有4个电子,不符合Huckle规则,所以它没有芳香性。(五)写出下列反应的主要产物。解:红色括号中为各小题所要求填充的内容。
(1)(2)(3)(4)(5)(6)(7)(8)(9)(10)(11)(12)
(13)(六)怎样从糠醛制备下列化合物?(1)(2)解:(1)(2)(七)杂环化合物C5H4O2经氧化后生成羧酸C5H4O3。把此羧酸的钠盐与碱石灰作用,转变为C4H4O,后者与金属钠不起作用,也不具有醛和酮的性质。原来的C5H4O2是什么?解:原来的C5H4O2是糠醛。(八)溴代丁二酸乙酯与吡啶作用生成不饱和的反丁烯二酸乙酯。吡啶在这里起什么作用?它比通常使用的氢氧化钾乙醇溶液有什么优点?解:这是一个E2反应。吡啶具有一定的碱性,它可以进攻溴原子的β-H,使溴代丁酸乙酯消除一分子HBr,形成稳定的产物。吡啶的优点是它的碱性小于氢氧化钾/乙醇溶液,不会使酯皂化,而KOH/乙醇则会使酯皂化。
(九)为什么吡啶进行亲电溴化反应时不用Lewis酸,例如FeBr3?解:吡啶与Lewis酸作用,生成吡啶-Lewis酸络合物,后者对亲电试剂很不敏感。(十)奎宁是一种生物碱,存在于南美洲的金鸡纳树皮中,一次也叫金鸡纳碱。奎宁是一种抗疟药,虽然多种抗疟药已人工合成,但奎宁仍被使用。奎宁的结构式如下:分子中有两个氮原子,哪一个碱性大些?解:
(十一)用浓硫酸在220~230℃时使喹啉磺化,得到喹啉磺酸(A)。把(A)与碱共熔,得到喹啉的羟基衍生物(B)。(B)与应用Skraup法从邻氨基苯酚制得的喹啉衍生物完全相同。(A)和(B)是什么?喹啉在进行亲电取代反应时,苯环活泼还是吡啶环活泼?解:(A)和(B)的结构分别为:(A)(B)进行亲电取代反应时,苯环比吡啶环活泼。因为苯环上电子云密度大于吡啶环。(十二)解释1-甲基异喹啉甲基上的质子的酸性比3-甲基异喹啉甲基上的质子的酸性强的原因。解:根据共振论,1-甲基异喹啉负离子的结构可表示如下:共振结构式(B)具有特殊的稳定性:负电荷分散到电负性较大的N上的同时,还保持了一个完整的苯环;另外,1-甲基异喹啉负离子有三个共振结构式保持了完整的苯环,使真实结构较稳定性。3-甲基异喹啉负离子的结构可表示如下:共振结构式(III)的稳定性不如(B):虽然负电荷分散到电负性较大的N上,但却不能保持完整的苯环。另外,在3-甲基异喹啉负离子中,只有两个共振结构式保持了完整的苯环,使得3-甲基异喹啉负离子的稳定性不如1-甲基异喹啉负离子。所以,1-甲基异喹啉甲基上质子的酸性比3-甲基异喹啉甲基上质子的酸性大。
(十三)喹啉和异喹啉的亲核取代反应主要分别发生在C2和C1上,为什么不分别以C4和C3为主?解:喹啉与亲核试剂反应时,进攻C2可形成更稳定的负离子中间体,使反应活化能降低,反应速度加快:异喹啉与亲核试剂反应时,进攻C1可形成更稳定的负离子中间体,使反应活化能降低,反应速度加快:(十四)2,3-吡啶二甲酸脱羧生成β-吡啶甲酸,为什么脱羧反应发生在α位?解:2,3-吡啶二甲酸是以偶极离子的形式存在的,而且N原子上的正电荷可以共振到2-、4-、6-位,但不能共振到3-位:其中正电荷带在2-位上的(II),有利于在2-上发生脱羧反应:
(十五)古液碱C8H15NO(A)是一种生物碱,存在于古柯植物中。它不溶于氢氧化钠水溶液,但溶于盐酸。它不与苯磺酰氯作用,但与苯肼作用生成相应的苯腙。(A)与NaOI作用生成黄色沉淀和一个羧酸C7H13NO2(B)。(B)与CrO3强烈氧化,转变成古液酸C6H11NO2,即N-甲基-2-吡咯烷甲酸。写出(A)和(B)的结构式。解:(A)和(B)的结构式分别为:(A)(B)第十八章类脂类习题(一)下列化合物均存在于天然植物中,可从天然精油中分离得到,很多亦可人工合成,是重要的萜类香料,用来配制香精。它们均有俗名,试用系统命名法命名之,并分别指出它们分别属于几萜(单萜、倍半萜、二萜等)类化合物。(1)(2)(3)
芳樟醇橙花叔醇香茅醇3,7-二甲基-1,6-辛二烯-3-醇3,7,11-三甲基-1,6,10-十二碳三烯-3-醇3,7-二甲基-6-辛烯醛单萜倍半萜单萜(4)(5)(6)β-甜橙醛薄荷酮d–葑酮2,6-二甲基-10-亚甲基2,6,11-十二碳三烯醛5-甲基-2-异丙基环己酮1,3,3-三甲基双环[2.2.1]庚-2-酮倍半萜单萜单萜(二)2-油酰-1,3-二硬脂酰甘油水解后将得到什么脂肪酸?什么三酰甘油水解后,能得到与2-油酰-1,3-二硬酯酰甘油水解后相同的脂肪酸?解:可见,1-油酰-2,3-二硬脂酰甘油水解后,能得到与2-油酰-1,3-二硬酯酰甘油水解后相同的脂肪酸。(三)油脂、蜡、磷脂在结构上的主要区别是什么?解:油脂是高级脂肪酸与甘油形成的酯;蜡是高级脂肪酸与高级脂肪醇形成的酯;磷脂是二羧酸甘油磷酸酯。(四)试用化学方法鉴别下列各组化合物:(1)α-蒎烯、冰片和樟脑(其结构见教材)(2)三油酸甘油酯和三硬脂酸甘油酯(3)鲸蜡和石蜡解:(1)α-蒎烯、冰片和樟脑的结构分别为:
∴(2)(3)鲸蜡为高级脂肪酸的高级脂肪醇酯,可以水解;石蜡是相对分子质量较高的饱和烃,不能水解。(五)下列化合物分别属于几萜类化合物?试用虚线分开其结构中的异戊二烯单位。(六)完成下列各反应式:(1)(2)
(3)(七)写出下列反应可能的反应机理:(1)解:(2)解:
(八)某单萜分子式为C10H18(A),催化加氢生成分子式为C10H22(B)。用高锰酸钾氧化(A),则得到乙酸、丙酮和4-氧代戊酸。试推测(A)和(B)的构造式。解:(九)11-十八碳烯酸是油酸的构造异构体,它可以通过下列一系列反应合成。试写出11-十八碳烯酸和各中间产物的结构式。解:第十九章碳水化合物(一)写出D-(+)-葡萄糖的对映体。α和β的δ-氧环式D-(+)-葡萄糖是否是对映体?为什么?解:D-(+)-葡萄糖的对映体为(L-(-)-葡萄糖)。α和β的δ-氧环式D-(+)-葡萄糖不是对映体,因为α和β的δ-氧环式D-(+)-葡萄糖之间不具有实物与镜像的关系。α和β的δ-氧环式D-(+)-葡萄糖分子中均含有五个手性碳原子,其中有四个手性碳的构型相同,只有苷原子的构型不同,所以它们互为差向异构体或异头物。
(一)写出下列各化合物立体异构体的投影式(开链式):(1)(2)(3)解:(1)(2)(3)(三)完成下列反应式:(1)(2)(3)内消旋酒石酸(4)旋光性丁四醇(5)
(6)(7)(8)(四)回答下列问题:(1)单糖是否均是固体?都溶于水?都不溶于有机溶剂?都有甜味?都有变旋光现象?答:一般一般情况下,是。(2)下列两个异构体分别与苯肼作用,产物是否相同?(A)(B)答:产物不同。(A)与苯肼作用只能生成腙;(B)与过量苯肼作用可生成脎。(3)糖苷既不与Fehling试剂作用,也不与Tollens试剂作用,且无变旋光现象,试解释之。答:糖苷是稳定的缩醛结构,不能形成氧环式和开链式的动态平衡,因而不能通过开链式发生差向异构化和逆羟醛缩合反应。所以,糖苷既不与Fehling试剂作用,也不与Tollens试剂作用。糖苷无变旋光现象的原因同样归结为它不能形成氧环式和开链式的动态平衡。(4)什么叫差向异构体?它与异头物有无区别?答:两个含有多个手性碳原子手性分子中,构造相同,只有一个手性碳的构型不同,而其它手性碳的构型均相同时,这两个旋光异构体互为差向异构体;两个末端手性碳的构型不同的差向异构体互为异头物。(5)酮糖和醛糖一样能与Tollens试剂或Fehling试剂反应,但酮不与溴水反应,为什么?答:因为酮糖可以在碱性介质中发生差向异构化反应及逆羟醛缩合反应,使原来的酮糖转化为醛糖,达到动态平衡,从而使原来的酮糖被氧化。而溴水不是碱性介质,不能使酮糖发生差向异构及逆羟醛缩合反应,所以溴水不能氧化酮糖。(6)写出D-吡喃甘露糖(A)和D-吡喃半乳糖(B)最稳定的构象式(α-或β-吡喃糖)。
答:(A)(B)(五)用化学方法区别下列各组化合物:(1)解:(2)葡萄和蔗糖解:或(3)麦芽糖和蔗糖解:或(4)蔗糖和淀粉解:
(六)有两个具有旋光性的丁醛糖(A)和(B),与苯肼作用生成相同的脎。用硝酸氧化,(A)和(B)都生成含有四个碳原子的二元酸,但前者有旋光性,后者无旋光性。试推测(A)和(B)的结构式。解:(A)的结构式为:或(B)的结构式为:或(七)化合物C5H10O5(A),与乙酐作用给出四乙酸酯,(A)用溴水氧化得到一个酸C5H10O6,(A)用碘化氢还原给出异戊烷。写出(A)可能的结构式。(提示:碘化氢能还原羟基或羰基成为烃基。)解:(A)可能的结构式有:(八)一种核酸用酸或碱水解后,生成D-戊醛糖(A)、磷酸以及若干嘌呤和嘧啶。用硝酸氧化(A),生成内消旋二元酸(B)。(A)用羟氨处理生成肟(C),后者用乙酐处理转变成氰醇的乙酸酯(D),(D)用稀硫酸水解给出丁醛糖(E),(E)用硝酸氧化得到内消旋二元酸(F)。写出(A)至(F)的结构式。[提示:]
解:(A)(B)(C)(D)(E)(F)(九)有三种D型己醛糖(A)、(B)和(C),其中(A)和(B)经催化加氢生成光学活性的相应醇;用苯肼处理,(A)和(B)生成不同的脎,而(B)和(C)生成相同的脎;但(B)和(C)经催化加氢生成的相应醇不同。试写出(A)、(B)和(C)的结构式并命名。解:或者:
(十)光学活性化合物C5H10O4(A),有三个物性碳原子,构型均匀为R。(A)与NH2OH生成肟。(A)用NaBH4处理得到光学活性化合物C5H12O4(B),(B)与乙酐反应得到四乙酸酯;在酸存在下,(A)与甲醇作用生成C6H12O4(C),(C)与HIO4反应得到C6H10O4(D),(D)经酸性水解得到乙二醛(OHC-CHO),D-α-羟基丙醛和甲醇。试写出(A)~(D)的结构式。解:第二十章氨基酸、蛋白质和核酸(一)命名下列化合物:(1)(2)甘氨酸铵亮氨酸(3)(4)赖氨酸谷氨酸(5)(6)γ-丁内酰胺半胱氨酸(二)写出下列氨基酸的投影式,并用R,S-标记法表示它们的构型。(1)L-天门冬氨酸(2)L-半胱氨酸(3)L-异亮氨酸
解:(1)(2)(3)S-天门冬氨酸S-半胱氨酸(2S,3S)-(三)用化学方法区别和。解:(四)指出下列氨基酸与过量HCl或NaOH溶液反应的产物。(1)Pro(2)Tyr(3)Ser(4)Asp解:(1)(2)(3)(4)
(三)说明为什么Lys的等电点为9.74,而Trp的等电点是5.88。(提示:考虑为什么杂环N在Trp中不是碱性的。)解:Lys的结构为:,其分子中有两个氨基,在水溶液均可电离,必须加入碱才能抑制氨基的电离,使Lys以偶极离子形式存在,而碱的加入必然会使溶液的pH升高,所以,Lys的等电点为9.74,高于中性氨基酸。Trp的结构为:,其分子中虽然有两个氮原子,但吡咯氮上的一对孤对电子参与了环状离域体系,碱性非常弱,在水溶液中并不电离,所以Trp的等电点是5.88,接近中性氨基酸。(六)按要求分别合成下列化合物(原料自选)。(1)应用丙二酸酯合成法合成苯丙氨酸[PhCH2CH(NH2)COOH]。分析:解:(2)应用Gabriel合成法和丙二酸酯合成法相结合的方法合成蛋氨酸[CH3SCH2CH2CH(NH2)COOH]。解:
(3)应用Strecker合成法合成蛋氨酸。解:(七)写出下列反应式中(A)~(I)的构造式。(1)(2)(3)
(八)一个氨基酸的衍生物C5H10O3N2(A)与NaOH水溶液共热放出氨,并生成C3H5(NH2)(COOH)2的钠盐,若把(A)进行Hofmann降解反应,则生成α,γ-二氨基丁酸,推测(A)的构造式,并写出反应式。解:A的结构为或(不稳定);相关的反应式如下:或:(九)DNA和RNA在结构上有什么主要差别?解:DNA和RNA在结构上有两点不同。(1)戊糖不同。DNA中的戊糖为脱氧核糖核酸,而RNA中的戊糖为核糖核酸;(2)碱基不同。DNA中的碱基有胞嘧啶、胸腺嘧啶、腺嘌呤、鸟嘌呤,而RNA中的碱基有胞嘧啶、尿嘧啶、腺嘌呤、鸟嘌呤。'
您可能关注的文档
- 大气污染控制工程课后题答案.doc
- 大气污染控制工程郝吉明第三版课后答案郝吉明.doc
- 大物(第四版)-祝之光-课后习题解答.doc
- 大物》第二版 毛峰 ch12课后习题及答案.pdf
- 大连交通大学《数据库原理及应用》刘金玲版(56课时)习题参考答案.doc
- 大连理工大学《工程制图》习题集答案.pdf
- 大连理工大学《汽车构造》试题及答案(共八套).doc
- 天大无机化学_课后习题参考答案.doc
- 天津大学《反应工程》(第二版)课后习题答案(2014年修改).doc
- 天津大学高等教育出版社第五版《物理化学》课后习题答案第七章.doc
- 天津大学高等教育出版社第五版《物理化学》课后习题答案第五章.doc
- 天津市领导干部网上学法用法课后习题(含答案).docx
- 央企班组长作业题及答案.docx
- 奥本海姆《信号与系统(第二版)》习题参考答案.doc
- 奥本海默《信号与系统》第二版习题答案(英文版)(上).pdf
- 奥鹏《平面数字图像设计》练习题 练习题参考答案.doc
- 妇产科护理学试题库集(各章).doc
- 姚启钧编著的《光学教程》(第四版)课后习题答案.doc
相关文档
- 施工规范CECS140-2002给水排水工程埋地管芯缠丝预应力混凝土管和预应力钢筒混凝土管管道结构设计规程
- 施工规范CECS141-2002给水排水工程埋地钢管管道结构设计规程
- 施工规范CECS142-2002给水排水工程埋地铸铁管管道结构设计规程
- 施工规范CECS143-2002给水排水工程埋地预制混凝土圆形管管道结构设计规程
- 施工规范CECS145-2002给水排水工程埋地矩形管管道结构设计规程
- 施工规范CECS190-2005给水排水工程埋地玻璃纤维增强塑料夹砂管管道结构设计规程
- cecs 140:2002 给水排水工程埋地管芯缠丝预应力混凝土管和预应力钢筒混凝土管管道结构设计规程(含条文说明)
- cecs 141:2002 给水排水工程埋地钢管管道结构设计规程 条文说明
- cecs 140:2002 给水排水工程埋地管芯缠丝预应力混凝土管和预应力钢筒混凝土管管道结构设计规程 条文说明
- cecs 142:2002 给水排水工程埋地铸铁管管道结构设计规程 条文说明