- 659.75 KB
- 2022-04-22 13:49:25 发布
- 1、本文档共5页,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报电话:19940600175。
'中国科技论文在线http://www.paper.edu.cn#α7-nAChR激动剂的合成以及成药性评价**谢冰雪,薛雨,马小卓,张亮仁(北京大学药学院,北京100191)5摘要:目的:α7-nAChR激动剂的合成路线研究以及化合物X1的成药性评价。方法:通过Suziki、Baylis-Hillman、热环化反应等合成目标化合物X1。通过急性毒性试验、豚鼠心电影响试验和药物代谢动力学试验评价化合物的成药性。结果:化合物X1LD50大于2000mg/kg,阳性对照物EVP-6124LD50为1882.7mg/kg,属于低毒化合物。豚鼠心电影响结果10显示:化合物X1在10、20mg/kg时对麻醉豚鼠的QT间期及QTc间期均延长超过了10%;EVP-6124在10mg/kg时仍未发生显著的QT间期延长。化合物X1吸收排泄均较慢,生物利用度53.2%,可以达到脑组织并在脑内蓄积。结论:化合物X1毒性小,吸收排泄慢,可能具有潜在的心脏毒性,可作为候选化合物,为临床研究提供重要数据。关键词:药物化学;精神分裂症;α7-nAChR激动剂;成药性评价15中图分类号:R914.4Synthesisofα7-nAChRagonistsdrugsanddrugevaluationXIEBingxue,XUEYu,MAXiaozhuo,ZHANGLiangren(SchoolofPharmacueticalSciences,PekingUniversityHealthScienceCenter,Beijing100191)20Abstract:Objective:Synthesisofα7-nAChRagonistsanddrugevaluation.Method:CompoundX1wassynthesizedwithSuziki,Baylis-hillmanreactionandet.al.Evaluationondrugabilitymainlyincludedacutetoxicitytest,guinea-pigscardio-toxicitytestandpharmacokineticstudy.Results:acutetoxicitytestsshowedthatLD50ofcompoundX1wasmorethan2000mg/kg,whileEVP-6124was1882.7mg/kg,bothofwhichblongtolowtoxicitycompounds.Guinea-pigscardio-toxicitytest25illuminatedthatcompoundX1appearcardio-toxicity.WhendoseofcompoundX1was10,20mg/kg,theQTandQTcinanesthetizedguineapigswereprolongedbymorethan10%.While,EVP-612410mg/kgstilldiden’toccursignificantprolongationinQTandQTc.AbsorptionandexcretionofcompoundX1wasslow.X1canpassthebloodbrainbarrierandaccumulateinbraintissue.Conclusion:compoundX1canbeacandidatewithlowacutetoxicityandgoodpharmacokinetic30properties.However,compoundX1maightbeofpotentialcardio-toxicity.Keywords:Medicinalchemistry;Schizophrenia;α7-nAChRagonists;medicinalevaluation350引言[1][2]α7-nAChR是由5个α7单体组成的同源性五聚体。编码α7单体的基因位于染色体[3][4][5]15q14,称为CHRNA7。人类α7单体大约在50kD,由502个氨基酸组成。同源性α7-nAChR与配体结合的结合位点在两个单体的交界面上(见图1)。40基金项目:国家自然科学基金项目(81373272)作者简介:谢冰雪(1990-),女,a7烟酰胺乙酰胆碱受体激动剂的合成以及成药性评价通信联系人:张亮仁(1963-),博导,主要研究方向:核苷、核苷酸及寡核苷酸的设计与合成.E-mail:.E-mail:liangren@bjmu.edu.cn-1-
中国科技论文在线http://www.paper.edu.cn图1α7-nAChR结构示意图Fig.1Simulationstructureofα7-nAChR研究认为烟碱型乙酰胆碱受体是精神分裂症的一个重要靶点,α7-nAChR与认知密切相[6][7]关。α7-nAChR主要分布在海马区、皮层区和皮下边缘区,这些区域与认知功能紧密关联;45精神分裂症患者中吸烟者的比例比正常人高,烟草中的尼古丁持续刺激α7-nAChR,可导致[8]α7-nAChR敏感度降低;尸检结果显示精神分裂症患者脑内海马区等部位的α7-nAChR数[9][10][11]目减少;病理研究结果显示,尼古丁等α7-nAChR激动剂可以改善认知障碍问题。目前,基于α7-nAChR在治疗精神分裂症中认知障碍的药物研发已经较为深入,其中,[12][13]EVP-6124已经进入临床Ⅲ期试验。本研究在本课题组前期工作基础上,选取化合物50X1用于进一步合成以及成药性评价。1实验材料与仪器1.1合成实验材料与仪器6-溴吡啶-2-甲醛(北京偶合科技有限公司);丙烯酸甲酯(北京偶合科技有限公司);DABCO(阿拉丁);乙酸酐(北京化工厂);HATU(北京偶合科技有限公司);DIPEA55(北京偶合科技有限公司);Pb(OAc)2(阿拉丁);苯硼酸(北京偶合科技有限公司);R-3-氨基奎宁(北京偶合科技有限公司)BrukerAvanceIII400型核磁共振仪;QSTAR液质联用仪;BrukerApexIVFTMS型傅立叶离子回旋变换质谱仪;薄层层析硅胶板(上海上邦实业有限公司);柱层析硅胶(200-300目,上海上邦实业有限公司)。601.2动物实验材料及实验器材KM小鼠(由徐州医学院实验动物中心提供);豚鼠(徐州医学院提供);环糊精、氟哌啶醇、乌拉坦(sigma公司产品);乙腈(色谱纯,MerckCompany,Germany),甲醇(色谱纯,MerckCompany,Germany),甲酸(TEDIACompany,USA)。Powerlab生理记录仪采(南京美易科技有限公司);CMS-2010EV高效液相色谱-质谱联65用仪(岛津公司);LC-20AD泵;CBM-20A系统控制器;SIL-20AC自动进样器;CTO-20A柱温箱;Milli-QGradientA10超纯水仪(MilliporeInc,USA)。-2-
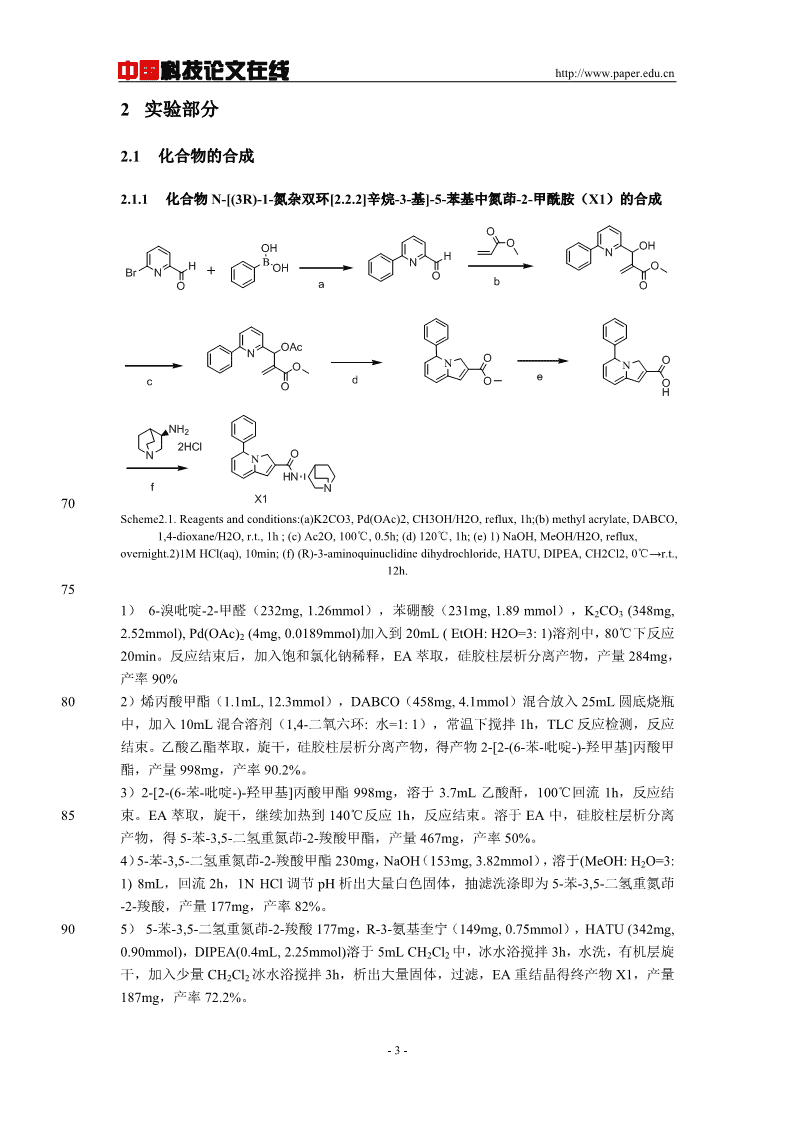
中国科技论文在线http://www.paper.edu.cn2实验部分2.1化合物的合成2.1.1化合物N-[(3R)-1-氮杂双环[2.2.2]辛烷-3-基]-5-苯基中氮茚-2-甲酰胺(X1)的合成OOHOOHHNHBOHNOBrNOOabOOAcNNONOOecOdOOHNH22HClNNOHNfN70X1Scheme2.1.Reagentsandconditions:(a)K2CO3,Pd(OAc)2,CH3OH/H2O,reflux,1h;(b)methylacrylate,DABCO,1,4-dioxane/H2O,r.t.,1h;(c)Ac2O,100℃,0.5h;(d)120℃,1h;(e)1)NaOH,MeOH/H2O,reflux,overnight.2)1MHCl(aq),10min;(f)(R)-3-aminoquinuclidinedihydrochloride,HATU,DIPEA,CH2Cl2,0℃→r.t.,12h.751)6-溴吡啶-2-甲醛(232mg,1.26mmol),苯硼酸(231mg,1.89mmol),K2CO3(348mg,2.52mmol),Pd(OAc)2(4mg,0.0189mmol)加入到20mL(EtOH:H2O=3:1)溶剂中,80℃下反应20min。反应结束后,加入饱和氯化钠稀释,EA萃取,硅胶柱层析分离产物,产量284mg,产率90%802)烯丙酸甲酯(1.1mL,12.3mmol),DABCO(458mg,4.1mmol)混合放入25mL圆底烧瓶中,加入10mL混合溶剂(1,4-二氧六环:水=1:1),常温下搅拌1h,TLC反应检测,反应结束。乙酸乙酯萃取,旋干,硅胶柱层析分离产物,得产物2-[2-(6-苯-吡啶-)-羟甲基]丙酸甲酯,产量998mg,产率90.2%。3)2-[2-(6-苯-吡啶-)-羟甲基]丙酸甲酯998mg,溶于3.7mL乙酸酐,100℃回流1h,反应结85束。EA萃取,旋干,继续加热到140℃反应1h,反应结束。溶于EA中,硅胶柱层析分离产物,得5-苯-3,5-二氢重氮茚-2-羧酸甲酯,产量467mg,产率50%。4)5-苯-3,5-二氢重氮茚-2-羧酸甲酯230mg,NaOH(153mg,3.82mmol),溶于(MeOH:H2O=3:1)8mL,回流2h,1NHCl调节pH析出大量白色固体,抽滤洗涤即为5-苯-3,5-二氢重氮茚-2-羧酸,产量177mg,产率82%。905)5-苯-3,5-二氢重氮茚-2-羧酸177mg,R-3-氨基奎宁(149mg,0.75mmol),HATU(342mg,0.90mmol),DIPEA(0.4mL,2.25mmol)溶于5mLCH2Cl2中,冰水浴搅拌3h,水洗,有机层旋干,加入少量CH2Cl2冰水浴搅拌3h,析出大量固体,过滤,EA重结晶得终产物X1,产量187mg,产率72.2%。-3-
中国科技论文在线http://www.paper.edu.cn6)结构鉴定(附件1)195HNMR400MHz,DMSO-d6)δ8.33(d,J=6.1Hz,1H),7.84(d,J=1.0Hz,1H),7.68(dd,J=8.0,1.4Hz,2H),7.65-7.54(m,3H),7.51(d,J=9.0Hz,1H),7.03(d,J=1.5Hz,1H),6.88(dd,J=9.0,6.7Hz,1H),6.60(dd,J=6.6,0.9Hz,1H),4.20(d,J=4.9Hz,1H),3.50(t,J=11.5Hz,1H),3.27-3.15(m,1H),3.07(dd,J=18.0,11.5Hz,4H),2.09(d,J=2.7Hz,1H),1.98(dd,J=15.8,10.9Hz,1H),1.81(dd,J=7.6,5.3Hz,2H),1.61(t,J=12.1Hz,1H);13CNMR(101MHz,100DMSO-d6)δ163.8,136.6,134.2,133.2,129.6,129.3,128.3,123.4,119.0,118.8,112.6,111.8,99.8,51.4,45.8,45.3,44.8,24.6,2.2,17.7;HRMS(ESI-TOF+)m/zCalcd.ForC22H23N3O+[M+1]:346.1914;found346.1919.2.1.2对照品N-[(3R)-1-氮杂双环[2.2.2]辛烷-3-基]-7-氯苯并[b]噻吩-2-甲酰胺盐酸盐(EVP-6124盐酸盐)的合成NH2ClOKOH2HClOHSSONClOHaClOHHATU,DIPEACH2Cl2bClClSOEtOH/HClSOHClHNcHNN105NScheme2.2SynthesisrouteofEVP-6124.Reagentsandconditions:(a)1)HSCH2CO2H,KOH,H2O,reflux,2h;2)HCl;(b)(R)-3-aminoquinuclidinedihydrochloride,HATU,DIPEA,DMF,0℃→r.t.,overnight.1)1.34g(1.0mL,14.4mmol)巯基乙酸,1.62g(28.8mmol,2.0eq.)氢氧化钾溶于30mL110水中,加入2.50g(14.4mmol,1.0eq.)2,3-二氯苯甲醛,加热回流反应2天,TLC监测反应进程。反应完成后冷却到室温,加入20mL水,并用乙醚洗涤。取水相,加入足量的浓盐酸酸化,有淡黄色固体析出,抽滤,水洗,干燥得淡黄色固体产物(7-氯-1-苯并噻吩-2-甲酸)1.47g,收率:48.2%。2)117mg(0.55mmol,1.1eq.)上步的产物,100mg(0.5mmol,1.0eq.)3-(3R)-氨基奎宁二盐115酸盐,387mg(0.53mL,3.0mmol,6.0eq.)DIPEA加入到10mLDMF中,冷却到0℃后缓慢加入380mg(1.0mmol,2.0eq.)HATU,自然升至室温,室温反应12h。完全反应后,旋转蒸发除去溶剂,残渣溶于二氯甲烷,依次用饱和碳酸氢钠溶液和饱和食盐水洗,无水硫酸钠干燥,减压浓缩,硅胶柱层析(DCM/CH3OH/浓氨水=90/10/2)得油状化合物。3)向油状物中加入3mL3M的氯化氢的乙醇溶液,室温反应过夜后旋干,加入1mL甲醇、1202mL异丙醇和足量的无水乙醚,直到有浑浊出现并且不再增加。抽滤、干燥得到类白色固体144mg,收率:89.2%。4)结构鉴定(附件2)1HNMR(400MHz,DMSO-d6)δ10.45(s,1H),9.33(d,J=6.0Hz,1H),8.53(s,1H),7.96(d,J=7.8Hz,1H),7.72-7.41(m,2H),4.34(d,J=5.6Hz,1H),3.63(t,J=11.5Hz,1H),3.52125-3.33(m,5H),3.31-3.08(m,3H),2.30-2.06(m,2H),1.91(dd,J=7.8,5.4Hz,2H),1.73(t,J=12.0Hz,1H);13CNMR(101MHz,DMSO-d6)δ161.4,140.5,140.2,139.0,126.7,126.6,126.5,+125.8,124.3,50.3,45.4,45.0,24.3,21.3,17.1;MS(ESI-TOF+)m/z321.3[M+H].-4-
中国科技论文在线http://www.paper.edu.cn2.2急性毒性试验2.2.1限度实验130取KM小鼠,雌雄各半,随机分为3组,每组5只,分别为化合物X1以及阳性对照药EVP-61242000mg/kg组和溶剂组,0.2mL/10g灌胃给药。观察动物7日内的死亡情况。2.2.2半数致死量试验取KM小鼠,雌雄各半,随机分为6组,每组6只,分别为1200、1500、1875、2344、2930mg/kg和溶剂组,按0.2mL/10g灌胃给药,观察动物3日内的死亡情况。1352.3优选化合物对豚鼠心电的影响2.3.1实验方法及步骤(1)给药体积与途径:1mL/kg,颈静脉给药。(2)配药:将药物溶解于20%β-环糊精。(3)分组:豚鼠随机分为阴性对照组(20%β-环糊精),阳性对照组(氟哌啶醇)、化合140物高、中、低剂量组,每组6只,雌雄各半。(4)手术过程:豚鼠以20%的乌拉坦(0.75mL/100g,ip)麻醉,分离气管和颈静脉,对豚鼠颈静脉置管。气管剪开,止血。术后将麻醉豚鼠保温(保持肛温38±0.5℃)。按心电图标准II导联安置心电电极,Powerlab多通道记录仪记录,同步监测麻醉豚鼠的心电图。(5)给药方法:注射泵推注药物10min。145(6)心电测定:测定每次给药前及给药后5、10、15、20、25、30min时的豚鼠心电图各1min。2.4血浆药物代谢动力学以及通过血脑屏障实验2.4.1血浆药物代谢动力学研究1)色谱和质谱条件150色谱条件:色谱柱为AgilentZorbaxBPC18柱(150mm×4.6mm,5μm,美国Agilent公司);预柱:C18保护柱(4mm×3.0mm,5μm,美国X1omenex公司);流动相:乙腈-30mM醋酸铵水溶液(含0.1%甲酸)=35:65(v/v);流速:1.0mL•min-1;柱温:30℃。质谱条件:离子化方式:电喷雾离子化(ESI);温度350℃;选择性离子监测(selected-ionmonitoring,SIM),正离子检测;干燥器温度:350℃;碎裂电压:75V;雾化器压力(psig):15535;干燥气流速12.0L/min;高度真空1.3E-005Torr。检测离子为:X1[M+H]+(质荷比,m/z):346.0。2)血浆样品预处理取血浆样品180μL,置于2.0mL离心管中,加入乙腈溶液20μL,混匀,再加入乙腈600μL,涡旋3min,4℃下离心(12,000rpm)10min,取上清液于50℃氮气流下吹干,将吹干样品用160150μL乙腈复溶,涡旋混匀,4℃下离心(12,000rpm)5min,取上清液50μL进行LC-MS-5-
中国科技论文在线http://www.paper.edu.cn分析。3)化合物在大鼠体内的药动学研究尾静脉组:SD大鼠12只,雄性。试验前禁食12h,自由饮水,尾静脉注射给予X1-11.0mg•kgPEG400生理盐水溶液,分别于给药前和给药后0.083、0.25、0.5、1、2、3、5、-11657、9和12h于眼底静脉丛采血0.3mL,置离心管中,3500r•min离心10min,分离血浆,冷冻保存在-20℃冰箱中待测。-1灌胃组:各取SD大鼠12只,雄性。试验前禁食12h,自由饮水,灌胃给予3.0mg•kg和30mg•kg-1X1水溶液,分别于给药前和给药后0.167、0.5、1、2、3、5、7、9、12和-124h于眼底静脉丛采血0.3mL,置离心管中,3500r•min离心10min,分离血浆,冷冻保存170在-20℃冰箱中待测。2.4.2化合物在大鼠体内的血脑屏障透过性试验-1取SD大鼠9只,雄性,随机分成3组。试验前禁食12h,自由饮水,灌胃给予30mg•kgX1水溶液,分别于给药前和给药后2、3、7h于眼底静脉丛采血0.3mL后立即腹主动脉放血处死,取脑,用生理盐水洗净残留血迹,滤纸吸干,称重,加入适量(1:1)生理盐水进-1175行匀浆,制成脑组织匀浆液,冷藏备用。将血液样品置于离心管中,4000r•min离心10min,分离血浆,冷冻保存在-20℃冰箱中待测。2.5数据统计处理LD50的计算釆用Bliss法;LD50与曲线斜率的比较采用多重t检验。全部实验数据以Mean±SD表示,统计学差异采用配对t检验,P<0.05为差异具有统180计学意义,P<0.01为显著性差异,当心电参数给药前后的变化率≧10%时,认为药物对该心电参数具有明显的影响。应用DAS2.1.1程序计算主要药动学参数。Tmax和Cmax采用实测值,采用梯形法计算AUC0-t值和AUC0-∞值,以半对数作图法,由消除相末端浓度点计算t1/2。若在达峰前用零表示,达峰后以n.d.(notdetectable)表示,均用零值计算。1853实验结果与讨论3.1化合物X1合成结果与讨论[14]Suziki反应,使用Pd(OAc)2作为催化剂、K2CO3提供碱性,甲醇和水作溶剂,回流反应1h,收率可达90%。Baylis–Hillman反应,醛基部分与丙烯酸甲酯的投料比为1:3,催化剂为1.0eq.DABCO,190溶剂为1,4-二氧六环和水(1:1),室温反应1h。此方法所得产物的收率普遍较高,均大于80%。TLC监测反应进程,底物(醛基部分)可以完全反应。Baylis–Hillman反应机理见图2-6-
中国科技论文在线http://www.paper.edu.cn图2Baylis–Hillman反应机理195Fig.2Baylis–HillmanReactionMechanism3.2急性毒性试验实验结果及讨论3.2.1限度实验结果在限度实验中,化合物X1组小鼠在灌胃给予2000mg/kg后,观察7天,在前两天有两只小鼠死亡,EVP-6124共死亡三只。2003.2.2EVP-6124半数致死量试验根据限度实验,可知EVP-6124在2000mg/kg时共死亡3只,因此选择空白组和5个剂量组进行实验(表1)。表1EVP-6124半数致死量试验测定动物死亡情况Tab.150%LethalDoseTestforEVP-6124剂量/(mg/kg)动物数/(只)死亡数/(只)空白60120060150061187564234464293066205Bliss方法测定化合物EVP-6124结果如下:回归方程y(Probit)=-26.908+9.7435Log(D)半数致死量LD50=1882.7mg/kg3.3优选化合物对豚鼠心电的影响本次实验发现,20%β-环糊精溶媒对照组对麻醉豚鼠的QTc间期没有明显影响,210EVP-6124对麻醉豚鼠的QT间期及QTc间期均没有明显延长的影响,相反还缩短了豚鼠QTc间期。氟哌啶醇是临床上易引起病人QT延长风险的抗精神分裂症药物,在本次豚鼠心电实验中也发现其剂量在1、3mg/kg时对QT间期及QTc间期均延长超过了10%,具有剂量关系。化合物X1剂量在10、20mg/kg时对麻醉豚鼠的QT间期及QTc间期均延长超过了10%,-7-
中国科技论文在线http://www.paper.edu.cn215具有剂量关系。不同药物给药后对麻醉豚鼠QT及QTc-B等参数的影响的平均值见表2。(+表示给药后提高,-表示给药后降低;当变化率≧10%时说明参数有明显改变)表2给药后对麻醉豚鼠QT及QTc-B等参数的影响平均结果Tab.2QTandQTc-BofAnaestheticGuineaafterDrugInjection与基础值相比,给药后相应参数平均变化率(%)剂量心率PR间QT间QTc-B药物QRSP波R波T波/mg/kg/(次期期间期/(ms)/(mv)/(mv)/(mv)/min)/(ms)/(ms)/(ms)20%-0.81.01.20.10.0-3.2-0.7-4.8溶媒组20%-7.7-1.713.710.35.3-12.9-2.828.520%-1.3-1.73.71.20.0-12.5-5.7950.3-5.5-3.0-4.711.57.5-5.60.397.7氟哌啶醇1-15.17.6-8.825.815.2-9.1-1.2217.73-22.115.7-1.731.216.3-4.6-5.4379.55-2.40.813.71.71.36.013.87.2X1100.325.572.319.813.4-6.7-40.1295.520-16.333.092.831.422.1-7.6-50.0396.92.55.90.0-2.5-6.5-3.3-3.5-5.457.4EVP-612454.91.1-0.7-6.6-4.6-13.1-8.69.6104.60.13.7-4.1-2.0-15.6-7.56.03.4化合物X1药代动力学实验结果与讨论2203.4.1标准曲线以及线性范围以药物浓度(ng/mL)为横坐标,峰面积为纵坐标,进行线性回归,得到标准曲线方程为:y=723.41x+23405,r=0.9978。结果表明,X1血药浓度在2-2000ng/mL范围内,峰面积与血药浓度具有良好的线性关系(图3)225图3LC-MS法测定大鼠血浆中化合物X1含量的标准曲线-8-
中国科技论文在线http://www.paper.edu.cnFig.3StandardCurveofCompoundX1UtilizingLC-MS3.4.2化合物X1血浆样品测定结果230尾静脉组和低、高剂量灌胃组大鼠血浆药物浓度-时间曲线见图4。图4鼠尾静脉注射给予1.0mg/kgX1、灌胃给予3.0mg/kgX1、灌胃给予30mg/kgX1后的血浆药物浓度-时间曲线235Fig.4Concentration-TimeCurveof1.0mg/kgX13.0mg/KgX1forInjection、3.0mg/kgX1And30mg/kgX1ByGavage3.4.3X1药动学参数将尾静脉组和高低剂量灌胃组所测得的血药浓度-时间数据代入DAS2.1.1程序计算得到的主要药动学参数结果见表3。240表3尾静脉组和高低剂量灌胃组的主要药动学参数Tab.3PharmacokineticParametersofInjectionGroupandGavageGroupsNo.t1/2/Tmax/Cmax/AUC0-t/AUC0-∞/Cl/V/F/(h)(h)(μg·L-1)(μg·h·L-1)(μg·h·L-1)(L·(h·kg)-1)(L·kg-1)%尾静1.4±0.50.08394.4±5296.1±52.8111.1±609±5.724.9±1.4脉灌胃-4.6±1.45.5±2.3443.42±46151.9±121177.4±14522.8±9.728.2±3.653.2低灌胃-3.58±0.55.33±2.33425±91.44269±7444336±7377.1±1.3336.7±8.7高由药动学参数可以看出灌胃组的高低剂量组之间t1/2和Cmax与剂量呈正相关。由t1/2和Cl可知化合物在大鼠体内清除较快。灌胃高剂量组由于代谢饱和导致其代谢相对缓245慢,即AUC0-∞较大,从而导致其生物利用度无法计算。相反,灌胃组低剂量由于代谢较-9-
中国科技论文在线http://www.paper.edu.cn为迅速,使得其AUC0-∞较小,生物利用度为53.2%。3.4.4化合物大鼠血脑透过性实验结果大鼠灌胃给予30mg/kg的化合物X1后,不同时刻脑组织和血浆中化合物X1的含量结果见表4所示。250表4不同时刻脑组织和血浆中化合物X1的含量(ng/mL,n=3)Tab.4ConcentrationsofX1inBrainandBlood脑组织/(ng/mL)血浆/(ng/mL)Time/(h)237237130.9855.53233.65677.40444.671324.63212.5454.3797.23112.52510.92308.03363.2782.4884.101815.831012.91613.96平均值35.6064.12138.33868.58656.17748.87标准差25.6815.9182.81867.60310.72521.55由表中数据结果可以看出,化合物X1在脑组织中和血浆中的趋势是相同的,化合物可以透过血脑屏障到达脑中。由化合物X1在脑组织中含量变化趋势可以得出其在脑组织中有255蓄积。4结论本论文基于α7-nAChR激动剂进行合成,并进行了成药性评价。对优选化合物X1进行急性毒性试验,并与临床Ⅲ药物EVP-6124进行比较。实验结果显示X1LD50大于2000mg/kg,EVP-6124为1882.7mg/kg,安全级别均为低毒。通过观察动物中毒表现,小鼠多数260表现出萎靡的状态,表明药物作用可能具有神经抑制的作用。豚鼠心电的影响实验结果显示,X1对豚鼠心电具有潜在的心脏毒性,而EVP-6124安全性高,10mg/kg仍未对QT间期有明显的影响。该化合物吸收慢,清除也较慢,生物利用度高。3mg/kgX1在大鼠体内的绝对生物利用度为53.2%。化合物X1能穿过血脑屏障到达脑组织且在脑组织中有蓄积。本试验结果明确了化合物X1在大鼠体内的药动学行为,为化合物X1的成药性评价提供了依据。265附件1113X1的HNMR,CNMR-10-
中国科技论文在线http://www.paper.edu.cn270附件2113EVP-6124的HNMR,CNMR-11-
中国科技论文在线http://www.paper.edu.cn275[参考文献](References)[1]JensenAA,FrølundB,LiljeforsT,etal.Neuronalnicotinicacetylcholinereceptors:structuralrevelations,targetidentifications,andtherapeuticinspirations[J].JMedChem,2005,48(15):4705-4745.[2]HurstR,RollemaH,BertrandD.Nicotinicacetylcholinereceptors:frombasicsciencetotherapeutics[J].PharmacolTher,2013,137(1):22-54.280[3]GaultJ,RobinsonM,BergerR,etal.Genomicorganizationandpartialduplicationofthehumanα7neuronalnicotinicacetylcholinereceptorgene(CHRNA7)[J].Genomics,1998,52(2):173-185.-12-
中国科技论文在线http://www.paper.edu.cn[4]CanastarA,LogelJ,GrawS,etal.Promotermethylationandtissue-specifictranscriptionoftheα7nicotinicreceptorgene,CHRNA7[J].JMolNeurosci,2012,47(2):389-400.[5]CeliePH.NicotineandcarbamylcholinebindingtonicotinicacetylcholinereceptorsasstudiedinAChBP285crystalstructures[J].Neuron,2004:41(6),907-914.[6]PicciottoMR,CaldaroneBJ,BrunzellDH,etal.Neuronalnicotinicacetyl-cholinereceptorsubunitknockoutmice:physiologicalandbehavioralphenotypesandpossibleclinicalimplications.PharmacolTher[J],2001,92(2-3):89-108.[7]GottiC,ZoliM,ClementiF,etal.Brainnicotinicacetylcholinereceptors:nativesubtypesandtheir290relevance[J].TrendsPharmacolSci,2006,27(9):482-491.[8]LohrJB,FlynnK.Smokingandschizophrenia.SchizophrRes,1992,8(2):93-102.[9]FreedmanR,HallM,AdlerLE,etal.Evidenceinpostmortembraintissuefordecreasednumbersofhippocampalnicotinicreceptorsinschizophrenia[J].BiolPsychiatry,1995,38(1):22-33.[10]SmithRC,WarnerCJ,MatuteM,etal.Effectsofnicotinenasalsprayoncognitivefunctionin295schizophrenia[J].Neuropsychopharmacology,2005,31(3):637-643.[11]HeishmanSJ,KleykampBA,SingletonEG.Meta-analysisoftheacuteeffectsofnicotineandsmokingonhumanperformance[J].Psychopharmacologia,2010,210(4):453-469.[12]PrickaertsJ,ChesworthR.EVP-6124,anovelandselectivealpha7nicotinicacetylcholinereceptorpartialagonist,improvesmemoryperformancebypotentiatingtheacetylcholineresponseofalpha7nicotinic300acetylcholinereceptors[J].Neuropharma-cology,2012,62(2):1099-1110.[13]马小卓.以α7-nAChR为靶点的抗精神分裂症化合物的设计、合成及活性研究[D].北京:北京大学,2014.MaXiaozhuo.Design,synthesisandevalutionofα7-nAChRagonistforschizophrenia.Beijing:PekingUniversity,2014.[14]LiuC,HanN,SongXX,etal.Ageneralandhighlyefficientmethodfortheconstructionofaryl-substituted305N-heteroarenes[J].EuropeanJOrgChem,2010:5548–5551.-13-'
您可能关注的文档
- 最新应届毕业生人事部实习报告范文篇四.doc
- 最新应届毕业生人事部行政工作实习报告范文篇七.doc
- 最新应届毕业生人事部行政工作实习报告范文篇八.doc
- 最新班级管理策略学习反思心得体会.doc
- 最新课堂上教师必须规避的四种现象学习体会.doc
- 证券公司大学生实习报告范文模板(一).doc
- 证券公司大学生实习报告范文模板(三).doc
- 证券公司大学生实习报告范文模板(二).doc
- 通用委托书模板格式及范文(新).doc
- 优化的地表气流及气象数据可视化方法.pdf
- 养老金融影响消费支出的区域差异性研究.pdf
- 利用匹配策略扩展卷积神经网络的分面标注方法.pdf
- 双变量对称式液压变压器的压力特性分析.pdf
- 基于农地综合价值的土地增值收益分配研究.pdf
- 基于在线品牌社区的社会影响对顾客参与活跃度的作用研究.pdf
- 基于宽禁带半导体GaN的高温电子电路研究.pdf
- 基于鸽子群优化算法的四旋翼无人直升机姿态控制.pdf
- 基于齿轮-五杆机构的液动仿袋鼠跳跃机器人腿部机构设计与增速特性研究.pdf
相关文档
- 施工规范CECS140-2002给水排水工程埋地管芯缠丝预应力混凝土管和预应力钢筒混凝土管管道结构设计规程
- 施工规范CECS141-2002给水排水工程埋地钢管管道结构设计规程
- 施工规范CECS142-2002给水排水工程埋地铸铁管管道结构设计规程
- 施工规范CECS143-2002给水排水工程埋地预制混凝土圆形管管道结构设计规程
- 施工规范CECS145-2002给水排水工程埋地矩形管管道结构设计规程
- 施工规范CECS190-2005给水排水工程埋地玻璃纤维增强塑料夹砂管管道结构设计规程
- cecs 140:2002 给水排水工程埋地管芯缠丝预应力混凝土管和预应力钢筒混凝土管管道结构设计规程(含条文说明)
- cecs 141:2002 给水排水工程埋地钢管管道结构设计规程 条文说明
- cecs 140:2002 给水排水工程埋地管芯缠丝预应力混凝土管和预应力钢筒混凝土管管道结构设计规程 条文说明
- cecs 142:2002 给水排水工程埋地铸铁管管道结构设计规程 条文说明