- 452.22 KB
- 2022-04-22 13:45:06 发布
- 1、本文档共5页,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报电话:19940600175。
'中国科技论文在线http://www.paper.edu.cnPak2在浆液性卵巢癌耐药的组织和细胞中#表达及临床意义研究**刘易斯,王敏,双婷5(中国医科大学附属盛京医院,沈阳市,110000)摘要:目的:检测Pak2在浆液性卵巢癌敏感、耐药组织、细胞中的表达差异。方法:免疫组化方法化疗耐药与敏感卵巢浆液性癌组织Pak2表达情况Westernblot方法表明Pak2在浆液性卵巢癌化疗敏感、耐药组织中表达。Real-timePCR方法及Westernblot方法检测耐紫10杉醇卵巢癌SKOV3-TR30细胞及其亲本细胞SKOV3中Pak2mRNA及蛋白表达。结果:免疫组化及Westernblot方法证明Pak2在化疗耐药卵巢浆液性癌组织表达较敏感组织显著升高,免疫组化实验证明Pak2在化疗耐药卵巢浆液性癌组织中以细胞浆表达为主。Real-timePCR表明,Pak2mRNA在两个细胞系中表达无显著差异,Westernblot方法表明蛋白表达在SKOV3-TR30细胞中较SKOV3细胞中显著高表达。结论:Pak2在化疗耐药卵巢浆液性癌15组织与细胞中显著升高且与卵巢癌化疗耐药相关关键词:卵巢癌;Pak2;化疗耐药中图分类号:R737.3StudyontheexpressionofPak2inchemo-resistancein20ovariancancertissueandcellsanditsclinicalsignificanceLiuyisi,WangMin,ShuangTing(ChinaMeidicalSchool,ShengjingHospital,ShenYang,110000)Abstract:Objective:todetectthedifferentialexpressionofPak2inserousovariancancerresistantandsensitivetissuesandcells.Method:Immunohistochemistryanalysisandwesternblotwereappliedfor25thedetectionofPak2inserousovariancancerchemotherapyresistantandsensitivetissues.UsingqRT-PCRmethodtodetectthedifferentialexpressionofPak2inserousovariancancerresistantSKOV3-TR30andsensitiveSKOV3cells.ResultImmunohistochemistryandWesternblotassayshowedthattheexpressionofPak2inchemotherapyresistantovariancancertissueswassignificantlyhigherthanthesensitivetissue,andmainlyinthecytoplasm.Byapplyingreal-timePCRandwestern30blotwefoundthattherewasnosignificantdifferenceofPak2mRNAexpressionlevelsbetweenthesetwocelllines.TheexpressionofPak2proteinwassignificantlyover-expressedinovariancancerpaclitaxelresistancecelllineSKOV3-TR30thaninitsparentalcelllineSKOV3.Conculsions:Pak2expressioninchemotherapyresistantovariancancertissueswassignificantlyhigherandtheoverexpressionwasassociatedwithdrugresistance。35Keywords:Ovariancancer;Pak2;drugresistance;1引言卵巢癌发病率在女性生殖系统恶性肿瘤中占第二位,近年来呈逐年增加趋势。虽然目前世界范围内推荐的最佳治疗方案是手术加紫杉醇和铂类联合化疗(一线化疗)为主的辅助化[1]疗,但其死亡率仍徘徊在70%左右,高居妇科恶性肿瘤首位。卵巢癌患者的5年生存率仅40为20%-30%,化疗耐药是导致其预后不良的最主要原因。因此,深入研究并阐明卵巢癌耐药机制,寻找关键的基因靶点并实现耐药逆转是提高卵巢癌患者治愈率的关键。基金项目:miR-134负向调控Pak2在卵巢癌耐药中的作用(20132104110014)作者简介:刘易斯(1991),男,医师,从事妇科肿瘤研究通信联系人:王敏(1963),女,教师、博导,从事妇科肿瘤研究.E-mail:wm21st@126.com-1-
中国科技论文在线http://www.paper.edu.cn寻找鉴定miRNAs靶mRNAs是目前miRNAs领域主要研究热点之一。课题组前期通[2]过HybridPCR方法在化疗耐药卵巢癌细胞中筛选出8个靶mRNAs,在化疗敏感卵巢癌细胞中筛选出5个靶mRNAs。我们拟确定对筛选出的miR-134潜在靶向调控基因Pak2(p2145proteinactivatedkinase2,p21活化激酶2)进行深入研究2资料及方法2.1.1组织:卵巢癌组织样本63例取自中国医科大学盛京医院之间2008至2013年经手术及病理证实原发性上皮性卵巢浆液性癌患者,用于免疫组化检测;另分别取化疗耐药卵巢浆液性癌组织14例,化疗敏感卵巢浆液性癌组织16例,用于Pak2mRNA检测。所有病例50均行肿瘤细胞减灭术并在术后接受6~8个疗程TC方案正规化疗,均没有在手术前进行放疗或化疗。收集患者临床资料包括年龄、分期、分化及淋巴结转移情况。本研究获得中国医科大学附属盛京医院道德与伦理委员会审核批准。根据NCCN指南,其中在化疗期间或化疗后6个月内复发者为化疗耐药;完成化疗后6个月到12个月期间复发者视为化疗部分敏感,完成化疗12个月以上未复发者视为化疗敏感。552.1.2细胞:SKOV3细胞系来源于人卵巢腺癌腹水,由中国医学科学院肿瘤细胞库研究所提供;SKOV3-TR30由浙江大学医学院附属妇产科医院提供。2.1.3主要试剂:兔抗人Pak2抗体(英国Abcam公司),免疫组化试剂盒、DAB显色试剂盒(中杉金桥);Pak2引物(生工生物);Actin扩增引物(生工生物);westernbolt试剂盒(上海碧云天生物);聚丙烯酰胺凝胶电泳(SDSPAGE)蛋白上样缓冲液(5×)(上60海碧云天生物);聚偏氟乙烯(PVDF)膜(0.45μm)(Millipore公司);marker(立陶宛Fermentas);PRIM1640培养基(HyClone)胎牛血清(FBS)(HyClone公司),Trizol(英国Invitrogen公司)。2.2方法免疫组化:常规包蜡块,切片。免疫组化染色程序严格按照试剂盒规程操作。所有切片采用盲法由2名病理科医生独立阅片,参照免疫反应积分(IRS)评分法,观察染色65强度,计数免疫组化标记定位准确的阳性细胞占视野内细胞数的比例并计分,将二者计分乘积作为最后结果。Westernbolt方法:RIPA组织裂解液提取总蛋白,测定蛋白浓度。电泳2h,转膜1h,5%脱脂奶粉封闭2h,一抗孵育过夜,二抗孵育2h。发光后采用电泳凝胶成像分析仪进行分析。70细胞的培养:卵巢癌SKOV3细胞用1640培养基(10%FBS,青霉素100μg/ml和链霉素100μg/ml)培养,SKOV3-TR30细胞用1640培养基(10%FBS,青霉素100μg/ml和链霉素100μg/ml,20nmol/L紫杉醇)培养,实验前一周撤药培养。以上细胞系均在37℃、5%CO2的饱和湿度条件下培养,取对数生长期的细胞用于实验。-2-
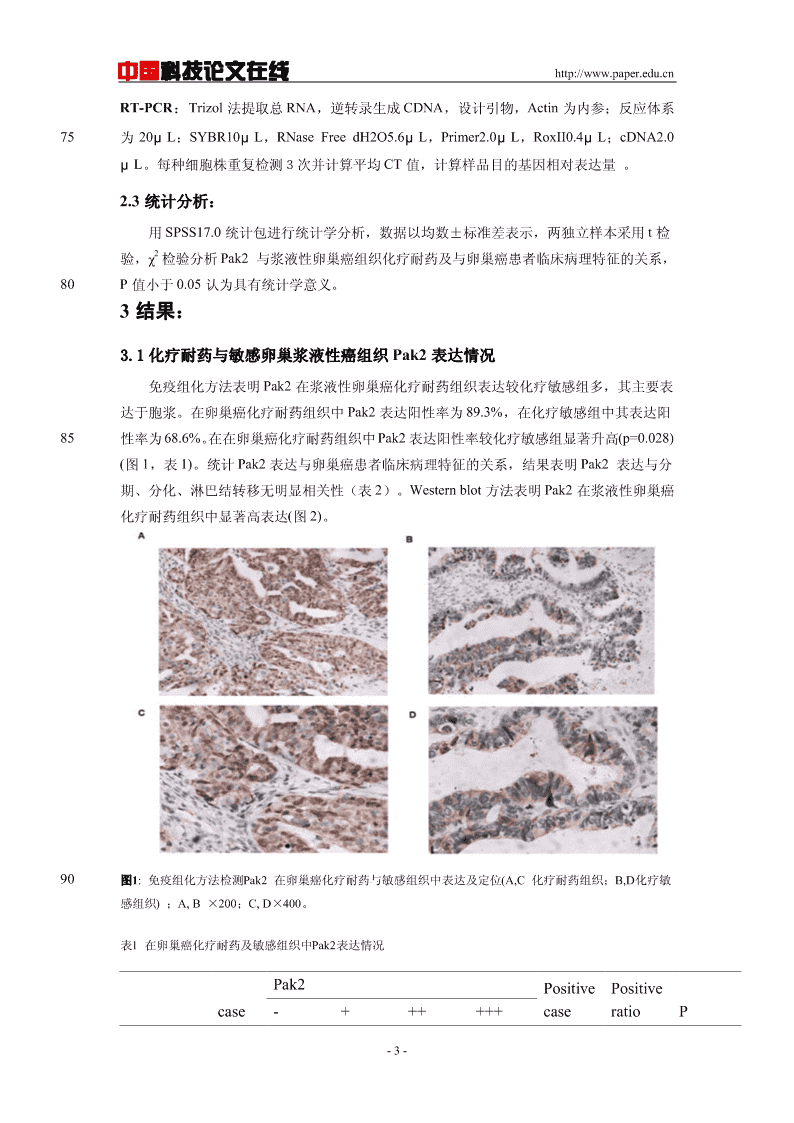
中国科技论文在线http://www.paper.edu.cnRT-PCR:Trizol法提取总RNA,逆转录生成CDNA,设计引物,Actin为内参;反应体系75为20μL:SYBR10μL,RNaseFreedH2O5.6μL,Primer2.0μL,RoxII0.4μL;cDNA2.0μL。每种细胞株重复检测3次并计算平均CT值,计算样品目的基因相对表达量。2.3统计分析:用SPSS17.0统计包进行统计学分析,数据以均数±标准差表示,两独立样本采用t检2验,χ检验分析Pak2与浆液性卵巢癌组织化疗耐药及与卵巢癌患者临床病理特征的关系,80P值小于0.05认为具有统计学意义。3结果:3.1化疗耐药与敏感卵巢浆液性癌组织Pak2表达情况免疫组化方法表明Pak2在浆液性卵巢癌化疗耐药组织表达较化疗敏感组多,其主要表达于胞浆。在卵巢癌化疗耐药组织中Pak2表达阳性率为89.3%,在化疗敏感组中其表达阳85性率为68.6%。在在卵巢癌化疗耐药组织中Pak2表达阳性率较化疗敏感组显著升高(p=0.028)(图1,表1)。统计Pak2表达与卵巢癌患者临床病理特征的关系,结果表明Pak2表达与分期、分化、淋巴结转移无明显相关性(表2)。Westernblot方法表明Pak2在浆液性卵巢癌化疗耐药组织中显著高表达(图2)。90图1:免疫组化方法检测Pak2在卵巢癌化疗耐药与敏感组织中表达及定位(A,C化疗耐药组织;B,D化疗敏感组织);A,B×200;C,D×400。表1在卵巢癌化疗耐药及敏感组织中Pak2表达情况Pak2PositivePositivecase-++++++caseratioP-3-
中国科技论文在线http://www.paper.edu.cn(%)resistancegroup283322025*89.3Sensitivegroup351212922368.60.028*Pak2表达(化疗耐药组vs化疗敏感组*P=0.028)表2Pak2表达与卵巢癌患者临床病理特征关系Pak2lowPak2highcaseexpression(-/+)expression(++/+++)Pvalue633033FIGO,nI-II1385III-IV5022280.207Differentiation,nHigh532Moderate-low5827310.454Nodalstatus,nNegative472522Positive165110.10995图2:Westernblot方法检测Pak2在化疗耐药与敏感卵巢浆液性癌组织中表达。其中1、2、3、7、8、9为化疗耐药卵巢浆液性癌组织;4、5、6、10、11、12为化疗敏感卵巢浆液性癌组织。3.2、Pak2在耐紫杉醇卵巢癌SKOV3-TR30细胞及其亲本细胞中的表达Real-timePCR方法及Westernblot方法检测耐紫杉醇卵巢癌SKOV3-TR30细胞及其亲-4-
中国科技论文在线http://www.paper.edu.cn100本细胞SKOV3中Pak2mRNA及蛋白表达,结果表明,Pak2mRNA在两个细胞系中表达无显著差异,而Pak2蛋白表达在SKOV3-TR30细胞中较SKOV3细胞中显著高表达。Pak2在SKOV3细胞中表达记为1,Pak2在SKOV3-TR30细胞中8.2746±0.38828(P=0.001)(图3)。105图3:Westernblot检测Pak2在耐紫杉醇卵巢癌SKOV3-TR30细胞及其亲本细胞中的表达。4讨论本课题组前期研究发现在卵巢癌耐药细胞及组织中miR-134低表达,同时通过Hybrid[2]方法筛选出Pak2为miR-134潜在靶基因。p21激活激酶(p21protein(Cdc42/Rac)-activatedkinases,Paks)是一类丝氨酸/苏氨酸激酶,在进化上高度保守,是小G蛋白Rho家族Rac110和Cdc42重要的下游效应分子。Pak2是I类Paks中的成员,在细胞骨架重塑、细胞活性、[3]细胞入侵、细胞周期进展、细胞骨架蛋白调节的细胞增殖及凋亡中起重要作用。研究证[4]实Pak2异常高表达与乳腺癌耐药相关。2010年SiuMK等表明异常磷酸化的Pak2能促进[5]卵巢癌的发展。2014年YanB-x等研究报道Prostasin通过CASP/Pak2-p34/actin信号通路[6]逆转卵巢癌细胞耐药。由于Pak2会被Caspase-3切割并活化产生一个活性片段Pak2-p34,115这个片段进而从细胞浆转移到细胞核中,引起细胞凋亡的发生。而同时,Pak2可以通过抑制Caspase-3的活性以及自身的被切割,维持pak2自身表达水平,而使乳腺癌细胞对化疗药[7-8]物诱导的凋亡敏感性降低。2014年的最新研究发现Pak2与卵巢癌细胞系OV2008及C13[9]的侵袭行为相关,并提出Pak2可能是促进卵巢癌转移的基因。而Pak2与卵巢癌化疗耐药的研究尚有待深入。[10]120Gao等人研究发现Pak2蛋白在胃癌组织中显著高表达。Li等人研究表明Pak2在[11]乳腺浸润性导管癌高表达且可能介导化疗耐药。而Pak2在化疗耐药与敏感卵巢浆液性癌组织中是否存在差异性表达尚不清楚。本研究通过免疫组化方法及Westernblot方法发现耐药较敏感卵巢癌组织Pak2异常高表达,其表达主要位于细胞浆,与卵巢浆液性癌化疗耐药显著相关。-5-
中国科技论文在线http://www.paper.edu.cn125首先,通过qRT-PCR方法及Westernblot方法检测Pak2在耐紫杉醇卵巢癌SKOV3-TR30细胞及其亲本细胞中的表达,结果提示:SKOV3-TR30细胞与其亲本SKOV3细胞Pak2在mRNA水平相似,而Pak2在蛋白表达却显著升高。Pak2参与细胞凋亡、细胞周期阻滞和生[12-13]存从而可能影响药物的化疗敏感性。多项研究表明,与Pak1基因类似,Pak2基因具有双重功能和调节细胞存活率和细胞死亡通路。激活全长PAK2基因通过Bad磷酸化,减少[14]130Bad与bcl-2或Bcl-x(L)的结合抑制细胞凋亡。因此我们推测Pak2磷酸化异常是导致在两珠细胞中表达相似而蛋白表达差异显著的原因。本研究首先通过在临床标本中应用免疫组化方法检测Pak2蛋白表达,证明Pak2高表达与卵巢浆液性癌组织化疗耐药的关系,进而在细胞系中验证,下一步将研究miR-134与靶基因Pak2之间的关系;从磷酸化共价修饰角度明确miR-134转录后调控Pak2磷酸化异常在卵135巢癌耐药中起作用,寻找逆转耐药靶点。[参考文献](References)[1]曹泽毅等.中华妇产科学[M].北京.人民卫生出版社.2010[2]双婷,王敏.耐药与敏感卵巢癌组织中microRNA表达差异谱检测及分析.中国实用妇科与产科杂志[J].2013,29(01):33-36140[3]李晓东,李彦姝,赵大林,李丰.P21活化激酶的生物学活性及其与肿瘤的关系.细胞生物学杂志[J].2006;28:399-404.[4]Li,X,Wen,W,Liu,K,Zhu,F,Malakhova,M.,Peng,C.,Li,T.,Kim,H.G.,Ma,W.,Cho,Y.Y.,Bode,A.M.,Dong,Z.andDong,Z.(2011)Phosphorylationofcaspase-7byp21-activatedproteinkinase(PAK)2inhibitschemotherapeuticdruginducedapoptosisofbreastcancercelllines[J].Biol.Chem.286,22291-22299.145[5]SiuMK,WongES,ChanHY,KongDS,WooNW,TamKF,NganHY,ChanQK,ChanDC,ChanKY,CheungAN.DifferentialexpressionandphosphorylationofPak1andPak2inovariancancer:effectsonprognosisandcellinvasion[J].IntJCancer.2010;127(1):21-31.[6]YanBX,MaJX,ZhangJ,GuoY,MuellerMD,RemickSC,YuJJ.Prostasinmaycontributetochemoresistance,represscancercellsinovariancancer,andisinvolvedinthesignalingpathwaysof150CASP/PAK2-p34/actin.CellDeathDis[J].2014;16(5):e995.[7]WalterBN,HuangZ,JakobiR,TuazonPT,AlnemriES,LitwackG,TraughJA.Cleavageandactivationofp21-activatedproteinkinasegamma-PAKbyCPP32(caspase3).Effectsofautophosphorylationonactivity[J].JBiolChem.1998;273(44):28733-28739.[8]FischerU,StrohC,Schulze-OsthoffK.Uniqueandoverlappingsubstratespecificitiesofcaspase-8and155caspase-10[J].Oncogene2006;25(1):152-159.[9]FlateE1,StalveyJR1.Motilityofselectovariancancercelllines:effectofextra-cellularmatrixproteinsandtheinvolvementofPAK2[J].IntJOncol.2014Oct;45(4):1401-11.doi:10.3892/ijo.2014.2553.Epub2014Jul22.[10]GaoC,MaT,PangL,XieR.ActivationofP21-activatedproteinkinase2isanindependentprognosticpredictorforpatientswithgastriccancer.Diagnosticpathology.2014;9:55.160[11].LiX,WenW,LiuK,ZhuF,MalakhovaM,PengC,LiT,KimHG,MaW,ChoYY,BodeAM,DongZ,DongZ.Phosphorylationofcaspase-7byp21-activatedproteinkinase(Pak)2inhibitschemotherapeuticdrug-inducedapoptosisofbreastcancercelllines.JBiolChem.2011;286(25):22291-9.[12]Jakobi,R.,Moertl,E.andKoeppel,M.A.(2001)P21-activatedproteinkinasegamma-PAKsuppressesprogrammedcelldeathofBALB3T3fibroblasts[J].Biol.Chem.276,16624-16634165[13]Molli,P.R.,Li,D.Q.,Murray,B.W.,Rayala,S.K.andKumar,R.(2009)PAKsignalinginoncogenesis[J].Oncogene28,2545-2555.[14]Radu,M.,Semenova,G.,Kosoff,R.andChernoff,J.(2014)PAKsignallingduringthedevelopmentandprogressionofcancer.[J]Nat.Rev.Cancer14,13–25-6-'
您可能关注的文档
- 关于投诉重庆--收藏品文化传播有限公司销售大量假冒收藏品的范文.doc
- 关于投诉重庆品渝轩售卖三无食品的情况汇报范文.doc
- 关于辽宁大连普兰店区教育文化体育局2017年所属自主招聘教师的通知范文.doc
- 关于面积超过144平房子的契税缴纳比例问题咨询范文.doc
- 写给重医附一院陈--的表扬信.doc
- 湖北黄冈市团风县2017年幼儿园教师招聘通知范文.doc
- 西安市教育局关于特岗教师招聘计划调整有关问题的通知.doc
- 重庆市中小学教师继续教育证明范文.doc
- Al2O3超疏水薄膜的制备及其耐腐蚀研究.pdf
- 一种基于C4.5算法的车载CAN总线恶意帧检测方案.pdf
- 冀西北坝上地区五种作物的耗水肥特性与水分效益比较.pdf
- 功能化石墨烯负载金纳米粒子制备及其电学性能探究.pdf
- 华南陆块北缘新元古代负δ18O岩浆作用.pdf
- 双重不确定信息下双源采购策略研究.pdf
- 国际税收信息自动交换标准研究.pdf
- 基于光子技术的高速可调微波开关.pdf
- 基于遗传算法的茶多酚快速测定模型优化研究.pdf
- 尼古丁对MPTP致帕金森病小鼠嗅觉障碍的作用研究.pdf
相关文档
- 施工规范CECS140-2002给水排水工程埋地管芯缠丝预应力混凝土管和预应力钢筒混凝土管管道结构设计规程
- 施工规范CECS141-2002给水排水工程埋地钢管管道结构设计规程
- 施工规范CECS142-2002给水排水工程埋地铸铁管管道结构设计规程
- 施工规范CECS143-2002给水排水工程埋地预制混凝土圆形管管道结构设计规程
- 施工规范CECS145-2002给水排水工程埋地矩形管管道结构设计规程
- 施工规范CECS190-2005给水排水工程埋地玻璃纤维增强塑料夹砂管管道结构设计规程
- cecs 140:2002 给水排水工程埋地管芯缠丝预应力混凝土管和预应力钢筒混凝土管管道结构设计规程(含条文说明)
- cecs 141:2002 给水排水工程埋地钢管管道结构设计规程 条文说明
- cecs 140:2002 给水排水工程埋地管芯缠丝预应力混凝土管和预应力钢筒混凝土管管道结构设计规程 条文说明
- cecs 142:2002 给水排水工程埋地铸铁管管道结构设计规程 条文说明