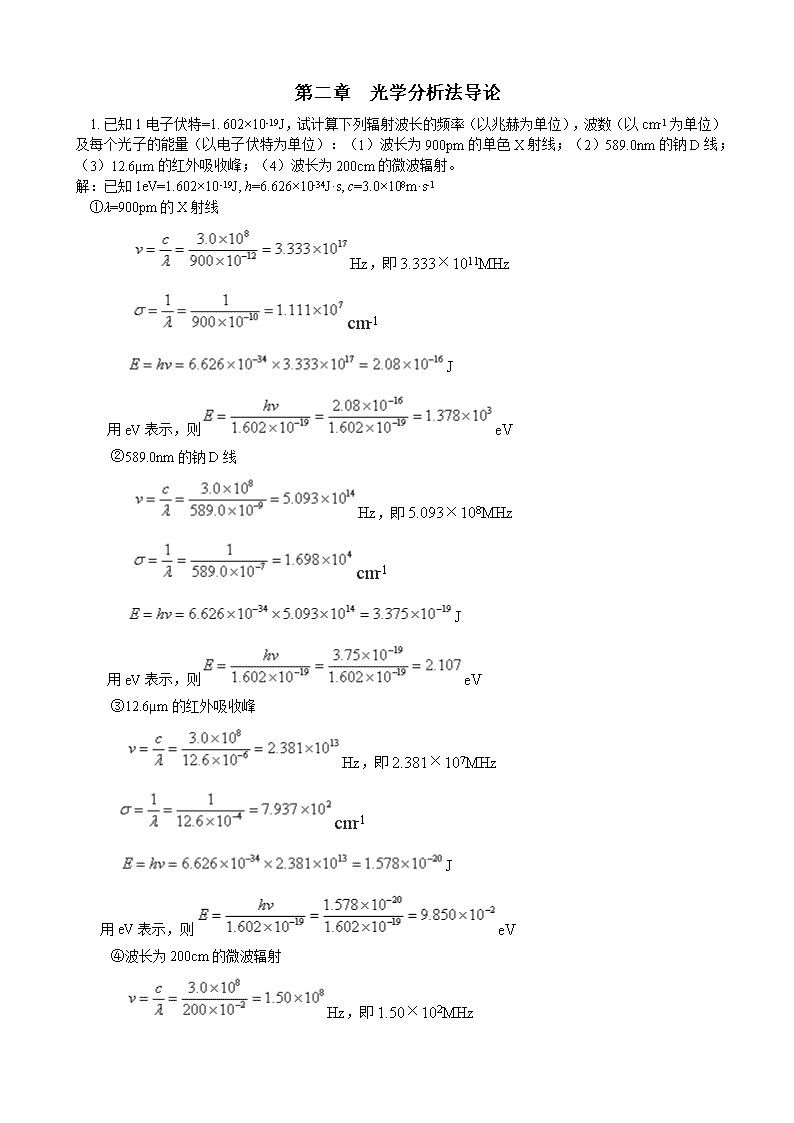- 450.28 KB
- 2022-04-22 11:54:51 发布
- 1、本文档共5页,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报电话:19940600175。
'第二章 光学分析法导论 1. 已知1电子伏特=1.602×10-19J,试计算下列辐射波长的频率(以兆赫为单位),波数(以cm-1为单位)及每个光子的能量(以电子伏特为单位):(1)波长为900pm的单色X射线;(2)589.0nm的钠D线;(3)12.6µm的红外吸收峰;(4)波长为200cm的微波辐射。解:已知1eV=1.602×10-19J, h=6.626×10-34J·s, c=3.0×108m·s-1 ①λ=900pm的X射线 Hz,即3.333×1011MHz cm-1 J 用eV表示,则eV②589.0nm的钠D线 Hz,即5.093×108MHz cm-1 J 用eV表示,则eV③12.6µm的红外吸收峰Hz,即2.381×107MHz cm-1 J 用eV表示,则eV④波长为200cm的微波辐射Hz,即1.50×102MHz
cm-1 J用eV表示,则eV 2. 一个体系包含三个能级,如果这三个能级的统计权重相同,体系在300K温度下达到平衡时,试计算在各能级上的相对分布(Ni/N).能级的相对能量如下。 (1) 0eV,0.001eV,0.02eV; (2) 0eV,0.01eV,0.2eV;(3) 0eV,0.1eV, 2eV。解:已知T=300K, k=1.380×10-23J·K-1=8.614×10-5eV·K-1, kT=8.614×10-5×300=0.0258eV ①E0=0eV, E1=0.001eV, E2=0.02eV ②E0=0eV, E1=0.01eV, E2=0.2eV ③E0=0eV, E1=01eV, E2=2eV
3. 简述下列术语的含义 电磁辐射 电磁波谱 发射光谱 吸收光谱 荧光光谱 原子光谱 分子光谱自发发射 受激发射 受激吸收 电致发光 光致发光 化学发光 热发光电磁辐射――电磁辐射是一种以巨大速度通过空间传播的光量子流,它即有波动性,又具有粒子性.电磁波谱――将电磁辐射按波长顺序排列,便得到电子波谱.电子波谱无确定的上下限,实际上它包括了波长或能量的无限范围.发射光谱――原来处于激发态的粒子回到低能级或基态时,往往会发射电磁辐射,这样产生的光谱为发射光谱.吸收光谱――物质对辐射选择性吸收而得到的原子或分子光谱称为吸收光谱.荧光光谱――在某些情形下,激发态原子或分子可能先通过无辐射跃迁过渡到较低激发态,然后再以辐射跃迁的形式过渡到基态,或者直接以辐射跃迁的形式过渡到基态。通过这种方式获得的光谱,称为荧光光谱.原子光谱――由原子能级之间跃迁产生的光谱称为原子光谱.分子光谱――由分子能级跃迁产生的光谱称为分子光谱.自发发射――处于两个能级Ei、Ej(Ei>Ej)上的粒子浓度分别为Ni、Nj.当i能级上的一个粒子跃迁到j能级时,就自发发射一个能量为Ei-Ej的光子,这类跃迁称为自发发射.受激发射――对于处于高能级i的粒子,如果有频率恰好等于(Ei-Ej)/h的光子接近它时,它受到这一外来光子的影响,而发射出一个与外来光子性质完全相同的光子,并跃迁到低能级j.这类跃迁过程为受激发射.受激吸收――频率为(Ei-Ej)/h的辐射照射时,粒子从能级j跃迁到能级i,使得辐射强度降低,这种现象称为受激吸收.电致发光――电场引起的碰撞激发,是指被电场加速的带电粒子碰撞而受到激发,从而发射出电磁辐射.这一过程称为电致发光.光致发光――电磁辐射吸收激发,是指吸收电磁辐射而引起的激发,从而发射出电磁辐射,这一过程称为光致发光.化学发光――在一些特殊的化学反应体系中,有关分子吸收反应所释放的化学能而处于激发态,回到基态时产生光辐射。这样获得的光谱称为化学发光光谱.热发光――物体加热到一定温度也会发射出电磁辐射,称为热发光.4. 什么是光谱分析法,它包括哪些主要方法?答:当物质高温产生辐射或当辐射能与物质作用时,物质内部能级之间发生量子化的跃迁,并测量由此而产生的发射,吸收或散射辐射的波长和强度,进行定性或定量分析,这类方法就是光谱分析法. 光谱分析法主要有原子吸收光谱法、原子发射光谱法、原子荧光法、紫外-可见分光光度法、红外光谱法、分子荧光法、X射线荧光法等.5. 辐射光子能量与波长的关系怎样,按光子能量从高到低有哪些辐射类型?答:辐射光子能量与波长的关系为:E=hc/λ按光子能量从高到低的顺序为:γ射线,X射线,紫外,可见,红外,微波,无线电波6. 电子光谱一般在什么波长区?振动光谱在什么波长区?转动光谱在什么波长区?答:电子光谱——紫外、可见区(Ee、Eυ、E r 均改变) 62~620nm振动光谱——近红外区(Ev及E r改变) 620~24.8µm转动光谱——远红外、微波区(仅E r改变) >24.8µm第三章 紫外及可见吸收光谱法
1.已知某Fe(Ⅲ)络合物,其中铁浓度为0.5µg·mL-1,当吸收池厚度为lcm时,百分透光率为80%。试计算:(1)溶液的吸光度;(2)该络合物的表观摩尔吸光系数;(3)溶液浓度增大一倍时的百分透光率;(4)使(3)的百分透光率保持为80%不变时吸收池的厚度。解:已知b=1cm, T=80%, c=0.5µg·mL-1 则mol·L-1 (1)A= –lgT= –lg0.80=0.0969 (2)由A=εbc得到: L·mol-1·cm-1 (3)c2=2c, A2=2A=0.1938 即–lgT2=0.1938, T2=0.640 (4)A3= –lgT3= –lg0.80=0.0969, c3=2c, 则A3=A, b3=b/2 cm2.钢样中的钛和钒,可以同时用它们的过氧化氢络合物形式测定,1.000g钢样溶解,发色并稀释至50mL。如果其中含1.00mg钛,则在400nm波长的吸光度为0.269;在460nm的吸光度为0.134。在同样条件下,1.00mg钒在400nm波长的吸光度为0.057;在460nm为0.091。表中各试样均重1.000g,最后稀释至50mL。根据它们的吸光度计算钛和钒的百分含量。 试样号A400A460试样号A400A460101720.11650.9020.57020.3660.43060.6000.66030.3700.29870.3930.21540.6400.43680.2060.130解:依条件,对钛(Ti):, 对钒(V):, c=1mg/50mL,相当于1g钢样中有1mg钛或钒. 则根据吸光度的加和性,得到: 0.269c1 +0.057c2=A400 0.134c1 +0.091c2=A460将实验数据代入该方程组,计算结果列于下表. 试样号A400A460c1(%)c2(%)注101720.1160.05370.04841mg/g=0.1%20.3660.4300.0520.395 30.3700.2980.0990.181 40.6400.4360.1980.187 50.9020.5700.2950.192
60.6000.6600.1010.576 70.3930.2150.1400.0305 80.2060.1300.0670.044 3.取2.00mL含2mol·L-1NH3的Cu2+溶液放入1.00cm的吸收池中。测得在某一确定波长的吸光度为0.600。然后取0.0100mol·L-1 CuSO4溶液1.00mL添加到第一个吸收池中。再测得的吸光度为0.800。试指出第一个溶液中Cu2+的浓度为多少?解:已知A1=0.600, A2=0.800, b=1cm 依条件,有:A1=εbcx 即 0.600=ε×1×cx cx=0.00500mol·L-1 4.螫合物吸收峰波长为575nm,实验表明,当配位体的初始浓度超过Cu2+浓度20倍时,吸光度数值只取决于Cu2+浓度而与配位体浓度无关。今有两种Cu2+和X浓度均己知的溶液,实验数据如下:3.10×10-55.00×10-52.00×10-26.00×10-4A(吸光度)0.6750.366试求出的离解常数。解:(1)A=εb[CuX2], A=0.675, c=3.10×10-5(CuX2) (2)CuX2=Cu2+ +2X-, c(Cu2+)=5.00×10-5mol·L-1,c(X-)=6.00×10-4 mol·L-1 [CuX2]=mol·L-1 [Cu2+]=(5.00-1.68)×10-5=3.32×10-5mol·L-1 [X-]=6.00×10-4 -2×1.682×10-5=5.66×10-4 mol·L-1 K离解=5.配制一组溶液,其中铁(II)的含量相同,各加入7.12´10-4mol·L-1亚铁溶液2.00mL,和不同体积的7.12´10-4mol·L-1邻菲罗啉溶液,稀释至25mL后,用1.00cm吸收池在510nm测得各溶液的吸光度如下:邻菲罗啉 V/mL吸光度邻菲罗啉 V/mL吸光度2.000.2406.000.7003.000.3608.000.7204.000.48010.000.7205.000.59312.000.720
(1)问亚铁-邻菲罗啉络合物的组成是怎样的?(2)络合物的形成常数是多少?解:(1)作A~c关系图. 当VL=6mL时对应的cL/cM值3:1,即络合物组成为FeL3. (2)在VL=6mL时,离解度为 0.0278 mol·L-1 K形成=或b=1cm,FeL3的摩尔吸光系数为: mol·L-1 A=0.700时, mol·L-1 此时[Fe2+]=mol·L-1 [L]=3[Fe2+]=0.42×10-5mol·L-1(或[L]=cL-3[FeL3]) 于是K形成=6.若透光率读数误差DT=0.0040,计算下列各溶液的普通光度法浓度相对误差: (1)T=0.204;(2)A=0.195;(3)A=0.280;(4)T=94.4%。解:ΔT=0.0040 (1)T=0.204
(2)A=0.195 T=0.638 (3)A=0.280 T=0.525 (4)T=94.4%=0.944 7.若采用高吸光度示差法,以T=80%的参比溶液调节满标度,题6中哪些溶液可用此法测定?试分别求出表现透光率Tf及浓度相对误差,并与题6比较。解: Ts=0.80,(4)不能用示差光度法测定. (1)T=0.204, Tr=0.204/0.80=0.255 (2)T=0.638, Tr=0.7975 (3)T=0.525, Tr=0.656 与6题比较,利用示差法,提高了测定结果的准确度。 8.镉的某种络合物,它的摩尔吸光系数为2.00´104 ,用于分析一组水溶液中镉的浓度,浓度范围为0.5´10-4mol·L-1~1.00´10-4mol·L-1,光度计配有1.00cm吸收池。仪器透光率读数误差为0.004,这一误差与T的数值无关。 (1)测得的吸光度和透光率将在什么范围? (2)对于Cd2+浓度为0.50´10-4mol·L-1和1.5´10-4mol·L-1的试液,由于仪器读Cd2+数误差而引起结果的相对误差是多少? (3)如果(2)中的溶液稀释5倍后再测定,则结果的相对误差是多少? (4)如果用Cd2+浓度为0.45´10-4mol·L-1溶液校正仪器达满刻度(T=100),以进行示差测定,则(2)中溶液由于仪器读数误差而引起结果的相对误差是多少?解:ΔT=0.0040, ε=2.00´104L·mol-1·cm-1, b=1cm (1)A=εbc A1=εbc1=2.00´104´1´0.5´10-4=1.00 T1=0.100A2=εbc2=2.00´104´1´1´10-4=2.00 T2=0.010
即测得的吸光度范围为1.00~2.00,透光度范围为0.010~0.100. (2)对于c=0.50´10-4mol·L-1,A1=1.00, T1=0.10 对于c=1.50´10-4mol·L-1,A3=3.00 T3=0.0010 (3) 对于c1=0.10´10-4mol·L-1,A1=0.200, T1=0.631 对于c2=0.30´10-4mol·L-1,A2=0.600, T2=0.251 (4) cs=0.45´10-4mol·L-1, A=εbc=0.90, Ts=0.126 Tr1=0.10/0.126=0.794 Tr2=0.0010/0.126=0.00794 9.有两种异构休,a-异构体的吸收峰在228nm(e =14000),而b-异构体吸收峰在296nm(e=11000)。试指出这两种异构体分别属于下面结构中的哪一种? 结构Ⅰ结构Ⅱ 解:共轭体系,吸收峰向长波长方向移动,因此结构I为β-异构体,结构II为α-异构体. 10.已知丙酮的正己烷溶液的两个吸收峰138nm和279nm,分别属于n→π*和π→π*。试计算n、π、π*轨道的能量差,分别以电子伏特(eV)和焦/摩尔(J·mol-1)为单位。解:π→π*, λ1=138nm;n→π*, λ2=279nm;1eV=1.602×10-19J (1)π→π*能量差
J 以J·mol-1表示,为Nhc/λ1=8.69×105J·mol-1 以eV表示,为eV (2)n→π*能量差 J 以J·mol-1表示,为Nhc/λ2=4.29×105J·mol-1 以eV表示,为4.44eV (3)n→π能量差E3=E1-E2=8.99-4.44=4.55eV(7.12×10-19J)即4.40×105J·mol-1 11.假定滴定反应为A+B®C。B是滴定剂,根据下述条件,给出表示分光光度滴定过程的曲线图,(1)A和C是无色物质,B是吸光物质;(2)A和B是吸光物质,C是无色物质;(3)A是吸光物质,B和C是无色物质(分光光度滴定曲线:以吸光度为纵坐标,以滴定剂体积为横标作图)。解: 12.试说明和比较下列术语复合光和单色光 单色器和色散元件 棱镜dq /dl dq /dn dn /dl荧光激发光谱和荧光发射光谱 辐射跃迁和非辐射跃迁 红移和紫移复合光和单色光 一束具有多种波长的光称为复合光,具有单一波长的光称为单色光.单色器和色散元件 单色器是一种能将辐射分解成它的各成分波长,并能从中分出任一所需部分的仪器部件。单色器有一个棱镜或光栅色散元件。棱镜dq /dl指棱镜的角色散率,是指两条波长相差dl的光线被棱镜色散后所分开的角度dq。dq /dn――表示作为棱镜材料折射率函数的q 的变化。dn /dl――表示折射率随波长的变化。荧光激发光谱和荧光发射光谱 改变激发光波长,在荧光最强的波长处测量荧光强度的变化,作激发光波长与荧光强度的关系曲线,可得到激发光谱,激发光谱实质上就是荧光物质的吸收光谱。保持激发光波长和强度不变,测量不同波长处荧光强度的分布,作荧光波长与荧光强度的关系曲线,可得到荧光光谱或称发射光谱。辐射跃迁和非辐射跃迁 一个分子的电子能态的激发包含了电子从基态跃迁到激发态的任一振动能态,处在激发态的分子是不稳定的,在返回低能级的过程中产生辐射,称为辐射跃迁,不产生辐射,则称为非辐射跃迁.红移和紫移 在分子中引入的一些基团或受到其它外界因素影响,吸收峰向长波方向(红移)或短波方向(蓝移)移动的现象。13.试举例说明生色团和助色团。
答:分子中含有非键或p键的电子体系,能吸收外来辐射时并引起p–p*和n–p*跃迁,可产生此类跃迁或吸收的结构单元,称为生色团。主要的生色团有–C=O、–N=N–、–N=O等。 含有孤对电子(非键电子对),可使生色团吸收峰向长波方向移动并提高吸收强度的一些官能团,称之为助色团,如–OH、–OR、–NHR、–SH、–Cl、–Br、–I等。14.试比较双光束和双波长分光光度法在仪器结构上有何不同,双波长分光光度法的原理是什么?答:(1) 双光束分光光度计,在单色器的后面放置一切光器,将光分为两路强度相同的两部分,分别通过参比和样品溶液测定。 双波长分光光度计,将同一光源发出的辐射通过两个单独调节的单色器,产生两条不同波长的光,分别进行测定。 (2)由于双波长分光光度计采用统一光源,调节仪器使两波长处光强度相等,则两波长处吸光度之差为ΔA= Aλ2 –Aλ1 =(ελ2 –ελ1)bc 即输出信号ΔA浓度c成正比.消除了参比溶液和样品溶液组成不同带来的误差。15.与紫外分光光度计比较,荧光分光光度计有何不同。答:光源:激发光源强度比吸收测量中的光源强度大。 单色器:两个单色器,激发单色器和发射单色器。 检测器:荧光强度很弱,检测器有较高的灵敏度。 试样池:荧光分析中要求用石英材料。由于荧光强度与透过光强度相比小得多,在测量荧光时必须严格消除透过光的影响,在测量荧光计的仪器中,是在与入射光和透过光垂直的方向上来测量荧光。(荧光光度计有两个单色器,且入射光路与检测系统的光路垂直。)第四章 红外分光光光度法1.CO的红外光谱在2170cm-1处有一振动吸收峰.问 (1)CO键的力常数是多少? (2)14CO的对应峰应在多少波数处发生吸收?解:碳原子的质量g 氧原子的质量g (1) σ =2071cm-1 =18.6×105 dyn·cm-1=18.6N·cm-1(厘米克秒制) (2)14CO g cm-1
或 σ =2080cm-12.已知C―H键的力常数为5N/cm,试计算C―H键伸展振动的吸收峰在何波数?若将氘(D)置换H,C―D键的振动吸收峰为多少波数.解:C-H键:k=5N·cm-1=5.0×105dyn·cm-1 碳原子的质量:mC=2.0×10-23g,氢原子的质量:g氘原子的质量: g依得cm-1cm-13.指出以下振动在红外光谱中是活性的还是非活性的 分 子 振 动(1)CH3一CH3 C―C伸缩振动(2)CH3一CC13 C―C伸缩振动(3)SO2 对称伸缩振动(4)CH2=CH2 C―H伸缩振动(5)CH2=CH2 C―H伸缩振动(6)CH2=CH2 CH2摆动(7)CH2=CH2 CH2扭曲振动解:非红外活性:(1),(5),(7)
红外活性:(2),(4),(6),(8)4.下面三个图形(图4-20)分别为二甲苯的三种异构体的红外光谱图。请说明各个图形分别属于何种异构体(邻、间、对位)?并指明图中主要吸收峰的来源。解:分别为间二甲苯、对二甲苯、邻二甲苯 主要吸收峰来源:苯环骨架振动,1700cm-1~2000cm-1C-H面外弯曲振动,650~900cm-15.有一种苯的氯化物在900~660cm-1区域没有吸收峰,它的可能结构是什么?答:C6Cl6 (六六六)6.图4-21是由组成为C3H6O的纯液体获得的红外谱图,试推断这种化合物的结构。答:丙酮 7.下面两个化合物的红外光谱有何不同?(a) (b) 答:红外光谱不同点: (a)3300cm-1,N-H伸缩振动(宽且强),CH2-伸缩振动峰,苯环骨架振动峰(1600cm-1附近),一取代指纹峰(770~730,710~690cm-1) (b)1680cm-1,C=O强伸缩振动峰,甲基的伸缩振动峰(2928cm-1)8.某化合物分子式为C5H8O,有下面的红外吸收带:3020 ,2900,1690和1620cm-1;在紫外区,它的吸收峰在227nm处(e=104)。试提出一个结构,并说明它是否是唯一可能的结构。答:,否.9. 下面两个化合物中哪一个νC=O吸收带出现在较高频率,为什么?(a) (b) 答:(a)化合物的羰基吸收带出现在较高频率. N原子提供孤对电子,与苯环、C=O形成大π键,中介效应.10. 举例说明分子的基本振动形式。答:CO2和H2O的振动模式 11. 试说明产生红外吸收的条件是什么?答:(1)必要条件:振动或转动时会引起偶极矩净变化的分子. (2)辐射的频率与分子的固有振动频率相匹配.
12. 试说明什么是基团频率和“指纹区”?各有什么特点和作用?答:组成分子的各种原子基团都有自己的特征红外吸收的频率范围和吸收峰,称这些能用于鉴定原子基团存在并有较高强度的吸收峰为特征峰,其相应的频率称为特征频率或基团频率。“指纹区”:在1300cm-1~600cm-1(7.7mm~16.7mm)范围的光谱区,分子构型和结构的微小差别,都可引起吸收峰分布的明显改变。这一区域内的光谱对于分子来说就好像“指纹”对人一样,具有各自独特的特征。基团频率:有一定的范围,吸收峰较强,用于鉴定原子基团的存在.指纹区:分子构型和结构的微小差别,会引起吸收峰分布的明显改变,可用于区分化合物的精细结构.13. 什么是拉曼散射,Stokes线和反Stokes线。答:一束单色光作用于透明介质时,在透射和反射方向以外出现的光称为散射光。当散射的粒子为分子大小时,发生与入射光频率相同的瑞利(Rayleigh)散射光,另外在其两侧对称分布有强度较弱的频率不同于入射光的散射光,称之为拉曼(Raman)光。这种现象称为拉曼散射.其中频率较低的称为斯托克斯(Stokes)线,频率较高的称为反斯托克斯线 (anti-Stokes)。14. 下述分子的振动各具有什么活性(红外、拉曼、或两者均有)(1)O2的对称伸缩振动; (2)CO2的不对称伸缩振动;(3)H2O的弯曲振动; (4)C2H4的弯曲振动。答: 红外活性 拉曼活性 备 注 (1)O2的对称伸缩振动 非 是(2)CO2的不对称伸缩振动 是 非 (3)H2O的弯曲振动 是 是 (4)C2H4的扭曲(或弯曲)振动 非 非第五章 原子发射光谱分析法 1.从棱镜摄谱仪摄取的光谱上获得下面的数据,从参考点至波长为324.754nm、 326.233nm和327.396nm的谱线的距离依次为0.50,6.42和11.00mm,参考点至未知谱线的距离为8.51mm,求未知谱线的波长。解:: 已知,于是 nm 2.一台光谱仪配有6cm的光栅,光栅刻线数为每厘米6250条,当用其第一级光谱时,理论分辨率是多少?理论上需要第几级光谱才能将铁的双线309.990nm和309.997nm 分辨开?
解:分辨率R=λdλ=Nm (1)m=1, R=6×6250=37500 (2) 因此,理论上需二级光谱才能将铁的双线分开. 3.用光谱法测定合金中铅的含量,用镁线作内标线,得到如下数据。溶 液测 微 光 度 计 读 数铅的浓度/mg·mL-1MgPb17.317.50.15128.718.50.20137.311.00.301410.312.00.402511.610.40.502A8.815.5 B9.212.5 C10.712.2 (1)在1g~1g坐标图上作一校正曲线;(2)由校正曲线估计溶液A、B和C的铅浓度。解:(1)下图为R~c的关系图 (2)依条件,lgRA=0.246,lgRB=0.133,lgRC=0.0570 于是得到cA=0.237mg·mL-1, cB=0.324mg·mL-1, cC=0.401mg·mL-1 4.某一含铅的锡合金试样用电弧光源激发时,摄谱仪的狭缝前放置一旋转阶梯扇板,扇板的每一阶梯所张的角度之比为1:2:4:8:16:32。光谱底片经显影定影干燥后,用测微光度计测量一适当锡谱线的每一阶梯的黑度,由各阶梯所得i0/i值为1.05,1.66,4.68,13.18,37.15和52.5。绘制感光板的乳剂特性曲线,求出反衬度值。解:
T12481632i0/i1.051.664.6813.1837.1552.5lgT00.3010.6020.9031.2041.505S=lgi0/i0.020.220.671.121.571.72 中间四点线性非常好,其回归方程为:S=1.5lgT–0.23, R2=1 所以反衬度为γ=1.5 5.几个锡合金标准样品中的铅含量已由化学分析法测得,将这些锡合金做成电极,拍摄它们的光谱。用测微光度计测量276.1nm锡谱线和283.3nm铅谱线。结果如下:试样编号%PbS锡线S铅线10.1261.5670.25920.3161.5711.01330.7081.4431.54641.3340.8251.42752.5120.4471.580利用题4的结果,以铅百分浓度的对数为横坐标,以lg(IPb/ISn)为纵坐标绘制工作曲线。一个未知的锡合金试样用标准试样相同的方法处理。从底片上测得276.1nm锡线的黑度为0.920,而283.3nm铅线的黑度为0.669,问未知试样中铅的百分含量为多少?解: 将已知数据转换,得到下表.试样编号%PbS锡线S铅线lgPb%ΔS=SSn-SPb10.1261.5670.259-0.9001.30820.3161.5711.013-0.5000.55830.7081.4431.546-0.150-0.10341.3340.8251.4270.125-0.60252.5120.4471.580.400-1.133样品0.4610.9200.669-0.3360.251 以ΔS对lgPb%作最小二乘法线性回归分析,得到 SSn–SPb= –1.8737 lgPb% –0.3784, R2=1 样品ΔS=SSn–SPb =0.251, 依回归方程计算得到样品中Pb的含量为Pb%=0.460 (注:lg(IPb/ISn)=lg(IPb/Io·IoISn)=SSn–SPb=ΔS) 6.已知ZnI213.856nm及ZnI307.590nm。其激发能分别为5.77eV和4.03eV,自发发射跃迁几率分别为6´108 s-1,激发态与基态统计权重的比值(gi/g0)均为3,试计算并讨论:
(1)T=5000K时,二激发态的原子密度(N1及N2)与基态原子密度(N0)的比值;(2)T=2500K,5000K及10000K时,该二谱线强度比(I1/I2);(3)根据这个计算能得到什么结论?解:玻尔兹曼公式为:,(1)T=5000K T=10000K, N1/N0=0.0037, N1/N2=0.028 通常情况下,等离子体中基态粒子数N0是该种离子总数的绝大部分. (2) Iij = Aij Ni hvij = Aij Ni hc/λij,Ni=Ni/N0×N0, A1=A2=6×108s (ⅰ)T=2500K (ⅱ) T=5000K 或利用(1)的结果:(ⅲ) T=10000K (3)通常激发温度下,基态原子数占绝大部分; 在激发温度恒定时,处于低能态的原子数大于高能态的原子数;随温度增加,I1/I2增大,N/N0也增大.7.解释下列名词电极温度 电弧温度 灵敏线 最后线 共振线 第一共振线 自吸 自蚀 分析线 内标线 均称线对 黑度 黑度换值 反衬度 惰延量 展度 雾翳黑度答:电极温度――即蒸发温度 电弧温度――即激发温度 灵敏线――元素的灵敏线一般是指强度较大的谱线,通常具有较低的激发电位和较大的跃迁几率。 最后线――由于谱线的强度与样品中元素的浓度有关,因而当元素浓度逐渐减小时,谱线数目相应减少,最后消失的谱线,称为最后线,最后线一般就是最灵敏的谱线。
共振线――由任何激发态跃迁到基态的谱线称为共振线. 第一共振线――而相应于最低激发态与基态之间跃迁产生的辐射称为第一共振线。自吸――大多数光源的中心部分的温度较高,外层的温度较低,中心部分原子所发射的谱线,会被外层处于基态的同类原子所吸收,结果谱线强度减弱。这种现象称为谱线的自吸收。自蚀――原子浓度增加有自吸发生时,谱线中心较强处的吸收比边缘部分更显著,这是因为吸收线的宽度比发射线小的缘故,吸收严重时中心的辐射有可能完全被吸收。这是自吸的极端情况,称自蚀。分析线――在分析元素的谱线中选一根谱线,称为分析线.内标线――从内标元素的谱线中选一条谱线称为内标线,这两条谱线组成分析线对。均称线对――分析线和内标线组成分析线对。激发电位和电离电位相等的分析线对称为均称线对.黑度――谱线变黑的程度简称为黑度,黑度用S表示。谱线的黑度用测微光度计测量,是利用还原银愈多愈不透明的光学性质而测量的。黑度换值――采用与黑度有关的其他黑度换值代替黑度,使乳剂特性曲线的直线部分向下延长,以扩大曲线的便于利用的直线范围。反衬度――乳剂特性曲线正常曝光部分,S = g(lgH–lgHi)= g lgH–i,式中i为常数项,g=tgα是乳剂特性曲线中间直线部分的斜率,表示当曝光量改变时黑度变化的快慢,称为感光板的反衬度.惰延量――1gHi为直线部分延长线在横轴上的截距;Hi称为感光板的惰延量,惰延量的倒数决定了感光板的灵敏度.展度――乳剂特性曲线所在横轴上的投影b称为感光板的展度,它决定了在定量分析时用这种感光板能分析含量的线性范围的大小.雾翳黑度――乳剂特性曲线曲线下部与纵轴相交的黑度S0,称为雾翳黑度。8.光谱分析仪由哪几部分组成,各部分的主要功能是什么?解:光谱分析仪由光源、分光仪和检测器三部分组成. 光源――提供能量,使物质蒸发和激发.(要求:具有高的灵敏度和好的稳定性) 分光仪――把复合光分解为单色光,即起分光作用. 检测器――进行光谱信号检测,常用检测方法有摄谱法和光电法.摄谱法是用感光板记录光谱信号,光电法是用光电倍增管等元件检测光信号.9.常用光源有哪几种,它们各有什么特点,在实际工作中应怎样正确选择。答:火焰、直流电弧、交流电弧、高压电容火花、电感耦合等离子体炬光源. 火焰:最简单的激发光源,至今仍被广泛用于激发电位较低的元素. 直流电弧光源特点: (1)阳极斑点,使电极头温度高,有利于试样蒸发,龙适用于难挥发元素; (2)阴极层效应增强微量元素的谱线强度,提高测定灵敏度; (3)弧焰温度较低,激发能力较差,不利于激发电离电位高的元素; (4)弧光游移不定,分析结果的再现性差; (5)弧层较厚,容易产生自吸现象,不适合于高含量定量分析. 直流电弧主要用于矿物和纯物质中痕量杂质的定性、定量分析,不宜用于高含量定量分析和金属、合金分析. 交流电弧光源特点:(1)弧焰温度比直流电弧稍高,有利于元素的激发;(2)电极头温度比直流电弧低,不利于难挥发元素的蒸发;(3)电弧放电稳定,分析结果再现性好;(4)弧层稍厚,也易产生自吸现象.交流电弧光源适用于金属、合金定性、定量分析. 高压电容火花光源特点: (1)电极瞬间温度很高,激发能量大,可激发电离电位高的元素; (2)电极头温度低,不利于元素的蒸发;
(3)稳定性好,再现性好; (4)自吸现象小,适用于高含量元素分析.电火花光源适用于低熔点金属、合金的分析,高含量元素的分析,难激发元素的分析.电等离子体源(ICP)的优点:(1)检出限低,可达10-3~10-4µg·g-1;(2)精密度高,可达≤1%;(3)基体和第三元素影响小,准确度高;(4)工作曲线线性范围宽,可达4~5个数量级;(5)光谱背景一般较小,多元素同时测定.电感耦合等离子体焰光源(ICP)是原子发射光谱分析理想的激发光源.ICP原子发射光谱分析(ICP-AES)的应用十分广泛,并已成为当今环境科学、材料科学及生命科学等重要领域中各种材料的元素分析的有效方法之一.另外,ICP与其他分析技术的联用也引人注目.比如,ICP为原子化器与原子吸收、原子荧光分析联用(ICP-AAS或ICP-AFS),ICP为离子源与质谱联用(ICP-MS)和ICP-AES为检测器与色谱(气相、液相)联用等.是分析液体试样的最佳光源。必须针对所分析对象的性质和分析任务的要求,考虑如下几个方面:①分析元素的性质 首先要考虑待分析元素的挥发性及它们的电离电位大小。对易挥发易电离的元素,如碱金属可以采用火焰光源。对难挥发元素可考虑采用直流电弧光源。对一些难激发的元素,可考虑采用火花光源。以利于这些元素的测定。②分析元素的含量 低含量元素需有较高的绝对灵敏度,而绝对灵敏度大小决定于激发温度和被测元素进入分析间隙的量,应采用电弧光源。而对高含量的元素,要求测定准确度较高,可采用火花光源。③试样的形状及性质 对块状金属合金,火花和电弧光源均适合,而对一些导电性差的粉末类样品,则常采用电弧光源。④光谱定性还是定量分析 定性分析要求灵敏度高,常采用直流电弧。而定量分析要求准确度高一些,常使用稳定性较好的火花光源和交流电弧,但当测定极痕量元素时,常采用灵敏度较高的直流电弧。 选择光源时要考虑一系列问题,有时这些问题是矛盾的,但是只要抓住主要矛盾,从蒸发温度、激发温度和放电稳定性三方面综合考虑,就能得到较理想的效果。10.实际测得钠原子的第一共振线波长588.994nm和589.593nm,求钠原子该两条谱线对应的共振电位是多少?解: 以eV表示,为11.什么叫摄谱仪的线色散率、分辨率及集光本领?它们各与哪些主要因素有关。答:线色散率是指在焦面上波长相差dl的二条谱线被分开的距离dl,用dl/dl表示。 棱镜摄谱仪: 由此式看出,影响dl/dλ的因素有投影物镜焦距(f),棱角的角色散率,光轴与感光板的夹角等.暗箱物镜焦距越长,光轴与感光板夹角越小,棱镜角色散率越大,则线色散率越大。 光栅摄谱仪: 由此式看出,影响dl/dλ的因素有光谱级数(m),投影物镜焦距(f),光栅常数(b)及光栅衍射角(θ),而与波长几乎无关.
d越小,m越大,线色散率越大;而增大f和θ也能增大线色散率,但受到限制.增大f,光强会减弱,增大θ,像色散严重.分辨率指分开相邻谱线的能力.可用下式表示R =,式中l为两条谱线的平均波长;dl为恰好能分辨两条谱线间的波长差.棱镜摄谱仪R =式中m为棱镜数目,b为棱镜底边长度,dn/dl为棱镜材料的色散率。可见,棱镜的数目越多及其底边越长,分辨率越大。已知dn/dl与棱镜材料和波长有关,因此,摄谱仪的分辨率也与这些因素有关。对于同一棱镜,在短波长区有较大的分辨率。分辨率与棱镜顶角、暗箱物镜焦距及光轴与感光板的夹角无关,这是与线色散率不同的。棱镜的实际分辨率比理论分辨率稍差。光栅摄谱仪R==Nm,光栅的理论分辨率与光栅的总刻线数和光谱的级次成正比. 集光本领表示摄谱仪光学系统传递辐射能的能力,常用入射于狭缝的光源亮度B为一单位时,在感光板上所得照度E来表示。摄谱仪L = 式中d/f为暗箱物镜的相对孔径,τ为入射光的辐射通量与经过一系列棱镜、透镜后透射光辐射通量之比。当棱镜数目增多,棱镜底边增大,或暗箱物镜焦距增长时,均使透射比τ变小,而使集光本领减弱.12.影响谱线强度的因素是什么,哪些是主要因素。答: (原子线) 从上式可以看出,影响谱线强度(I)的因素有: (1)激发电位(E),I与E是负指数关系,E越大,I越小; (2)跃迁几率(A),I与A成正比; (3)统计权重(g1/g2),统计权重是与能级简并度有关的常数,I与g1/g2成正比; (4)激发温度(T),T升高,I增大,但I与T关系往往是曲线关系,谱线各有其最合适的温度,在此温度时,I最大; (5)基态原子(N0),I与N0成正比,由于N0是元素的浓度(C)决定的,所以在一定条件下,N0正比于浓度C,这是光谱定量分析的依据.假如是离子线,其I除与上述因素有关外,还与元素的电离电位(V)有关.13.元素光谱性质与元素周期表之间有什么关系。答:如同元素的化学性质和物理性质一样,元素的光谱学性质在元素周期表中,也呈现周期性变化:(1)同一周期的元素,随着原子序数增大,外层价电子数也逐渐增加。因此,光谱越复杂,其谱线强度逐步减弱。(2)对于主族元素,大部分外层、次外层为s、p电子排列,所以,它们的谱线数目较少,谱线强度较大。同一主族元素,由于外层电子数目相同,电子排列相似,故它们的光谱性质很相似。(3)对于副族元素,内层d电子数已经饱和的元素,如铜、银、金、锌、镉、汞,由于外层为s电子排列,谱线简单且强度较大;而对于d电子数未饱和的铁、钨等元素,因具有外层d电子排列,谱线较复杂,强度也较弱。
(4)同一元素的离子和原子,由于外层价电子数目不同,它们的离子光谱和原子光谱截然不同。而对于z+n的n级离子和原子序数为z的原子,外层价电子数及排列相同,它们的光谱则很相似。如碳的三级离子光谱、硼的二级离子光谱、铍的一级离子光谱均和锂的原子光谱相似。(5)对于同一周期的元素,原子序数越大,第一共振电位及电离电位越高,相应第一共振线波长越短。对于同一主族元素,原子序数越大,第一共振电位及电离电位越低,相应的第一共振波长越长。究其原因,可以从价电子的状态来解释:价电子离核越远,数目越少,受核的作用越小,相应的第一共振电位于电离电位越小,第一共振线波长越长。相反,价电子离核越近,数目越多,受核的作用越大,相应的第一共振电位于电离电位越大,第一共振线波长越短。14.光谱背景是怎样产生的,有什么影响,怎样消除这种影响。答:当试样被光源激发时,常常同时发出一些波长范围较宽的连续辐射,形成背景叠加在线光谱上.即光谱背景常常是由于灼热的固体辐射的连续光谱,分子辐射的带光谱,以及分析线旁边很强的扩散线所造成,在光谱分析中谱线通常是叠加在背景之上的。 扣除背景的基本原则是,以谱线加背景的强度减去背景的强度,例如扣除的是分析线的背景,则为强度I1+Ib减去强度Ib,而不是黑度相减。先测量黑度S1+b,由乳剂特性曲线查出其对应的强度的对数1gI1+b,从而求出I1+b。再在分析线近旁测量出背景的黑度Sb.由乳剂特性曲线查出其对应的强度Ib,因I1=I1+b – Ib,即可求出分析线强度I1,用同样方法,也可扣除内标线的背景,求出内标线强度I0,分析线对的强度比,应用扣除背景后的1gR或换算成DS进行工作。 从理论上讲,背景会影响分析的准确度应予以扣除.在摄谱法中,因在扣除背景的过程中,要引入附加的误差,故一般不采用扣除背景的方法,而针对背景产生的原因,尽量减弱、抑制背景,或选用不受干扰的谱线进行测定.15.光谱标样的制备要求有哪些?答:(1)选择一套含量不同的分析试样,用不同的化学方法独立测定,以获得可靠数据,作为原始标准。(2)用不含被测成分的同类物质作为基准物,加入一定量的欲测元素,配制成一系列含量范围的标准试样。(3)进行岩石、矿物分析时,如找不到不含欲测元素的空矿,可以用人工合成的方法制备基准物,然后加入待测元素,制成一套标准样品。不论用哪种方法制备光谱标准样品,都必须满足以下条件:(1)标准样品化学成分应极为准确。(2)标准样品中各成分分布极为均匀。(3)标准样品的尺寸、形状、热处理过程、物理性能和制造方法应与待测样品相同。(4)标准样品基体成分应与待测试样相同或尽可能接近。(5)标准样品要有足够的稳定性,特别是待测元素的含量,应在长时期内保持不变。16.如何提高光谱分析的灵敏度和准确度。答:灵敏度光谱分析中灵敏度的表示,同一般分析化学中采用的表示法类似,即绝对灵敏度(检出限)和相对灵敏度(最低浓度),而更有意义的是绝对灵敏度(检出限),其公式为:即检出限近似等于均方误差的三倍。光谱分析的灵敏度与光源中分析线与背景强度比,谱线的自吸系数b(一般很小)与感光板的反衬度、黑度测量误差
有关,而且与摄谱仪的集光本领、感光板灵敏度、光源亮度有关。一般说来,分析线与背景强度比越大,谱线自吸系数越小,感光板反衬度越大,黑度测量误差越小,灵敏度就越高;摄谱仪的集光本领越大,感光板的灵敏度越高,光源亮度越大,也能提高灵敏度。准确度 光谱分析的准确度决定于测定系统中偶然误差和系统误差总和——分析总误差。要提高光谱分析的准确度,要求尽可能降低测定系统的偶然误差和系统误差。光谱分析偶然误差的来源:1. 分析试样和标准样品不均匀的误差2. 光源不稳定的误差3. 感光板不均匀的误差4. 分析结果处理的有关误差而光谱分析的系统误差则有以下几个方面:1. 仪器构件不准确或校正不当的误差,如阶梯减光器2. 仪器本身误差,如狭缝的不当改变3. 光源电路条件变化引起的误差,如电压变化4. 分析试样的组成、物理和化学状态与标准样不一致而引起的误差。有效减少或消除光谱分析存在的偶然和系统误差是提高光谱分析准确度的有效途径。 消除系统误差和偶然误差.第六章 原子吸收分光光度法 1.试比较原子吸收分光光度法与紫外-可见分光光度法有哪些异同点?答:相同点: 二者都为吸收光谱,吸收有选择性,主要测量溶液,定量公式:A=kc,仪器结构具有相似性.不同点: 原子吸收光谱法 紫外――可见分光光度法 (1) 原子吸收 分子吸收 (2) 线性光源 连续光源 (3) 吸收线窄,光栅作色散元件 吸收带宽,光栅或棱镜作色散元件 (4) 需要原子化装置 (吸收池不同) 无(5) 背景常有影响,光源应调制(6) 定量分析 定性分析、定量分析(7) 干扰较多,检出限较低 干扰较少,检出限较低 2.试比较原子发射光谱法、原子吸收光谱法、原子荧光光谱法有哪些异同点?答:相同点:属于原子光谱,对应于原子的外层电子的跃迁;是线光谱,用共振线灵敏度高,均可用于定量分析. 不同点: 原子发射光谱法 原子吸收光谱法 原子荧光光谱法 (1)原理 发射原子线和离子线 基态原子的吸收 自由原子(光致发光) 发射光谱 吸收光谱 发射光谱 (2)测量信号 发射谱线强度 吸光度 荧光强度 (3)定量公式 lgR=lgA+blgc A=kc If=kc (4)光源作用不同 使样品蒸发和激发 线光源产生锐线 连续光源或线光源 (5)入射光路和检测光路 直线 直线 直角 (6)谱线数目 可用原子线和 原子线(少) 原子线(少)离子线(谱线多) (7)分析对象 多元素同时测定 单元素 单元素、多元素 (8)应用 可用作定性分析 定量分析 定量分析
(9)激发方式 光源 有原子化装置 有原子化装置 (10)色散系统 棱镜或光栅 光栅 可不需要色散装置 (但有滤光装置) (11)干扰 受温度影响严重 温度影响较小 受散射影响严重 (12)灵敏度 高 中 高 (13)精密度 稍差 适中 适中 3.已知钠蒸气的总压力(原子+离子)为1.013´l0-3Pa,火焰温度为2500K时,电离平衡常数(用压力表示)为4.86´l0-4Pa。试计算: (1)未电离钠原子的分压和电离度; (2) 加入钾为缓冲剂,电子分压为为1.013´l0-2Pa时未电离的钠原子的分压。 (3) 设其它条件(如温度等)不变,加入钾后的钠原子线发射强度和吸光度的相对变化。 [提示:火焰气态原子行为可近似看成“理想”气体,即p=nkT。火焰气体的电离忽略不计]解:(1)Na==Na+ +e a b b 则未电离的钠原子的分压为5.135×10-4Pa 电离度 (2)加入钾缓冲剂 即 则钠原子占总的分数为 (3)A=K’N0, N0为基态原子数.(Iij = Aij E i N1, ) A1=K’·0.506N, A2=K’·0.954N 4.设测定硅时,N2O-乙炔焰温度为3000±100K,SiI251.9nm上能级的能量为4.95eV,下能级的能量为0.0279eV。试计算谱线发射强度及吸光度因温度变化引起的相对波动(即DI / I及DA / A值)。[提示:从温度变化导致波耳兹曼因子e-E/kT变化去考虑]解:已知λ=251.9nm, k=1.380×10-23J·K-1, 用eV表示为k=8.614×10-5eV·K-1,谱线251.9nm对应的能量为4.95eV,在此温度下,基态原子数占绝大多数,认为N0代替总的原子数N.
则于是将Ni对T求导数,得到(1)发射线强度与激发态原子数成正比,则温度变化引起的谱线发射强度的相对变化为 (Ei=4.95– 0.0279=4.922eV)T=2900K时,T=3000K时,T=3000K时, (2)吸光度A与基态原子数成正比,于是温度变化引起的吸光度相对波动为 统计权重比为1T=2900时,T=3000时,T=3100时,5.用原子吸收法测定元素M时。由未知试样得到的吸光度为0.435,若9毫升试样中加入1毫升100mg·L-1的M标准溶液,测得该混合液吸光度为0.835.问未知试液中M的浓度是多少?解:标准加入法 解得cx=9.81mg·L-16.测定镍时所得数据如下: 吸光度加入镍量/µg·200mL-1空 白样 品0.00200.00900
0.02140.02842.000.04140.04844.000.06070.06776.00 应用标准加入法求出样品中的镍含量。解:此系标准加入法,但空白视为一个样品,亦需作标准加入线,分别求出Fe含量,然后相减,或将两条线作在一张图上,直接取差值。 V空白=0.2,V样品=0.9143,V实际=V样品–V空白=0.714 ck0=0.700 cx=0.714/200=3.57×10-3µg·mL-17.试指出下列说法的错误:(1)原子吸收测量时,采用调制光源也可以消除荧光干扰。 (2) 原子荧光是一种受激发射。(3)原子化器温度越高,自由原子密度越大。(4)用氘灯校正背景时,氘灯同时起着内标线的作用,可以校正附随物质的干扰效应。答:(1)荧光产生是由于受光源来的光刺激产生的,从光源来的光成为调制信号,那么由此引起的荧光也会成为调制信号,因此不能消除荧光干扰。 (2) 对于处于高能级i的粒子,如果有频率恰好等于(Ei-Ej)/h的光子接近它时,它受到这一外来光子的影响,而发射出一个与外来光子性质完全相同的光子,并跃迁到低能级j。这类跃迁过程为受激发射。受激发射产生的是与激发光同等性质的光. 气态原子吸收辐射能后跃迁至高能态,在很短时间内(约10-3s),部分将发生自发的辐射跃迁而返回低能态或基态,这种二次辐射即为原子荧光。原子荧光波长可以与辐射光的波长不同。 (3)原子化器温度越高,激发态原子密度越大,基态原子密度变小。对易电离的元素,温度高,容易电离。 (4)氘灯产生连续辐射,仅能校正背景,起不到内标线的作用。干扰线比氘灯谱带宽度窄得多,则吸收近似为0,不能校正.8.在原子吸收分析中为什么要使用空心阴极灯光源?为什么光源要进行调制?解:原子吸收光谱分析的光源应当符合以一基本条件:(1)谱线宽度“窄”(锐线),有利于提高灵敏度和工作曲线的线性;(2)发射线、吸收线中心频率完全一致;(3)谱线强度大、背景小,有利于提高信噪比,改善检出限;(3)稳定,有利于提高测量精密度;(4)灯的寿命长. 空心阴极灯:(1)阴极元素与被测元素完全一致,中心频率与吸收线频率完全相同.(2)发射的谱线半宽度窄,是锐线光源。产生锐线的原因:这与灯本身的构造和灯的工作参数有关系。从构造上说,它是低压的,故压力变宽小;从工作条件方面,它的灯电流低,故阴极强度和原子溅射也低,故热变宽和自吸变宽较小。正是由于灯的压力变宽、热变宽和自吸变宽较小,致使灯发射的谱线半宽度很窄。调制原因:为了消除热激发自发发射的干扰,对光源进行调制,使光源发射的信号成为交变信号。因此在一定温度下热激发自发发射是一个恒定的直流量,就可以与空心阴极灯的发射相区别。光源调制方法:电调制――方波脉冲电源供电;机械调制。9,用氘灯校正背景时,设单色仪的倒线色散率为7nm·mm-1,其出射狭缝与入射狭缝几何宽度均为0.1mm,若吸收线的半宽度为0.002nm,试计算:(1)单色仪的有效带宽为多少nm? (2) 线吸收最大使氘灯透射强度减少的百分数。解:(1)单色仪的有效带宽为W=7×0.1=0.7nm (2)0.002/0.7=0.3%
10.原子荧光分光光度计的构造有何特点?为什么?答:原子荧光分光光度计的基本构造与原子吸收仪器相似,但光源应置于与单色仪光轴相垂直的位置,目的是为了消除透射光以荧光测量的干扰。 激发光源必须进行调制,消除原子化器中被测原子热激发自发发射的干扰。 光源强度大,检测器放大倍数高,以提高测定的灵敏度。11.原子吸收分析的灵敏度定义为能产生1%吸收(即0.0044吸光度)时,试样溶液中待测元素的浓度(单位:mg/mL/1%或mg/g/1%)。若浓度为0.13mg·mL-1的镁在某原子吸收光谱仪上的测定吸光度为0.267。请计算该元素的测定灵敏度。解:依条件,有 x=2.14×10-3µg·mL-112.原子吸收分光光度法所用仪器有哪几部分组成,每个主要部分的作用是什么?答:单光束原子吸收分光光度计由光源、原子化器、单色器和检测系统四部分组成。光源:发射待测元素的特征谱线,供吸收测量用。 原子化器:将被测试样气化分解,产生气态的基态原子,以便吸收待测谱线。 分光系统(单色器):将欲测的谱线发出并投射到检测器中,滤除其它非吸收谱线的干扰。 检测系统:使光信号转化为电信号,经过放大器放大,输入到读数装置中进行测量。(1)光电元件――把来自分光系统的光吸收信号转变成便于放大、读数的电信号;(2)放大器――将电信号放大,并有效消除火焰中待测元素热激发自发发射的干扰;(3)读数装置――读出透光率或吸光度。13.怎样评价一台原子吸收分光光度计的质量优势?答:进行微量和痕量组分分析时,分析的灵敏度和检出限是评价分析方法和仪器的重要指标.(1)灵敏度:原子吸收光谱中,用1%吸收灵敏度.越小越好.特征浓度、特征质量。 (µg·mL-1) cx――待测元素浓度;A――多次测量的吸光度。(2)检出限:以特定的方法,以适当的置信水平被检出的最低浓度或最小量。 D=3δc/Am (D=3S0/S) S0――空白溶液多次测定的标准偏差;S――灵敏度。(3)精密度好.用相对标准偏差表示。14.原子吸收光谱线为什么是有一定宽度的谱线而不是波长准确等于某一值的无限窄谱线,试分析分析谱线宽度变宽的原因。答:(1)自然宽度 原子吸收线的自然宽度与激发态的平均寿命有关。激发态的原子寿命越长,则吸收线的自然宽度越窄,其平均寿命约为10-8s数量级。一般来说,其自然宽度为10-5nm数量级.(2)多普勒变宽 它是由于原子无规则的热运动而产生的,故又称为热变宽。多普勒变宽随着原子与光源相对运动的方向而变化,基态原子向着光源运动时,它将吸收较长波长的光。反之,原子离开光源方向运动时,它将吸收较短波长的光。由于原子无规则的热运动将导致吸收线变宽,多普勒变宽的程度大约为10-4~10-3nm。原子化温度越高,多普勒变宽越严重.(3)劳伦茨变宽 被测原子与其它原子或分子相互碰撞,使其基态能级稍有变化,从而导致吸收线变宽,又称为碰撞变宽。变宽程度约为10-4~10-3nm数量级.15.原子吸收分光光度法有哪些干扰,怎样减少或消除。答:干扰有以下几种: 光谱干扰:由于原子吸收光谱较发射光谱简单,谱线少,因而谱线相互重叠的干扰少,绝大多数元素的测定相互之间不会产生谱线重叠的光谱干扰,但仍有少数元素相互间会有某些谱线产生干扰。消除方法:改用其它吸收线作分析线。
电离干扰:原子失去一个电子或几个电子后形成离子,同一元素的原子光谱与其离子光谱是不相同的。所以中性原子所能吸收的共振谱线,并不被它的离子吸收。火焰中如果有显著数量的原子电离,将使测得的吸收值降低。消除方法:加入电离缓冲剂,抑制电离的干扰。化学干扰:指火焰中由于待测元素与试样中的共存元素或火焰成分发生反应,形成难挥发或难分解的化合物而使被测元素的自由原子浓度降低而导致的干扰。常见的化学干扰可分为阳离子干扰和阴离子干扰。消除方法:采用温度较高的火焰可以消除或减轻形成难挥发化合物所造成的干扰,也可以用加入“释放剂”的办法消除干扰。 背景干扰:背景干扰主要来自两个方面;一是火焰或石墨炉中固体或液体微粒及石墨炉管壁对入射光的散射而使透射光减弱,这种背景称为光散射背景;另一来源是火焰气体和溶剂等分子或半分解产物的分子吸收所造成的背景干扰。消除方法:改用火焰(高温火焰);采和长波分析格;分离和转化共存物;扣除方法(用测量背景吸收的非吸收线扣除背景,用其它元素的吸收线扣除背景,用氘灯背景校正法和塞曼效应背景校正法)。 盐效应和溶剂效应等。16.原子吸收分光光度法定量分析什么情况下使用工作曲线法,什么情况下使用标准加入法。答:工作曲线法:为保证测定的准确度,要注意以下几点: ①虽然原子吸收测定较原子发射法受试样组成的影响较小,但标准溶液的组成也应尽量与试样溶液接近,尤其是对于固体样品(如合金)中微量杂质的测定,应采用组成相近的标样经相同的溶样过程配制标准溶液。 ②标准溶液的浓度范围应在浓度与吸光度的线性关系范围内,并使吸光度读数在0.1~0.7之间为宜。 ③测定中应以空白溶液来校正吸光度零点,或从试样的吸光度中扣除空白溶液的吸光度。④标准液做工作曲线的操作过程和测定的操作过程,应保持光源、喷雾、燃气与助燃气流量、单色器通带及检测器等操作条件恒定。标准加入法当试样组成的影响较大,又没有合适的标样时,或个别样品的测定的情况下往往采用标准加入法,它有外推法和计算法。第七章 电化学分析法导论1.对于下述电池,(1)写出两电极上的半电池反应;(2)计算电池的电动势;(3)如题中的写法,这些电池是原电池还是电解池?假设温度为25℃,活度系数均等于1。① Pt|Cr3+(1.0×l0-4 mol·L-1), Cr2+(1.0×10-1 mol·L-1)‖Pb2+(8.0×10 –2mol·l-1)│Pb已知 Cr3+ +e ⇌ Cr2+ E= –0.41V Pb2+ +2e ⇌ Pb E= –0.126V解:(a)半电池反应:阳极 Cr2+ – e ⇌ Cr3+ 阴极 Pb2+ +2e ⇌ Pb (b) V
(c)由于EC>0,所以为原电池. ② Cu|CuI(饱和),I-(0.100mol·L-1)‖I-(1.00×10-3 mol·L-1),CuI(饱和)|Cu已知 Cu+ +e ⇌ Cu E=0.521V KSP,CuI=1.1×10-12解:(a) 半电池反应:阳极 Cu – e ⇌ Cu+, Cu – e+I- ⇌ CuI阴极 Cu+ +e ⇌ Cu, CuI+e ⇌ Cu+I- (b) V (c) 由于EC>0,所以为原电池.2.计算下述反应的标准电位 +2e⇌Zn+2已知络合物的生成常数为2.3×107 ,Zn2++2e⇌Zn的E= –0.763V解: 所以V3.根据以下标准电位Ag2CrO4+2e⇌2Ag+ E=0.446VAg++e⇌Ag E=0.799V计算Ag2CrO4的溶度积常数。解: 当[CrO42-]=1.00mol·L-1时,
Ksp=1.08×10-124.有0.03A电流流过以下电池Pt│V3+(1.0×10-5mol·L-1),V2+(1.0×10-1 mol·L-1)║Br-(2.0×10-1mol·L-1),AgBr(饱和)│Ag电池最初的内阻为1.8Ω,计算电池最初的电动势(端电压)。已知 V3++e⇌V2+ E=– 0.255VKSP,AgBr=7.7×10-12解:EiR=0.03×1.8=0.054V VE端=E电池 –EiR=0.675– 0.054=0.621V5.标准甘汞电极与铂电极同置于Sn4+ 和Sn2+ 离子溶液中,甘汞电极为正极,25℃时,电动势是0.07V。计算该溶液中Sn4+ 与Sn2+ 离子的比率。解:ENCE=0.280V,E0Sn4+/Sn2+=0.150V 即 则 6.决定电化学电池的阴、阳极和正、负极的根据各是什么?答:凡是电极反应是氧化反应的,称此电极为阳极(anode);电极上发生的是还原反应的,称此电极为阴极(cathode)。 同时按物理学规定:电流的方向与电子流动的方向相反,电流总是从电位高的正极(positivepole)流向电位低的负极(negativepole)。电极的正和负是由两电极的电极电位相比较,正者为正,负者为负。7.举出第二类电极、第三类电极的例子,并试推导其电极电位表示式。答:第二类电极:Ag êAgC1êCl- AgC1+e⇌Ag+C1- AgC1+e⇌Ag+C1- EAgCl/Ag –又例如,甘汞电极 Hg êHg2C12 êC1- Hg2Cl2+e⇌ Hg+Cl- EHg2Cl2/Hg– 第三类电极:Ag2C2O4,CaC2O4 ,Ca2+︱Ag是指金属及其离子与另一种金属离子具有共同阴离子的难溶盐或难离解的络离子组成的电极体系,典型例子是草酸盐:Ag2C2O4,CaC2O4, Ca2+︱Ag
例如,EDTA与汞及另一金属离子(Ca2+)形成的电极体系 Hg êHgY2-,CaY2-,Ca2+电极反应为 HgY2-+Ca2+ +2e ⇌ Hg+CaY2-电极电位为 常数+8.什么是参比电极?在电分析中,对参比电极通常有哪些要求?答:电极电势已知、恒定,且与被测溶液组成无关,则称之为参比电极。 (1)电极反应可逆,符合Nernst方程;(2)电势不随时间变化;(3)微小电流流过时,能迅速恢复原状;(4)温度影响小.虽无完全符合的,但一些可以基本满足要求.对于参比电极应满足三个条件:可逆性,重现性和稳定性。衡量可逆性的尺度是交换电流.如果电极有较大的交换电流,则使用时如有微量电流通过,其电极电位仍能保持恒定,所以参比电极都是难以极化的.重现性是指当温度或浓度改变时,电极仍能按能斯特公式响应而无滞后现象,以及用标准方法制备的电极应具有相似的电位值.稳定性是指在测量时随温度等环境因素影响较小.9.举例说明:在25℃时,某电极的电极电位值,如何由相对于标准氢电极换算为相对于饱和甘汞电极。答:ESCE=ENHE – 0.242 比如银电极的标准电位为V(vsNHE) V(vsSCE)10.一电池由下列物质组成:银电极,未知Ag+溶液,盐桥,饱和KCl溶液,Hg2Cl2(s),Hg(1)。(1)写出其电池符号;(2)哪一个电极是参比电极?哪一个电极是指示电极?(3)盐桥起什么作用?该盐桥内应充以什么电解质?答:(1)Hg(l)|Hg2Cl2(s),KCl(饱和)‖Ag+(x mol·L-1)|Ag(s) (2)饱和甘汞电极为参比电极,银电极为指标电极 (3)盐桥的作用:接通电路,消除或减小液接电位;KNO3(通常,盐桥内充饱和KCl溶液)11.阐明并区分下列术语的含义 (1)指示电极 工作电极(2)极化电极 去极化电极答:(1)指标电极――指示电极用于测定过程中溶液主体浓度不发生变化的情况,即指示电极用于指示被测离子的活(浓)度。 工作电极――工作电极用于测定过程中主体浓度会发生变化的情况。因此,在电位分析中的离子选择电极和极谱分析法中的滴汞电极应称为指示电极。在电解分析法和库仑分析法中的铂电极,是被测离子起反应的电极,它能改变主体溶液的浓度,应称为工作电极。 (2)极化电极――当电极电位完全随外加电压的改变而改变时,或者当电极电位改变很大而电流改变很小,即di/dE值很小时,这种电极称为极化电极。 去极化电极――当电极电位的数值保持不变,即不随外加电压的改变而改变,或者当电极电位改变很小而电流改变很大,即di/dE值很大时,这种电极称为去极化电极.第八章 电位分析法
1.下述电池用于测定pAg︱Ag2CrO4(饱和),(x mol·L-1)‖SCE(1)不计液接电位导出电池电动势与p的关系式。(2)测得电池电动势为-0.285V,计算p。 已知 Ag+ +e ⇌Ag E=0.799V ; 解:(1) Ksp=[Ag+]2[CrO42-] 所以 () (2)E电池=-0.285V ([CrO42-]=1.80×10-3mol·L-1 )2.一个天然水样中大约含有1.30´l03μg·mL-1 Mg2+ 和4.00´l02 mg·mL-1Ca2+,用Ca2+离子电极直接法测定Ca2+ 浓度。求有Mg2+ 存在下测定Ca2+ 含量的相对误差。已知Ca2+电极对Mg2+的选择性系数为0.014。解:3.测得下述电池的电动势为0.275V.Mg2+ 离子选择电极︱Mg2+(a=1.15´l0-2 mol·L-1)‖ SCE(1)用未知溶液取代已知镁离子活度的溶液后,测得电池的电动势为0.412V,问未知液的pMg是多少?(2)假定由液接电位造成的误差为±0.002V,则Mg2+ 离子活度的真实值在什么范围以内?解: E电池=ESCE-E膜+E接界= 依条件,有 则K=0.218 (1)因为
aMg2+=2.65×10-7mol·L-1 (pMg=6.58) (2)ΔE=±0.002V, 即 ΔpMg=±0.078, pMg=6.51~6.65 则aMg2+的范围:2.27×10-7~3.10×10-7mol·L-1 或 aMg2+1=2.27×10-7mol·L-1 aMg2+2=3.10×10-7mol·L-1 或 Δc=±0.156×c=±0.156×2.65×10-7=±0.41×10-7 mol·L-14. 测得下述电池的电动势为0.672V。Pt,H2(1.013´105 Pa)︱HA(0.200mol·L-1),NaA(0.300mol·L-1)‖SCE计算弱酸HA的电离常数,液接电位忽略不计。解:液接电位忽略不计,已知E=0.672V即 Ka=7.73×10-8 5.取10mL含氯离子水样,插入氯离子电极和参比电极,测得电动势为200mV,加入0.1mL0.1mol·L-1的NaC1标准溶液后电动势为185mV。已知电极的响应斜率为59mV。求水样中氯离子含量。解:已知E1=0.200V, E2=0.185V 下式减上式,得 则cx=1.26×10-3mol·L-1 6.用氟离子选择电极测定天然水中的氟离子的含量。取水样25.00mL,用离子强度调节剂稀释至50.00mL,测得其电位为88.3mV。若加入5.0´10-4mol·L-1的标准氟离子溶液0.50mL,测得的电位为68.8mV。然后再分别加入标准氟离子溶液0.50mL并依次测定其电位,得到下列数据(空白值为0):次数 0 1 2 3 4 5
E/mV 88.3 68.8 58.0 50.5 44.8 40.0已知该氟离子选择电极的实际斜率为58.0mV/pF-。试分别用标准加入法和格氏作图法(空白试验直线通过0点).求天然水中氟离子的含量。解:标准加入法: 则天然水中F-含量为:4.23×2=8.46×10-6mol·L-1采用格氏作图法,结果为:8.40×10-6mol·L-17.下述电池:玻璃电极│H+(未知液或标准缓冲液)‖SCE25℃时测得pHs=4.00的缓冲液的电动势为0.209V。当缓冲液由未知液代替,测得的电动势分别为:(1)0.312V;(2)–0.017V;计算未知液的pHx值。解: K=E电池–0.059pH=0.209 – 0.059×4.00= –0.027 (1) (2) 或依条件,有 (1) (2) 8.某pH计的指针每偏转1个pH单位,电位改变60mV。今欲用响应斜率为50mV/pH的玻璃电极来测定pH=5.00的溶液,采用pH=2.00的标准溶液定位,测定结果的绝对误差为多大(用pH表示)?而采用pH为4.01的标准溶液来定位,其测定结果的绝对误差为多大?由此可得到何重要结论?解:E电池=K + S·pH 120=K +50×2(pH=2.00定位) 得到K=20E测=20+50×5=270mV,E理=5×60=300mV则ΔE= –30mV,即–0.5pH或pHx=pHs +ΔE/60 pHx=2.00+(250–100)/60=4.50 ΔpH=4.50–5.00= –0.5 试液和标准溶液pH值之差所引起的电位变化为: ΔE=50×(5.00–2.00)=150mV ΔE相当于pH值的改变为:ΔpH=150/60=2.50pH 实际测量得到的pH值为:2.00+2.50=4.50
故绝对误差为:4.50–5.00= –0.50pH若以pH=4.01的标准溶液来定位,同上得到: ΔE=50×(5.00 – 4.01)=49.5mV ΔE相当于pH值的改变为:ΔpH=49.5/60=0.83pH 实际测量得到的pH值为:4.01+0.83=4.84 故绝对误差为:4.84–5.00= –0.16pH 由上得到一个重要结论:选用不同pH值标准溶液定位,其绝对误差不同.为了得到精确结果,应选用与试液pH值相近的标准溶液定位.9.用混合溶液法测定中性载体电极膜K+离子电极的选择性系数得如下数据: [K+]/mol·L-1 10-5 10-4 10-3 10-2 10-1 1.0E/mV –38 –38 –23 –8 6 21[Na+]=10-1 mol·L-1。计算KK+·Na+。解:后四点:E=14.6lgcK+ +20.9, R2=0.998 当E= –38mV时, cK+ =3.26×10-4mol·L-1 则mol·L-110.两支性能相同的氟电极,分别插入体积为25mL的含氟试液和体积为50mL的空白溶液中(两溶液含相同的离子强度调节剂)。两溶液间用盐桥相连接,测量此电池的电动势。向空白溶液中滴加浓度为1×10-4 mo1·L-1的氟离子标准溶液,直至电池电动势为零,所消耗标准溶液的体积为5.27mL。计算试液的含氟量。解:mol·L-1 即mg·L-111.为什么不能用伏特计或普通电位计来测量玻璃电极组成的电动势?用玻璃电极测量溶液的pH值时,为什么要用标准缓冲溶液校准?答:离子选择电极的内阻很高,尤其以玻璃电极为最高,可达108Ω数量级,故不能采用普通电位计来测量其电位,否则会引起较大的测量误差. 若用普通电位计测量电极所组成电池的电动势时,其指示平衡点的检流计的灵敏度为10-9A(即电流的测量误差可低至10-9A),玻璃电极的内阻为108Ω.当微小电流(10-9A)流经电极时,由于电压降所引起的电动势测量误差可达:ΔE=Δi×R=10-9×108=0.1V 电动势的测量误差为0.1V,它相当于近1.7个pH单位.因此,不能用普通电位计或伏特计来测量玻璃电极的电位.为了消除或样正液接电位和不对称电位,用标准缓冲溶液校准仪器.测定结果的准确度,首先决定于标准缓冲溶液pHS值的准确度。用于校准pH电极的标准缓冲溶液必须仔细选择和配对。此外,还应使标准缓冲溶液和未知溶液的pH值和组成尽可能接近,这样可以减小测定误差。液接电位和不对称电位恒定不变. 酸度计是以pH单位作为标度的,在25℃时,每单位pH标度相当于0.059V的电动势变化值.测量时,先用pH标准溶液来校正酸度计上的标度,使指示值恰恰为标准溶液的pH值.换上试液,便可直接测得其pH值.由于玻璃电极系数不一定等于其理论值(在25℃时,0.059V/pH),为了提高测量的准确度,故测量时所选用的标准溶液pH值应与试液的pH值相接近.12.为什么离子选择性电极对待测离子具有选择性?如何估量这种选择性?
答:离子选择性电极,都具有一个传感膜,或称敏感膜,是离子选择性电极的最重要的组成部分,也是决定该电极的性质的实体。膜电极组成的半电池,没有电极反应;相界间没有发生电子交换过程。表现为离子在相界上的扩散,用Donnan膜理论解释。不同敏感膜对不同的离子具有选择的透过性,因此具有选择性. 电位选择性系数Ki·j来估量离子选择性电极对待测离子的选择性.13.若离子选择电极的电位表达式为: E=常数+lg(ai+Ki·j)试问:(1)Ki·j>>1时,该离子选择电极主要响应什么离子?什么离子干扰?(2)Ki·j<>1时,该离子选择电极主要响应j离子,i离子干扰.(2)Ki·j<>r,R≈R+r,才可视为与E相等。保证千分之一的测量准确度,仪器的输入阻抗应是电池内阻的1,000倍以上,即离子电极内阻若为108Ω数量级,则要求离子计的输入阻抗必须大于1011Ω。这是离子选择电极法的测量仪器和实验技术必须保证的基本条件。16.电位滴定法有哪些类型?与普通化学分析中的滴定方法相比有何特点?并说明为什么有这些特点?答:电位滴定法的类型有四种:(1)酸碱滴定;(2)氧化还原滴定;(3)沉淀滴定;(4)络合滴定. 电位滴定的基本原理与普通容量分析相同,其区别在于确定终点的方法不同,因而具有下述特点:(l)准确度较电位法高,与普通容量分析一样,测定的相对误差可低至0.2%.(2)能用于难以用指示剂判断终点的浑浊或有色溶液的滴定. (3)用于非水溶液的滴定.某些有机物的滴定需在非水溶液中进行,一般缺乏合适的指示剂,可采用电位滴定. (4)能用于连续滴定和自动液定,并适用于微量分析. 原因:采用仪器记录滴定过程中相应量的变化,克服了手工操作带来的误差.第九章 电解分析法和库仑分析法1.某电解池的内阻为0.5W,铜在硫酸铜溶液中的分解电压为1.35V,问要获得0.75A的电解电流(假设在此电流密度下浓差极化可以忽略不计),外加电压应是多少?解:r=0.5, Ea=1.35V, i=0.75A E外=E外 + ir=1.35+0.75×0.5=1.725V
2.一个0.1mo1·L-1 CuSO4溶液,其中H2SO4的浓度为1mol·L-1,用两个铂电极进行电解,氧在铂上析出的超电位为0.40V,氢在铜上析出的超电位为0.60V。 (1)外加电压达到何值Cu才开始在阴极析出。 (2)若外加电压刚好等于氢析出的分解电压,当电解完毕时留在溶液中未析出的铜的浓度是多少?解:(1)V V E外=Ea +ηa–Ec=1.22+0.40-0.307=1.313V (2) 即Ec= –0.60V [Cu2+]=1.73×10-32mol·L-1 3.有人建议用电解沉积法分离含0.800mol·L-1 Zn2+ 和0.060mol·L-1 Co2+的溶液中的阳离子。 (1)假定这一分离可以实现,试指出哪一种阳离子将被沉积,哪一种阳离子仍留在溶液中? (2)假定以1.0´10–6 mo1·L-1的残留浓度为定量分离的一个合理标志,为达到这一分离必须让阴极电位控制在(如果存在的话)什么范围内(对饱和甘汞电极)?解:[Zn2+]=0.800mol·L-1 [Co2+]=0.060mol·L-1(1)V V 金属离子在阴极还原析出,析出电位正者先析出,所以Co2+先沉积,Zn2+后沉积. (2)ESCE=0.242V, [Co2+]=1.0×10-6mol·L-1 V V(vsSCE) 控制阴极电位:–0.454~ –0.766V(vsNHE) –0.696~ –1.008V(vsSCE)4.一个炼焦厂下游河水中的含酚量用库仑法进行测定。为此,取100mL水样,酸化并加入过量KBr,电解产生的Br2同酚发生如下反应: C6H5OH+3Br2 ⇌ Br3C6H2OH+3HBr 电解电流为0.0208A,需要580s。问水样中含酚量为多少(μg·mL-1)?解:100mL水样 μg
则水样中酚含量为:μg·mL-1 5.10.0mL电镀液样品中的氰化物浓度用电发生的氢离子滴定至甲基橙终点。在43.4mA电流流过3min22s后颜色发生变化。计算每升溶液中NaCN的克数。解:H2O, i=4.4mA, t=202s CN- HCN 甲基橙变色,1e 1H+ 1HCN g·L-1 6.水样中的H2S含量用电发生碘加以检验。在25.0mL水中加入3.00g碘化钾后,需通66.4mA电流7.25min进行滴定,反应为 H2S+I2 ⇌ S+2H+ +2I-试以每升样品中H2S的毫克数表示所得H2S的浓度。解:i=66.4mA, t=7.25min=435s mg·L-1 7.阐明为什么有些比氢更活泼的金属可以从酸溶液中用电解法沉积下来。答:因为在电解时,H2在阴极有超电位,使得水电解析出氢的电位变负. 8.阐明为什么间接库仑滴定法比直接恒流库仑法更为实用。答:间接库仑滴定法比直接恒电流库仑法更易控制电流效率为100%. 库仑分析的理论依据是Farady(法拉第)定律,只有当电流效率为100%时,通过溶液或者电解时所消耗的电量才能完全用于被测物质进行电极反应.恒定电流对被测物质进行电解,很难保证电流效率为100%. 9.试比较电解分析和库仑分析的相似处和不同点。答:相同点:都是电解过程,不需要基准物质或标准溶液,可测定高含量组分.都可分为控制电位和控制电流两种方法. 不同点:电解分析用于电重量分析或分离.库仑分析是依据法拉第定律,测定电解过程中消耗的电量.可用于痕量组分的分析. 10.解释超电位、超电压、反电动势、去极化剂。答:超电位――实际电位与它的可逆电位之间的偏差称为超电位。对于阳极,它的超电位称为阳极超电位(ha),其值为正值。对于阴极,它的超电位称为阴极超电位(hc),其值为负值。超电压――实际分解电压与理论分解电压之差称作超电压。反电动势――电解时,电极本身所构成的原电池的电动势,称为反电动势.对于可逆过程来说,分解电压在数值上等于它本身所构成的原电池的电动势.去极化剂――在电解时,可加入一种物质(氧化剂或还原剂),使它优先在电极(阴极或阳极)上反应(还原或氧化),维持电极(阴极或阳极)电位不变,以防止电极(阴极或阳极)干扰反应的发生,这种物质则称为去极化剂(阴极去极化剂或阳极去极化剂)。 11.试比较控制电流电解法和控制阴极电位电解法的特点,并说明其原因。答:控制电流电解法的特点: 仪器装置简单,准确度高,但选择性差.主要分离电动序中氢以上和氢以下的金属. 原因:电流不变,外加电压增大,易达到其它组分的析出电位. 控制阴极电位电解法的特点:
选择性好,有测量和控制阴极电位的设备,参与阴极反应的常常只有一种物质.阴极电位不变,外加电压减小,电流逐渐减小,选择性高.只要阴极电位选择得当,可以使共存金属离子依次先后在阴极上分别析出,实现分离或送还上分别定量测定.第十章 伏安法和极谱分析法 1.在0.10mol·L-1 KCl溶液中锌的扩散电流常数为3.42.问0.00200mol·L-1的锌溶液,所得的扩散电流在下列条件下各为多少(微安)?所用毛细管汞滴落时间分别为3.00s,4.00s和5.00s,假设每一滴汞重5.00mg。解:平均扩散电流公式为 扩散电流常数,汞滴质量为5mg,c=0.00200mol·L-1=2mol·L-1(1) τ =3.00S, mg·s-1 则µA(2) τ =4.00S, mg·s-1 则µA(3) τ =5.00S, m=1mg·s-1 则µA2.某金属离子作极谱分析因得两个电子而还原。该金属离子浓度为0.0002mol·L-1,其平均扩散电流为12.0mA,毛细管的m2/3t1/6值为1.60.计算该金属离子的扩散系数。解:已知n=2, c=0.000200mol·L-1=0.200mmol·L-1, µA, 于是cm2·s-13.作一种未知浓度的铅溶液的极谱图,其扩散电流为6.00mA。加入10mL0.0020mol·L-1 Pb2+溶液到50mL上述溶液中去,再作出的极谱图其扩散电流为18mA,计算未知溶液内铅的浓度。 解: 代入已知数据,得
求得cx=1.54×10-4mol·L-14.用未知浓度的铅溶液5.00mL稀释到25.0mL作极谱图,其扩散电流为0.40μA。另取这种铅溶液5.00mL和10.0mL的0.00100mol·L-1铅溶液相混合,混合液稀释到25.0mL,再作极谱图。此时波高为2.00μA。试计算未知溶液的浓度。解:已知 ,于是 ,求得cx=5.00×10-4mol·L-15.用极谱法测定铟获得如下数据溶 液在-0.70V处观测到的电流/mA25.0mL0.40mol·L-1 KCl稀释到100.0mL8.725.0mL0.40mol·L-1 KCl和20.0mL试样稀释到100.0mL49.125.0mL0.40mol·L-1 KCl和20.0mL试样并加入10.0mL2.0×10-4 mol·L-1 In(Ⅲ)稀释到100.0mL 64.6计算样品溶液中铟的含量(mg·L-1)。解:标准加入法,需扣除空白值 ix=49.1-8.7=40.4mA,Δi=64.6-49.1=15.5mA 依题意,有 则cx=2.608×10-4mol·L-1 即cx=2.606×10-4×114.8×103=29.9mg·L-16.在稀的水溶液中氧的扩散系数为2.6´10-5cm2/s。一个0.01mol·L-1 KNO3溶液中氧的浓度为2.5´10-4 mol·L-1。在Ede=-1.50V(vsSCE)处所得扩散电流为5.8μA, m及τ依次为1.85mg/s及4.09s,问在此条件下氧还原成什么状态?解:扩散电流公式,代入已知数据,得 ,氧被还原为-2价. 在所给条件下氧被还原为H2O(O2 +2H2O+4e=4OH-)7.在25℃时测定某一电极反应(Ox+ ne = Red)得下列数据: Ede(vsSCE)/V 平均扩散电流:i(/μA) -0.395 0.48 -0.406 0.97 -0.415 1.46 -0.422 1.94 -0.431 2.43
-0.445 2.92平均极限扩散电流为3.24 mA,求:(1)电极反应的电子数;(2)电极反应是否可逆;(3)假定氧化态和还原态的活度系数和扩散系数相等,氧化还原体系的标准电位(vsSCE)。解:(1)将所给数据列表,已知 编 号项 目123456Ede(vsSCE)-0.395-0.406-0.415-0.422-0.431-0.445平均扩散电流i(mA)0.480.971.461.942.432.920.7600.3690.0861-0.174-0.477-0.960 因为 或 其中 采用最小二乘法,得到 (或) 则0.059/n=0.029,n=2.03≈2, 即电极反应的电子数为2. (2)从作图看到,Ede与具有良好的线性关系,是典型可逆极谱波的对数分析图,因此该电极反应是可逆的. (3)对数项为0时的电位即为半波电位,即E1/2= –0.417V(vsSCE) 因为氧化态和还原态的活度系数与扩散系数相等,标准电位等于半波电位, 所以E0= –0.417V(vsSCE)8.1.00×10-4 mol·L-1 Cd2+在0.100mol·L-1 KNO3底液中,加入不同浓度的X2-络合并进行极谱分析,实验数据如下:CX2-/ mol·L-10.001.00×10-33.00×10-31.00×10-23.00×10-2E1/2/V(vsSCE)-0.586-0.719-0.743-0.778-0.805求此络离子可能的组成及其稳定常数。
解:(1) n=2E1/2-0.586-0.719-0.743-0.778-0.805lgcx -3-2.52-2.00-1.52 (直接代入两组数据计算) 故Cd2+与X形成络合物的化学式为CuX2. 或求回归方程,得到(E1/2)c =-0.0591lgcx-0.895, R2=0.997 (2) 代入数据, 计算得到Kc=3.15×10-11, 则K稳=3.22×1010 或进行最小二乘法计算(E1/2)c-(E1/2)s-0.133-0.157-0.192-0.219lgcx-3-2.52-2-1.52 (E1/2)c-(E1/2)s=-0.0591lgcx-0.309, R2=0.997 则, K稳==2.95×1010 故Cd2+与X形成络合物的化学式为CuX2.8题再解: (1)对于不同浓度的络合剂,得到不同的半波电位移动值,即得到式子:任意选择题中所列出的两组数据,代入上式,得: p=1.71≈2也可另选两组数据进行验证,如: p=2.26≈2故Cd2+与X形成络合物的化学式为CuX2.
(2)将p及有关数据代入下式,可求得该络合物的稳定常数. K稳=3.22×10109.在方波极谱中,若方波振幅为30mV,频率为100Hz,电解池线路的电阻为100Ω,,双电层电容为0.3μF。(1)刚加上方波电压瞬间产生的电容电流是多少?(2)在方波半周末时,电容电流为多少?解:ΔE=39mV, v=100Hz, R=100Ω, C=0.3µF (1)刚加上方波电压瞬间,t=0 此时mA (2)在方波半周末时,τ =0.01S,t=0.005s时 mA,即近似为0.10.极谱分析与普通电解分析有哪些相同和不同之处?答:相同点: 都是电解过程,需要外加电压才能进行.极谱分析是控制电极电位的电解分析过程. 不同点: (1) 所用电极不同极谱分析使用一个通常是面积很小的滴汞电极,另一个通常是面积很大的饱和甘汞电极,而一般电解分析都使用二个面积大的电极。(2) 电解条件的特殊性极谱分析的溶液是静止的,以利产生浓差极化,且加入了大量的支持电解质,而电解分析是在搅拌的溶液中进行.(3)极谱分析是利用被测物质所产生的氧化还原电流的强度来进行定量.而电解分析是将被测离子还原为金属或氧化为金属氧化物,最后称重进行定量.(4)极谱分析是一种微量成份的分析方法,而电解分析是一种常量成份的分析方法.11.极限扩散电流主要受哪些因素的影响?在进行定量分析时,怎样消除这些影响?解:影响极限扩散电流的主要因素有下面几项:(1)滴汞电极毛细管特性的影响.汞的流速和汞滴滴下的时间都会影响扩散电流,即汞柱高度影响扩散电流.一般来说,汞柱高度每增加1cm,扩散电流大约增加2%.因此实验中应保持汞柱的高度不变. (2) 溶液组分的影响.扩散电流随扩散系数的增加而增加,而溶液的组份不同,其粘度也不同,并且粘度小,被测物质的扩散系数就越大.在分析中,试液和标准溶液组份力求一致.(3)温度的影响.从扩散电流方程式可知,扩散电流与扩散系数D有关,而D受温度的影响较大.在严格的条件下,一般使用恒温装置.在实际分析中,试液和标准溶液的温度相近,故可以不考虑温度的影响.12.什么叫底液?底液中的成分各起什么作用?答:为了消除干扰和控制溶液条件而加入的各种试剂的混合溶液称为极谱分析的“底液”。底液一般是由下列几种类型的物质组成:
①支持电解质(以消除迁移电流);②极大抑制剂(以消除极大);③除氧剂(以消除氧波);④其它有关试剂,如用以控制溶液酸度的试剂,改善波形的缓冲剂、络合剂等等。13.阐明下列术语的含义:电容电流;迁移电流。答:电容电流――电容电流是由于汞滴表面与溶液间形成的双电层,在与参比电极连接后,随着汞滴表面的周期性变化而发生的充电现象所引起的。此电流与滴汞电极的电位有关。 迁移电流――迁移电流是指主体溶液中的离子,受静电引力的作用到达电极表面,在电极上还原而产生的电流。它和扩散电流的本质区别在于离子从主体溶液到达电极表面的过程或机理不同。扩散电流基于扩散力,与电极附近的浓度梯度成正比;迁移电流是基于电引力,与电极附近的电位梯度成正比。14.阐明半波电位的特性及其影响因素。答:(1)半波电位的特性①当温度和支持电解质浓度一定时,则半波电位数值一定,而与在电极上进行反应的离子浓度无关。在一定条件下,半波电位是最具特征的数值。②半波电位的数值与所用仪器(如毛细管、检流计)的性能无关。③半波电位与共存的其它反应离子无关.(2)半波电位的影响因素①支持电解质的种类;②溶液的酸度;③温度;④络合物的形成.15.试区别下列术语: (1) 分解电压和半波电位; (2)极限电流和极限扩散电流。答:(1)分解电压――被电解的物质在两电极上产生迅速的和连续不断的电极反应时所需的最小的外加电压。 半波电位――当电流等于极限扩散电流的一半时相应的滴汞电极电位,称为半波电位 (2)极限电流――在极谱分析中,电流随外加电压的增大而增加,当外加电压增加到一定数值时,电流不再增加而达到一个极限值,此时的电流称为极限电流.极限扩散电流――在排除了其它电流的影响后,极限电流减去残余电流后的值,称为极限扩散电流,简称扩散电流。16.说明极谱法中使用滴汞电极的优缺点。答:极谱法中使用滴汞电极的优点:①汞滴的不断下滴,电极表面吸附杂质少,表面经常保持新鲜,测定的数据重现性好。②氢在汞上的超电位比较大,滴汞电极的电位负到1.3V(vsSCE)还不会有氢气析出,这样在酸性溶液中也可进行极谱分析。③许多金属可以和汞形成汞齐,降低了这些金属离子在滴汞电极上的还原电位,使之更易电解析出。④汞易提纯。能够得到高纯度的汞,是保证极谱法具有很好的重现性和准确度的重要条件之一。极谱法中使用滴汞电极的缺点: ①汞易挥发且有毒。 ②汞能被氧化,滴汞电极不能用于比甘汞电极正的电位。 ③滴汞电极上的残余电流较大,限制了测定的灵敏度。17.为什么在经典极谱分析中溶液要保持静止且需使用大量的支持电解质。答:电解过程中,电解电流的大小主要决定于离子到达电极表面的速度。离子由溶液本体到达电极表面主要有三种运动形式,即电迁移运动、对流运动和扩散运动。相应地产生三种电流,即迁移电流、对流电流和扩散电流。这三种电流只有扩散电流与被测物有定量关系。如果溶液保持静止,则对流切向运动可以忽略不计;若溶液中加入大量支持电解质,则可消除离子的电迁移运动。那么离子从溶液本体向电极表面就只有一种运动形式,即由于浓度差异而引起的扩散运动,而极谱法中测定的正是这种完全受扩散运动控制的电流。18.单扫描极谱怎样使汞滴面积保持相对恒定?答:峰电流与滴汞电极最大表面积成正比.Amax=0.85m2/3t2/3,维持汞滴流速和滴汞周期相对恒定.19.交流示波极谱如何进行定量分析?怎样判别电极的可逆性?答:对于可逆电极反就,所叠加的交流电压不大(ΔE≤RT/nF)时,峰电流为
在一定条件下,ip=Kc,即波高与浓度成正比. 峰电位与普通极谱法的半波电位相同.在条件一定时,求电子转移数n,根据n值偏离整数的情况确定电极反应的可逆性.20.证明化学反应平行于电极反应的催化电流与汞柱高度无关。答:物质O的电极反应与电极反应产物的化学反应平行地进行:Z是氧化剂,将R氧化为O。O是电活性物质,在电极上还原而产生电流。O在电极反应中消耗,然后又在化学反应中得到补偿,其浓度不变,电流却增加,因此可以把物质O及其还原态R视作催化剂。这种由再生反应产生的电流称为催化电流,相应的极谱波称为催化波。若电极上无吸附现象,波形与直流极谱波相似。催化电流的大小决定于R与Z的化学反应速率。化学反应与电极反应平行进行,催化电流叠加在物质O的扩散电流上,因此在总电流中扣除扩散电流后才是催化电流,当催化电流很大时,相应的扩散电流可以忽略不计。催化电流为: 或 由该式知,催化电流随速率常数kf增大而增加,而与汞柱高度无关。21.为什么方波极谱比交流极谱的灵敏度高?答:在交流极谱中,于叠加了交流电压,滴汞电极表面的双电层迅速充电和放电,产生较大的电容电流,因而其灵敏度与经典极谱相比并没有提高。方波极谱所记录通过电解池的电流中,电容电流趋于0,主要是电解电流,因此灵敏度较普通极谱法高,也比方波极谱法高。22.与方波极谱相比较,脉冲极谱为什么降低了测定的空白值?答:在方波极谱中,为了将电容电流消除掉,支持电解质必须保持较高浓度(一般要大于0.lmol·L-1,最好是 lmol·L-1)。对于这样高浓度的支持电解质,杂质的影响变得十分突出,这将增大试剂空白,给提高灵敏度带来了困难。在微分脉冲极谱中,被测物质浓度在10-8 mol·L-1数量级时,可允许支持电解质有较小的浓度(可小至10-3 mol·L-1)。当被测物质的浓度很低时,背景电流的影响显著,此时支持电解质的浓度不宜太小。23.试从下述方面比较常规脉冲极谱和微分脉冲极谱:(1)施加电压方式;(2)极谱波形。答:常规脉冲极谱和微分脉冲极谱都是在汞滴生长后期,在线性扫描电压上叠加一个矩形脉冲电压,记录脉冲电解电流与电极电位的关系曲线.它们的不同之处是(1) 施加电压方式 施加极化脉冲电压和电流取样方法不同.常规脉冲极谱是叠加一个振幅逐渐递增的脉冲电压,脉冲持续时间为60ms,在每一个脉冲即将消失前20ms进行电流取样.微分脉冲极谱是将一个等幅的脉冲电压叠加在一个直流线性扫描电压上,脉冲电压的持续时间为60ms,其电流取样方式是在脉冲电压加入间20ms和消失前20ms各取一次样,记录两个电流之差值,这样,微分脉冲能很好地扣除因直流电压引起的背景电流. (2) 极谱波形
常规脉冲极谱和微分脉冲极谱所记录的极谱图不一样,前者得到的是与普通极谱法相似的极谱图形,而后者的极谱图呈对称峰状.24.举例说明阳极溶出伏安法与阴极溶出伏安法的主要区别。答:溶出伏安法,是预先在恒电压下将溶液中低浓度的被测物质在固定电极上慢慢地发生氧化还原反应而电解富集到体积很小的电极上或电极中去,然后在扫描电压下(变化的电压下)向反方向扫描,使富集在电极上的物质重新迅速地电解溶出,通过记录溶出过程中的电流―电压曲线,根据曲线上呈现的峰电位和峰电流来进行定性定量的电化学分析法。 阳极溶出伏安法的预电解富集是发生还原反应,而溶出过程是发生氧化反应。 在恒电位下,预电解反应为:Cu2+ +2e→Cu (还原反应,沉积过程) 电极电位向正的方向扫描,富集在电极上的Cu发生氧化反应而溶出: Cu+2e→Cu2+ (氧化反应,溶出过程)阴极溶出伏安法的两个电极过程与阳极溶出伏安法的两个过程刚好相反,它的预电解富集是发生氧化反应,而溶出过程是发生还原反应。具体的反应可以作如下表示:在恒电位下,工作电极材料M本身发生氧化反应: M→Mn+ + ne (电极氧化)与A-离子形成难溶化合物而富集在电极上: A- +Mn+ → MAn (化学沉积) 电极电位向较负的方向扫描,富集在电极上的MAn发生还原反应而溶出: MAn + ne →M+ nA-25.溶出分析常用的工作电极分几类?各有什么要求?答:机械挤压式悬汞电极 玻璃毛细管的上端连接十密封的金属储汞器中,旋转顶端的螺旋将汞挤出,使之悬挂于毛细管口,汞滴的体积可从螺旋所旋转的圈数来调节.这类悬汞电极使用方便,能准确控制汞滴大小,所得汞滴纯净.其缺点是当电解富集的时间较长时,汞滴中的金属原子会向毛细管深处扩散,影响灵敏度和准确度. 挂吊式悬汞电极 在玻璃管的一端封入直径为0.1mm的铂丝(也有用金丝或银丝的),露出部分的长度约0.1mm,另一端联结导线引出。将这—细微铂电极浸入硝酸亚汞溶液中,作为阴极进行电解,汞沉积在铂丝上,可制得直径为1.0~1.5mm的悬汞滴.汞滴的大小可由电流及电解时间来控制.此外,也可以将汞直接粘挂在铂微电极上,但汞滴大小的重现性较差.这类电极易于制造,但有时处理不好,铂、金会溶入汞生成汞齐而影响被测物质的阳极溶出;或汞滴未非常严密地盖住铂丝,这样会降低氢的过电位,出现氢波. 汞膜电极 汞膜电极是以玻璃石墨(玻碳)电报)作为基质,在其表面镀上很薄的一层汞,可代替悬汞电极使用.由于汞膜很薄,被富集的能生成汞齐的金属原子,就不致向内部扩散,因此能经较长时间的电解富集,而不会影响结果.玻碳电极还由于有较高的氢过电位,导电性能良好,耐化学侵蚀性强以及表面光滑不易粘附气体及污物等优点,因此常用作伏安法的工作电极. 其它固体电极 当溶出伏安法在较正电位范围内进行时,采用汞电极就不合适了.此时可采用玻碳电极、铂电极和金电极等.26.从提高信噪比的角度比较溶出分析方法与方波、脉冲极谱各自侧重提高灵敏度的手段?答:溶出分析法:有个预电解富集过程,溶出时峰电流增加. 方波极谱法:减小了电容电流. 脉冲极谱:较小的电解质浓度,空白值较小.微分脉冲极谱的灵敏度还与所加脉冲电压的振幅有关.27.简述计时电位溶出法和电位溶出法的异同点。答:共同点:在恒电位下将被测物质预先电解富集在汞电极上形成汞齐,然后再氧化而溶出。记录的都是E~t曲线。计时电位溶出法和电位溶出法使用的仪器设备简便,并具有溶出伏安法的选择性和灵敏度。
不同点:溶出的方式不同.计时电位溶出法是在恒电流条件下,使电积物又重新氧化溶出,并记录电极电位―时间曲线。电位溶出法的溶出是利用溶液中的氧化剂如Hg2+ 或溶解的O2 来氧化电极上的电积物,记录电极电位~时间曲线。 28.在 0.1mol·L-1氢氧化钠介质中,用阴极溶出伏安法测定 S2-。以悬汞电极作为工作电极,在-0.40V时电解富集,然后溶出。 (l)分别写出富集和溶出时的电极反应式。 (2)画出它的溶出伏安曲线。答:(1)富集:Hg+S2- -2e=HgS 溶出: HgS+2e=Hg+S2- 第十一章 电导分析法 1. 在25℃时,用面积为1.11cm2,相距1.00cm的两个平行的铂黑电极来测定纯水的电导,其理论值为多少?解:已知A=1.11cm2, l=1.00cm 查表知,H+、OH-离子的极限摩尔电导率分别为λH+=349.82×10-4S·m2·mol-1,λOH-=349.82×10-4S·m2·mol-1纯水的极限摩尔电导率Λm=λH+ +λOH-=547.42×10-4S·m2·mol-1纯水中氢离子、氢氧根离子的浓度均为10-7mol·L-1,即c=10-4mol·m-3由纯水的电导率为k=cΛm=5.4742×10-6S·m-1所以纯水电导率为G=kA/l=5.4742×10-6×1.11×10-2=6.08×10-8S2. 用电导池常数为0.53cm-1的电导池测得某硝酸溶液的电导为22.7mS,计算该硝酸溶液的物质的量的浓度。解:电导池常数θ=l/A=0.53cm-1=53m-1, G=22.7mS 由条件,得G=c·Λm/θ, Λm=λH+ +λNO3- 则mol·m-3 即c=0.0286mol·L-13. 在电池中,放有两支面积为1.25×10-4m2的平行电极,相距0.105m,测得某溶液的电阻为1995.6Ω,计算池常数和溶液的电导率。解:已知A=1.25×10-4m2, l=0.105m,R=1995.6Ω 池常数m-1
由G=1/R=k/θ 得到:k=θ/R=840/1995.6=0.421S·m-14. 某电导池内装有两个直径为4.0×10-2m并相互平行的圆形电极,电极之间的距离为0.12m,若池内盛满浓度为0.1mol·L-1 的AgNO3溶液,并施加20V电压,则所测电流强度为0.1976A。试计算池常数、溶液的电导、电导率和AgNO3的摩尔电导率。解:已知A=3.14×4×10-4=1.256×10-3m2, l=0.12m,c=0.1mol·L-1=100mol·m-3 池常数θ=l/A=0.12/(1.256×10-3)=95.5m-1 溶液的电导G=i/E=9.88×10-3S 电导率k=G·θ=9.88×10-3×95.5=0.943S·m-1 Λm=k/c=9.43×10-3S·m2·mol-15. 用一个具有池常数为555m-1的电导池测得饱和AgCl水溶液的电阻值为67953Ω(298K),实验用水的电导率为8×10-5S·m-1。计算AgCl的溶度积。解:k溶液=θ/R=555/67953=8.167×10-3S·m-1 kAgCl= k溶液-k水=8.167×10-3-8×10-5=8.087×10-3S·m-1 以于AgCl的离解平衡,AgCl==Ag+ +Cl-, a(Ag+)=a(Cl-) kAgCl=a(Ag+)·λAg+ + a(Cl-)·λCl-=a(Ag+)(λAg+ +λCl-) 即8.087×10-3= a(Ag+)×(61.9+76.34)×10-4 则a(Ag+)=0.585mol·m3=5.85×10-4 =mol·L-1 Ksp-AgCl= a(Ag+)·a(Cl-)=(5.85×10-4)2=3.42×10-76. 给出下列滴定体系的电导滴定曲线:(1)用KCl滴定AgNO3;(2)用LiCl滴定AgAc.解: 7. 普通电导法测量中,为什么以交流电源对电导池供电为好?解:因为直流电通过电解质溶液时,会发生电解作用,使溶液中组分的浓度发生变化,电阻也随之改变,同时由于两电极上的电极反应,产生反电动势,影响测定.因此以交流电源对电导池供电为好.8. 用电导法测SO2气体时,通常选什么吸收液?为什么?解:用固定浓度的NaOH溶液作吸收液.因为产物SO32-的电导率与OH-的摩尔电导率差别比较大.9. 高频滴定的主要特点和优点是什么?解:特点:电极不直接与溶液接触,避免了电解和极化现象. 高频电导滴定的优点是: 1.电极不直接与试液接触,避免了电解和电极极化现象。适用于沉淀滴定,也可用于一般金属离子的EDTA络合滴定。 2.能测定电容变化。对于非水溶剂的滴定分析,由于电导值变化小而电容变化大,高频电导滴定特别适宜。 3.对于介电常数相差远的两组分混合物的分析,普通滴定法则难以实现准确测定,应用高频滴定法能得到比较理想的测定结果。
10. 绘出用0.1mol·L-1NaOH滴定0.01mol·L-1HCl的电导滴定曲线,并解释曲线的形状。解:用NaOH滴定HCl溶液时,反应的结果是溶液中的H+被Na+代替,由于Na+的摩尔电导率远小于H+,则滴定过程中电导不断下降(AB段);化学计量点后,过量的NaOH存在,导致电导又上升(BC段).第十二章 色谱分析法(书后习题参考答案) 1.色谱法有哪些类型?其分离的基本原理是什么?答:气体为流动相的色谱称为气相色谱(GC),根据固定相是固体吸附剂还是固定液(附着在惰性载体上的一薄层有机化合物液体),又可分为气固色谱(GSC)和气液色谱(GLC).液体为流动相的色谱称液相色谱(LC)。同理,液相色谱亦可分为液固色谱(LSC)和液液色谱(LLC).超临界流体为流动相的色谱称为超临界流体色谱(SFC)。随着色谱工作的发展,通过化学反应将固定液键合到载体表面,这种化学键合固定相的色谱又称化学键合相色谱(CBPC)。 2.试述热导池及氢焰离子化检测器的原理?答:热导池检测器是利用组分蒸气与载气导热系数不同来测定各组分的. 氢焰离子化检测器是利用有机物在氢气――空气火焰中产生离子化反应而生成许多离子对,在加有电压的两极间形成离子流. 3.如何选择气液色谱的固定液?答:对固定液的选择并没有规律性可循。一般可按“相似相溶”原则来选择。在应用时,应按实际情况而定。(i)分离非极性物质:一般选用非极性固定液,这时试样中各组分按沸点次序流出,沸点低的先流出,沸点高的后流出。(ii)分离极性物质:选用极性固定液,试样中各组分按极性次序分离,极性小的先流出,极性大的后流出。(iii)分离非极性和极性混合物:一般选用极性固定液,这时非极性组分先流出,极性组分后流出。(vi)分离能形成氢键的试样:一般选用极性或氢键型固定液。试样中各组分按与固定液分子间形成氢键能力大小先后流出,不易形成氢键的先流出,最易形成氢键的最后流出。(v)复杂的难分离物质:可选用两种或两种以上混合固定液。对于样品极性情况未知的,一般用最常用的几种固定液做试验。 对固定液的要求:首先是选择性好.另外还要求固定液有良好的热稳定性和化学稳定性;对试样各组分有适当的溶解能力;在操作温度下有较低蒸气压,以免流失太快。(a.在操作温度下呈液态,并有足够的稳定性,能溶解被分离混合物中的各组分,且不与组分发生化学反应。b.在操作温度下粘度要低,以保证固定液能均匀分布在担体上形成均匀的液膜。c.对被分离的各组分有足够的分离能力。) 4.柱的分离效能指标H与分配比k,相对保留值,分离度R之间有什么关系?解:
5.气相色谱法有哪些常用的定性分析方法和定量分析方法?答:常用的定性分析方法:绝对保留值法,相对保留值法,加入已知物峰高增加法,保留指数定性. 常用的定量分析方法:归一化法,内标法,外标法. 6.影响分辨率的因素有哪些?如何选择最佳的工作条件?答: R=0.59R’ 该方程推导出分离度与相对保留值(a)、理论塔板数(n)和分配比(k)三个基本参数之间的关系,根据计算得知,影响分离度的三个参数中,a的增加对分离的改进最有效,k从1增加到3,R只增加到原来的1.5倍.n增加到原来的3倍,而R只增加到1.7倍.而a从1.01增加到1.1,约增加9%,而Rs却增加到原来的9倍. 工作条件的选择: (1)柱长的选择 固然增加柱长可使理论塔板数增大,但同时使峰宽加大,分析时间延长。因此,填充柱的柱长要选择适当。过长的柱子,总分离效能也不一定高。一般情况下,柱长选择以使组分能完全分离,分离度达到所期望的值为准。具体方法是选择一根极性适宜,任意长度的色谱柱,测定两组分的分离度,然后根据基本色谱分离方程式,确定柱长是否适宜。 (2)载气及其流速的选择 当载气线速度较小时,宜选择相对分子量较大的载气;当载气线速度较大时,宜选择相对分子量较小的载气.载气的选择还要考虑与检测器相适应. (3)柱温的选择 柱温是一个重要的操作参数,直接影响分离效能和分析速度.在使最难分离的组分有尽可能好的分离前提下,采取适当低的柱温,但以保留时间适宜,峰形不拖尾为度。具体操作条件的选择应根据实际情况而定。另外,柱温的选择还应考虑固定液的使用温度,柱温不能高于固定液的最高使用温度,否则固定派挥发流失,对分离不利。 (4)载体粒度及筛分范围的选择 载体的粒度愈小,填装愈均匀,柱效就愈高。但粒度也不能太小。否则,阻力压也急剧增大。一般粒度直径为柱内径的1/20~l/25为宜。在高压液相色谱中,可采用极细粒度,直径在μm数量级。 (5)固定液及其配比 分离气体及低沸点组分可采用10%~25%配比,其它组分采用5%~20%配比为宜。 (6)进样量的选择 在实际分析中最大允许进样量应控制在使半峰宽基本不变,而峰高与进样量成线性关系。一般说来,气体样品进样量为0.1~10mL,液体样品进样量为0.1~10 mL. 7.色谱定量分析时,为什么要引入定量校正因子?答:由于组分的峰面积与其重量或百分含量不成正比,也就是说,在同一类型的检测器上,重量或浓度相同的不同物质,在同一条件下,产生的信号是不一样的(得到的色谱峰面积却常常不同);在不同类型的检测器上,同一种物质产生的信号也是不一样的.因此,为使产生的响应信号(测出的峰面积)能定量代表物质的含量,就要对峰面积进行校正,即在定量计算时要引入校正因子。 8.试述塔板理论和速率理论的要点?答:塔板理论反色谱柱看作一个蒸馏塔,借用蒸馏塔中“塔板”的概念来描述组分在两相间的分配行为.它的贡献在于解释色谱流出曲线的形状,推导出色谱流出曲线方程,及理论塔板数的计算公式,并成功地解释了流出曲线的形状及浓度极大值的位置,还提出了计算和评价柱效的参数。
速率理论提出,色谱峰受涡流扩散、分子扩散、气液两相间的传质阻力等因素控制,从动力学基础上较好解释影响板高的各种因素,对选择合适的操作条件具有指导意义.根据三个扩散方程对塔板高度H的影响,导出速率理论方程或称VanDeemter方程式: H=A+B/u+Cu 式中u为流动相的线速度;A,B,C为常数,分别代表涡流扩散项系数、分子扩散项系数、传质阻力项系数。 9.一根2m长的填充柱的操作条件及流出曲线的数据如下: 流量 20mL/min(50℃) 柱温50℃ 柱前压力:133.32 KPa 柱后压力101.32KPa 空气保留时间0.50min 正己烷保留时间3.50min 正庚烷保留时间4.10min ①计算正己烷,正庚烷的校正保留体积; ②若正庚烷的半峰宽为0.25min,用正庚烷计算色谱柱的理论塔板数和理论塔板高度; ③求正己烷和正庚烷的分配比k1和k2。解:F=20mL/min, t0=30s=0.50min, t已=3.50min=210s, t庚=4.10min=250s ①V已’=F(t已-t0)=20×(3.50-0.50)=60mL V庚’=F(t庚-t0)=20×(4.10-0.50)=72mL②W1/2(庚)=0.25min n理=5.54×(t/W1/2)2=5.54×(4.10/0.25)2=1490H=L/n理=200/1490=0.13cm 对正已烷,若半峰宽也为0.25min,则W1/2(已)=0.25min n理=5.54×(t/W1/2)2=5.54×(3.5/0.25)2=1086H=L/n理=200/1086=0.184cm③ 10.正庚烷与正己烷在某色谱柱上的保留时间为94s和85s,空气在此柱上的保留时间为10s,所得理论塔板数为3900块,求此二化合物在该柱上的分离度?解:已知n理=3900, t0=10s, t1=85s, t2=94s n理=16×(t1/w1)2 n理=16×(t1/w1)2 即3900=16×(85/w1)2 3900=16×(94/w2)2 求得w1=5.44s, w2=6.02s 所以11.在某色谱柱上,二组分的相对保留值为1.211。若有效板高度为0.1cm,为使此组分在该色谱柱上获得完全分离,求所需色谱柱的最低长度?解:已知Heff=0.1cm, r21=1.211, R=1.5
cm,近似为120cm. 12.一液体混合物中,含有苯、甲苯、邻二甲苯、对二甲苯。用气相色谱法,以热导池为检测器进行定量,苯的峰面积为1.26cm2。甲苯为0.95cm2,邻二甲苯为2.55cm2,对二甲苯为1.04cm2。求各组分的百分含量?(重量校正因子:苯0.780,甲苯0.794,邻二甲苯0.840.对二甲苯0.812)。解: A苯=1.26cm2 A甲苯=0.95cm2 A邻=2.55cm2 A对=1.04cm2 归一化法: f 苯=0.780 f甲苯=0.794 f邻=0.840 f对=0.812 Y= f 苯A苯 + f甲苯A甲苯 + f邻A邻 + f对A对 =0.780×1.26+0.794×0.95+0.840×2.55+0.812×1.04 =0.9828+0.7543+2.142+0.8448=4.7236 W苯=0.9828/4.7236×100%=20.8% W甲苯=0.7543/4.7236×100%=16.0% W邻=2.142/4.7236×100%=45.3% W对=0.8448/4.7236×100%=17.9% 13.在某一色谱柱上,下列各化合物的校正保留时间如下,求下述各化合物的保留指数。 正丁烷0.95 异辛烷13.7 1-己烯2.95 正戊烷1.80 2-甲基丁烷1.20 苯3.75 正己烷3.50 1-丁烯0.80 正辛烷8.4 正庚烷6.95解: 14.指出下列物质在正相色谱中的洗脱顺序 (1)正己烷,正己醇,苯 (2)乙酸乙酯,乙醚,硝基丁烷答:(1)苯、正已烷、正已醇;(2) 乙醚、硝基丁烷、乙酸乙酯 15.指出下列各种色谱法,最适宜分离什么物质? (1)气液色谱 (2)正相色谱 (3)反相色谱(4)离子交换色谱 (5)凝胶色谱 (6)气固色谱 (7)液固色谱答:(1)气液色谱――分离易挥发、受热稳定的物质 (2)正相色谱――分离极性亲水性化合物 (3)反相色谱――分离疏水性化合物(4)离子交换色谱――离子型化合物 (5)凝胶色谱――分离相对分子量高的化合物,常用于鉴定聚合物(6)气固色谱――分离气体烃类、永久性气体
(7)液固色谱――极性不同的化合物、异构体 16.根据范·第姆特方程式,推导出以常数A、B和C表示的最佳线速度和最小塔板高度表达式。解:已知H=A + B/u + Cu 则dH/du=C-B/u2 要求H最小,则在极值处,dH/du=0 即C-B/u2=0 所以 17.热导池检测器的灵敏度测定:进纯苯1mL,苯的色谱峰高为4mV,半峰宽为1min,柱出口载气流速为20mL/min,求该检测器的灵敏度(苯的比重为0.88g/mL)。若仪器噪声为0.02mV,计算其检测限。解:mV·mL·mg-1 mg·mL-1第十三章 其它仪器分析法介绍1. 指出下列原子核中,哪些核能产生核磁共振谱?答:下面四个原子核能产生核磁共振.2.当振荡频率为56.4兆赫时,要使19F和1H产生核磁共振信号,所需外加磁场各为多少微特斯拉?解:已知 -1.40T -1.32T3.使用60.0MHz的核磁共振仪时,某化合物中的质子与TMS的吸收频率差为180Hz,如果使用40.0MHz的仪器,它们之间的频率差应是多少?解:化学位移与外加磁场强度无关 于是有 MHz 4.三个不同质子A、B、C,其屏蔽常数的次序是σB>σA>σC,问这三个质子共振时,其所需外磁场排列次序如何?解: HB
您可能关注的文档
- 《人工智能》--课后习题答案.pdf
- 《人教版初中物理教材插图改编试题及答案:9年级全一册》.doc
- 《从技术走向管理》试题及答案大全.doc
- 《仪器分析》习题及参考答案.pdf
- 《仪器分析》思考题与习题答案.doc
- 《仪器分析》朱明华 第三版 课后习题解答.doc
- 《仪器分析》朱明华第四版 习题解答(完美打印版).pdf
- 《仪器分析》朱明华第四版_习题解答(完美打印版).docx
- 《仪器分析》朱明华第四版习题解答(完美打印版).pdf
- 《企业内部控制》习题答案.docx
- 《企业纳税实务》课后答案.doc
- 《优化重组卷》2016高考生物复习系列(真题+模拟)专题重组:参考答案(考点1-考点16+模块滚动卷1).doc
- 《优化重组卷》2016高考生物复习系列(真题+模拟)专题重组:参考答案(考点17-考点32+模块滚动卷2).doc
- 《优化重组卷》2016高考生物复习系列(真题+模拟)专题重组:参考答案(考点33-考点48).doc
- 《会计信息系统》习题含答案.docx
- 《会计信息系统》习题答案.doc
- 《会计信息系统》课程期末复习题与参考答案.doc
- 《会计基础》习题及答案1~10.doc
相关文档
- 施工规范CECS140-2002给水排水工程埋地管芯缠丝预应力混凝土管和预应力钢筒混凝土管管道结构设计规程
- 施工规范CECS141-2002给水排水工程埋地钢管管道结构设计规程
- 施工规范CECS142-2002给水排水工程埋地铸铁管管道结构设计规程
- 施工规范CECS143-2002给水排水工程埋地预制混凝土圆形管管道结构设计规程
- 施工规范CECS145-2002给水排水工程埋地矩形管管道结构设计规程
- 施工规范CECS190-2005给水排水工程埋地玻璃纤维增强塑料夹砂管管道结构设计规程
- cecs 140:2002 给水排水工程埋地管芯缠丝预应力混凝土管和预应力钢筒混凝土管管道结构设计规程(含条文说明)
- cecs 141:2002 给水排水工程埋地钢管管道结构设计规程 条文说明
- cecs 140:2002 给水排水工程埋地管芯缠丝预应力混凝土管和预应力钢筒混凝土管管道结构设计规程 条文说明
- cecs 142:2002 给水排水工程埋地铸铁管管道结构设计规程 条文说明