- 1.05 MB
- 2022-04-22 11:33:22 发布
- 1、本文档共5页,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报电话:19940600175。
'第四章1.试用离子键理论说明由金属钾和单质氯反应,形成氯化钾的过程?如何理解离子键没有方向性和饱和性?答原子所得,二者因静电引力而吸引,之间得作用力成为离子键。离子键没有方向性可以这样理解:阴离子与阳离子并非只有再某一方向才具有吸引力,而是在任何方向都有力的作用,只不过当距离远时其作用力小一点而已。2.用下列数据求氢原子的电子亲和能:K(s)→K(g)△H1=83kJ·molK(g)→K+(g)△H2=419kJ·molH2(g)→H(g)△H3=218kJ·molK+(g)+H(g)→KH(s)△H4=-742kJ·molK(s)+H2(g)→KH(s)△H5=-59kJ·mol解3.ClF的解离能为246kJ·mol-1,ClF的生成热为—56kJ·mol-1Cl2的解离能为238kJ·mol-1,试计算F2(g)解离能。解
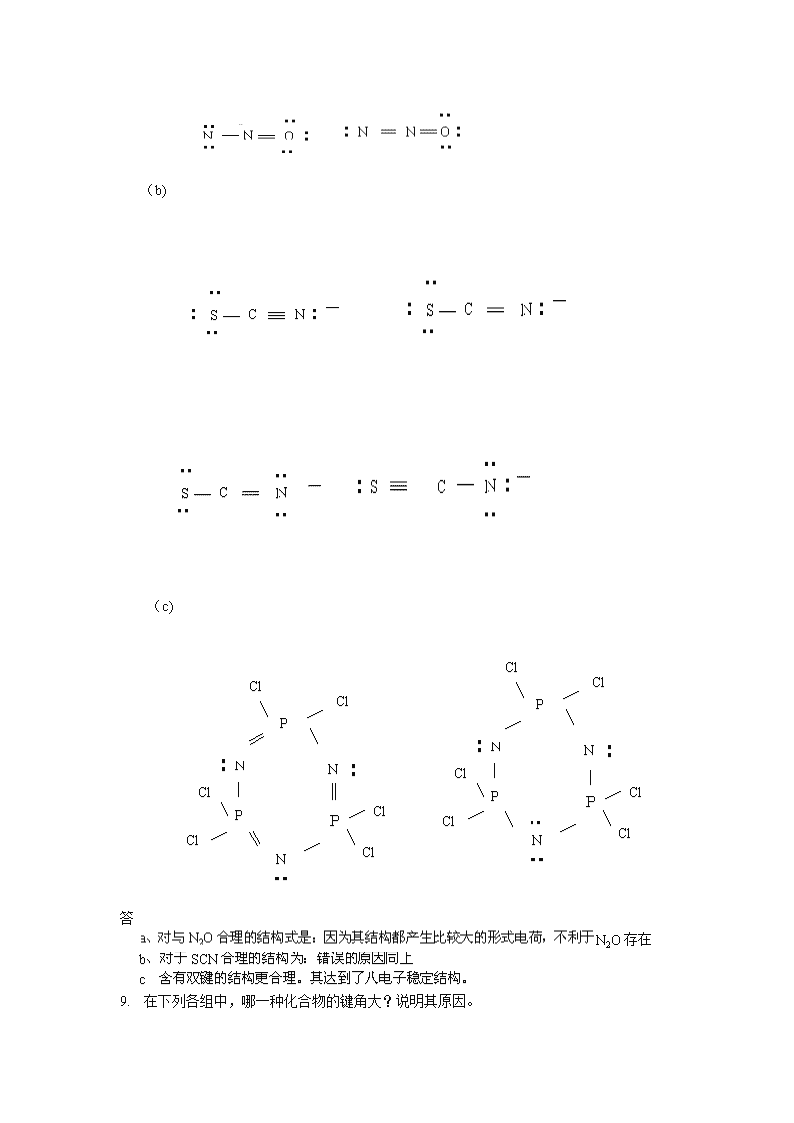
1.试根据晶体的构型与半径比的关系,判断下列AB型离子化合物的晶体构型:BeO,NaBr,CaS,RbI,BeS,CsBr,AgCl。答2.试从电负性数据,计算下列化合物中单键的离子性百分数各为多少?并判断哪些是离子型化合物?哪些是共价型化合物?NaF,AgBr,RbF,HI,CuI,HBr,CrCl。答3.如何理解共价键具有方向性和饱和性?答4.BF3是平面三角形的几何构型,但NF3却是三角的几何构型,试用杂化轨道理论加以说明。答5.指出下列化合物合理的结构是哪一种?不合理结构的错误在哪里?(a)
(b)(c)答N2O存在1.在下列各组中,哪一种化合物的键角大?说明其原因。
(a)CH4和NH3(b)OF2和Cl2O(c)NH3和NF3(d)PH3和NH3答1.试用价层电子互斥理论判断下列分子或离子的空间构型。说明原因。HgCl2BCl3SnCl2NH3H2OPCl5TeCl4ClF3IClSF6IF5FCl4CO2COCl2SO2NOClSO2Cl2POCl3SOClOIO2F答
1.试用价键法和分子轨道法说明O2和F2分子的结构。这两种方法有何区别?答见书177页。价键理论认为形成共价键的电子只局限于两个相邻原子间的小区域内运动,缺反对分子作为一个整体的全面考虑,因此它对有些多原子分子,特别是有机化合物分子的结构不能说明,同时它对氢分子离子中的单电子键、氧分子中的三电子键以及分子的磁性等也无法解释。分子轨道理论,着重于分子的整体性,它把分子作为一个整体来处理,比较全面地反映了分子内部电子的各种运动状态,它不仅能解释分子中存在的电子对键、单电子键、三电子键的形成,而且对多原子分子的结构也能给以比较好的说明。2.今有下列双原子分子或离子Li2,Be2,B2,N2,HF,F2,CO+①写出它们的分子轨道式。②计算它们的键级,判断其中哪个最稳定?哪个最不稳定?③判断哪些分子或离子是顺磁性。哪些是反磁性?答
1.写出O,O2,O,O分子或离子的分子轨道式。并比较它们的稳定性?答2.已知NO2,CO2,SO2分子其键角分别为132°,180°,120°,判断它们的中心原子轨道的杂化类型?答
。1.写出NO+,NO,NO分子或离子的分子轨道式,指出它们的键级,其中哪一个有磁性?答16.举例说明金属导体,半导体和绝缘体的能带结构有何区别?答17.简单说明键和π键的主要特征是什么?答18.试比较如下两列化合物中正离子的极化能力的大小:①ZnCl2,FeCl2,CaCl2,KCl。②SiCl4,AlCl3,PCl5,MgCl2,NaCl。答19.试用离子极化的观点,解释下列现象:①AgF易溶于水,AgCl,AgF,AgI难溶于水,溶解度由AgF到AgI依次减小。
①AgCl,AgBr,AgI的颜色依次加深。答20.试比较下列物质中键的级性的大小。NaF,HF,HCl,HI,I2答21.何谓氢键?氢键对化合物性质有何影响?答22.下列化合物中哪些存在氢键?并指出它们是分子间氢键还是分子内氢键?C6H6,NH3,C2H6,,,,H3BO3(固)答23.判断下列各组分子之间存在着什么形式的分子间作用力?①苯和CCl4;②氦和水;③CO2气体;④HBr气体;⑤甲醇和水。答24.试判断Si和I2晶体哪种熔点较高,为什么?答
'
您可能关注的文档
- 高玉良《电路与模拟电子技术》第2版,课后习题答案,第七章.doc
- 高玉良《电路与模拟电子技术》第3版全部习题答案.doc
- 高电压技术 1到8章 课后习题答案.doc
- 高电压课后吴广宇习题答案.doc
- 高等代数习题答案.doc
- 高等学校——数据结构习题答案.doc
- 高等教育出版常微分答案.pdf
- 高等教育出版社 无机化学 第八章 课后习题答案.doc
- 高等教育出版社 无机化学 第十章 课后习题答案.doc
- 高等教育出版社-天津大学-无机化学-课后习题参考答案.doc
- 高等教育出版社《复变函数》与《积分变换》第四版课后习题参考答案.pdf
- 高等教育出版社《金融市场学(第三版)》课后习题答案.doc
- 高等教育学20套题答案.doc
- 高等数学参考答案.doc
- 高等数学复习题及答案.doc
- 高等数学定积分应用习题答案.doc
- 高等数学科学出版社下册课后答案第十章曲线积分与曲面积分习题简答.doc
- 高等数学课后习题答案--第七章.pdf
相关文档
- 施工规范CECS140-2002给水排水工程埋地管芯缠丝预应力混凝土管和预应力钢筒混凝土管管道结构设计规程
- 施工规范CECS141-2002给水排水工程埋地钢管管道结构设计规程
- 施工规范CECS142-2002给水排水工程埋地铸铁管管道结构设计规程
- 施工规范CECS143-2002给水排水工程埋地预制混凝土圆形管管道结构设计规程
- 施工规范CECS145-2002给水排水工程埋地矩形管管道结构设计规程
- 施工规范CECS190-2005给水排水工程埋地玻璃纤维增强塑料夹砂管管道结构设计规程
- cecs 140:2002 给水排水工程埋地管芯缠丝预应力混凝土管和预应力钢筒混凝土管管道结构设计规程(含条文说明)
- cecs 141:2002 给水排水工程埋地钢管管道结构设计规程 条文说明
- cecs 140:2002 给水排水工程埋地管芯缠丝预应力混凝土管和预应力钢筒混凝土管管道结构设计规程 条文说明
- cecs 142:2002 给水排水工程埋地铸铁管管道结构设计规程 条文说明