- 858.55 KB
- 2022-04-22 11:38:59 发布
- 1、本文档共5页,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报电话:19940600175。
'中华人民共和国国家标准犌犅4789.41—2016食品安全国家标准食品微生物学检验肠杆菌科检验20160831发布20160920实施中华人民共和国发布国家卫生和计划生育委员会
犌犅4789.41—2016食品安全国家标准食品微生物学检验肠杆菌科检验1范围本标准规定了食品中肠杆菌科(Enterobacteriaceae)的检验方法。本标准第一法适用于肠杆菌科含量较高的食品中肠杆菌科的计数;第二法适用于肠杆菌科含量较低食品中肠杆菌科的计数。2术语和定义2.1肠杆菌科犈狀狋犲狉狅犫犪犮狋犲狉犻犪犮犲犪犲在给定条件下发酵葡萄糖产酸、氧化酶阴性的需氧或兼性厌氧革兰氏阴性无芽胞杆菌。2.2肠杆菌科计数犈狀狌犿犲狉犪狋犻狅狀狅犳犈狀狋犲狉狅犫犪犮狋犲狉犻犪犮犲犪犲按本标准规定方法,对每克或每毫升检样中的肠杆菌科进行计数。2.3最可能数犿狅狊狋狆狉狅犫犪犫犾犲狀狌犿犫犲狉;犕犘犖基于泊松分布的一种间接计数方法。3设备和材料除微生物实验室常规灭菌及培养设备外,其他设备和材料如下:3.1恒温培养箱:36℃±1℃。3.2冰箱:2℃~5℃。3.3水浴箱:46℃±1℃。3.4天平:感量0.1g。3.5显微镜:10倍~100倍。3.6均质器。3.7振荡器。3.8无菌吸管:1mL(具0.01mL刻度)、10mL(具0.1mL刻度)或微量移液器及吸头。3.9无菌锥形瓶或等效容器:容量150mL、500mL。3.10无菌培养皿:直径90mm。3.11无菌试管:18mm×180mm、15mm×150mm。3.12pH计或pH比色管或精密pH试纸。4培养基和试剂4.1缓冲蛋白胨水(BPW):见B.1。1
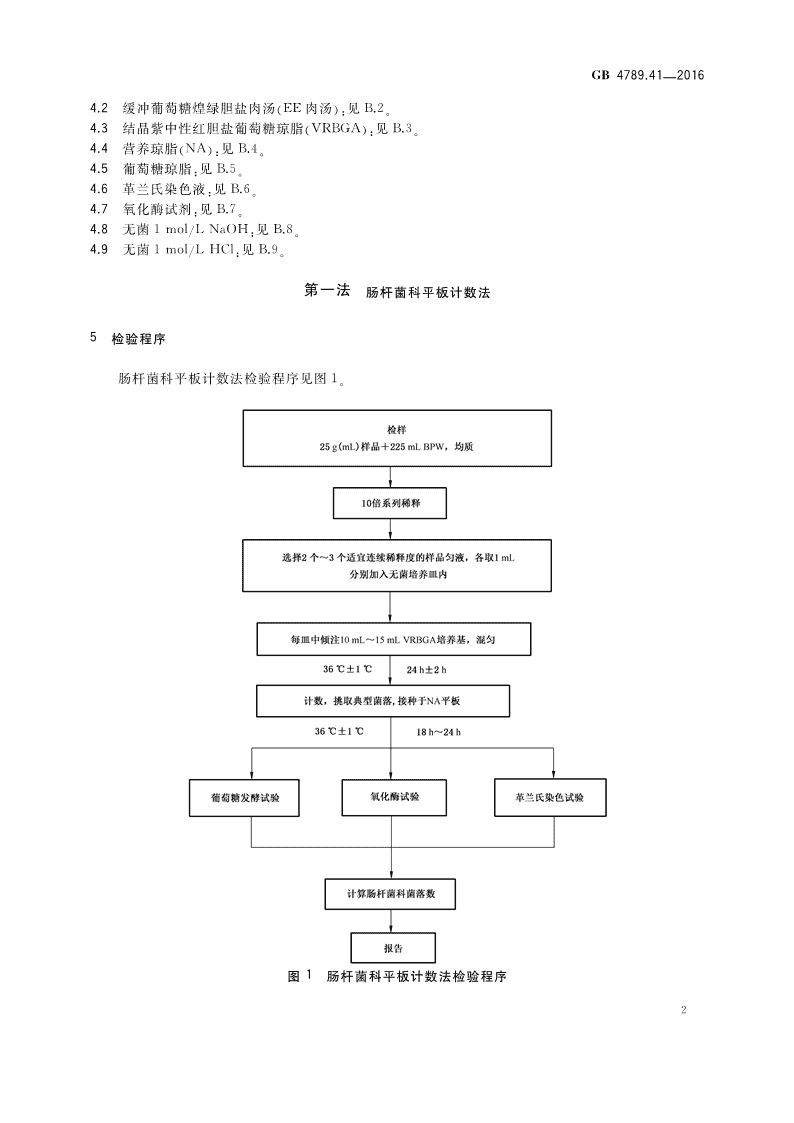
犌犅4789.41—20164.2缓冲葡萄糖煌绿胆盐肉汤(EE肉汤):见B.2。4.3结晶紫中性红胆盐葡萄糖琼脂(VRBGA):见B.3。4.4营养琼脂(NA):见B.4。4.5葡萄糖琼脂:见B.5。4.6革兰氏染色液:见B.6。4.7氧化酶试剂:见B.7。4.8无菌1mol/LNaOH:见B.8。4.9无菌1mol/LHCl:见B.9。第一法肠杆菌科平板计数法5检验程序肠杆菌科平板计数法检验程序见图1。图1肠杆菌科平板计数法检验程序2
犌犅4789.41—20166操作步骤6.1样品的稀释6.1.1固体和半固体样品:称取25g样品放入盛有225mLBPW的无菌均质杯中,8000r/min~10000r/min均质1min~2min,或放入盛有225mLBPW的无菌均质袋中,用拍击式均质器拍打1min~2min,制成1∶10的样品匀液。6.1.2液体样品:以无菌吸管吸取25mL样品放入盛有225mLBPW的无菌锥形瓶(瓶内预置适当数量的无菌玻璃珠)中,充分混匀,制成1∶10的样品匀液。6.1.3用1mL无菌吸管或微量移液器吸取1∶10样品匀液1mL,沿管壁缓缓注入盛有9mLBPW的无菌试管中(注意吸管或吸头尖端不应触及稀释液面),振摇试管或换用1支1mL无菌吸管反复吹打,使其混合均匀,制成1∶100的样品匀液。6.1.4按6.1.3操作程序,依次制成10倍递增系列稀释样品匀液。每递增稀释1次,换用1支1mL无菌吸管或吸头。从制备样品匀液至样品接种完毕,全过程不得超过15min。6.2倾注平板和培养6.2.1根据对样品污染状况的估计及相关限量要求,选择2个~3个适宜的连续稀释度的样品匀液(液体样品可以选择原液),每个稀释度接种2个无菌平皿。同时,分别吸取1mLBPW加入两个无菌平皿内作为空白对照。6.2.2将10mL~15mL冷却至46℃的VRBGA(可放置于46℃±1℃恒温水浴箱中保温)倾注于每个平皿中。小心旋转平皿,使样品匀液与培养基充分混匀。6.2.3待琼脂凝固后,倾注一薄层同样的培养基覆盖平板表层。防止蔓延生长并使菌落特征更为明显。6.2.4待VRBGA平板上层琼脂凝固后翻转平板,36℃±1℃培养18h~24h。6.3典型菌落计数和确认6.3.1肠杆菌科典型菌落为有或无沉淀环的粉红色至红色或紫色菌落。选取典型菌落数在15CFU~150CFU之间、无蔓延菌落生长的平板,只计数典型菌落数。菌落计数以菌落形成单位(colonyformingunits,CFU)表示。6.3.2其中一个平板有较大片状菌落生长时,则不宜采用,而应以无片状菌落生长的平板作为该稀释度的菌落数;若片状菌落不到平板的一半,而其余一半中菌落分布又很均匀,即可计算半个平板后乘以2,代表一个平板菌落数。6.3.3当平板上出现菌落间无明显界线的链状生长时,则将每条单链作为一个菌落计数。6.3.4从每个平板上至少挑取5个(小于5个全选)典型菌落进行确认;如果有不同形态的典型菌落,则每种形态分别至少挑取1个菌落进行确认。6.3.5典型菌落的确认:a)分别将所挑选的每一个菌落,划线于营养琼脂平板,36℃±1℃培养18h~24h,挑取平板上的菌落进行革兰氏染色镜检、氧化酶试验及葡萄糖发酵试验。b)革兰氏染色镜检:肠杆菌科为革兰氏阴性杆菌,无芽孢,大小为(0.3~1.0)μm×(1.0~6.0)μm。c)氧化酶试验:用铂/铱接种环或玻璃棒(不要用镍铬接种环)挑取单个菌落涂于浸湿氧化酶试剂3
犌犅4789.41—2016的滤纸上,滤纸的颜色在10s内变成蓝紫色,判为阳性反应。d)葡萄糖发酵试验:用接种针挑取少许氧化酶阴性的同一个菌落,穿刺于葡萄糖琼脂内,于36℃±1℃培养24h±2h,若试管内的内容物变为黄色,判为阳性反应。6.4结果的计算6.4.1一般原则若有两个连续稀释度的平板典型菌落数在适宜计数范围内,按式(1)计算,示例见A.1、A.2、A.3、A.4。犖=(狀∑犪…………………………(1)1+0.1狀2)犱式中:犖———样品中肠杆菌科菌落数;∑犪———确证的肠杆菌科菌落数之和;狀1———第一稀释度(低稀释倍数)平板个数(含确证的肠杆菌科菌落);狀2———第二稀释度(高稀释倍数)平板个数(含确证的肠杆菌科菌落);犱———稀释因子(第一稀释度)。其中,犪按式(2)计算:犪=犃犫×犆…………………………(2)式中:犪———确证的肠杆菌科菌落数;犫———某一平板中犃个菌落中被确证为肠杆菌科的菌落数,犫≤犃;犃———某一平板中用于确认试验的菌落数;犆———某一平板中典型菌落总数。6.4.2低菌落数若最低稀释度(包括液体样品原液)平板的典型菌落数均小于15CFU,具有确证的肠杆菌科菌落,则以确证的菌落数乘以最低稀释倍数计算。若最低稀释度(包括液体样品原液)平板均无菌落生长,或典型菌落数均小于15CFU,且无确证的肠杆菌科菌落,则以小于1乘以最低稀释倍数计算。6.4.3特殊情况第一稀释度平板上的典型菌落数均大于150CFU,且有确证的肠杆菌科菌落,以及第二稀释度平板上无确证的肠杆菌科菌落或典型菌落数不在15CFU~150CFU之间,则以确证的菌落数乘以第一稀释倍数计算,示例见A.5。若所有稀释度的平板上典型菌落数均不在适宜计数范围内,且无确证的肠杆菌科菌落,则以小于1乘以最低稀释倍数计算。7报告7.1菌落数小于100时,以整数报告。7.2菌落数大于或等于100时,对第3位数字进行修约后,取前2位数字,后面用0代替位数;也可用10的指数形式来表示,采用两位有效数字。7.3数字修约按“四舍五入”原则进行。4
犌犅4789.41—20167.4若所有平板上为蔓延菌落而无法计数,则报告菌落蔓延。7.5若空白对照上有菌落生长,则此次检测结果无效。7.6称重取样以CFU/g为单位报告,体积取样以CFU/mL为单位报告。第二法肠杆菌科犕犘犖计数法8检验程序肠杆菌科MPN计数法检验程序见图2。图2肠杆菌科犕犘犖计数法检验程序5
犌犅4789.41—20169操作步骤9.1样品的稀释按6.1进行。9.2接种和培养9.2.1非选择性前增菌根据对样品污染状况的估计及相关限量要求,选择3个适宜连续稀释度的样品匀液,每个稀释度3管,共9管BPW于36℃±1℃培养18h±2h。9.2.2选择性增菌从BPW各培养管中,分别移取1mL培养物,接种于10mL的EE肉汤中,36℃±1℃培养24h±2h。9.2.3分离用接种环从EE各肉汤管中分别取培养物1环,划线接种于VRBGA平板,36℃±1℃培养24h±2h,观察平板上有无典型菌落。9.3典型菌落的确认典型菌落确认见6.3。10报告肠杆菌科为革兰氏阴性无芽胞杆菌,发酵葡萄糖产酸、氧化酶阴性。只要有1个菌落确认为肠杆菌科,其所代表的EE管即为肠杆菌科阳性,依据EE阳性管数查MPN表(见附录C),报告每克(毫升)样品中肠杆菌科的MPN值。称重取样以MPN/g为单位报告,体积取样以MPN/mL为单位报告。6
犌犅4789.41—2016附录犃结果计算示例犃.1两个连续稀释度均含适宜的典型菌落数平板,并含有已确证的肠杆菌科菌落,数据见表A.1。表犃.1肠杆菌科平板计数结果示例1稀释度1∶100(第一稀释度)1∶1000(第二稀释度)典型菌落数/CFU1261452024用于确认试验的菌落数/CFU5555确证的菌落数/CFU4543犪4/5×126=1015/5×145=1454/5×20=163/5×24=14犖=[210+1+(01.145×+2)1]6×+1104-2=02.07262=12545上述数据按7.2数字修约后,表示为13000或1.3×104。犃.2两个连续稀释度均含适宜典型菌落数平板,其中某一稀释度的一个平板菌落数不在适宜范围内,或者两个稀释度各有一个平板菌落数不在适宜范围内,则相应的平板不作为计数平板,数据见表A.2。表犃.2肠杆菌科平板计数结果示例2稀释度1∶100(第一稀释度)1∶1000(第二稀释度)典型菌落数/CFU1261182010用于确认试验的菌落数/CFU585—确证的菌落数/CFU454—犪4/5×126=1015/8×118=744/5×20=16—犖=[2+10(01.1+×741)+]1×610-2=01.09211=9095上述数据按7.2数字修约后,表示为9100或9.1×103。犃.3两个连续稀释度均含适宜典型菌落数平板,其中一个平板无已确证的肠杆菌科菌落,则相应的平板不作为计数平板,数据见表A.3。表犃.3肠杆菌科平板计数结果示例3稀释度1∶100(第一稀释度)1∶1000(第二稀释度)典型菌落数/CFU1261182020用于确认试验的菌落数/CFU5655确证的菌落数/CFU4640犪4/5×126=1016/6×118=1184/5×20=160犖=[210+1(+0.111×81+)1]6×+100-2=02.03251=11190上述数据按7.2数字修约后,表示为11000或1.1×104。7
犌犅4789.41—2016犃.4两个连续稀释度均含适宜典型菌落数平板,但无已确证的肠杆菌科菌落,则以小于1乘以最低稀释倍数计算。犃.5第一稀释度平板上的菌落数超过150CFU,且有证实的肠杆菌科菌落,以及第二稀释度平板上无确证的肠杆菌科菌落或典型菌落数不在15CFU~150CFU之间,则以确证的菌落数乘以第一稀释倍数计算,数据见表A.5。表犃.5肠杆菌科平板计数结果示例5稀释度1∶100(第一稀释度)1∶1000(第二稀释度)典型菌落数/CFU2201982317用于确认试验的菌落数/CFU5555确证的菌落数/CFU4300犪4/5×220=1763/5×198=11900犖=(176+2119)×102=147508
犌犅4789.41—2016附录犅培养基和试剂犅.1缓冲蛋白胨水(犅犘犠)犅.1.1成分蛋白胨10.0g氯化钠5.0g磷酸氢二钠3.5g磷酸二氢钾1.5g蒸馏水1000.0mL犅.1.2制法将B.1.1成分加热溶解,于25℃时调节pH至7.2±0.2,分装于500mL广口瓶中,每瓶225mL,121℃高压灭菌15min。犅.2缓冲葡萄糖煌绿胆盐肉汤(犈犈肉汤)犅.2.1成分蛋白胨10.0g葡萄糖5.0g磷酸氢二钠(无水)6.45g磷酸二氢钾2.0g牛胆盐20.0g煌绿0.0135g蒸馏水1000.0mL犅.2.2制法将B.2.1成分溶于水中,加热煮沸至完全溶解,加热不宜超过30min,迅速冷却培养基,于25℃调节pH至7.2±0.2,分装于灭菌的18mm×180mm试管中,每管10mL,不需高压灭菌,5℃±3℃可存放一个月。犅.3结晶紫中性红胆盐葡萄糖琼脂(犞犚犅犌犃)犅.3.1成分蛋白胨7.0g酵母浸膏3.0g3号胆盐1.5g葡萄糖10.0g氯化钠5.0g9
犌犅4789.41—2016中性红0.03g(或0.6%酒精溶液5mL)结晶紫0.002g(或0.1%水溶液2mL)琼脂粉10.0g~12.0g蒸馏水1000.0mL犅.3.2制法将B.3.1成分溶于水中,加热煮沸至完全溶解,25℃时调节pH至7.4±0.2,分装于灭菌的锥形烧瓶中,不需高压灭菌,用前制备。倾注平板,使用前干燥平板。未干燥的平板5℃±3℃可存放两周。犅.4营养琼脂(犖犃)犅.4.1成分牛肉浸膏3.0g蛋白胨5.0g琼脂粉10.0g~12.0g蒸馏水1000.0mL犅.4.2制法将B.4.1成分溶于水中,加热煮沸,25℃时调节pH至7.3±0.2,121℃高压灭菌15min。倾注平板,使用前干燥平板。未干燥的平板于5℃±3℃可存放两周。犅.5葡萄糖琼脂犅.5.1成分胰蛋白胨10.0g酵母浸膏1.5g葡萄糖10.0g氯化钠5.0g溴甲酚紫0.015g(或0.4%溴甲酚紫酒精溶液3.75mL)琼脂粉10.0g~12.0g蒸馏水1000.0mL犅.5.2制法将B.5.1成分溶于水中,加热煮沸,25℃时调节pH至7.0±0.2,分装于15mm×150mm试管,每管约5mL,121℃高压灭菌15min后,试管垂直放置。于5℃±3℃可存放1周。为去除培养基中的氧气,使用前可将葡萄糖琼脂试管置于沸水浴中15min,然后迅速冷却,备用。犅.6革兰氏染色液犅.6.1结晶紫染色液犅.6.1.1成分结晶紫1.0g10
犌犅4789.41—201695%乙醇20.0mL1%草酸铵水溶液80.0mL犅.6.1.2制法将结晶紫完全溶解于乙醇中,然后与草酸铵溶液混合。犅.6.2革兰氏碘液犅.6.2.1成分碘1.0g碘化钾2.0g蒸馏水300.0mL犅.6.2.2制法将碘和碘化钾先行混合,加入少许蒸馏水充分振摇,待完全溶解后,再加蒸馏水至300mL。犅.6.3沙黄复染液犅.6.3.1成分沙黄0.25g95%乙醇10.0mL蒸馏水90.0mL犅.6.3.2制法将沙黄溶解于乙醇中,然后用蒸馏水稀释。犅.6.4染色方法犅.6.4.1将涂片在火焰上固定,滴加结晶紫染色液,染1min,水洗。犅.6.4.2滴加革兰氏碘液,作用1min,水洗。犅.6.4.3滴加95%乙醇脱色15s~30s,直至染色液被洗掉,但不要过分脱色、水洗。犅.6.4.4加沙黄复染液,复染1min,水洗、干燥、镜检。犅.6.4.5革兰氏阳性菌呈紫色,革兰氏阴性菌呈红色。犅.7氧化酶试剂犅.7.1成分犖,犖,犖′,犖′四甲基对苯二胺盐酸盐1.0g蒸馏水100.0mL犅.7.2制法将B.7.1成分溶解于冷水中,少量新鲜配制。犅.7.3试验方法用细玻璃棒或一次性接种针挑去单个菌落,涂布在氧化酶试剂湿润的滤纸上。在10s内呈现粉红11
犌犅4789.41—2016或紫红色,即为氧化酶试验阳性。不变色者为氧化酶试验阴性。犅.8无菌1犿狅犾/犔犖犪犗犎犅.8.1成分NaOH40.0g蒸馏水1000.0mL犅.8.2制法称取40g氢氧化钠溶于1000mL蒸馏水中,121℃高压灭菌15min。犅.9无菌1犿狅犾/犔犎犆犾犅.9.1成分HCl90.0mL蒸馏水1000.0mL犅.9.2制法移取浓盐酸90mL,用蒸馏水稀释至1000mL,121℃高压灭菌15min。12
犌犅4789.41—2016附录犆肠杆菌科最可能数(犕犘犖)检索表每克(毫升)检样中肠杆菌科最可能数(MPN)的检索见表C.1。表犆.1肠杆菌科最可能数(犕犘犖)的检索表阳性管数95%置信区间阳性管数95%置信区间MPNMPN0.100.010.001下限上限0.100.010.001下限上限000<3.0—9.5220214.5420013.00.159.6221288.7940103.00.1511222358.7940116.11.218230298.7940206.21.218231368.7940309.43.638300234.6941003.60.1718301388.71101017.21.3183026417180102113.6383104391801107.41.3203117517200111113.63831212037420120113.64231316040420121154.5423209318420130164.542321150374202009.21.43832221040430201143.642323290901000202204.542330240421000210153.742331460902000211204.54233211001804100212278.794333>1100420—注1:本表采用3个稀释度[0.1g(mL)、0.01g(mL)和0.001g(mL)],每个稀释度接种3管。注2:表内所列检样量如改用1g(mL)、0.1g(mL)和0.01g(mL)时,表内数字应相应降低10倍;如改用0.01g(mL)、0.001g(mL)、0.0001g(mL)时,则表内数字应相应增高10倍,其余类推。13'
您可能关注的文档
- GB4789.35-2010发布稿食品微生物学检验乳酸菌检验发布稿.pdf
- GB4789.35-2016食品安全国家标准食品微生物学检验乳酸菌检验.pdf
- GB4789.36-2016食品安全国家标准食品微生物学检验大肠埃希氏菌O157H7NM检验.pdf
- GB4789.38-2012食品微生物检验大肠埃希氏菌计数.pdf
- GB4789.39-2013食品安全国家标准食品微生物学检验粪大肠菌群计数.pdf
- GB4789.4-2010发布稿食品微生物学检验沙门氏菌检验发布稿.pdf
- GB4789.4-2016食品安全国家标准食品微生物学检验沙门氏菌检验.pdf
- GB4789.40-2010发布稿食品微生物学检验阪崎肠杆菌检验发布稿.pdf
- GB4789.40-2016食品安全国家标准食品微生物学检验克罗诺杆菌属(阪崎肠杆菌)检验.pdf
- GB4789.42-2016食品安全国家标准食品微生物学检验诺如病毒检验.pdf
- GB4789.5-2012食品微生物学检验志贺氏菌检验.pdf
- GB4789.7-2013食品安全国家标准食品微生物学检验副溶血性弧菌检验.pdf
- GB4789.8-2016食品安全国家标准食品微生物学检验小肠结肠炎耶尔森氏菌检验.pdf
- GB4789.9-2014食品安全国家标准食品微生物学检验空肠弯曲菌检验.pdf
- GB47891-2010食品安全国家标准食品微生物学检验总则.pdf
- GB478910-2010食品安全国家标准食品微生物学检验金黄色葡萄球菌检验.pdf
- GB478915-2010食品安全国家标准食品微生物学检验霉菌和酵母计数.pdf
- GB478918-2010食品安全国家标准食品微生物学检验乳与乳制品检验.pdf
相关文档
- 施工规范CECS140-2002给水排水工程埋地管芯缠丝预应力混凝土管和预应力钢筒混凝土管管道结构设计规程
- 施工规范CECS141-2002给水排水工程埋地钢管管道结构设计规程
- 施工规范CECS142-2002给水排水工程埋地铸铁管管道结构设计规程
- 施工规范CECS143-2002给水排水工程埋地预制混凝土圆形管管道结构设计规程
- 施工规范CECS145-2002给水排水工程埋地矩形管管道结构设计规程
- 施工规范CECS190-2005给水排水工程埋地玻璃纤维增强塑料夹砂管管道结构设计规程
- cecs 140:2002 给水排水工程埋地管芯缠丝预应力混凝土管和预应力钢筒混凝土管管道结构设计规程(含条文说明)
- cecs 141:2002 给水排水工程埋地钢管管道结构设计规程 条文说明
- cecs 140:2002 给水排水工程埋地管芯缠丝预应力混凝土管和预应力钢筒混凝土管管道结构设计规程 条文说明
- cecs 142:2002 给水排水工程埋地铸铁管管道结构设计规程 条文说明