- 3.46 MB
- 2022-04-22 11:34:27 发布
- 1、本文档共5页,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报电话:19940600175。
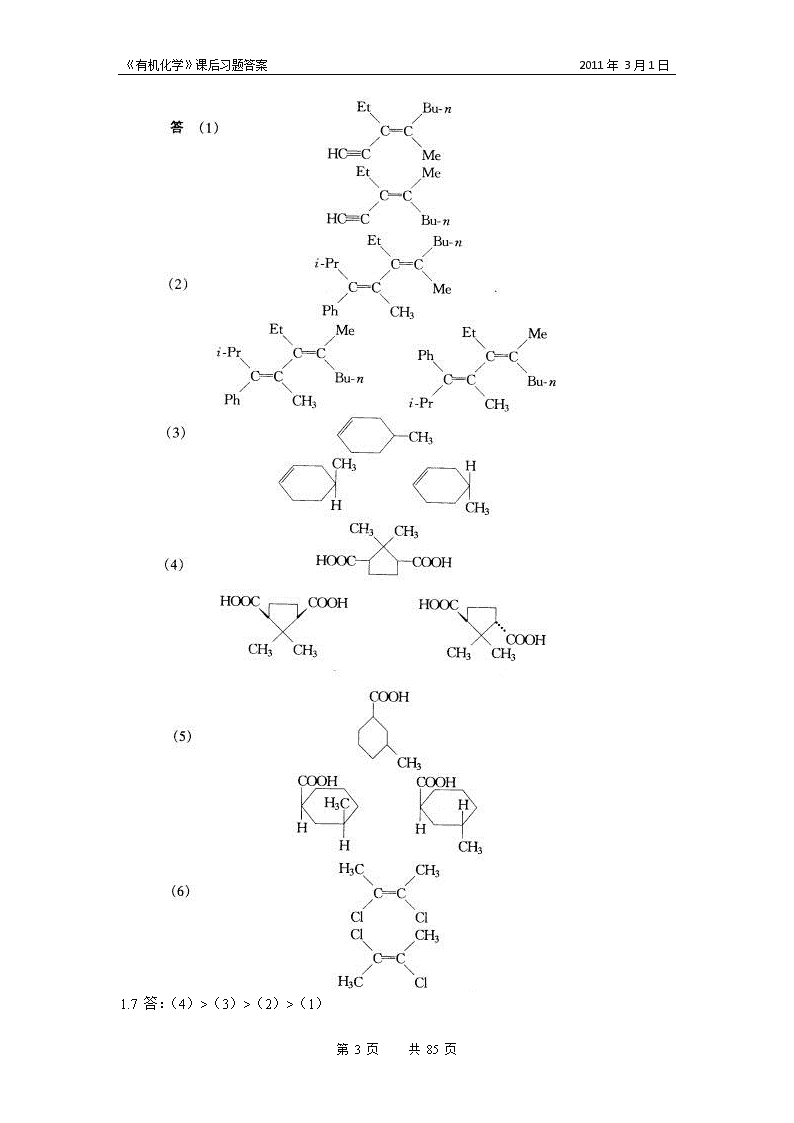
'《有机化学》课后习题答案2011年3月1日《有机化学》课后习题答案第1章思考题答案1.1答:具有同一个分子结构通式,且结构和性质相似的一系列化合物称为同系列。分子式相同而结构相异,因而其性质也各异的不同化合物,称为同分异构体,这种现象叫同分异构现象。1.2答:因某一原子或基团的电负性而引起电子云沿着键链向某一方面偏移的效应叫诱导效应。1.3答:影响有机化学反应活性的因素主要有三个:底物(反应物)的结构和特性,进攻试剂的性质和反应环境条件(温度、压强、溶剂、反应时间等)。1.4答:有机物的沸点、熔点比无机盐低。在水中的溶解度比无机盐小。1.5答:溶解度跟有机物和水分子间形成的氢键有关,因二者和水解都能形成氢键,而沸点与同种物质分子间氢键有关,正丁醇分子间能形成氢键,乙醚分子间不能形成氢键。1.6答:自由基反应和离子型的反应。习题答案1.1答:(1)6-甲基-4,5-辛二醇 (2)3-甲基-5氯-4-壬醇 (3)3-甲基-5丙基-4-壬醇 (4)4-甲基-3-乙基-已醛 (5)2,4-二甲苯甲酸 (6)2-甲基-4-氨基苯甲酸 (7)2-氨基-4-硝基苯甲酸 (8)4-硝基苯甲酸 (9)3-甲基苯甲酸 (10)环已胺 (11)2-环已烯甲酸 (12)4-甲基环已胺 (13)4-甲基-4-丙基-2-氯苯磺酸 (14)3-甲基-4-丙基-3-辛烯1.2答:1.3答:第85页共85页
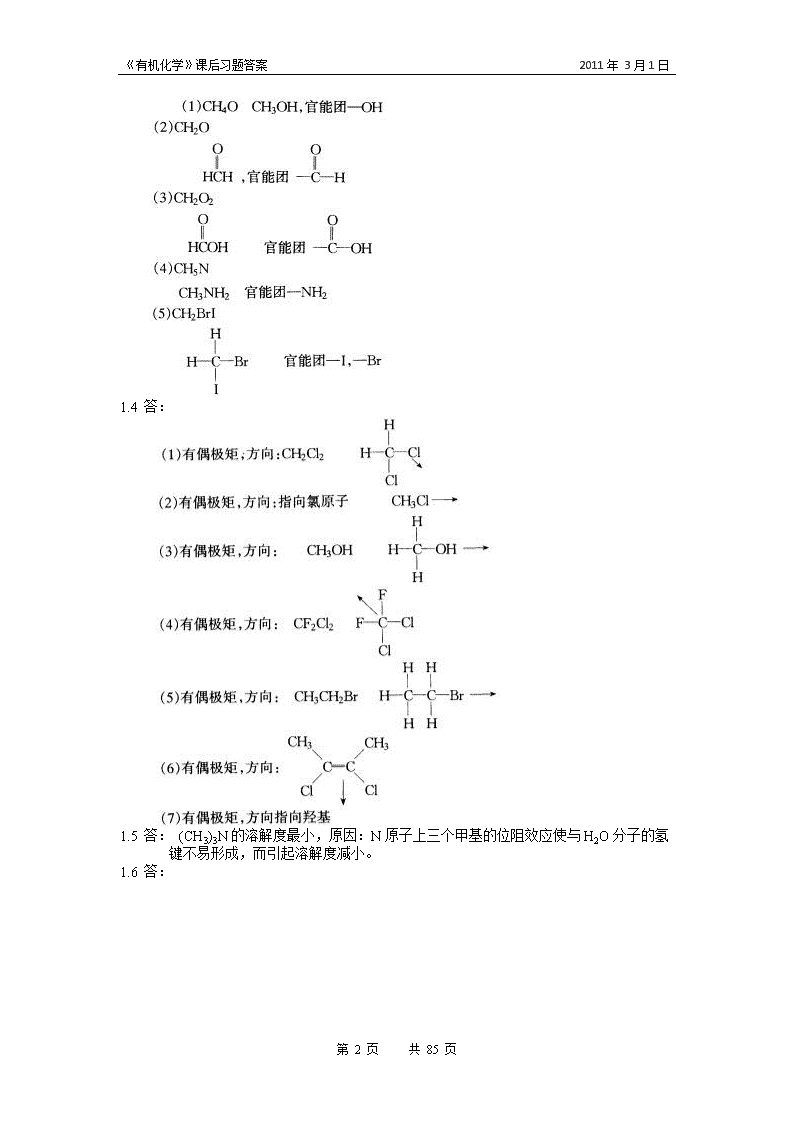
《有机化学》课后习题答案2011年3月1日1.4答:1.5答:(CH3)3N的溶解度最小,原因:N原子上三个甲基的位阻效应使与H2O分子的氢键不易形成,而引起溶解度减小。1.6答:第85页共85页
《有机化学》课后习题答案2011年3月1日1.7答:(4)>(3)>(2)>(1)第85页共85页
《有机化学》课后习题答案2011年3月1日第2章思考题答案2.1答:在离域体系中,键长趋于平均化,体系能量降低而使分子稳定性增加。共轭体所表现出来的这种效应叫共轭效应。共轭体系分为π-π共轭体系和p-π共轭体系。超共轭效应是当C—H键与相邻的π键处于能重叠位置时,C—H键的轨道与π轨道也有一定程度的重叠,发生电子的离域现象,此时,键向π键提供电子,使体系稳定性提高。它分为-p和-π超共轭。超共轭效应比共轭效应小。2.2答:异构现象异同点举例构造异构分了中原互相联结的方式和次序不同 1.碳链异构碳链不同2.位置异构取代基在碳链或环上的位置不同3.官能团异构官能团不同立体异构分子中原子在空间 2.3答:(1)无引发剂自由基产生(2)光照射,产生Cl·,氯自由基非常活泼与甲烷立即反应。(3)所生成的Cl·重新变为Cl2,失去活性。(4)光照射,CH4不能生成自由基,不能与Cl2在黑暗中反应。第85页共85页
《有机化学》课后习题答案2011年3月1日(5)自由基具有连锁反应。 2.4答:2.5答:2.6答:(略)2.7答:+5o,-175o2.8答: 习题答案 2.12.2答:第85页共85页
《有机化学》课后习题答案2011年3月1日2.3解:烷烃的沸点随相对分子质量增大而升高,相对分子质量相同时,支链越多,沸点越低,顺序:(3)>(2)>(1)>(5)>(4)2.4解:(略)2.5+第85页共85页
《有机化学》课后习题答案2011年3月1日2.6答:(1)最稳定构象:图略(全交叉式),最不稳定构象:图略(全重叠式)(2)设该烷烃的分子式为,则2.7答:(4)>(2)>(3)>(1)2.8答:有顺反异构现象,即2.9解:第85页共85页
《有机化学》课后习题答案2011年3月1日2.10答:主要是因为中间经历了碳正离子重排历程。2.11答:以上烯烃如用酸性KMnO4溶液氧化,则醛被继续氧化成羧酸,酮不变。2.12答:第85页共85页
《有机化学》课后习题答案2011年3月1日2.132.14答:构造式为CH3CH=CHCH32.152.162.17解:(1)热KMnO4试液第85页共85页
《有机化学》课后习题答案2011年3月1日2.182.192.20第85页共85页
《有机化学》课后习题答案2011年3月1日 2.212.222.23第85页共85页
《有机化学》课后习题答案2011年3月1日2.24解(1)将乙烷气体通入Cu(NH3)2Cl溶液中洗涤可除去乙炔。(2)同上2.25解(1)1,2-加成快,因为该反应中间体与Br-反应生成1,2-加成产物所需的活化能较低。(2)因为1,4-加成产物超共轭效应化,12-加成产物大,故比1,2-加成产物稳定。2.262.27第85页共85页
《有机化学》课后习题答案2011年3月1日2.28解(1)对映体(2)(略)(3)非对映体(4)对映体(5)同一化合物,[都为(S,S)型](6)对映体2.292.302.31第85页共85页
《有机化学》课后习题答案2011年3月1日2.32 第85页共85页
《有机化学》课后习题答案2011年3月1日第3章思考题答案1、答:环的实际角度与碳原子正四面体所需要的角度不一致,导致分子的热力学能高于正常烷烃的热力学能,这种高出的能量叫张力能。这种张力是由于键角的偏差所引起的,所以叫张角张力。2、答:命名螺环化合物时,根据组成环的碳原子总数,命名为“某烷”,加上词头“螺”。再把连接于螺原子的两个环的碳原子数目,按由小到大的次序写在“螺”和“某烷”之间的方括号内,数字用圆点分开。例如命名桥环化合物时,根据组成环的碳原子总数命名为“某烷”,加上词头“双环”,再把各“桥”所含碳原子的数目,按由大到小的次序写在“双环”和“某烷”之间的方括号里,数字用圆点分开。注意编号顺序。例如3.3答:环烷烃越不稳定,其燃烧热越大。这里环丙烷的张力最大,所以燃烧热最大。环丁烷的张力比环丙烷小,比环戊烷要大,所以其燃烧热值也居中,而环戊烷基本上无张力,所以燃烧热与烷烃的很相近。3.4答:环丙烷的张力最大,容易加氢、加卤素、加卤化氢等得到相应的开环产物。3.5答:在环已烷的构象中,每个碳原子上的两个碳氢键,可以分为两类:一类是垂直于碳环所在的平面,称为直立键(a键)。另一类是大体平行碳环的平面,称为“平伏键”(e键)。习题答案3.13.2解(1)1-甲基-3-异丙基-环已烯(2)1-甲基-4-乙烯基-1.3-环已二烯(3)1,3,5-环已三烯(4)螺[2,5]-4-辛烯(5)双环[2.2.2]-2-辛烯(6)3,7,7-二甲基-4-乙基环戊烷(7)1,2-二甲基-4-乙基环戊烷第85页共85页
《有机化学》课后习题答案2011年3月1日3.33.43.53.6第85页共85页
《有机化学》课后习题答案2011年3月1日3.73.83.9第85页共85页
《有机化学》课后习题答案2011年3月1日 第85页共85页
《有机化学》课后习题答案2011年3月1日 第4章思考题答案4.1答:(1)因烷基正离子容易重排,易形成烷基异构化产物;(2)烷基可活化苯环,易使烷基化反应产物为多元取代产物;(3)烷基化反应是可逆反应,使得产物可能复杂化。4.2答:苯环上已有一个取代基后,再进行亲电取代反应时,新进入的基团进入苯环的位置由环上原有取代基的性质决定,这个原有的取代基叫定位基。定位基可分为三类,即(1)邻、对位定位基,如—OH、—NH2、—NHCOCH3、—CH3等,这类基团使苯环活化,并且使新引入的取代基在定位基的邻位和对位。(2)间位定位基,如—NO2、—CN、—COCH3、—COOH、—SO3H等,这类基团使苯环钝化,并使新引入的取代基在它的间位。(3)卤素是一类特殊的定位基,它使苯环钝化,但都是邻、对定位基。4.3答:邻、对位定位基的推电子作用是苯环活化的原因,这又可分为两种情况:①在与苯环成键的原子上有一对未共享电子,这对电子可以通过大π键离域到苯环上;②虽无未共享电子对,但能通过诱导效应或超共轭效应起推电子作用的基团,如甲基或其他烷基。当邻、对位定位基直接连在带δ+的碳上时,能更好地使中间体δ络合物稳定,故新取代基主要进入邻、对位。间位定位基的吸电子作用使苯环上电子云密度降低,结果使苯环钝化。当间位定位基直接连在带δ+的碳上时,使中间体络合物更不稳定,但它连在间位时,使络合物不稳定的影响就小些,故新取代基主要进入间位。卤素的诱导效应和共轭效应的总结果使苯环上电子云密度降低,故使苯环钝化,共轭效应决定着反应的方向,因此卤素是邻,对位定位基。4.4答:(1)共轭式中原子的排列完全相同,不同的是电子的排布。例如,乙烯醇与乙醛间的互变异构就不是共振关系。(2)共振式中配对电子或未配对的电子数应是相等的。(3)中性分子也可用电荷分离式表示,但是电子的转移要与原子的电负性一致。 4.5答:芳香亲电取代反应主要有:卤化、硝化、磺化和弗-克反应。其反应机制可表示如下: 通常形成络合物这步是反应速度的决定步骤。络合物失去质子一般比失去亲电试剂(即逆反应)要快,从而得到取代产物。4.6答:对二甲苯和对游离基卤代反应更活泼。因为对二甲苯在卤素游离基作用下生成以对甲苄基游离基,由于甲基的给电子作用,使得它的稳定性大于苄基游离基。即稳定性:第85页共85页
《有机化学》课后习题答案2011年3月1日4.7答:p-NO2-C6H4CH3的极性大于甲苯,使更易溶于K2CrO7+H+体系中发生氧化反应,故有较好的产率。4.8答:(1)说明环丁二烯没有形成闭合的共轭大π键,无芳香性。环上的4个碳原子不等同。习题答案4.14.2第85页共85页
《有机化学》课后习题答案2011年3月1日4.3解(1)加溴水,使溴水褪色的为,剩下的两种化合物中加浓硫酸,加热后溶于酸层的为(2)加AgNO3氨溶液,有白色沉淀的为,剩下的两种化合物中加溴水,使溴水褪色的为4.4解(1)间二乙苯>对二乙苯>乙苯>苯(2)丙苯>苯>氯苯>硝基苯(3)间二甲苯>甲苯>对甲苯甲酸>对苯二甲酸(4)氯苯>对氯硝基苯>2,4-二硝基氯苯4.5解(1)D>B>A>C>E(2)B>D>A>C4.6第85页共85页
《有机化学》课后习题答案2011年3月1日4.7第85页共85页
《有机化学》课后习题答案2011年3月1日4.84.9第85页共85页
《有机化学》课后习题答案2011年3月1日(2)(A)具有吸电子基相连的苯环不发生弗-克反应;(B)氧化时烃基侧链变成COOH。 4.104.11第85页共85页
《有机化学》课后习题答案2011年3月1日4.12第85页共85页
《有机化学》课后习题答案2011年3月1日4.134.14解(2)4.15第85页共85页
《有机化学》课后习题答案2011年3月1日4.164.17解(1)C>A>B(2)C>B>A4.184.19解(1),(4),(8),(11),(12)有芳香性4.20第85页共85页
《有机化学》课后习题答案2011年3月1日2-苯基丙烯在同样的反应条件可能生成: 第85页共85页
《有机化学》课后习题答案2011年3月1日第5章思考题答案5.1答:可分为三类:(1)丙烯基卤代烃,如CH3CH=CHX(2)烯丙基卤代烃,如CH2=CH-CH2X(3)孤立式卤代烃,如CH2=CHCH2CH2X5.2答:(略)5.3答:在溶剂中,分子或离子都可以通过静电力与溶剂分子相互作用,称为溶剂化效应。5.4答:增加温度可提高消除反应的比例。5.5答:在卤代芳烃分子中,卤素连在sp2杂化的碳原子上。卤原子中具有弧电子对的p轨道与苯环的π轨道形成p-π共轭体系。由于这种共轭作用,使得卤代芳烃的碳卤键与卤代脂环烃比较,明显缩短。5.6答:对二卤代苯的对称性好,分子排列紧密,分子间作用力较大,故熔点较大。由于对二卤代苯的偶极矩为零,为非极性分子,在极性分子水中的溶解度更低。5.7答:(略)习题答案5.1(1)1-溴-3-氯丁烷(2)四氟乙烯(3)2-氯-3-乙烯(4)3-氯环已烯(5)2-甲基-3-氯-6-碘-1,4-已二烯(6)2-甲基-3-乙基-4-溴戊烷(7)4-甲基-1-溴环已烯(8)1-氯-4-溴苯5.25.3第85页共85页
《有机化学》课后习题答案2011年3月1日第85页共85页
《有机化学》课后习题答案2011年3月1日5.4解5.5(略)5.6第85页共85页
《有机化学》课后习题答案2011年3月1日5.7解(1)第二个反应较快,由于反应主要是SN2历程,而第二个反应的原料(1-溴丁烷)有较小的空间障碍(无支链)(2)反应主要按SN1历程进行,由于(CH3)3C+比(CH3)2CH+更稳定,故第一个反应较快。(3)第二个反应较快。SH-亲核性比OH-好(4)反应主要是按E2历程进行,由于Br是比Cl更好的离去基,所以第一个反应更快。5.8解(1)是SN2历程(2)是SN1历程,(最初生成的碳正离子可能重排成更稳定的碳正离子)(3)是SN2历程,(SN1历程属一级,与亲核试剂无关)(4)是SN1历程,(叔碳正离子比仲碳正离子稳定)(5)是SN1历程,(含水量增加,意味着反应体系溶剂极性增加,有利于SN1)(6)是SN1历程,(SN2反应只有一步,没有中间体生成,而SN1反应属于二步反应,有中间体碳正离子形成)。(7)试剂亲核性愈强,反应速度愈快。属SN2历程,(SN1反应中,第一步是决定反应速度的一步,所以SN1的反应速度与亲核试剂无关)。5.9解(1)A错:加成方向反了。B错:分子中的OH基存在可破坏生成的Grignard试剂,应先保护。(2)A无错。B错:NaCN为强碱弱酸盐,它的溶液呈碱性。叔卤代烃在碱性溶液中一般生成消除产物,而不是取代产物。5.10第85页共85页
《有机化学》课后习题答案2011年3月1日第85页共85页
《有机化学》课后习题答案2011年3月1日5.11第85页共85页
《有机化学》课后习题答案2011年3月1日5.12反应的第一步三种原料均生同一中间体碳正离子,故得到相同的产物,由于不同卤原子离去难易不同(I>Br>Cl),故反应速度不同。5.13第85页共85页
《有机化学》课后习题答案2011年3月1日5.145.155.16解I-无论是作为亲核试剂还是作为离去基团,都表现出很高的活性,因此在SN反应中,常加入少量I-,使反应速度加快,显然,反应过程中I-未消耗,但是促进了反应。5.17解(1)该同学得到了A,同时也得到了B,反应如下页所示。(2)该同学的设计第一步(烷基化)不合理,选用的CH3CH2CH2Cl容易产生重排的碳正离子。 第85页共85页
《有机化学》课后习题答案2011年3月1日第6章思考题答案6.1答(1)乙醇的活泼氢能与Na发生反应,苯与Na无反应。(2)RMgX不仅是一种强的亲核试剂,同时又是一种强碱,可与醇羟基中的H结合,即RMgX可被具活性氢的物质所分解,如(3)LiAlH4既是一种强还原剂,又是一种强碱,它所提供H-与醇发生反应,如6.2叔丁基醚用H2SO4脱水法合成时,主要产生烯烃。6.3答甲苯和苯酚的相对分子质量相近,但是甲苯的沸点110.6℃,而苯酚的沸点181.8℃,这是由于苯酚可以形成分子间氢键;甲苯不溶于水,而苯酚易溶于水,是由于苯酚与水分子之间会形成氢键:第85页共85页
《有机化学》课后习题答案2011年3月1日6.4习题答案 6.1解:(1)2-甲基-2-戊醇>二乙基甲醇>正戊醇(2)对甲基苄醇>苄醇>对硝基苄醇,(3)α-苯基乙醇>苄醇>β-苯基乙醇6.2解:(1)可按以顺序进行鉴定①与金属Na作用无H2放出者为C6H5OCH3②与FeCl3溶液作用有颜色产生的为(或与溴水作用生成白色沉淀者)③剩下的三种醇分别为伯、仲、叔醇,可用卢卡斯试剂进行区分室温下很快(约1min)出现浑浊或分层现象者:(CH3)3COH室温下较快(约10min)出现浑浊或分层现象者:室温上述现象不明显(或很慢),经加热有明显现象者是CH3CH2CH2OH(2)可按以下顺序进行鉴定第85页共85页
《有机化学》课后习题答案2011年3月1日 6.36.4第85页共85页
《有机化学》课后习题答案2011年3月1日第85页共85页
《有机化学》课后习题答案2011年3月1日 第85页共85页
《有机化学》课后习题答案2011年3月1日 第85页共85页
《有机化学》课后习题答案2011年3月1日6.56.66.76.86.9第85页共85页
《有机化学》课后习题答案2011年3月1日6.106.116.12(略)6.136.14第85页共85页
《有机化学》课后习题答案2011年3月1日6.156.16(略)6.17(2)(略)(3)(略)第85页共85页
《有机化学》课后习题答案2011年3月1日第7章思考题答案7.1答(1)邻位取代苯甲酸的酸性,均大于间位和对位异构体。(2)间、对位上的吸电子基使苯甲酸酸性增加、供电子基使苯甲酸酸性降低。7.2答(1)立体因素的影响:当羰基上的两个取代基和亲核试剂体积越小,反应速度越快。(2)电子因素的影响:反应物羰基碳原子的正电性越强,羰基进行亲核加成反应活性越大。(3)亲核试剂的影响:亲核试剂的亲核性越强,对反应越有利。(4)酸碱的影响:适当控制羰基化合物与亲核试剂反应的酸碱性,有利于提高反应速率。7.3答(1)不饱和羰基化合物,根据种类考虑可分为不饱和醛酮、不饱和羧酸、不饱和羧酸衍生物及醌。根据双键和羟基的相对位置,可分为烯酮(如RCH=C=O),弧立不饱和羰基化合物,(醌是一类特殊的α,β-不饱和羰基化合物如苯醌)7.4答醛酮和氨的衍生物的反应一般为加成、消去两步反应。pH太大,消除脱水步较慢,pH太小,加成步骤慢。7.5答叔丁基的空间位阻效应大于乙基,再者供电子效应比乙基大使羰基碳的亲电性降低,故反应慢。7.6答利用醛的沸点比醇低这一特点,使反应生成的醛不断蒸发出来以免被进一步氧化。7.7答缩醛在碱性条件下稳定。7.8答乙酸在NaOH条件下,形成CH3COO-,氧负离子与羰基共轭,电子离域化的结果,降低了羰基碳的正电性,因此α-氢活泼性降低,不能发生碘仿反应。7.9答乙酸存在分子间氢键,故沸点比相对分子质量相近的有机物要高。而烯醇酸中对C=C加溴可从平面上或下两个方向,故为外消旋体。习题答案7.1第85页共85页
《有机化学》课后习题答案2011年3月1日 7.2第85页共85页
《有机化学》课后习题答案2011年3月1日7.3第85页共85页
《有机化学》课后习题答案2011年3月1日7.47.57.6解(1)会(2)会(3)不会7.7第85页共85页
《有机化学》课后习题答案2011年3月1日7.87.97.10解(1)与吐伦试剂共热,试管壁上形成银镜的是苯甲醛或与金属Na反应有气体放出为苯甲醇。(2)方法同(1),也可用费林试剂(CuSO4/NaOH)加热有砖红色沉淀的是丁醛。(3)能发生碘仿反应(I2/NaOH)的是2-戊酮。(4)分别加入2,4-二硝基苯肼生成黄色沉淀的是丙酮,红色沉淀的是苯乙酮,再者生成的结晶能溶解于丙酮的是丙酮。(5)与金属钠反应有气体放出是2-丙醇。(6)能发生碘仿反应的是1-苯基乙醇。(7)能与Na2CO3溶液反应放出CO2气体的是乙酸,能发生银镜反应的是乙醛。(8)能发生银镜反应的是甲酸。加热有气体放出的是丙二酸。第85页共85页
《有机化学》课后习题答案2011年3月1日(9)加入溴水、褪色为马来酸,再加入KMnO4溶液褪色为草酸。(10)加入FeCl3溶液呈紫色为水杨酸,加入Na2CO3溶液有气体放出为苯甲酸。(11)加入AgNO3溶液有白色沉淀为乙酰氯,加入Na2CO3溶液有气体放出为乙酸酐。(12)能发生碘仿反应的是CH3COCH2COOH(13)能使能溴水褪色CH2COCH(CH3)COOC2H57.117.127.137.14 7.157.16第85页共85页
《有机化学》课后习题答案2011年3月1日7.17第85页共85页
《有机化学》课后习题答案2011年3月1日第85页共85页
《有机化学》课后习题答案2011年3月1日7.18第85页共85页
《有机化学》课后习题答案2011年3月1日7.19(1)2、7-辛二酮第85页共85页
《有机化学》课后习题答案2011年3月1日7.207.21解(1)草酸>丙二酸>甲酸>乙酸>苯酚(2)三氟乙酸>氯乙酸>乙酸>丙酸>苯酚>乙醇>乙炔>乙烷(3)对硝基苯甲酸>间硝基苯甲酸>苯甲酸>苯酚>环已醇7.22第85页共85页
《有机化学》课后习题答案2011年3月1日7.237.247.25第85页共85页
《有机化学》课后习题答案2011年3月1日7.267.27第85页共85页
《有机化学》课后习题答案2011年3月1日第8章思考题答案8.1答在强酸中,由于胺基形成铵盐,邻对位定位基本转变为间位基,所以若在强酸中进行会得间位取代产物。8.2答苯酚的苯环上引入硝基,吸电子的硝基通过诱导效应和共轭效应的传递增加了羟基中的氢解离成质子的能力,酸性增强。8.3答呋喃遇盐酸浸湿的松木片呈绿色。吡咯遇盐酸浸湿的松木片呈红色。噻吩在浓H2SO4存在下与靛红一同加热显示蓝色。8.4答卡宾又称碳烯,是电中性的活性中间体,其中碳原子与两个原子或基团以单键相连,另外还有两个非键电子用通式R2C:表示,卡宾有单线态和三线态之分,卡宾的碳原子外围只有六个电子,具有强烈的亲电性。8.5答三甲胺的氮原子上没有氢原子,不能像二甲胺那样分子间形成氢键,故沸点低于二甲胺。8.6答邻位和对位连有硝基时,重氮盐的稳定性增加,亲电性增强,有利于偶合反应。8.7答苯胺分子中氮原子的p轨道与苯环的π轨道形成给电子的p-π共轭轨道从而使苯环上电子云密度增大,发生电子离域,而吡啶分子中氮原子与五个碳原子各提供一个具有1个成单电子的p轨道,它们相互平行,侧面重叠而成闭合共轭体系。8.8第85页共85页
《有机化学》课后习题答案2011年3月1日因为磺化反应是可逆反应,对氨基苯磺酸是热力学稳定的产物,在高温下长时间加热,动力学产物(间氨基苯磺酸)最终转变成热力学稳定的对位产物。8.9答(1)伯胺与亚硝酸作用生成极不稳定的脂肪族重氮氨盐,能立即分解。(2)二甲胺基的邻位为甲基占据,位阻迫使两个甲基偏离苯环平面,位于平面的上下,氮原子上的弧电子对不能与苯环有效共轭,使电子密度降低,故不能再接受芳基重氮盐的亲电进攻。例如化合物1,2的取代基为对位定位基,故生成对硝基苯胺。化合物3,4的取代基为间位定位基,故生成间硝基苯胺。第85页共85页
《有机化学》课后习题答案2011年3月1日咪唑新增加的一个氮原子上孤电子对,在环平面上,与环内的π电子不共轭,这样就提供了接受质子的位置,故碱性强。新增加的氮原子为sp2杂化取代一个C原子,吸电子能力增加使负离子更加稳定故酸性增强。习题答案8.1解8.2第85页共85页
《有机化学》课后习题答案2011年3月1日第85页共85页
《有机化学》课后习题答案2011年3月1日8.3第85页共85页
《有机化学》课后习题答案2011年3月1日8.4 8.5解(1)苯甲醛与糠醛能使浸过浓HCl的松木片变成绿色的是糠醛(2)吡啶与2-甲基吡啶能使酸性KMnO4溶液褪色者为α-甲基吡啶(3)8-羟基喹啉与2,8-二甲基喹啉溶于NaOH的为8-羟基喹啉,也可用FeCl3水溶液,呈紫色的为8-羟基喹啉8.6解(1)D>A>B>C(2)C>A>D>E>B8.78.8第85页共85页
《有机化学》课后习题答案2011年3月1日8.9解(1)室温下,用浓H2SO4来溶解噻吩,静置分层后将酸液分出,再将处理后的苯进行蒸馏即得无噻吩的纯苯。(2)用盐酸溶液,吡啶生成盐而溶于盐酸溶液中与甲苯分层。3)用苯磺酰氯与六氢吡啶反应生成苯磺酰胺,而吡啶不反应,蒸出吡啶。8.10解(1)BrCH2CH2CN酸催化(2)CH2=CHCH2CN碱催化8.118.128.138.14第85页共85页
《有机化学》课后习题答案2011年3月1日8.158.168.17(略)8.188.19第85页共85页
《有机化学》课后习题答案2011年3月1日第85页共85页
《有机化学》课后习题答案2011年3月1日8.208.21第85页共85页
《有机化学》课后习题答案2011年3月1日8.228.23(略)8.248.25第85页共85页
《有机化学》课后习题答案2011年3月1日第9章思考题答案9.1答磷化氢(PH3)分子中的氢被烃基代生成的化合物称为膦。例如CH3CH2PH2乙膦、(C6H5)3P三苯膦。膦酸酯和磷酸酯在结构上本质的区别是膦酸酯含磷氧键和磷磷键,而磷酸酯只含有磷氧键。9.2答合成有机硅化合物的基本原料是硅和四氯化硅。9.3答三烃基锍盐中硫原子为sp3杂化态,硫与三个烃基形成键外,还有一孤对电子占据另一个sp3杂化轨道,故呈锥形结构。如三个烃基互不相同,分子没有对称因素,是手性分子。9.4答硅油、硅橡胶和硅树脂。9.5答有机化合物主要含有C、H及O、N、卤素等元素。有机化合物中所含的其他元素都称为异元素。9.6答异元素直接与碳原子相连的有机化合物称为元素有机化合物。此外,异元素通过O、N等原子间接与C相连的有机化合物也归属于有机化合物的范围。9.7答硫醚与卤代烃反应生成锍盐。锍盐中硫带单位正电荷,以致α-H有一定的酸性。因此,锍盐在碱作用下失去一个质子形成较稳定的两性离子型化合物,即硫叶立德。9.8答凡具有结构的一类化合物称为磷叶立德,磷叶立德通常由三苯基膦和一个伯卤烷(或仲卤烷)反应先生成季磷盐,再用一个强碱处理而得。磷叶立德α碳原子上带有负电荷,是具有碱性和极性的化合物,性质活泼,它是一类很强的亲核试剂,但与一般的碳负离子不同,它们之中绝大多数都能稳定地存在。磷叶立德作为强亲核试剂,可发生一系列化学反应,其中尤其重要的是与羰基化合物反应,在有机合成上有重要的用途。习题答案9.19.2第85页共85页
《有机化学》课后习题答案2011年3月1日9.39.49.59.69.7第85页共85页
《有机化学》课后习题答案2011年3月1日9.8第85页共85页
《有机化学》课后习题答案2011年3月1日第10章思考题答案10.1答糖分子具有羰基和羟基,当它们距离适当时在分子内可形成半缩醛环状结构。羰基是平面结构,羟基可以从平面的两侧分别加上去。加成后,原来羰基碳变成了手性碳,如葡萄糖C-5羟基从C-1羰基平面两边加上去的结果是生成与C-1构型不相同的两种氧环式结构。这两种氧环式除C-1构型不同外,其余手性碳原子的构型都相同,因此它们称为差向异构体。10.2答蛋白质分子中氨基酸连接的基本方式是一分子氨基酸的羧基与另一分子氨基酸的氨基,通过脱水(缩合反应),形成一个酰胺键,新生成的化合物称为肽。肽分子中的酰胺键也称为肽键。10.3答(1)蛋白质不可逆沉淀;(2)蛋白质水解;(3)蛋白质可逆沉淀;(4)蛋白质凝絮;(5)蛋白质结构改变;(6)蛋白质结构改变。10.4答DNA相对分子质量非常庞大,由脱氧核糖组成,在RNA中,核糖代替脱氧核糖,DNA含有胸腺嘧啶,RNA中含鸟嘧啶。10.5答酪氨酸的等电点小于7,使它达到等电点应加酸。10.6答α-氨基酸同一分子内,氨基与羧基作用而生成内盐(偶极离子),降低了它的亲核性。加碱可以使反应加速。在碱性溶液中,氨基酸主要以H2NCHRCOO-形式存在,它的亲核性增大。10.7答醛基和Schiff试剂、亚硫酸氢钠等反应是可逆的,平衡偏向未反应的醛基一边;成脎及和Fehillng溶液反应是不可逆的,使平衡移向产物一边,因而尽管开链的醛基浓度很低(0.02%),也可显示出正反应。10.8答在D型已醛糖的Haworth式中,C1上的—OH与C5上的—CH2OH在环的不同一边时为α-差向异构体,若C1上的—OH与C5上的—CH2OH在环的同一边时为β-差向异构体。10.9答在需要使一种氨基酸的羧基和另一种氨基酸的氨基相结合时,要防止同一种氨基酸分子之间相互结合,因此,在合成时,必须某种氨基或羧基保护起来,以便反应能按所要求的方式进行。将两个相应氨基被保护和羧基被保护氨基酸放在溶液内,并不形成肽键。要形成肽键,经常用的手段是将羧基活化,其方法是变成一个所谓的混合酸酐,或者将它变为活泼酯,这样就增加了羧基的亲电能力。或者用强的脱水剂也可促进形成肽键。10.10答糖苷是一种缩醛(或缩酮),它没有半缩醛羟基,所以没有醛基的反应,如不能与Fehling试剂、Tollens试剂作用。它在溶液中也不能通过开链结构转变为另一个差异构体,所以无变旋光现象。10.11答(1)在蛋白质水溶液中,加入足量的盐类,可使很多蛋白质从其溶液中沉淀出来,这种现象叫做盐析。(2)蛋白质因受物理因素或化学因素的影响,改变了分子内部的特有结构,导致理化性质改变,生理活性丧失,称为蛋白质变性。(3)简单蛋白质与脂类化合物结合的蛋白质。(4)蛋白质的三级结构是指蛋白质分子中各组成部分在三维空间的排布,涉及蛋白质分子中所有原子的空间排布。习题答案10.1答(1)D-甘露糖和(2)D-阿拉伯糖有还原性10.2第85页共85页
《有机化学》课后习题答案2011年3月1日10.310.410.5第85页共85页
《有机化学》课后习题答案2011年3月1日10.6答(1)10.7答(1)与Tollens试剂反应有银镜产生。(2)与I2反应变蓝色。(3)与本题(1),(2),(4)(5)试剂均无反应现象。(4)与水合茚三酮的反应呈蓝紫色。(5)加热有氨气产生。10.8答(1)D-葡萄糖与Tollens试剂反应有银镜,D-葡萄糖醇无反应现象。(2)D-葡萄二酸使湿蓝色石蕊试纸变红,D-葡萄糖醇无反应现象。(3)D-葡萄糖可使Br2-H2O褪色。D-果糖无反应。(4)D-葡萄糖用浓HNO3氧化产物有旋光活性。D-葡萄糖用浓HNO3氧化产物无旋光活性。(5)麦芽糖与Tollens试剂反应有银镜。蔗糖无反应。(6)麦芽糖与Tollens试剂反应有银镜,麦芽糖酸无反应。(7)2,3,4,6-四-O-甲基-β-D-吡喃葡萄糖与Tollens试剂反应有银镜。β-D吡喃葡萄酸甲酯无反应。(8)α-D呋喃核糖甲酯为一连二醇,可被高碘酸氧化。2-脱氧-α-D-呋喃核糖酸甲酯无反应。10.9答第85页共85页
《有机化学》课后习题答案2011年3月1日10.1010.11答化学式为C5H10O4的D型单糖(I)能还原斐林试剂,能生成脎,发生变旋现象与能用溴水氧化,说明该糖是还是糖,是一醛糖。根据反应推论,(I)是D-3-脱氧呋喃核糖,各步反应如下:第85页共85页
《有机化学》课后习题答案2011年3月1日 10.1210.13第85页共85页
《有机化学》课后习题答案2011年3月1日10.14 第85页共85页
《有机化学》课后习题答案2011年3月1日第11章思考题答案11.1答周环反应的特点是在反应中没有活性中间体生成,反应一般在加热或光照下进行;反应速度基本上不受溶剂或催化剂的影响;反应具有很高的立体选择性;反应过程中共价键的断裂和形成经过环状过渡态协同进行。周环反应包括电环化反应、环加成反应和键迁移反应等。11.2答环加成反应主要是指两个烯烃或共轭多烯烃分子由于双键的相互作用,通过两个键连接成一个单一的新的环状化合物的反应。环加成反应主要是[2+2]和[2+4]两类反应,如Diels-Alder反应就是一个[2+4]环加成反应。11.3答由于双烯合成反应是协同反应,亲二烯体必须在同一时间与二烯的两端起作用。为了使反应能够发生,二烯必须采用S-顺式构象。如果二烯采取S-反式构象,亲二烯体将不能在同一时间去接近二烯的两端。虽然S-反式构象比S-顺式稳定,但在进行反应时,S-反式需转变成S-顺式才能进行反应。2-叔丁基-1,3-丁二烯与顺丁烯二酸酐的反应,1,3-丁二烯快27倍。因为叔丁基使S-顺式构象比S-反式构象更稳定,使其容易生成而有利于反应的进行。当一个较大的取代基在1-顺位时,如顺-1-叔丁基-1,3-丁二烯的S-顺式构象相对于未取代的二烯(1,3-丁二烯)是不利的,这是因为顺-1-叔丁基-1,3-丁二烯S-顺式构象中的取代基与4位氢原子之间存在着非键张力比较大之故。11.4答(1)这是一个[3,3]迁移反应。(2)反应是通过椅式过渡态完成的。(3)反应的详细过程如下所示第85页共85页
《有机化学》课后习题答案2011年3月1日 11.5答(1)在Diels-Alder反应中,当二烯是环状共轭二烯如环戊二烯时,将生成刚性的二环化合物。如果亲二烯体是取代的乙烯,可能生成两种构型异构体。即内向型和外向型的。此反应中,内向产物优先的原因,认为是二烯和亲二烯体的π轨道之间相互作用的结果。在过渡态中一个π轨道完全处于另一个π轨道之上,故导致内向产物。这种定向内向比外向立体异构体需要略低的活化能。因此生成的速度较大。(2)Diels-Alder反应具有高度的立体选择性。两个反庆物取代基的定向被保留在生成的加合物中。即亲二烯体是反式二取代乙烯的衍生物时,在加合物中,两个取代基将处于反式;如果在亲二烯体中两个取代基处于顺式,则在加合物中它们仍以顺式存在。习题答案11.1解反应条件:(1)(2)△产物名称:(3E,5E)-3,5-辛二烯11.211.3解 (1)△,顺旋(2)△,顺旋(3),对旋(4)△,顺旋第85页共85页
《有机化学》课后习题答案2011年3月1日11.411.511.611.7答b边发生[1,3]异面迁移11.8第85页共85页
《有机化学》课后习题答案2011年3月1日11.9第12章思考题答案12.1答高选择性试剂和反应是有机合成中最主要的研究课题之一,其中包括化学的区域选择性、立体选择性控制和不对称合成。不对称合成是近十年发展得较快的领域,包括了反应底物中手性诱导的不对称反应,化学计量手性试剂的不对称反应,手性催化剂不对称反应,利用生物催化的不对称合成反应和新拆分方法(如酶、微生物催化有机合成)。复杂有机分子的全合成一直是最受关注的领域,体现合成化学的水平,与生物科学相结合是合成化学的新热点。12.2答合成子,通过切断有机分子而产生的一种想像中的碎片,通常为一个正离子或负离子、卡宾及合成等价物。它有时也包括一些简单的起始原料或试剂。合成树:逆向合成分析的结果可能形象地组织成一棵树,称为合成树。逆向合成分析:指在设计合成路线时,从产物开始,把分子结构加以分割,按照合理步骤一步步地倒推并分割成简单化合物,直至简单到可得的原料的过程。12.3答芳环的取代反应有时可利用先引入氨基来活化苯环而导向。例如,合成1,3,5-三溴苯,如果直接用苯溴化会得不到产物,但如果用苯胺溴化,由于氨基使苯环的邻对位活化,很容易得到2,4,6-三溴苯胺,然后去除氨基即得1,3,5-三溴苯,即第85页共85页
《有机化学》课后习题答案2011年3月1日12.4答手性是自然界最重要的属性之一,在生物体的代谢和调控过程中所涉及的物质(如酶和细胞表面的受体)一般也都具有手性,在生命过程中发生的各种生物—化学反应过程均与手性的识别和变化有关。同样,药物的手性对其生物具有应答关系,手性直接关系到药物的药理作用、临床效果、毒副作用、发挥药效和药效作用时间等。正是由于药物和其受体之间的这种立体选择性作用,使得药物(包括农药)的一对对映体不论是在作用性质还是作用强度上都可能会有差别。手性药物按其作用可分为3类:①异构体具有相似的药理性质,如异丙嗪(promethmine)的2个异构体具有相同的抗组织胺的活性;②异构体中一个有药理活性,另一个则没有,如抗炎镇痛药萘普生(Naproxen),(S)—异构体的疗效为(及)—异构体的28倍,后者可认为没有活性;③异构体具有完全不同的药理作用,反应停(丁halidomide)悲剧便是一个典型例子,后经研究证实:(R)-构型才真正起镇静作用,而(S)-构型则对妊娠妇女的胎儿有强致畸作用。以上各种情况表明,无论手性药物的另一异构体是无效的、有害的还是有其他生理作用,都要求我们对每一种手性药物的各个异构体进行分别的考察。美国FDA1992年提出的法规要求申请手性药物时,必须叙述清楚不同异构体的作用。在医药、农药化学中,许多化合物的制备愈来愈依赖于各种立体选择合成方法的不断发展,不少金属有机试剂如磷、硅、铜、锂等化合物在定向合成双键上得到广泛应用。采用手性试剂辅助和手性催化剂的不对称合成在生理活性化合物合成上得到大量应用。立体化学还能从作用机制上阐明底物(药物)如何立体地和生物受体结合,对新药设计有重要指导意义。习题答案12.1解第85页共85页
《有机化学》课后习题答案2011年3月1日12.212.3第85页共85页
《有机化学》课后习题答案2011年3月1日第85页共85页'
您可能关注的文档
- 港口规划习题及答案.doc
- 湖北省七市(州)教科研协作体2017届高三下学期3月联合调考试题 数学(理) Word版含答案.doc
- 湖北省干部在线学习《准则》《条例》测试题目及答案.doc
- 湖北省武昌区2017届高三元月调考语文试题(含答案).doc
- 湖北省武汉市武昌区2017届高三1月调研考试理数试题 Word版含答案.doc
- 湖南《财经法规与会计职业道德》教材各章练习题答案及解析.doc
- 湖南会计基础课后习题及答案解析.doc
- 湖南大学《中级财务会计学》第三版教材课后习题答案.doc
- 湖南大学《有机化学》习题解答.doc
- 湖南大学物理(2)第14,15章课后习题参考答案.doc
- 湖南省2011年会计基础-课后习题及配套答案解析.doc
- 湖南省2012年会计从业资格证三门教材答案总集.doc
- 湘教版七年级地理上册知识归纳习题答案.doc
- 湘潭大学2015大学物理练习册答案.doc
- 满分 华师《课程与教学论》试题及答案 最新包全完整汇总.doc
- 热力学统计物理第三版 第四章到第七章答案.pdf
- 热学课后习题答案.doc
- 热工与流体力学基础习题集(答案).doc
相关文档
- 施工规范CECS140-2002给水排水工程埋地管芯缠丝预应力混凝土管和预应力钢筒混凝土管管道结构设计规程
- 施工规范CECS141-2002给水排水工程埋地钢管管道结构设计规程
- 施工规范CECS142-2002给水排水工程埋地铸铁管管道结构设计规程
- 施工规范CECS143-2002给水排水工程埋地预制混凝土圆形管管道结构设计规程
- 施工规范CECS145-2002给水排水工程埋地矩形管管道结构设计规程
- 施工规范CECS190-2005给水排水工程埋地玻璃纤维增强塑料夹砂管管道结构设计规程
- cecs 140:2002 给水排水工程埋地管芯缠丝预应力混凝土管和预应力钢筒混凝土管管道结构设计规程(含条文说明)
- cecs 141:2002 给水排水工程埋地钢管管道结构设计规程 条文说明
- cecs 140:2002 给水排水工程埋地管芯缠丝预应力混凝土管和预应力钢筒混凝土管管道结构设计规程 条文说明
- cecs 142:2002 给水排水工程埋地铸铁管管道结构设计规程 条文说明