- 395.58 KB
- 2022-04-22 13:43:03 发布
- 1、本文档共5页,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报电话:19940600175。
'中国http://www.paper.edu.cn科技论文在线#EGFR抑制剂研究进展**陈海洋,郝永佳,李洪林(上海市新药设计重点实验室,华东理工大学药学院,上海200237)5摘要:表皮生长因子受体(EGFR)酪氨酸激酶在信号传导、细胞增殖、分化以及各种调节机制中均发挥着重要的作用,使其成为一种理想的肿瘤靶向治疗小分子靶标。近年来,许多以此为靶点的抗肿瘤药物被陆续开发,且在针对多种肿瘤的治疗中取得了令人鼓舞的疗效。本文综述了EGFR的结构和功能以及目前EGFR酪氨酸激酶抑制剂的研究进展。关键词:表皮生长因子受体;EGFR抑制剂;抗肿瘤活性10中图分类号:R914.2RecentprogressonEGFRinhibitorsCHENHaiyang,HAOYongjia,LIHonglin(ShanghaiKeyLaboratoryofNewDrugDesign,SchoolofPharmacy,EastChinaUniversityof15ScienceandTechnology,Shanghai200237)Abstract:Epidermalgrowthfactorreceptor(EGFR)tyrosinekinaseactivityleadstorecruitmentandphosphorylationofseveraldownstreamintracellularsubstrates,leadingtomitogenicsignalingandtumor-promotingcellularactivities.TheseobservationsindicatethattheEGFRisapromisingtargetforcancertherapy.Recently,EGFR-targetedtyrosinekinaseinhibitorshavebeendevelopedandusedforthe20treatmentofcancerpatientsandachievedsignificanttherapeuticeffect.Inthisarticle,thestructuresandfunctionsofEGFRaswellascurrentstatusofEGFRtyrosinekinaseinhibitorsarereviewed.Keywords:Epidermalgrowthfactorreceptor;EGFRinhibitors;antitumoractivity0引言25癌症是以细胞异常增殖及转移为特点的一大类疾病,具有发病率高、死亡率高的特点,是威胁人类健康、导致死亡的恶性疾病之一。在诸多诱发癌症的因素中,癌细胞中某些过度表达或异常表达的蛋白激酶是导致其信号转导异常的主要因素之一。而细胞信号转导参与调控细胞的增殖、分化、代谢、凋亡等多种生理过程,细胞信号转导通路异常与癌症的发生密切相关。因此,以蛋白激酶作为抗癌生物靶标,设计、开发作用于特定靶标的靶向激酶抑制[1-3]30剂已成为药物研究中最重要的研究领域之一。在已发现的人类518种蛋白激酶中,表皮生长因子受体(Epidermalgrowthfactorreceptor,EGFR)酪氨酸激酶是一种重要的蛋白激酶。又因其在控制细胞增殖、存活、代谢等方面的关键作用,使得EGFR成为一种理想的肿瘤靶[4]向治疗分子靶标。笔者仅就小分子EGFR酪氨酸激酶抑制剂的研究现状作一综述。1EGFR的结构与功能35表皮生长因子受体是由1186个氨基酸组成的,170-kDa的跨膜糖蛋白。EGFR由三部分组成:细胞外受体区域、跨膜区域和细胞内酪氨酸激酶区域。EGFR是受体酪氨酸激酶c-erbB基金项目:高等学校博士学科点专项科研基金博导类资助课题(20130074110004)作者简介:陈海洋(1990-),男,硕士研究生,主要研究方向:药物化学通信联系人:李洪林(1979-),男,教授,博导,主要研究方向:药物设计、计算生物学、化学信息学等.E-mail:hlli@ecust.edu.cn-1-
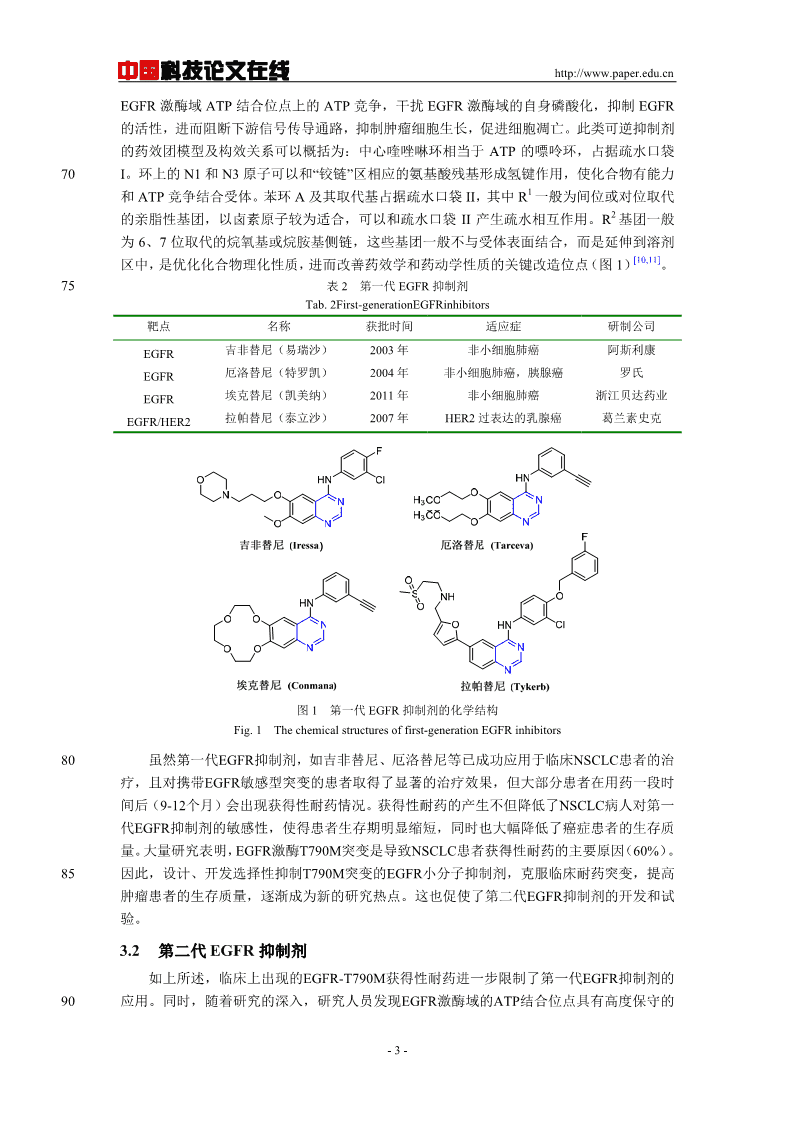
中国http://www.paper.edu.cn科技论文在线家族中的一员,与HER2(c-erbB-2),HER3(c-erbB-3)和HER4(c-erbB-4)共同组成c-erbB[5]家族。已经确认的可以与EGFR结合的配体有:表皮生长因子(EGF)、转化生长因子ɑ(TGFɑ)、40双向调节因子、肝素结合EGF、细胞调节素等。在人体组织中,EGF和TGFɑ被认为是EGFR[6]两种最重要的配体。当配体与EGFR在胞外结合域结合后,ErbB家族成员会形成同源或异源二聚体,引起胞浆内酪氨酸激酶区蛋白构象改变,与ATP结合而自身磷酸化,进而活化下游信号分子(Ras-Raf-MEK/MAPK,Ras-Raf-促分裂原活化蛋白激酶通路;PI3K/Akt,磷脂酰肌醇3激酶/Akt通路),发挥维持细胞生长增殖、细胞移动、血管生成、抑制凋亡等[7]45多种生理功能。2EGFR与肿瘤的关系EGFR是许多正常上皮组织,如皮肤和毛囊的组成性表达成分。对于正常细胞而言,EGFR在每个细胞中的表达量从40000-100000不等。而在大部分实体瘤中,例如乳腺癌、[8]头颈癌、非小细胞肺癌(NSCLC)、肾癌、卵巢癌、结肠癌,EGFR都会过表达(表1)。50如此的过表达会激活下游信号通路,导致细胞过度生长并且具有侵蚀性。表1EGFR在人类肿瘤中的表达率Tab.1FrequencyofexpressionoftheEGFRinhumancarcinomas癌症类型EGFR表达率/%癌症类型EGFR表达率/%肺癌40~80前列腺癌40~80乳腺癌14~91肾癌50~90胃癌33~74卵巢癌35~70结肠癌25~77头颈部肿瘤36~100胰腺癌40~80由于EGFR在控制细胞增殖、存活、及代谢方面的关键作用,干扰它的活动就可以阻断信号的转导,从而使得EGFR成为一种引人注目的肿瘤靶向治疗分子靶标,靶向EGFR药55物也已成为肿瘤治疗的热点。目前针对EGFR的肿瘤分子靶向药物,按其性质主要分为两大类:一类是直接作用于细胞外受体区域的单克隆抗体;另一类是干扰细胞内EGFR酪氨酸激酶活性的小分子抑制剂。单克隆抗体药物通过与EGFR的膜外配体结合域作用,使EGF等内源性配体无法与EGFR结合,从而阻止信号传入细胞;小分子药物则通过与胞内酪氨酸激酶催化区结合,抑制其催化活性,从而阻断细胞增殖信号。603EGFR小分子抑制剂3.1第一代EGFR抑制剂目前已上市的靶向EGFR小分子抑制剂主要有:吉非替尼(Iressa)、厄洛替尼(Tarceva)、埃克替尼(Conmana)以及作用于EGFR与HER2双靶点的拉帕替尼(Tykerb),详细信息[9]见表2,结构式见图1。65这四种已应用于临床的小分子EGFR抑制剂都是以喹唑啉为母核结构的药物,按其作用机制,划归为第一代、可逆的EGFR抑制剂。这类抑制剂是模拟ATP的腺嘌呤环,通过与-2-
中国http://www.paper.edu.cn科技论文在线EGFR激酶域ATP结合位点上的ATP竞争,干扰EGFR激酶域的自身磷酸化,抑制EGFR的活性,进而阻断下游信号传导通路,抑制肿瘤细胞生长,促进细胞凋亡。此类可逆抑制剂的药效团模型及构效关系可以概括为:中心喹唑啉环相当于ATP的嘌呤环,占据疏水口袋70I。环上的N1和N3原子可以和“铰链”区相应的氨基酸残基形成氢键作用,使化合物有能力1和ATP竞争结合受体。苯环A及其取代基占据疏水口袋II,其中R一般为间位或对位取代2的亲脂性基团,以卤素原子较为适合,可以和疏水口袋II产生疏水相互作用。R基团一般为6、7位取代的烷氧基或烷胺基侧链,这些基团一般不与受体表面结合,而是延伸到溶剂[10,11]区中,是优化化合物理化性质,进而改善药效学和药动学性质的关键改造位点(图1)。75表2第一代EGFR抑制剂Tab.2First-generationEGFRinhibitors靶点名称获批时间适应症研制公司EGFR吉非替尼(易瑞沙)2003年非小细胞肺癌阿斯利康EGFR厄洛替尼(特罗凯)2004年非小细胞肺癌,胰腺癌罗氏EGFR埃克替尼(凯美纳)2011年非小细胞肺癌浙江贝达药业EGFR/HER2拉帕替尼(泰立沙)2007年HER2过表达的乳腺癌葛兰素史克图1第一代EGFR抑制剂的化学结构Fig.1Thechemicalstructuresoffirst-generationEGFRinhibitors80虽然第一代EGFR抑制剂,如吉非替尼、厄洛替尼等已成功应用于临床NSCLC患者的治疗,且对携带EGFR敏感型突变的患者取得了显著的治疗效果,但大部分患者在用药一段时间后(9-12个月)会出现获得性耐药情况。获得性耐药的产生不但降低了NSCLC病人对第一代EGFR抑制剂的敏感性,使得患者生存期明显缩短,同时也大幅降低了癌症患者的生存质量。大量研究表明,EGFR激酶T790M突变是导致NSCLC患者获得性耐药的主要原因(60%)。85因此,设计、开发选择性抑制T790M突变的EGFR小分子抑制剂,克服临床耐药突变,提高肿瘤患者的生存质量,逐渐成为新的研究热点。这也促使了第二代EGFR抑制剂的开发和试验。3.2第二代EGFR抑制剂如上所述,临床上出现的EGFR-T790M获得性耐药进一步限制了第一代EGFR抑制剂的90应用。同时,随着研究的深入,研究人员发现EGFR激酶域的ATP结合位点具有高度保守的-3-
中国http://www.paper.edu.cn科技论文在线氨基酸序列。因此,第一代EGFR抑制剂的可改造空间越来越小。为了打破这种僵局,克服T790M耐药突变,研究人员逐渐开发出第二代EGFR抑制剂,即不可逆的共价抑制剂。EGFR受体家族ATP结合域开口附近存在特异性的半胱氨酸(Cys797)残基,相似位置的半胱氨酸残基只存在于11种激酶中,包括EGFR、HER2、HER4、Jak3、Blk、Lkb1、[12]95Bmx、Btk、Itk、Tec和Txk,有别于其它激酶的谷氨酸或丝氨酸残基。因此,在抑制剂中引入亲电性的迈克尔受体基团,以便和亲核性的Cys797发生迈克尔加成反应,不可逆地阻止激酶与ATP的结合,从而实现对EGFR激酶不可逆的选择性抑制,提高抑制剂的作用强度。目前针对这类抑制剂研究较成熟的思路是以图2所示喹唑啉骨架为母核,在环上引入长度合适的各类不饱和酰胺侧链,以便和Cys797残基的巯基发生迈克尔加成反应,不可逆100地抑制EGFR激酶的活性,从而达到抑制肿瘤细胞生长的目的。图2第二代EGFR抑制剂的药效团模型Fig.2Pharmacophoremodelofsecond-generationEGFRinhibitors目前已上市或处于临床期的第二代EGFR抑制剂主要有阿法替尼(Afatinib)、105PF-00299804(Dacomitibib)、HKI-272(Neratinib)、HM781-36B(Poziotinib)等,其详细信息见表3,化学结构见图3。虽然阿法替尼已于2013年获FDA批准上市,其间也有众多的第二代EGFR抑制剂处于临床研究阶段。但这些抑制剂普遍对T790M突变型和野生型EGFR激酶之间缺乏选择性,在抑制EGFR-T790M突变的同时也会对野生型EGFR激酶产生较强的抑制作用,因而会产110生一系列严重的剂量依赖性毒副作用,如皮疹、腹泻、恶心、疲劳等,进而影响其临床治疗效果的发挥。因此,开发特异性、选择性抑制EGFR-T790M突变的新型EGFR抑制剂迫在眉睫,这也促使了第三代EGFR激酶抑制剂的开发和试验。表3第二代EGFR抑制剂Tab.3Second-generationEGFRinhibitors名称研发状态研制公司阿法替尼(Giotrif)2013年获FDA批准上市(NSCLC)勃林格殷格翰PF-00299804PhIII(NSCLC)辉瑞HKI-272PhIII(Breastcancer)惠氏HM781-36BPhI/II韩美药业-4-
中国http://www.paper.edu.cn科技论文在线115图3第二代EGFR抑制剂的化学结构Fig.3Thechemicalstructuresofsecond-generationEGFRinhibitors3.3第三代EGFR抑制剂针对NSCLC患者使用第一代EGFR抑制剂后出现T790M获得性耐药,而第二代EGFR120抑制剂未能达到克服T790M获得性耐药的情况,2009年以来,学术界和制药企业纷纷开启了第三代EGFR抑制剂的开发和试验。这一类抑制剂对野生型的EGFR激酶活性较弱,对EGFR-T790M突变体具有较高的活性及选择性,因而可以减轻由于对野生型EGFR激酶的抑制所导致的毒副作用。第三代EGFR抑制剂的母核结构主要包括喹唑啉母核、嘧啶母核、嘧啶并杂环母核等三类结构。1253.3.1喹唑啉母核结构的化合物[13]2008年DanielRauh等人对EGFR不可逆抑制剂克服T790M突变耐药的机制进行了深入研究,初步合成了三个以喹唑啉为母核、6位侧链含有不同取代基的EGFR抑制剂(图4),结果发现6位带有不饱和酰胺侧链的化合物1、2对EGFR-T790M表现出较好的抑制活性。同时,他们获得了化合物2与野生型及突变型cSrc酪氨酸激酶的复合晶体结构,用T790M130以模拟2与EGFR激酶的结合模式。通过解析晶体结构发现:化合物2喹唑啉环上的N1与Met341氨基酸残基的NH侧链形成重要的氢键作用,同时Met338氨基酸残基的ε碳原子为了避免与间溴苯胺部分的碰撞,扭转了一定角度,从而指向ATP结合口袋的背部。而对于化合物3(可逆抑制剂),由于Met338氨基酸残基的立体位阻效应,降低了3与激酶的结合能力,导致其即使在体外对野生型EGFR表现出良好的抑制活性,但很难同细胞135内高浓度的ATP去竞争,从而达不到抑制EGFR-T790M的目的。2010年DanielRauh研究组为了验证喹唑啉环上3位的氮原子对化合物抑制活性是否有重[14]要影响,合成了一系列4-苯胺基喹唑啉和4-苯胺基喹啉母核的EGFR小分子抑制剂(图4)。L858R/T790M测试结果显示,喹啉母核的化合物4A、4B激酶抑制活性最好,并且对EGFR突变体也具有较好的抑制作用(4A:EGFR-WT<1nM,EGFR-L858R<1nM,EGFR-L858R/T790M:1403.2±1.6nM;4B:EGFR-WT:1.75±0.5nM,EGFR-L858R:0.5±0.07nM,EGFR-L858R/T790M:130±16nM)。[15]同年,CaterinaCarmi等人通过在4-苯胺基喹唑啉母核6位侧链上引入可以和半胱氨酸-5-
中国http://www.paper.edu.cn科技论文在线巯基共价加成的不同基团(环氧酰氨基与苯氧乙酰氨基),得到了一系列不可逆的EGFR抑制剂。测试结果显示化合物6可以抑制EGFR的自磷酸化,并且可以诱导H1975(表达L858R/T790M145EGFR突变的NSCLC细胞)细胞凋亡。6与EGFR激酶对接结果显示:喹唑啉环上的N1可以与Met793氨基酸残基的NH形成氢键作用,N3可以和Thr790氨基酸残基形成一个水分子介导的氢键作用,哌啶环上的N原子与Asp800氨基酸残基存在一个盐桥,Cys797巯基与环氧环上最近的碳原子的距离是4.13Å,可以与其发生亲核加成(图4)。HNBrHR=NRNNO123NHN4A:X=CH,Z=H,Y=HNBrHNOYYXXHNZNZN4B:X=CH,Z=H,Y=NO45OHNBrHNNNON6150图4化合物1-6的结构式Fig.4Chemicalstructuresofcompounds1-63.3.2嘧啶母核结构的化合物2009年,NathanaelS.Gray研究组通过筛选不可逆激酶抑制剂化合物库发现了一类新型嘧啶类的EGFR共价抑制剂,并对其进行结构优化,最终得到代表性化合物WZ4002(图5)。155研究表明,WZ4002对T790M突变或L858R/T790M双突变的EGFR激酶抑制效力和选择性较好,而对于野生型EGFR效力则较差。同时,研究者还获得了WZ4002与EGFR-T790M[16]突变体的复合物晶体结构(PDBcode:3IKA),详细阐明了此类抑制剂的构效关系。遗憾的是由于专利冲突,WZ4002并没有进入临床研究,但Gray研究组的研究工作为后续开发选择性T790M抑制剂提供了参考和依据,开启了学术界设计、开发选择性EGFR-T790M抑160制剂的序幕。近期,另一个与WZ4002结构类似的第三代EGFR抑制剂被公开报道,即CO-1686(Rociletinib,图5)。CO-1686是由ClovisOncology开发的共价、不可逆EGFR抑制剂。L858R/T790M其对EGFR激酶抑制活性较佳(IC50<0.51nM),相比于野生型的EGFR,显示出[17]T790M近22倍的选择性。CO-1686针对携带EGFR获得性突变的NSCLC患者的一期临床+165(NCT01526928)已经完成,总体有效率超过50%,对T790M的患者客观有效率达到64%,PFS大于6个月。主要药物相关不良反应包括皮疹(4%)、腹泻(23%)和高血糖症(22%)[18]。2014年5月,美国FDA授予CO-1686作为二线药物治疗EGFR-T790M突变的NSCLC-6-
中国http://www.paper.edu.cn科技论文在线患者突破性疗法认定。目前,CO-1686针对晚期EGFR-T790M突变NSCLC患者的二期临+床正在进行中。二期临床中期结果显示,CO-1686对于T790M的NSCLC患者客观有效率170达到58%,患者无进展生存期大于12个月。二期临床中最主要的不良反应为高血糖症(53%),[19,20]其中三级或四级高血糖症不良反应占整体患者的22%。导致这种不良反应的主要原因是CO-1686的代谢产物体内蓄积,引起胰岛素样生长因子1受体(IGF1R)抑制,从而导致血糖升高。与此同时,阿斯利康开发的另一个不可逆突变选择性EGFR抑制剂AZD9291出现在公L858R/T790MWT175众视野中(图5)。AZD9291对EGFR及EGFR的激酶抑制活性IC50值分别为1L858R/T790MnM和184nM,对EGFR显示出卓越的选择性。体外细胞抗增殖实验中,AZD9291对表达L858R/T790M双突变的H1975细胞也表现出了强力的抑制活性(IC50=15nM),[21]而对表达野生型EGFR的A431细胞抑制活性较弱(IC50>1000nM)。其对治疗携带T790MEGFR获得性突变耐药的NSCLC患者的一期临床也已完成,数据显示患者无进展生存+180期长达9.6个月,总体有效率达51%。对T790M的患者客观有效率达到61%,疾病控制率高达95%。主要副作用是腹泻(47%)、恶心(22%)、皮疹和痤疮(40%)。2014年,美国FDA授予AZD9291突破性疗法认定。近期,两项(NCT01802632,NCT02094261)关于+411名既往接受过EGFR抑制剂后疾病进展的晚期NSCLC患者(T790M)的多中心临床试验显示,这两项临床试验的客观有效率分别为58%和64%,且充分证实了AZD9291的安全®185性与有效性。2015年11月13日,AZD9291(Osimertinib,Tagrisso)获美国FDA加速批准,用于治疗携带EGFR-T790M突变、既往接受其它EGFR抑制剂后疾病进展的晚期NSCLC[22-24]患者。图5WZ4002、CO-1686和AZD9291的化学结构190Fig.5ChemicalstructureofWZ4002,CO-1686andAZD92913.3.3嘧啶并杂环母核结构的化合物[25]2012年JuswinderSingh等人设计、合成了基于嘧啶母核的不可逆EGFR抑制剂7及可逆抑制剂8(图6)。7与EGFR激酶ATP结合位点的结合模式显示,嘧啶环与EGFR激酶“铰链”区形成氢键作用,丙烯酰胺部分靠近Cys797,可以与其巯基发生共价结合。这两WTL858R/T790M195种抑制剂都对EGFR表现出较好的抑制活性,但对于突变的EGFR,只有化合物7表现出较好的抑制活性,IC50值达到5.4nM。对比这两个化合物的结构可以发现,两者的唯一区别在于右侧苯环上的酰胺侧链部分。化合物7的酰胺部分为丙烯酰胺(迈克尔受体),L858R/T790M化合物8的酰胺部分为饱和酰胺,这一点区别就导致了两者对EGFR明显的抑制差别,这也说明了不可逆抑制剂中丙烯酰胺迈克尔受体部分的重要性。2002016年李洪林教授课题组综合利用了合理药物设计、骨架跃迁等设计策略,设计、合成了6,7-二氧代-6,7-二氢喋啶类EGFR抑制剂,并通过在母核5位-N上引入不同烷基位阻-7-
中国http://www.paper.edu.cn科技论文在线[26]基团,提高了化合物对T790M突变体的选择性抑制作用。设计、合成的此类衍生物不但WTL858R/T790M对野生型(EGFR)及双突变型(EGFR)EGFR激酶表现出了不同水平的选择性,对于表达这两种激酶的A431细胞和H1975细胞也表现出了优良的选择性抑制作用。其中,205代表性化合物9对H1975细胞的抗增殖活性较强,IC50值为18.0nM;而对A431细胞的抑制效力则较弱(IC50=7772.8nM),故在细胞水平表现出431倍的选择性抑制作用(图6)。同时,9在裸鼠移植瘤模型抗肿瘤活性研究中对H1975移植瘤模型也表现出一定的抑瘤活性(TGI=51.6%)。2012年丁克教授研究组以化合物WZ4002为基础,将WZ4002的嘧啶环利用构象约束及210生物电子等排原理进行扩环,合成得到了一系列嘧啶并二氢嘧啶酮结构的化合物。激酶活性测试结果显示,该系列化合物对T790M突变型及野生型的EGFR均表现出良好的抑制效果。其中活性最好的化合物10、11(图6)对野生型及T790M突变型EGFR激酶的IC50值分别达到0.30nM、0.51nM(10),0.29nM、0.67nM(11),抑制效果甚至优于化合物WZ4002。此外,细胞测试结果显示化合物11对于H1975细胞也表现出较强的抗增殖效果(IC50=14nM)[27,28]215。2013年,借鉴前期的药物改造经验,丁教授课题组利用同样的药物设计策略,设计合成了一系列嘧啶并[4,5-d]嘧啶-4(1H)-酮衍生物,经过后续结构修饰最终得到化合物12,其在[29]激酶水平及细胞水平均对双突变型的EGFR表现出一定的选择性(图6)。图6化合物7-12的化学结构220Fig.6Chemicalstructureofcompounds7-123.4第四代EGFR抑制剂随着AZD9291临床用药人群的扩大,EGFR-L858R/T790M/C797S三突变的耐药突变也在患者体内被鉴定出来,EGFR三突变会导致AZD9291失去原有的药效。这一类人群目前还较少,但针对三突变开发的第四代EGFR抑制剂已经进入了临床前研究阶段(图7)。225诺华公司于2016年报道了可以克服L858R/T790M/C797S三突变的第四代EGFR小分[30]子抑制剂EAI045。与之前介绍的小分子抑制剂不同的是,EAI045是第一个针对EGFR三突变设计的非竞争性别构调节抑制剂。它的别构调节结合口袋仅出现在L858R的EGFR激活类突变中,这也很好的解释了EAI045对exon19del激活类突变的效果不佳同时对野生型-8-
中国http://www.paper.edu.cn科技论文在线的EGFR抑制能力不强的原因。由于EGFR非对称式二聚激活的存在,EAI045需要联合230EGFR单抗才能有效发挥其抑制EGFR三突变的效果。目前EAI045正在进行相关的临床前测试以进一步评估其安全性和有效性。Katayama等人于2017年发现ALK/EGFR双靶点可逆小分子抑制剂Brigatinib可以有效抑制AZD9291耐药的C797S三突变细胞株的增殖能力,与EGFR单抗联用在体内和体外实[31]验中都表现出非常好的抑瘤效果,这一发现又为克服AZD9291的三突变耐药提供了新的235治疗策略。图7第四代EGFR抑制剂的化学结构Fig.7Thechemicalstructuresoffourth-generationEGFRinhibitors4结论240综上所述,以EGFR受体酪氨酸激酶为靶点的抗肿瘤治疗已成为癌症研究中十分活跃的领域之一,并且取得了巨大的进展。靶向EGFR受体酪氨酸激酶的小分子抑制剂层出不穷,且在临床研究中表现出了较好的活性,这些都为今后设计开发出活性更好、选择性更强的小分子EGFR抑制剂提供了借鉴。但是由于突变产生的耐药性问题仍然没有得到完全解决,研发突变选择性EGFR抑制剂依然迫在眉睫。245[参考文献](References)[1]RoskoskiR.Ahistoricaloverviewofproteinkinasesandtheirtargetedsmallmoleculeinhibitors[J].PharmacologicalResearch,2015,100:1-23.[2]BiancoR,MelisiD,CiardielloF,TortoraG.Keycancercellsignaltransductionpathwaysastherapeutic250targets[J].EuropeanJournalofCancer,2006,42:290-294.[3]FavoniRE,DeCupisA.Theroleofpolypeptidegrowthfactorsinhumancarcinomas:newtargetsforanovelpharmacologicalapproach[J].PharmacologicalReviews,2000,52:179-206.[4]MendelsohnJ,BaselgaJ.Statusofepidermalgrowthfactorreceptorantagonistsinthebiologyandtreatmentofcancer[J].JournalofClinicalOncology,2003,21:2787-2799.255[5]HuangSM,HarariPM.Epidermalgrowthfactorreceptorinhibitionincancertherapy:biology,rationaleandpreliminaryclinicalresults[J].InvestigationalNewDrugs,1999,17:259-269.[6]YardenY,SliwkowskiMX.UntanglingtheErbBsignallingnetwork[J].NatureReviewsMolecularCellBiology,2001,2:127-137.[7]HerbstRS.Reviewofepidermalgrowthfactorreceptorbiology[J].InternationalJournalofRadiation260OncologyBiologyPhysics,2004,59:21-26.[8]NormannoN,MaielloMR,DeLucaA.Epidermalgrowthfactorreceptortyrosinekinaseinhibitors(EGFR-TKIs):Simpledrugswithacomplexmechanismofaction?[J].JournalofCellularPhysiology,2003,194:13-19.[9]杨雅琼,李宗海.以EGFR为靶点的肿瘤分子靶向药物研究进展[J].中国生物工程杂志,2012,32:91-96.-9-
中国http://www.paper.edu.cn科技论文在线265[10]WeiL,MalhotraSV.Recentdevelopmentofcyclicamide(pyridone/lactam)moietycontainingheterocyclesasproteinkinaseinhibitors[J].CurrentMedicinalChemistry,2010,17:234-253.[11]WoodER,TruesdaleAT,McDonaldOB,YuanD,HassellA,DickersonSH,EllisB,PennisiC,HorneE,LackeyK.AuniquestructureforepidermalgrowthfactorreceptorboundtoGW572016(Lapatinib)[J].CancerResearch,2004,64:6652-6659.270[12]HurW,VelentzaA,KimS,FlatauerL,JiangX,ValenteD,MasonDE,SuzukiM,LarsonB,ZhangJ.ClinicalstageEGFRinhibitorsirreversiblyalkylateBmxkinase[J].Bioorganic&MedicinalChemistryLetters,2008,18:5916-5919.[13]MichalczykA,KlueterS,RodeHB,SimardJR,GruetterC,RabillerM,RauhD.StructuralinsightsintohowirreversibleinhibitorscanovercomedrugresistanceinEGFR[J].Bioorganic&MedicinalChemistry,2008,16:2753482-3488.[14]PawarVG,SosML,RodeHB,RabillerM,HeynckS,VanOtterloWA,ThomasRK,RauhD.Synthesisandbiologicalevaluationof4-anilinoquinolinesaspotentinhibitorsofepidermalgrowthfactorreceptor[J].JournalofMedicinalChemistry,2010,53:2892-2901.[15]CarmiC,CavazzoniA,VezzosiS,BordiF,VacondioF,SilvaC,RivaraS,LodolaA,AlfieriRR,LaMonica280S.Novelirreversibleepidermalgrowthfactorreceptorinhibitorsbychemicalmodulationofthecysteine-trapportion[J].JournalofMedicinalChemistry,2010,53:2038-2050.[16]ZhouW,ErcanD,ChenL,YunCH,LiD,CapellettiM,CortotAB,ChirieacL,IacobRE,PaderaR.Novelmutant-selectiveEGFRkinaseinhibitorsagainstEGFRT790M[J].Nature,2009,462:1070-1074.[17]WalterAO,SjinRTT,HaringsmaHJ,OhashiK,SunJ,LeeK,DubrovskiyA,LabenskiM,ZhuZ,WangZ.285Discoveryofamutant-selectivecovalentinhibitorofEGFRthatovercomesT790MmediatedresistanceinNSCLC[J].CancerDiscovery,2013,3:1404-1415.[18]LiaoBC,LinCC,YangJC-H.Secondandthird-generationepidermalgrowthfactorreceptortyrosinekinaseinhibitorsinadvancednonsmallcelllungcancer[J].CurrentOpinioninOncology,2015,27:94-101.[19]SteuerCE,KhuriFR,RamalingamSS.Thenextgenerationofepidermalgrowthfactorreceptortyrosine290kinaseinhibitorsinthetreatmentoflungcancer[J].Cancer,2015,121:E1-E6.[20]StinchcombeTE.Recentadvancesinthetreatmentofnon-smallcellandsmallcelllungcancer[J].F1000PrimeRep,2014,6:117.[21]CrossDA,AshtonSE,GhiorghiuS,EberleinC,NebhanCA,SpitzlerPJ,OrmeJP,FinlayMRV,WardRA,MellorMJ.AZD9291,anirreversibleEGFRTKI,overcomesT790M-mediatedresistancetoEGFRinhibitors295inlungcancer[J].CancerDiscovery,2014,4:1046-1061.[22]CostaDB,KobayashiSS.Whackingamolecule:clinicalactivityandmechanismsofresistancetothirdgenerationEGFRinhibitorsinEGFRmutatedlungcancerswithEGFR-T790M[J].TranslationalLungCancerResearch,2015,4:809-815.[23]PlanchardD,BrownKH,KimDW,KimSW,OheY,FelipE,LeeseP,CantariniM,VishwanathanK,300JännePA.OsimertinibWesternandAsianclinicalpharmacokineticsinpatientsandhealthyvolunteers:implicationsforformulation,dose,anddosingfrequencyinpivotalclinicalstudies[J].CancerChemotherapyandPharmacology,2016,77:767-776.[24]Osimertinib:firstglobalapproval[J].Drugs,2016,76:263-273.[25]SinghJ,EvansE,HagelM,LabinskiM,DubrovskiyA,NachtM,PetterRC,PrasadA,SheetsM,StMartin305T.SuperiorityofanovelEGFRtargetedcovalentinhibitoroveritsreversiblecounterpartinovercomingdrugresistance[J].MedChemComm,2012,3:780-783.[26]HaoY,WangX,ZhangT,SunD,TongY,XuY,ChenH,TongL,ZhuL,ZhaoZ,ChenZ,DingJ,XieH,XuY,LiH.DiscoveryandStructuralOptimizationofN5-Substituted6,7-Dioxo-6,7-dihydropteridinesasPotentandSelectiveEpidermalGrowthFactorReceptor(EGFR)InhibitorsagainstL858R/T790MResistance310Mutation[J].JournalofMedicinalChemistry,2016,59:7111-7124.[27]ChangS,ZhangL,XuS,LuoJ,LuX,ZhangZ,XuT,LiuY,TuZ,XuY.Design,synthesis,andbiologicalevaluationofnovelconformationallyconstrainedinhibitorstargetingepidermalgrowthfactorreceptorthreonine790→methionine790mutant[J].JournalofMedicinalChemistry,2012,55:2711-2723.[28]XuS,XuT,ZhangL,ZhangZ,LuoJ,LiuY,LuX,TuZ,RenX,DingK.Design,synthesis,andbiological315evaluationof2-Oxo-3,4-dihydropyrimido[4,5-d]pyrimidinylderivativesasnewirreversibleepidermalgrowthfactorreceptorinhibitorswithimprovedpharmacokineticproperties[J].JournalofMedicinalChemistry,2013,56:8803-8813.[29]XuT,ZhangL,XuS,YangCY,LuoJ,DingF,LuX,LiuY,TuZ,LiS.Pyrimido[4,5-d]pyrimidin-4(1H)-oneDerivativesasSelectiveInhibitorsofEGFRThreonine790toMethionine790(T790M)Mutants[J].320AngewandteChemie,2013,125:8545-8548.[30]JiaY,YunCH,ParkE,ErcanD,ManuiaM,JuarezJ,XuC,RheeK,ChenT,ZhangH.OvercomingEGFR(T790M)andEGFR(C797S)resistancewithmutant-selectiveallostericinhibitors[J].Nature,2016,534:129-132.[31]UchiboriK,InaseN,ArakiM,KamadaM,SatoS,OkunoY,FujitaN,KatayamaR.Brigatinibcombinedwithanti-EGFRantibodyovercomesosimertinibresistanceinEGFR-mutatednon-smallcelllungcancer[J].325NatureCommunications,2017,8:14768.-10-'
您可能关注的文档
- 阿勒泰泥炭重金属元素异常记录的人类活动信息.pdf
- 陕西双王金矿床中自然金属与金属互化物.pdf
- 预磁化对SmBCO超导块材磁悬浮性能的影响.pdf
- 高效液相色谱法测定野生和人工种植库鲁木提草中柚皮苷和木犀草素的含量.pdf
- 高能球磨法对Li3Mg2NbO6陶瓷结构及性能的影响.pdf
- 1,25(OH)2D3对谷氨酸诱导HT-22细胞损伤保护作用研究.pdf
- 30种萱草属植物的倍性鉴定.pdf
- 4种独蒜兰属植物光合特性比较.pdf
- Clk1缺失通过AMPKmTORC1信号通路抑制自噬增加多巴胺能神经元死亡.pdf
- GDF11在肺癌患者血清中的表达及对肺癌细胞生长的影响.pdf
- H13热作模具钢疲劳蠕变交互损伤模型.pdf
- HPLC同时测定三黄片中盐酸小檗碱、黄芩苷和大黄素的含量.pdf
- ISOIEEE 11073个人健康设备标准相关专利分析.pdf
- La-Mg-Ni系储氢合金电极表面电镀处理对微观结构与电化学性能的影响.pdf
- Lnc-LEMGC调控ErbB信号通路抑制胃癌浸润、转移的研究.pdf
- MEMS微型富集器的制备及其对有机硫气体的吸附性能研究.pdf
- Mg-Zn-Y-Nd合金冠脉支架降解过程的模拟.pdf
- MicroRNAs对间充质干细胞成骨向分化的调控作用.pdf
相关文档
- 施工规范CECS140-2002给水排水工程埋地管芯缠丝预应力混凝土管和预应力钢筒混凝土管管道结构设计规程
- 施工规范CECS141-2002给水排水工程埋地钢管管道结构设计规程
- 施工规范CECS142-2002给水排水工程埋地铸铁管管道结构设计规程
- 施工规范CECS143-2002给水排水工程埋地预制混凝土圆形管管道结构设计规程
- 施工规范CECS145-2002给水排水工程埋地矩形管管道结构设计规程
- 施工规范CECS190-2005给水排水工程埋地玻璃纤维增强塑料夹砂管管道结构设计规程
- cecs 140:2002 给水排水工程埋地管芯缠丝预应力混凝土管和预应力钢筒混凝土管管道结构设计规程(含条文说明)
- cecs 141:2002 给水排水工程埋地钢管管道结构设计规程 条文说明
- cecs 140:2002 给水排水工程埋地管芯缠丝预应力混凝土管和预应力钢筒混凝土管管道结构设计规程 条文说明
- cecs 142:2002 给水排水工程埋地铸铁管管道结构设计规程 条文说明