- 284.22 KB
- 2022-04-22 13:43:00 发布
- 1、本文档共5页,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报电话:19940600175。
'中国科技论文在线http://www.paper.edu.cn#4种独蒜兰属植物光合特性比较1,21,21,2,31,21,21,2**李云霞,张艺祎,郭艳珊,彭东辉,翟俊文,吴沙沙(1.福建农林大学园林学院,福州350002;52.福建农林大学海峡兰花保育研究中心,福州350002;3.福建农林大学金山学院,福建福州350002)摘要:为了研究独蒜兰属植物的光合特性,以陈氏独蒜兰,独蒜兰,黄花独蒜兰和台湾独蒜兰为材料进行分析比较,结果表明:(1)4种独蒜兰属植物的光补偿点和光饱和点都较低,属于阴生植物;(2)独蒜兰的光补偿点较低,光饱和点、最大净光合速率和表观量子效率-2-110较高,最能适应多种光环境;(3)4种植物的最大羧化效率在10~20μmol•ms之间,表-2-1明其生产潜力低;(4)黄花独蒜兰在光强超过300μmol•ms时,出现“光抑制”现象。关键词:园林植物学;独蒜兰属;光合特性;叶绿素含量;叶绿素荧光参数中图分类号:S682.315PhotosyntheticCharacteristicsofFourPleioneSpecies1,21,21,2,31,21,2LIYunxia,ZHANGYiyi,GUOYanshan,PENGDonghui,ZHAIJunwen,1,2WUShasha(1.CollegeofLandscapeArchitecture,FujianAgricultureandForestryUniversity,Fuzhou350002,Fujian,China;202.FujianAgricultureandForestryUniversityCross-StraitsOrchidsConservationandResearchCenter,Fuzhou350002,,Fujian,China;3.JinshanCollegeofFujianAgricultureandForestryUniversity,Fuzhou350002,China)Abstract:InordertostudythephotosyntheticcharacteristicsofPleione,thephotosyntheticcharacteristicsofPleionechunii,P.bulbocodioides,P.forrestiiandP.formosanawerecompared25inthispaper.Theresultsshowthat:(1)Accordingtothelowerlightcompensationpointsandlightsaturationpoints,thefourspeciesofPleionehavethecharacteristicsofshadeplants.(2)P.bulbocodioideswithlowerlightcompensationpointandhigherlightsaturatedpoint,maximumnetphotosyntheticrateandapparentquantumefficiencywhichcanadapttoavarietyoflightenvironment;(3)themaximumcarboxylationrateofthefourplantsrangefrom10to20-2-130μmol•ms,indicatingalowerproductivitypotential;(4)P.forrestiicomestophotoinhibition-2-1whenthephotosyntheticallyactiveradiationirradiatedontheplantsmorethan300μmol•ms.Keywords:Landscapebotany;Pleione;photosyntheticcharacteristics;chlorophyllcontent;chlorophyllfluorescenceparameters350引言独蒜兰属(Pleione)为兰科极具园艺观赏和药用价值的一个属,又被称为“尼泊尔番红花(Napalesecrocuses)”或“窗台兰(window-sillorchids)”,具有花大色艳,花型奇特的特[1]点,深受欧洲、日本和中国台湾人士的喜爱;其干燥假鳞茎(俗称“冰球子”)是我国常用[2]中药材。独蒜兰属虽被列入《国家重点保护野生名录(第2批)》,但由于生态环境的破[3]40坏和人为无节制采挖,其野生资源濒临枯竭,因此发展人工栽培和育种技术来满足市场需求,从而杜绝对野生资源的破坏和加强保护具有重要意义。我国是独蒜兰属植物的分布中心,资源众多,但由于其自然分布地海拔较高,性喜冷凉基金项目:福建省自然科学青年基金(2014J0102);国家教育部博士点基金(20133515120017);福建省教育厅新教师项目(JA13123),国家自然基金青年科学基金项目(31500270)。作者简介:李云霞(1992-),女,研究生在读,从事园林植物资源与利用研究通信联系人:吴沙沙(1984—),女,河北邯郸,博士,副教授,从事园林植物资源与应用研究.E-mail:shashawu1984@126.com-1-
中国科技论文在线http://www.paper.edu.cn和对昼夜温差的要求较高,加之国内市场对其观赏价值认识不足,导致其开发利用滞后,当前我国大陆市售独蒜兰属植物基本均为野生种质资源;中国台湾地区已实现台湾独蒜兰(P.45formosana)优良品系的筛选和大规模商品化栽培,每年向日本和欧美市场出售约约20万粒[4]种球。而独蒜兰属植物自19世纪引入欧洲后,大量栽培的同时已培育出200余个品种。据[5]报道,适宜条件下栽培3年的独蒜兰假鳞茎鲜重约6.5g/株,亩栽6万株,产量可达390kg,具有相当可观的商业价值。因此我国大陆地区迫切需要加强对独蒜兰属植物生态习性、光合特性、栽培技术的研究。[6-9][10][7]50目前国内对独蒜兰的繁殖技术研究较多,但栽培方面仅见张毓、张燕等做了简[9]要描述,卢思聪等总结了独蒜兰的分球繁殖技术要点,但这些主要是基于栽培经验,缺乏理论依据。关于独蒜兰属的光饱和点、光补偿点、叶绿素荧光参数、光合机制等系统的光合特性鲜有报道。本文以4种独蒜兰属植物为研究材料,首次探究了独蒜兰属植物的光合生理生态特点,以期对独蒜兰属植物的栽培开发与利用提供一定的参考依据。551材料与方法1.1试验材料于2016年7月在福建农林大学园林学院实验楼室内进行,所用材料为假鳞茎大小接近,于2016年3月1日栽种在光照培养箱中,且生长状况良好的陈氏独蒜兰(P.chunii)、独蒜兰(P.bulbocodioides)、黄花独蒜兰(P.forrestii)和台湾独蒜兰(P.formosana),培养60条件为25℃/15℃(白天/夜晚),空气湿度75%,光周期为12h,测定时植株的状态为完成开花未结果且叶片完全成熟。1.2实验方法1.2.1光响应曲线测定在上午9:00-11:30,利用LI-6400便携式光合仪红蓝光源,测定光响应曲线。每种植物65随机选取5株,测定前对它们进行光诱导60min,待其完成光诱导达到稳态后开始测定。测-1定时设置最小等待时间为120s,最长等待时间300s,CO2浓度设定为400μmol·mol,内置光照强度(PAR,PhotosyntheticallyActiveRadiation)梯度设置为0、50、100、150、200、-2-1250、300、350、400、450、500、550、600μmol·ms。利用PhotosynAssistant软件对数据进行处理分析,可得光补偿点(LCP,lightcompensationpoint)、光饱和点(LSP,light70saturationpoint)、表观量子效率(AQE,apparentquantumefficiency)、最大净光合速率(Amax,maximumnetphotosyntheticrate)等值,并根据测定的净光合速率(Pn,netphotosyntheticrate),建立Pn-PAR响应曲线。1.2.2CO2响应参数的测定在上午9:00-11:30,利用LI-6400便携式光合仪红蓝光源自动CO2响应曲线测定功能测-2-175定4种独蒜兰属植物CO2响应曲线,设定PAR=450μmol·ms进行光诱导60min,以LI-6400光合测定系统的注入系统(CO2钢瓶)设定CO2浓度,控制梯度为0、50、100、200、400、-1600、800、1000、1200μmol·mol,设置最小等待时间为120s,最长等待时间360s。由于Ci(胞间CO2浓度)的降低会显著影响Rubisco(核酮糖-1,5-二磷酸羧化酶/加氧酶)的活[11]性和Rubp(1,5-二磷酸核酮糖)再生能力,因此测量过程尽量在短时间内完成。操作中80每变化一次CO2浓度,都进行1次光合仪的匹配操作,使其重新平衡。每种植物测定5株,-2-
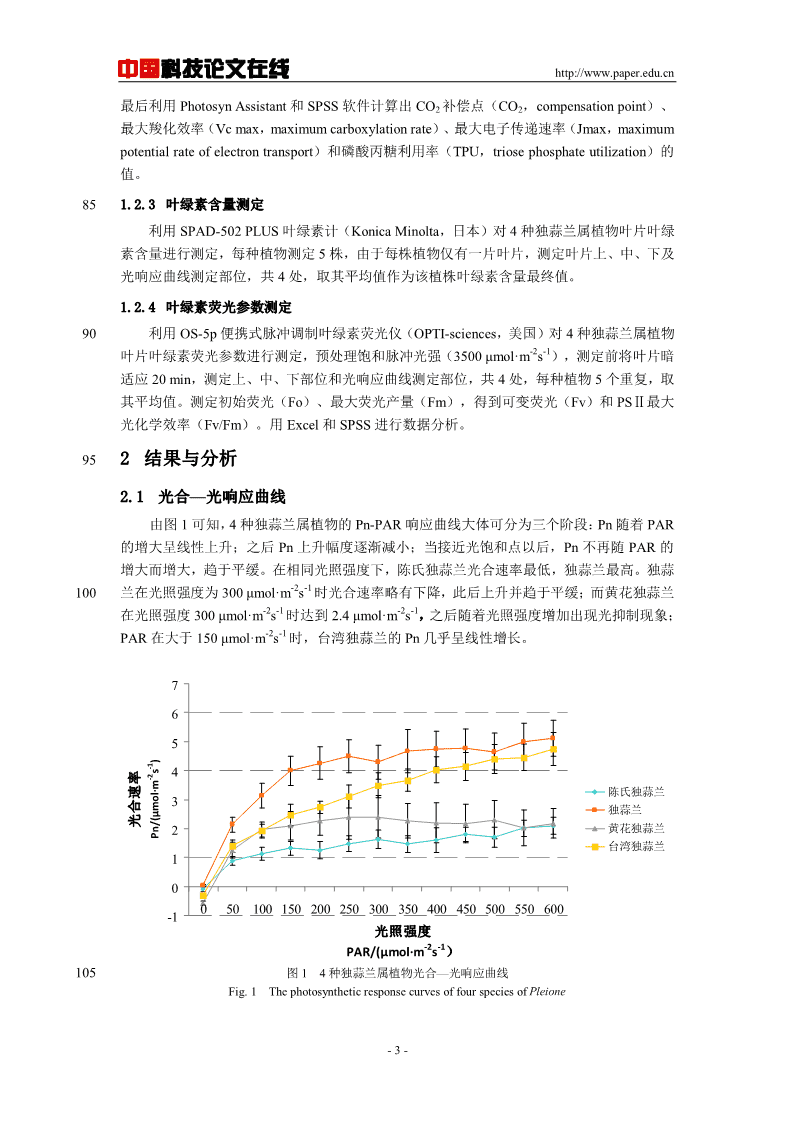
中国科技论文在线http://www.paper.edu.cn最后利用PhotosynAssistant和SPSS软件计算出CO2补偿点(CO2,compensationpoint)、最大羧化效率(Vcmax,maximumcarboxylationrate)、最大电子传递速率(Jmax,maximumpotentialrateofelectrontransport)和磷酸丙糖利用率(TPU,triosephosphateutilization)的值。851.2.3叶绿素含量测定利用SPAD-502PLUS叶绿素计(KonicaMinolta,日本)对4种独蒜兰属植物叶片叶绿素含量进行测定,每种植物测定5株,由于每株植物仅有一片叶片,测定叶片上、中、下及光响应曲线测定部位,共4处,取其平均值作为该植株叶绿素含量最终值。1.2.4叶绿素荧光参数测定90利用OS-5p便携式脉冲调制叶绿素荧光仪(OPTI-sciences,美国)对4种独蒜兰属植物-2-1叶片叶绿素荧光参数进行测定,预处理饱和脉冲光强(3500μmol·ms),测定前将叶片暗适应20min,测定上、中、下部位和光响应曲线测定部位,共4处,每种植物5个重复,取其平均值。测定初始荧光(Fo)、最大荧光产量(Fm),得到可变荧光(Fv)和PSⅡ最大光化学效率(Fv/Fm)。用Excel和SPSS进行数据分析。952结果与分析2.1光合—光响应曲线由图1可知,4种独蒜兰属植物的Pn-PAR响应曲线大体可分为三个阶段:Pn随着PAR的增大呈线性上升;之后Pn上升幅度逐渐减小;当接近光饱和点以后,Pn不再随PAR的增大而增大,趋于平缓。在相同光照强度下,陈氏独蒜兰光合速率最低,独蒜兰最高。独蒜-2-1100兰在光照强度为300μmol·ms时光合速率略有下降,此后上升并趋于平缓;而黄花独蒜兰-2-1-2-1在光照强度300μmol·ms时达到2.4μmol·ms,之后随着光照强度增加出现光抑制现象;-2-1PAR在大于150μmol·ms时,台湾独蒜兰的Pn几乎呈线性增长。765)-1s4-2陈氏独蒜兰3mol·m独蒜兰μ光合速率2黄花独蒜兰Pn/(台湾独蒜兰10050100150200250300350400450500550600-1光照强度-2-1PAR/(μmol·ms)105图14种独蒜兰属植物光合—光响应曲线Fig.1ThephotosyntheticresponsecurvesoffourspeciesofPleione-3-
中国科技论文在线http://www.paper.edu.cn2.24种独蒜兰属植物光响应参数的差异-2-14种植物的光补偿点均低于20μmol·ms,其中陈氏独蒜兰的光补偿点最高,达到17.99-2-1-2-1μmol·ms;黄花独蒜兰和台湾独蒜兰居中;独蒜兰的光补偿点最低,为0μmol·ms(表1101)。陈氏独蒜兰与独蒜兰、台湾独蒜兰的光补偿点在5%水平上差异显著,除此之外独蒜兰与黄花独蒜兰的光补偿点也有显著差异。陈氏独蒜兰和黄花独蒜兰的光饱和点低于210-2-1-2-1μmol·ms,而独蒜兰和台湾独蒜兰的光饱和点都高于538μmol·ms(表1)。-1-14种植物的表观量子效率差异较大,独蒜兰最大,为0.059μmolCO2·μmophoton,表明其捕获光子能力最强,且与陈氏独蒜兰、台湾独蒜兰的表观量子效率差异显著;黄花独蒜-1-1115兰次之;陈氏独蒜兰和台湾独蒜兰最小,分别为0.019和0.016μmolCO2·μmophoton。-2-1测定的4种独蒜兰属植物中,独蒜兰的最大净光合速率最大,为6.01μmolCO2·ms,-2-1是陈氏独蒜兰的2.78倍;台湾独蒜兰和黄花独蒜兰次之,达到4.68μmolCO2·ms和3.23-2-1μmolCO2·ms(表1)。表14种独蒜兰属植物光响应参数的差异120Table1ThedifferenceoflightresponseparametersinfourPlieoneplants表观量子效率最大净光合速光补偿点LCP光饱和点LSP暗呼吸速率种名-2-1-2-1AQY率-2-1μmol·msμmol·ms-1-2-1μmol·msμmolCO2·μmophotonμmolCO2ms陈氏独蒜17.99±3.180a209.08±10.148a0.019±0.004b2.160±0.310c-0.42±0.015b兰独蒜兰0±0c538.41±46.442b0.059±0.016a6.010±0.191a0.021±0.010a黄花独蒜10.81±1.386ab210.87±12.855a0.044±0.005ab3.235±0.453bc-0.50±0.003b兰台湾独蒜5.27±3.126bc609.90±20.849b0.016±0.004b4.683±0.814ab-0.42±0.174ab兰注:不同小写字母间表示5%水平上显著差异.Note:Differentlettersindicatesignificantdifferenceat5%level.2.34种独蒜兰属植物CO2响应参数的差异在4种植物中,独蒜兰的CO2补偿点最高,独蒜兰正常生长所需的最低CO2浓度比台-1125湾独蒜兰正常生长所需最低CO2浓度高出33μmol·mol;陈氏独蒜兰和黄花独蒜兰对低浓度CO2的利用能力相近。4种独蒜兰属植物的Vc,max、Jmax和VTPU均无显著差异。表24种独蒜兰属植物CO2响应参数的差异Table2thedifferenceofCO2responseparametersnfourPlieoneplantsCO2补偿点最大羧化效率Rupb最大再生速TPU磷酸丙糖种名μmol·mol-1-2-1-2-1Vc,maxμmol·msJmaxμmol·ms利用效率VTPU陈氏独蒜兰117.73315.377±7.98414.434±7.6332.103±0.908独蒜兰139.44316.500±0.87016.363±0.3322.553±0.357黄花独蒜兰112.4614.093±7.19713.560±8.8713.200±0.589台湾独蒜兰106.5119.850±3.02713.934±0.94211.052±3.726130注:不同小写字母间表示5%水平上显著差异.Note:Differentlettersindicatesignificantdifferenceat5%level.2.44种独蒜兰属植物叶绿素含量和叶绿素荧光参数的差异4种独蒜兰属植物中,黄花独蒜兰叶绿素含量最高,为42.119SPAD,其次为陈氏独蒜-4-
中国科技论文在线http://www.paper.edu.cn兰和台湾独蒜兰,为40.553SPAD和39.293SPAD,叶绿素含量最低的是独蒜兰,约为黄花135独蒜兰的0.59倍。独蒜兰、黄花独蒜兰和台湾独蒜兰3个品种两两之间在5%水平上具有显著差异,而陈氏独蒜兰只与独蒜兰具有显著差异。陈氏独蒜兰和台湾独蒜兰的Fv/Fm值在0.75-0.85间,而独蒜兰和黄花独蒜兰的Fv/Fm值略于低此区间,为0.730和0.732(表3),推测二者受到了一定程度的可逆胁迫作用。表34种独蒜兰属植物叶绿素含量与叶绿素荧光参数的差异140Table3thedifferenceofchlorophyllcontentandchlorophyllfluorescenceparameters种名叶绿素含量Fv/Fm陈氏独蒜兰40.553±1.419ab0.770±0.007a独蒜兰25.025±0.751c0.730±0.020b黄花独蒜兰42.119±0.457a0.732±0.011b台湾独蒜兰39.293±0.833b0.763±0.009ab注:不同小写字母间表示5%水平上显著差异.Note:Differentlettersindicatesignificantdifferenceat5%level.3讨论与结论3.1净光合速率对光合有效辐射的影响-2-1145本研究中4种独蒜兰属植物光补偿点(LCP)均小于20μmol·ms,光饱和点(LSP)-2-1也均小于610μmol·ms,表明4种植物均为阴生植物。较低的光补偿点反应出植物利用弱光的能力较强,较低的光饱和点表明植物不能高效利[12]用强光,甚至会出现“光抑制”现象。4种独蒜兰属植物的最大净光合速率显著低于常见的-2-1[13~14]C3植物(10~25μmol·ms),如小麦、大豆等。4种独蒜兰属基本表现出两种类型,150独蒜兰和台湾独蒜兰的光饱和点和最大净光合速率约为陈氏独蒜兰和黄花独蒜兰的2倍多,说明独蒜兰和台湾独蒜兰对光环境的适应性更广,而陈氏独蒜兰和黄花独蒜兰对栽培环境的-2-1光条件要求较高。两类植物光饱和点的差异大于320μmol·ms,在实际栽培中,可以此为依据进行栽培光环境的调控,以保证栽培品质。表观量子效率是衡量植物利用弱光能力的又一指标,自然条件下植物的表观量子效率在[15]1550.01-0.05之间。耐荫植物通常具有较高的捕获光量子能力,因此具有较高的表观量子效率。经计算,表观量子效率与最大净光合速率在P=0.05水平上不显著,独蒜兰和黄花独蒜兰具有较高的表观量子效率,分别达到0.059和0.044,但黄花独蒜兰的最大净光合速率约为独蒜兰的一半,可能是由于其用于呼吸消耗的能量多。独蒜兰耐荫性最强,光合速率最大,能适应多种光环境,因此在设施栽培中,一方面可以适当密植提高产量,另一方面,水分胁[16]160迫会引起Pn下降,而独蒜兰属植物多喜湿,因此要注意保持较高的空气湿度,通常采用[2]喷浇的方式,同时要注意通风。-5-
中国科技论文在线http://www.paper.edu.cn3.2净光合速率对胞间二氧化碳浓度的影响在Farquhar模型中,叶片在任意Ci下的光合速率A是Rubisco,Rubp,Tpu3者中的[17]-1最小值。当CO2浓度较低时(<200μmol·mol),光合速率受到Rubisco酶的限制,最165大羧化效率Vcmax可以反映Rubisco酶的活力,因此Vcmax与植物的最大净光合速率密切相-2-1关。4种独蒜兰植物的Vcmax值在10~20μmol·ms之间,符合植物叶片最大羧化速率为6~194-2-1[18]μmol·ms,同时也说明4种独蒜兰属植物的生产潜力都较低。研究发现,植物最大羧化[19][20]速率除与自身遗传特性有关外,还受光照、温度、水分、土壤养分的影响。Bunce等发现植物经过高温驯化,最大羧化速率增大,独蒜兰属性喜荫凉,夏季温度不能高于25℃,170这给独蒜兰的栽培环境条件提出了很高的要求。因此,可以尝试对独蒜兰进行适当高温驯化,-1提高其羧化效率,降低栽培成本。CO2浓度在>400μmol·mol后,光合速率受Rubisco酶[17]的限制;当CO2浓度超过光饱和点后,受限于磷酸丙糖利用率,此时达到最大净光合速率。-1陈氏独蒜兰、黄花独蒜兰和台湾独蒜兰的CO2补偿点在106~117μmol·mol之间,与墨兰的-2-1-2-1CO2补偿点(111μmol·ms)相近,独蒜兰的CO2补偿点(139μmol·ms)与春剑的CO2-2-1[21]175补偿点(133μmol·ms)相近。3.3叶绿素含量和荧光参数的特性影响叶绿素的含量、比例、荧光参数是影响叶片光合作用的重要指标;叶绿素含量在一定程[22]度上可以反映叶片光合能力、绿度、健康状况等。通常认为叶绿素含量越高,颜色越深,利用光能的能力越强,但仅在弱光下,光合速率与叶绿素含量存在良好的线性关系,当光照[23]180强度很强甚至超过光饱和点后,光合速率与叶绿素含量的并不具有相关性。独蒜兰叶绿素含量低,但光合速率明显高于叶绿素含量高的陈氏独蒜兰和黄花独蒜兰,可能是由于独蒜[24]兰单位面积内碳同化酶、光合机构的关键组分反应中心等的含量高。叶绿素荧光参数Fv/Fm指PSⅡ最大光化学效率,可表征植物在环境因子发生改变时产[25]生的光合生理变化。在非胁迫条件下Fv/Fm不随植物的种类、生长环境改变,处在0.75-0.85[26~27]185之间,当植物受到胁迫时,其比值会下降。当光照弱时,叶片吸收的光能几乎全部用于光反应,光化学淬灭系数大,PSⅡ电子传递活性强;随着光强的增加,叶片吸收光能过剩,就会通过非光化学淬灭方式实行自我保护机制,即出现“光抑制”现象。如果不能及时非-2-1光化学淬灭,就会对光合结构造成破坏。黄花独蒜兰在光照强度高于300μmol·ms后,净光合速率降低,出现“光抑制”现象。同时也说明最大的光合效率与最大转化效率并不对等,[28]190这与王建华等人测定的Fv/Fm日变化曲线与Pn日变化曲线相反的结果是一致的。3.4结论综上所述,陈氏独蒜兰对栽培环境的光条件要求较高,独蒜兰有较低的光补偿点和较高的光饱和点,耐荫性最强,最能适应多种光环境,可适当密植但要保湿和通风;黄花独蒜兰有较高的表观量子效率和最大净光合速率,但光补偿点低,通过合理调控光环境可以提高光195合能力;台湾独蒜兰的最大羧化效率和光饱和点最大,相比其他3种有较高的生产潜力。独蒜兰属植物性喜荫凉,夏季温度不能高于25℃,因此通过光环境调控,CO2调控,温度调控等提高独蒜兰属植物的栽培品质具有重要意义。200-6-
中国科技论文在线http://www.paper.edu.cn[参考文献](References)[1]张燕,李思锋,黎斌.独蒜兰属植物研究现状[J].北方园艺,2010,(10):232-234.[2]张正海,李爱民,魏盼盼.山慈菇应用现状及研究方向[J].特产研究,2009,(04):74-77.[3]刘虹,吴瑞云,陈雁.独蒜兰[J].生物学通报,2010,(12):50.205[4]CribbP,ButterfieldI.TheGenusPleione[M].Miami:AmericaOrchidSociety,1999.[5]陈德媛,胡成刚,陈远光,等.独蒜兰引种栽培[J].中国林副特产,1998,(3):36.[6]于晓娟,纳海燕,胡晓丽,等.毛唇独蒜兰的离体快速繁殖研究[J].四川大学学报(自然科学版),2007,44(4):891-894.[7]张燕,李思锋,黎斌.独蒜兰的生物学特性及栽培技术[J].陕西农业科学,2010,(01):267-268.210[8]李洪林,付志惠,杨波.独蒜兰的离体快速繁殖[J].植物生理学通讯,2005,(05):83.[9]张燕,黎斌,祁桦.濒危兰科植物独蒜兰的快繁技术研究[J].陕西农业科学,2013,(03):57-59.[10]张毓.高山兰精灵--独蒜兰[J].中国花卉盆景,2004,(3):12-13.[11]许大全.光合作用测定及研究中一些值得注意的问题[J].植物生理学报,2006,42(6):1163-1167.[12]蔡伟建,高捍东,白士杰.杂交新美柳幼苗光合特性[J].浙江林学院学报,2010,(03):340-346.215[13]杨巧凤,江华,许大全,小麦旗叶发育过程中光合效率的变化[J].植物生理学报,1999,(04):408-412.[14]高辉远,邹琦,程炳嵩.田间大豆及盆栽大豆光合日变化的比较[J].八一农学院学报,1992,(02):74-79.[15]LeeDW,BoneRA,TarsisSL,etal.Correlatesofleafopticalpropertiesintropicalforestsunandextreme-shadeplants[J].AmericanJournalofBotany,1990,77(3):370-380.[16]景茂,曹福亮,汪贵斌,等.土壤水分含量对银杏光合特性的影响[J].南京林业大学学报自然科学版,2202005,29(4):83-86.[17]LongSP,BernacchiCJ.Gasexchangemeasurements,whatcantheytellusabouttheunderlyinglimitationstophotosynthesis?Proceduresandsourcesoferror[J].JournalofExperimentalBotany,2003,54(392):393-401.[18]WullschlegerSD.BiochemicalLimitationstoCarbonAssimilationinC3,Plants-ARetrospectiveAnalysisoftheA/Ci,Curvesfrom109Species[J].JournalofExperimentalBotany,1993,44(5):907-920.225[19]张彦敏,周广胜,植物叶片最大羧化速率及其对环境因子响应的研究进展.生态学报,2012,(18):5907-5917.[20]BunceJA.AcclimationofphotosynthesistotemperatureineightcoolandwarmclimateherbaceousC3species:Temperaturedependenceofparametersofabiochemicalphotosynthesismodel[J].PhotosynthesisResearch,2000,63(1):59-67.230[21]李鹏民,高辉远,邹琦,等.5种国兰(Cymbidium)的光合特性[J].园艺学报,2005,32(1):151-154.[22]李淑文,李迎春,彭玉信,等.不同草坪草叶绿素含量变化及其与绿度的关系[J].草原与草坪,2008,(6):54-56,74.[23]许大全.叶绿素含量的测定及其应用中的几个问题[J].植物生理学通讯,2009,(09):896-898.[24]ArnonDI.Copperenzymesinisolatedchloroplasts:polyphenoloxidaseinBetavulgaris[J].PlantPhysiology,2351949,24(1):1-15.[25]陈辰,何小定,秦金舟,等.4种含笑叶片叶绿素荧光参数Fv/Fm特性的比较[J].安徽农业大学学报,2013,40(1):32-37.[26]何炎红,郭连生,田有亮.白刺叶不同水分状况下光合速率及其叶绿素荧光特性的研究[J].西北植物学报,2005,25(11):2226-2233.240[27]刘芳,张小青,吴三林,等.峨眉含笑精油对冬枣保鲜的研究[J].长春师范大学学报,2008,27(6):65-69.[28]王建华,任士福,史宝胜,等.遮荫对连翘光合特性和叶绿素荧光参数的影响[J].生态学报,2011,31(7):1811-1817.-7-'
您可能关注的文档
- 竹笋壳基活性炭材料的制备及其超级电容性能研究.pdf
- 莱维飞行中的轨线动力学.pdf
- 阿勒泰泥炭重金属元素异常记录的人类活动信息.pdf
- 陕西双王金矿床中自然金属与金属互化物.pdf
- 预磁化对SmBCO超导块材磁悬浮性能的影响.pdf
- 高效液相色谱法测定野生和人工种植库鲁木提草中柚皮苷和木犀草素的含量.pdf
- 高能球磨法对Li3Mg2NbO6陶瓷结构及性能的影响.pdf
- 1,25(OH)2D3对谷氨酸诱导HT-22细胞损伤保护作用研究.pdf
- 30种萱草属植物的倍性鉴定.pdf
- Clk1缺失通过AMPKmTORC1信号通路抑制自噬增加多巴胺能神经元死亡.pdf
- EGFR抑制剂研究进展.pdf
- GDF11在肺癌患者血清中的表达及对肺癌细胞生长的影响.pdf
- H13热作模具钢疲劳蠕变交互损伤模型.pdf
- HPLC同时测定三黄片中盐酸小檗碱、黄芩苷和大黄素的含量.pdf
- ISOIEEE 11073个人健康设备标准相关专利分析.pdf
- La-Mg-Ni系储氢合金电极表面电镀处理对微观结构与电化学性能的影响.pdf
- Lnc-LEMGC调控ErbB信号通路抑制胃癌浸润、转移的研究.pdf
- MEMS微型富集器的制备及其对有机硫气体的吸附性能研究.pdf
相关文档
- 施工规范CECS140-2002给水排水工程埋地管芯缠丝预应力混凝土管和预应力钢筒混凝土管管道结构设计规程
- 施工规范CECS141-2002给水排水工程埋地钢管管道结构设计规程
- 施工规范CECS142-2002给水排水工程埋地铸铁管管道结构设计规程
- 施工规范CECS143-2002给水排水工程埋地预制混凝土圆形管管道结构设计规程
- 施工规范CECS145-2002给水排水工程埋地矩形管管道结构设计规程
- 施工规范CECS190-2005给水排水工程埋地玻璃纤维增强塑料夹砂管管道结构设计规程
- cecs 140:2002 给水排水工程埋地管芯缠丝预应力混凝土管和预应力钢筒混凝土管管道结构设计规程(含条文说明)
- cecs 141:2002 给水排水工程埋地钢管管道结构设计规程 条文说明
- cecs 140:2002 给水排水工程埋地管芯缠丝预应力混凝土管和预应力钢筒混凝土管管道结构设计规程 条文说明
- cecs 142:2002 给水排水工程埋地铸铁管管道结构设计规程 条文说明