- 1.51 MB
- 2022-04-22 13:45:37 发布
- 1、本文档共5页,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报电话:19940600175。
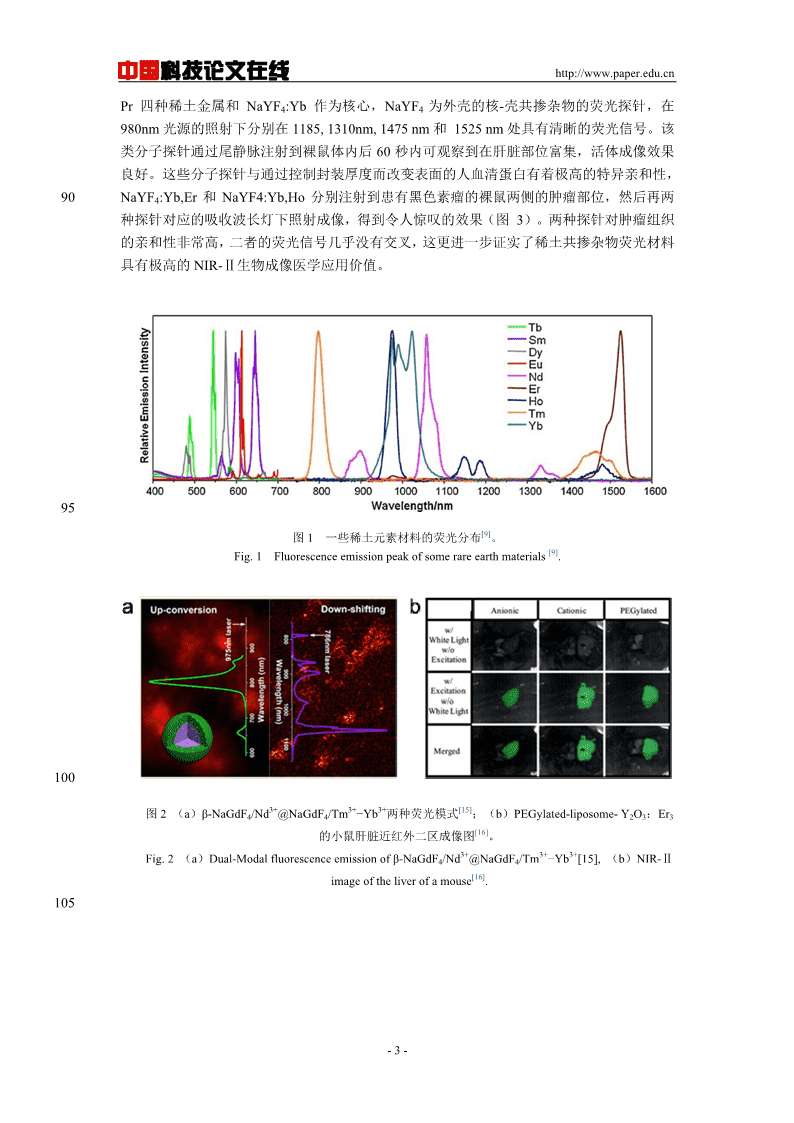
'中国科技论文在线http://www.paper.edu.cn#近红外二区生物成像材料研究进展**吴必应,黄矗鑫,杨涵,周小菊(武汉大学药学院,武汉430071)5摘要:分子影像探针广泛应用于浅层导向性生物成像,在临床医学领域有着极为重要的地位。近红外技术通过减少自身散射,降低生物组织吸收和避免自荧光效应,能实现良好的成像。近红外光谱分为一区(650nm-900nm,NIR-1)和二区(1000-1700nm,NIR-Ⅱ)。目前经过美国FDA批准的近红外一区成像试剂有吲哚菁绿(IndocyanineGreen,ICG)和亚甲基蓝10(Methyleneblue),由于有散射效应导致应用深度有限,二者的使用有较多限制。相较于近红外一区,近红外二区拥有更低的散射,更少的组织吸收性以及更低的组织自荧光等优点,近几年来受到越来越多的重视。本文将按照荧光材料的类型对新型的近红外二区成像技术进行分类综述,并就这些材料的自身特点和近红外二区成像研发趋势进行总结和探讨。关键词:药物化学;分子影像学;近红外二区成像15中图分类号:R9DevelopmentofNIR-ⅡBioimagingMaterialsResearch20WUBiying,HUANGChuxin,YANGHan,ZHOUXiaoju(SchoolofPharmceauticalScience,WuhanUniversity,Wuhan430071)Abstract:Molecularimagingprobeshavebeenwidelyusedinshallowguided-bioimaging,ithasplayedanextremelyimportantroleinclinicalmedicine.Byreducingself-scattering,decreasingtissueabsorptionandavoidingself-fluorescenceeffect,near-infrared(NIR)technologycanachieveagood25imaging.Thenear-infraredcouldbedividedintothefirstnear-infraredwindow(NIR-Ⅰ,650nm-900nm)andthesecondnear-infraredwindow(NIR-Ⅱ,1000nm-1700nm)towparts.TheUSFDAhasapprovedIndocyanineGreen(ICG)andMethylene-Blue(MB)astowNIR-Ⅰimagingagents.However,therearemultiplelimitationsontheirapplicationsduetotheirlowefficientdepthcausedbyscatteringeffect.ComparedwiththeNIR-Ⅰimagingspectra,theNIR-Ⅱimagingspectrahasadvantagesoflower30self-scattering,lowertissueabsorptionandlowerself-fluorescence,andresearchersworldwideareshowinggreatinterestinthissubject.Inthispaper,wewillsummarizeandreviewthenovelNIR-Ⅱimagingtechniquesbasedondifferentfluorescentmaterials,discussthecharacteristicsofthosechosenmaterialsandmakeaprospecttothetrendsoftheNIR-Ⅱbioimagingresearch.Keywords:medicinalchemistry;molecularimaging;NIR-Ⅱimaging350引言分子影像学是利用现有的成像手段借助分子探针无创地从分子或细胞水平,定性或定量的反映活体状态下机体的代谢情况以及酶、受体、基因等生物因子的表达等生理学信息的科40学,是目前肿瘤特异性诊断的发展方向。荧光像基于荧光物质通过吸收激发光的能量后放射不出不同波长的光子进入检测器被记录而成像。由于光学成像具有无创伤性,高灵敏度(检-15测限可达~10mol/L级别),高分辨率,低成本,无辐射,仪器设备的可操作性高,周期[1-3]短等优点,现在已成为该领域的热门研究方向。光学成像的主要不足之处是其成像深度比较浅,目前只能用于近表皮组织成像。现阶段的研究目标主要是集中于提高其成像深度方45面。光学波普中的近红外光谱成像由于其较强的荧光穿透力,低生物组织自发光干扰的有点儿备受亲睐。相对于传统的医学成像如PET,MRI,SPECT等技术,光学成像技术具有时间、基金项目:国家自然科学基金(81573383);国家自然科学基金青年基金(81402882)作者简介:吴必应(1991-),男,硕士研究生,主要研究方向:分子影像学通信联系人:周小菊(1975-),副教授、硕导,主要研向:智能纳米载体.E-mail:xjzhou@whu.edu.cn-1-
中国科技论文在线http://www.paper.edu.cn[4]空间分辨率高、检测速度快等优点。目前光学成像技术的最核心优点在于荧光成像可针对[5]不同靶点实现多通道成像,整合多种信号从而形成符合生物体信息图像。荧光成像主要是指发射光波长在400-800nm范围内的可见光成像,和在800-1700nm范围内的近红外荧光成[6]50像。临床上的荧光成像应用有用于检测肠粘膜异常增生的结肠自荧光内窥镜、荧光支气管[7]镜等。由于近红外区(NIR)具有较高穿透力,低自荧光干扰的特点,使其成为应用广泛的荧光成像区域。1近红外二区生物成像新材料从2003年开始,人们通过测量量子点荧光在生物组织和血液中的穿透力和散射绝对值,[8]55carroll等人提出了一个具有前瞻性的假设——生物体的荧光成像波长在1320nm周围区域的成像效果要优于840nm。此假设一经提出便得到众多学者的认同,越来越多的的科研工作者投入到近红外二区(NIR-Ⅱ)成像的领域来。而这项研究的重要组成部分就是新型仪器系统和新型发光材料的研发。近年来世界各地的生物光学成像领域学者纷纷致力于近红外二区新型荧光材料的研发,取得的硕果颇为丰厚。目前研究得比较热门的NIR-Ⅱ主要有稀土元60素荧光材料、金属量子点、单层碳纳米管、有机小分子染料和纳米晶/聚合物类。本文将按照材料类型对这些成果进行分类论述,并就近红外二区荧光成像技术的前景作简要展望。1.1稀土元素荧光材料在接受激发光的能量后,能够在区域内发出荧光的稀土纳米材料,一般是荧光波长大于激发光波长,在学术界被称为下转化发光材料(Lanthanidedown-conversionluminescent3+65nanoparticles,DCNPs)。稀土元素(尤其是正三价稀土元素离子,rare-earth,RE)掺杂[9]无机纳米材料的优良光学性能(如荧光寿命长、光谱线窄、荧光发射波长覆盖区域广等)及其在荧光生物标记等方面的潜在应用,已经引起了国内外学者的普遍关注,有望成为替代[10]分子探针的新一代荧光生物标记材料。2006年,Lezhnina等人研制出了一系列稀土氟化物纳米粒子,其中的((Nd0.05La0.95)F3)core-(LaF3)shell核-壳掺杂物在近红外一区和二区70都有高分辨率的荧光信号,在450W氙灯的照射下,此种包合物分别在793nm、1046nm和1063nm处有强烈荧光。研究发现,包合物内核的稀土材料的比例与荧光波长存在关系,研究者可按需求配制不同比例的稀土内核,从而得到不同发射波长的荧光包合物。3+3+Y2O3:Yb–Er共掺杂纳米纤维在978nm激发光源的照射下,在1563nm波长处有强烈荧光[11][12]3+3+。2008年,Pisarska等人报道了钕-铬共参杂物(Cr-Ndco-doped)在硼酸铅玻璃内75的能级跃迁,数据显示这种共杂物在632nm的激发光照射下,其荧光波长在1060nm处,展3+现出了其良好的NIR-Ⅱ光学性质的应用潜质。YVO4:Nd在808nm光源的照射下,在[13][14]3+3+1063nmm处有尖锐狭窄的荧光峰。2016年,Yu等人报道了Ho-Ybco-dopedKLu2F73+3+3+[15]在1190nm处有清晰荧光,量子产率极高。β-NaGdF4/Nd@NaGdF4/Tm−Yb这种核-壳纳米共掺杂结构具有独特是红外荧光活性,在照射光为975nm波长时,该晶体结构在800nm80处有明显荧光,表现处上转换发光材料的性质;在照射光波长为786nm时,其在1060nm波长处有明显荧光,此时表现出下转换发光材料(DCNPs)的性质(图2a)。包载在PEG修饰脂质体中的稀土材料Y2O3:Er3参杂物(PEGylated-liposome-Y2O3:Er3)在980nm激发光的照射下,在1550nm波长处有明显荧光。这种DevelopmentofNIR-ⅡBioimagingMaterialsResearch脂质体的尺寸才有650nm,可通过尾静脉注射到小鼠体内,在激发光院内的照射下[16,17][18]85可得到清晰的肝脏NIR-Ⅱ成像(图2b)。在Chen等人的试验中,以Er,Ho,Tm和-2-
中国科技论文在线http://www.paper.edu.cnPr四种稀土金属和NaYF4:Yb作为核心,NaYF4为外壳的核-壳共掺杂物的荧光探针,在980nm光源的照射下分别在1185,1310nm,1475nm和1525nm处具有清晰的荧光信号。该类分子探针通过尾静脉注射到裸鼠体内后60秒内可观察到在肝脏部位富集,活体成像效果良好。这些分子探针与通过控制封装厚度而改变表面的人血清蛋白有着极高的特异亲和性,90NaYF4:Yb,Er和NaYF4:Yb,Ho分别注射到患有黑色素瘤的裸鼠两侧的肿瘤部位,然后再两种探针对应的吸收波长灯下照射成像,得到令人惊叹的效果(图3)。两种探针对肿瘤组织的亲和性非常高,二者的荧光信号几乎没有交叉,这更进一步证实了稀土共掺杂物荧光材料具有极高的NIR-Ⅱ生物成像医学应用价值。95[9]图1一些稀土元素材料的荧光分布。[9]Fig.1Fluorescenceemissionpeakofsomerareearthmaterials.1003+3+3+[15]图2(a)β-NaGdF4/Nd@NaGdF4/Tm−Yb两种荧光模式;(b)PEGylated-liposome-Y2O3:Er3[16]的小鼠肝脏近红外二区成像图。3+3+3+Fig.2(a)Dual-Modalfluorescenceemissionofβ-NaGdF4/Nd@NaGdF4/Tm−Yb[15],(b)NIR-Ⅱ[16]imageoftheliverofamouse.105-3-
中国科技论文在线http://www.paper.edu.cn图3NaYF4:Yb,Er和NaYF4:Yb,Ho共掺杂物的肿瘤近红外成像(红色部分代表NaYF4:Yb,Er,绿色部[18]分代表NaYF4:Yb,Ho)。110Fig.3TumorNIRimageofNaYF4:Yb,ErandNaYF4:Yb,Hoonmice(redpartforNaYF4:Yb,Erandgreen[18]partforNaYF4:Yb,Ho).1.2量子点量子点是由有限数目的原子组成,三个维度尺寸均在纳米数量级。量子点一般为球形或类球形,是由半导体材料(通常由IIB~ⅥA或IIIA~VA元素组成)制成的、稳定直径在2~11520nm的纳米粒子。量子点是在纳米尺度上的原子和分子的集合体,既可由一种半导体材料组成,如由IIB、VIA族元素(如CdS、CdSe、CdTe、ZnSe等)组成,也可以由两种或两种以上的半导体材料组成。作为一种新颖的半导体纳米材料,量子点具有许多独特的光学性质,特别是在红外荧光这一范畴内,量子点相较于其他荧光材料具有吸收系数大,量子产率(quantumyield,QY)高等特点,深得研究者亲睐。经过修饰的量子点可具有特定的生物[19]120靶向性,结合其自身的光学活性,量子点在NIR-Ⅱ荧光成像方面具有极高研究价值。硫化铅(PbS)就是一种很理想的量子点材料,在电子受体二氧化钛的存在下,这种量子点材[20]料在近红外区表现出极强的荧光,可检测的荧光波长达到1200nm。PbS材料作为量子点,[21,22][22]其荧光产率也是相当可观的。2009年Rauch等人报道的PbS纳米晶量子点(重量比为1:1:4=P3HT:PCBM:PbS–QDs),其成像分辨率更是可以达到1.8µm级别,外部QY值也[23]125高达51%,保持正常荧光性质寿命在一年以上。早在2011年,Maksym等人就发现Ag2Se量子点在NIR-Ⅱ有明显荧光信号,以硒化银(Ag2Se)为核心,通过热注的正辛硫醇作为其配体而得到的Ag2Se-(1-octanethiol)QDs(硒化银-1-正辛硫醇量子点)(图4),其荧光分布在1080-1330nm,通过控制反应时间可得到特定荧光波长的量子点,可控性较高,并且稳定性相当好,通过11-巯基十一酸(11-mercaptoundecanoicacid)转换配体后得到亲水性130量子点,荧光性质保持不变且可均匀分布于水相中,具有良好的生物组织相容性,展现出极[24]高的分子影像探针潜在价值。硫化银(Ag2S)经过聚乙二醇(PEG)的修饰后得到的聚[25,26][27]乙二醇-硫化银量子点(PEGylated-Ag2SQDs),在NIR-Ⅱ内有强烈荧光,2013年Zhang等人在患有肿瘤的Balb/c小鼠身上用PEGylated-Ag2SQDs处理后,在808nm光源照射下得到了肿瘤部位良好的NIR-Ⅱ影像(图5),为Ag2SQDs的应用做了进一步铺垫。2015年,[28]135Yang等人使用Ag2TeQDs对小鼠全血样中的L929细胞进行红外成像,显微镜下可观察到单个细胞的荧光信号,暗示了金属银的盐类化合物多具有红外量子点的潜质。-4-
中国科技论文在线http://www.paper.edu.cn[24]图4硒化银-1-正辛硫醇螯合物量子点制备示意图。[24]Fig.4PreparationofAgS-1-octanethiolchelateQDs.140[28]图5硫化银量子点的激发荧光波长分布与其在Balb/c小鼠体内的近红外成像效果。[28]Fig.5EmissionspectraofAgSQDsanditsNIRimageonaBalb/cmouse.1.3单层碳纳米管145碳纳米管作为一维纳米材料,重量轻,六边形结构连接完美,具有许多异常的力学、电学和化学性能。近些年随着碳纳米管及纳米材料研究的深入其广阔的应用前景也不断地展现出来。单层碳纳米管(Single-walledcarbonnanotubes,SWCNTs)只具有一层的以六边形排列卷成管状的单质碳材料,其光学活性在碳纳米管材料中尤为突出。与其他不同材料结合后的不同类型,不同密度的SWCNTs有着不同波长的拉曼散射,其拉曼光谱延伸至近红外二[29][30][31]150区。SWCNTs作为造影剂的一大特点是信号强度稳定,长时间不会有光漂白现象。[32]2009年,Welsher等人报道了经过胆酸钠与PEG修饰的SWCNTs,其荧光波长在[33]1100-1700nm之间,该材料成功用于LS174T肿瘤部位血管的成像。Kim等人合成了一种3,4-二氨基葡聚糖(DAP-DEX)包裹的单层碳纳米管(SWCNTDAP-DEX),其在785nm波长光源照射下会有1260nm的荧光,并且这种近红外荧光效应会被一氧化氮(NO)所淬灭,155而NO是一种常见的生物信使。在体内试验中,SWCNTDAP-DEX的近红外荧光在30秒内即可被NO淬灭,前后信号对比明显。这种即时荧光淬灭效果使得SWCNTDAP-DEX成为了[34]NIR-Ⅱ分子影像造影剂的理想选择。Joshua等人将涂有50%二硬脂酰磷脂酰乙醇胺聚乙二醇——50%聚马来酸酐-alt-1-十八烯-聚乙二醇涂层(50%DSPE-mPEG/50%C18-PMH-mPEG)的单层碳纳米管从尾静脉注射到4T1肿瘤模型的BALB/c小鼠体内,48160小时后对其进行拉曼光谱成像,结果显示这种SWCNTs的肿瘤现象能力效果理想,肿瘤部[35]位清晰可见(图7)。2011年,Kim等人再次应用经过PEG修饰的SWCNTs进行了更加精细的生物成像,将SWCNTPEG通过尾静脉注射到小鼠体内,利用高速近红外摄像机拍摄-5-
中国科技论文在线http://www.paper.edu.cn得到了小鼠体内血液流动的视频,该工作计算出了小鼠平均一次血液循环的时间为15秒。[36,37]2014年Hong等人使用SWCNTDSPE-Mpeg通过组织灌注的测量对小鼠的后肢血管再生进165行了动态成像,效果良好,同年该课题组还使用SWCNTIRDye800对小鼠的脑血管进行动态成像,展现出了SWCNTs在血液疾病诊疗方面应用潜能。[28]图6不同密度单层碳纳米管材料的拉曼光谱。[28]Fig.6RamanspectraofSWCNTswithdifferentdensity.170图7(a)4T1肿瘤的BALB/c小鼠的可见光成像;(b)(50%DSPE-mPEG/50%C18-PMH-mPEG)-SWCNTs的[34]近红外肿瘤现象。Fig.7(a)OpticalimageofaBALB/cmousewithtwo4T1tumorsonaBALB/cmouse.(b)NIRimageof[34]175SWCNTsona4T1tumorsbearingmouse.1.4有机小分子染料NIR-Ⅱ的小分子成像材料是近几年新兴的生物成像试剂,相比传统的荧光材料,其具有潜在毒性小、生物相容性高、应用方便以及易于修饰等特点。IR-1061是一种小分子荧光染[38]180料,其在NIR-Ⅱ内有良好荧光信号。Tao等人将IR-1061与聚丙烯酸结合,然后包载与用PEG修饰的脂质体,得到了亲水性的NIR-Ⅱ荧光染料。将这种染料注射到小鼠体内,然后对其红外信号采集可得到清晰的血管分布图,并用主成分分析法(principalcomponentanalysis,PCA)得到小鼠体内各主要脏器的成像图,这也是有机小分子有机染料在NIR-Ⅱ[39]成像方面取得的重大突破。D’Aleo等人研制一种金属镱的配合物Yb1,在1000nm处有[40]185红外荧光,在此波长下可对小鼠脑切片进行清洗的光声成像。Chen等人合成了一种全对称的NIR-Ⅱ荧光成像小分子CH1055,其主体结构为‘电子供体-共轭大π键-电子受体-共轭-6-
中国科技论文在线http://www.paper.edu.cn大π键-电子供体’(D-π-A-π-D)的大共轭体系,该分子在750nm光源的照射下可实现分子内部的大π键电子跃迁,在1055nm处有强烈荧光并且信号极为清晰。经过PEG修饰的CH1055(CH1055-4PEG)由静脉注射到小鼠体内,经信号收集处理可得到清晰的荧光成像190图。Chen和其同事将CH1055与靶向试剂anti-EGFRAFFIBODY结合后,注射到患有SAS肿瘤的小鼠体内,对其进行荧光成像,得到肿瘤部位清晰的成像(图10)。类似的(D-π-A-π-D)[41][42]大共轭体系NIR-II染料还有IR-E1、Q4以及IR-FEP/IR-BBEP/IR-FTP[43]。其中IR-E1[41]是Zhang等人于2016年研制而成,其最大发射荧光波长在1071nm并成功用于颅脑损伤模型小鼠的脑血管成像,IR-FEP/IR-BBEP/IR-FTP三种有荧光材料是IR-E1的改进型材料,[41,43]195改进后三种材料的荧光量子效率大幅增加;Q4是参照CH1055重新设计而得的一种小分子材料,其荧光波长为1100nm,经过DSPE-mPEGNPs脂质体包载后得到Q4NPs可用于血管成像;Q4经过与RM26连接的PEG修饰后得到具有胃泌素释放肽受体靶向性的SCH1100探针,应用于PC3肿瘤模型小鼠成像,效果显著,首次实现了基于小分子肽链的[44]肿瘤靶向性NIR-II影像探针。2017年Sun等人合成了具有NIR-II(λEm=1100nm)荧光200的小分子H1,对其进行适当修饰后得到SXH、SDH和H1NPs三种NIR-II荧光探针。探针SXH在U87MG肿瘤模型的小鼠体内进行非替异性成像,得到肿瘤部位清晰的成像,持续时间达12h。SDH的体内分布试验表明H1小分子可通过肝胆系统和肾脏系统代谢排放。在H1NPs的红外信号的引导下,他们在实验小鼠完成了成像引导的前哨淋巴结移除手术。这些研究表明NIR-II小分子染料具有极高的应用潜能,虽然起步较晚,大有后来者居上的趋205势。图8(a)CH1055与anti-EGFRaffibody结合。(b)CH1055探针的光学性质。(c)注射了CH1055-affibody的患有SAS肿瘤小鼠与加了阻滞剂的对照组在注射后1小时、6小时以及24小时后进行近红外光引导肿瘤剔[40]210除手术后的成像对比。Fig.8(a)CH1055combinewithanti-EGFRaffibody.(b)OpticalpropertiesofCH1055.(c)ComparisonoftheNIRimagesbetweenCH1055-affibodyinjectedandCH1055-affibodywithblockingagentinjectedSAStumor-7-
中国科技论文在线http://www.paper.edu.cnbearingmouseat1h,6haftertheinjection,andtheNIRimagesbeforeandafterNIR-guidedtumorremoval[40]surgeryat24haftertheinjection.2151.5纳米晶和聚合物类随着NIR-Ⅱ成像从材料研究的热潮兴起,纳米晶与聚合物类荧光材料也越来越被人们[45]重视。金属金的纳米级晶体在近红外区有良好的荧光信号,早在1998年,Oldenburg等人就发现不同粒径的金-纳米球壳有着不同波长的荧光性质,当其粒径小到5nm时,起荧光[46]220波长在1030nm左右,处于NIR-Ⅱ内,拥有良好的生物成像潜质。2000年Bigioni等人报道过粒径在1.1-1.7nm的纳米金晶体在NIR-Ⅱ有良好的的光致荧光效应,其荧光波长分布在[47]1100-1600nm;2012年Liu等人报道了特定尺寸的胶体锑化铟(InSb)纳米晶在1500mn处有良好的荧光信号。IVA族元素组成的化合物一直都是光学研究的热门材料,不论是硅、[20,48][49]锗还是铅等材料都具有近红外光学特性。2008年Lee等人报道一系列锗纳米晶225(germaniumNanocrystals,GeNCs)的荧光信号覆盖了1000-1300nm,为GeNCs的生物成[50]像应用打下了基础。此后Daniel等人报道的不同尺寸的GeNCs荧光信号直接覆盖了NIR-1和NIR-Ⅱ两个区域,而且这些GeNCs被证实具有良好的生物相容性并且已经被以量[51,52]子点的形式用于HeLa细胞的可见光区荧光成像,使得GeNCs展现出良好的应用前景。[53]2014年,Hong等人合成了一种聚有机小分子单元聚合物pDA,其荧光波长为1047nm,230经DSPE-mPEG包载后得到pDA-PEG纳米颗粒(图11),这种荧光纳米年纳米颗粒成功用[54]于小鼠后肢血管成像。Meng等人研制出的FeS2-350是一种新型的基于无机盐的纳米材料,其在近红外一区到二区都有强烈荧光,其小鼠活体肿瘤成像试验结果理想,为无机盐在近红外成像方面的应用提供的方向。235[51]图9.(a)pDA的制备;(b)pDA-PEG的结构示意图;(c)pDA-PEG的小鼠后肢血管近红外成像图。Fig.9(a)PreparationofpDA.(b)StructureofpDA-PEG.(c)NIRimageofpDA-PEGonthehindlimbvesselofalivingmouse.2402结论与展望通过对NIR-Ⅱ生物成像材料的汇总,我们不难发现NIR-Ⅱ生物成像材料在近几年发展非常迅速。相较于传统光学成像,NIR-Ⅱ成像技术以自身不可代替的优势,大有代替传统光学成像的趋势。由于起步晚,NIR-Ⅱ生物成像目前基本还停留在动物实验阶段,距离临床应245用还有较大的距离。NIR-Ⅱ成像材料从动物实验阶段向临床应用阶段过渡的过程中,必须提高生物相容性低、体内物理和化学稳定性、生物水相分散稳定性和特殊光学性质等。上述的NIR-Ⅱ成像材料中稀土材料的近红外荧光覆盖范围最广(涵盖了NIR-Ⅰ和NIR-Ⅱ),其中基于RE3+的掺杂物类更是处在NIR-Ⅱ生物成像研究的前沿,在探针应用和体内/外成像两-8-
中国科技论文在线http://www.paper.edu.cn方面应用都较多;SWCNTs类材料由于其极高的空间和时间分辨率被广泛研究,目前阻碍250这类材料亟待克服的缺点是其潜在的生物毒性和较低的社会认可度;大部分量子点材料具有很理想的光学特性,但由于包含重金属而同样认可度不高,新兴的Ag类量子点材料或许能避开这个问题,近期报道的体内/外成像结果显示其有优秀的前景;目前符合NIR-Ⅱ成像特性的有机小分子数量非常有限,研究者多在原有NIR-Ⅰ分子上进行修/改造而得到新分子,效率较低,但由于其良好的生物相容性(溶解度高、可代谢、毒性低)、低成本和高可塑性255等特点而备受关注,有理由相信有机小分子NIR-Ⅱ成像材料将成为该领域的主流研究方向;纳米晶与聚合物类材料研发起步较晚,由于毒性低且易于修饰而被重视,多用于光热治疗,成像方面应用较少。NIR-Ⅱ成像技术使非侵入性观察活体动物体内的基因蛋白表达和各种细胞活动成为可能,相对于高场磁共振,放射性核素成像等其他非侵入性观察手段,NIR-Ⅱ荧光成像的光260子量探测域值低,故检测灵敏度高;每一探针均为针对某个具体的分子靶而设计,故特异性强。目前,NIR-Ⅱ荧光成像仍然处于体外细胞研究和动物实验研究阶段,且正在被越来越广泛地应用于医学及生物学研究领域。随着新技术的不断发展和新设备的不断涌现,NIR-Ⅱ荧光成像的研究范围将不断扩大,将为人类疾病诊断和治疗提供一种崭新的方法。致谢265本文化合物绘制及图片拼接使用到软件ChemOffice&ChemDarw16(www.cambridgesoft.com),此外,文中还引述了国内外多个课题组的研究工作,并且得到国家自然科学基金(NO.81573383)、国家自然科学基金青年基金(No.81402882)的帮助,在此一并表示感谢。270[参考文献](References)[1]AlexeyN.B.,ElinaA.G.,VyacheslavI,etal.OpticalpropertiesofhumanmaxillarysinusmucosaandestimationofMethyleneBluediffusioncoefficientinthetissue[C].ProceedingsofSPIE,2005,5771(5):316-327.[2]HahnM.K,SinghA.K.,SharmaP.,etal.Nanoparticlesascontrastagentsforin-vivobioimaging:currentstatusandfutureperspectives[J].AnalyticalandBioanalyticalChemistry,2011,339(1):3-27.275[3]Fernández-S.M.andTingA.Y.Fluorescentprobesforsuper-resolutionimaginginlivingcells[J].NatureReviewsMolecularCellBiology,2008,9:929-943.[4]AlexeyN.B.,ElinaA.G.,VyacheslavI,etal.Opticalpropertiesofhumancranialboneinthespectralrangefrom800to2000nm[C].ProceedingsofSPIE,2006,6163(6):1-11.[5]HongG.S.,JerryC.L.,JoshuaT.R.,etal.Multifunctionalinvivovascularimagingusingnear-infraredII280fluorescence[J].NatureMedicine,2012,18(12):1841-1846.[6]SharonB.,FrédéricL.,LauraM.,etal.Whole-bodyfluorescencelifetimeimagingofatumor-targetednear-infraredmolecularprobeinmice[J].JournalofBiomedicalOptics,2005,10(5):054003(1-6).[7]BundgaardE.andFrederikC.K.,Lowbandgappolymersfororganicphotovoltaics[J].SolarEnergyMaterials&SolarCells,2007,91:954-985.285[8]LisaCarroll,MD,TatyanaR.H.,LASER-tissueinteractions[J].ClinicsinDermatology,2006,24:2-7.[9]HyounsooU.andStéphaneP.,Novelantennaeforthesensitizationofnearinfraredluminescentlanthanidecations[J].ComptesRendusChimie,2010,13:668-680.[10]MarinaM.L.,ThomasJ.,HeikeK,etat.EfficientLuminescencefromRare-EarthFluorideNanoparticleswithOpticallyFunctionalShells[J].AdvancedFunctionalMaterials,2006,16:935-942.290[11]MartínezA.,MoralesJ.,SalasP.,etal.SynthesisandphotoluminescenceofY2O3:Yb3+-Er3+nanofibers[J].MicroelectronicsJournal,2008,39:551-555.[12]PisarskaJ.,EnergytransferfromCr3+toNd3+andNIRluminescenceofNd3+inleadborateglasses[J].OpticaApplicata,2008,38(1):203-210.[13]KolesnikovI.E.,GolyevaE.V.,KurochkinM.A.,etal.Nd3+-dopedYVO4nanoparticlesforluminescence295nanothermometryinthefirstandsecondbiologicalwindows[J].SensorsandActuatorsB,2016,235:287-293.-9-
中国科技论文在线http://www.paper.edu.cn[14]YuT.,YuT.C.,LinH.H.,etal.Single-bandnear-infraredquantumcuttingofHo3+-Yb3+codopedKLu2F7phosphorsbyenergyclustering[J].JournalofAlloysandCompounds,2017,695:1154-1159.[15]ZhouJ.J.,NaotoS.,SunH.T.,etal.EfficientDual-ModalNIR-to-NIREmissionofRareEarthIonsCodoped300NanocrystalsforBiologicalFluorescenceImaging[J].J.Phys.Chem.Lett.,2013,4:402−40.[16]KoheiS.,KimikazuT.,KosukeT.,etal.NIRBioimaging:DevelopmentofLiposome-Encapsulated,Rare-Earth-DopedY2O3NanoparticlesasFluorescentProbes[J].EuropeanJournalofInorganicChemistry,2010:2673-2677.[17]NallusamyV.,EvaH.,TomoyoshiY.,etal.Synthesisandtoxicityassayofceramicnanophosphorsfor305bioimagingwithnear-infraredexcitation[J].ProgressinCrystalGrowthandCharacterizationofMaterials,2012,58:121-134.[18]NaczynskiD.J.,TanM.C.,ZevonM.,etal.Rare-earth-dopedbiologicalcompositesasinvivoshortwaveinfraredreporters[J].NatureCommunications,2013,4,(2199).[19]HakS.C.,BinilI.I.,PreetiM.,etal.Tissue-andOrgan-SelectiveBiodistributionofNIRFluorescentQuantum310Dots.NanoLetters,2009,9(6):2354-2359.[20]AsimG.,ArupK.R.,AmlanJ.P.,Tomakepolymer:QuantumdothybridsolarcellsNIR-activebyincreasingdiameterofPbSnanoparticles.SolarEnergyMaterials&SolarCells,2011,95:651-656.[21]WangH.B.,TakayaK.,JotaroN.,etal.PbS-Quantum-Dot-BasedHeterojunctionSolarCellsUtilizingZnONanowiresforHighExternalQuantumEfficiencyintheNear-InfraredRegion[J].J.Phys.Chem.Lett.,2013,4:3152455−2460.[22]TobiasR.,MichaelaB.,SandroF.T.,etal.Near-infraredimagingwithquantum-dotsensitizedorganicphotodiodes,Naturephotonics,2009,3:332-336.[23]MaksymY.,StefanP.,MykhailoS.,etal.InfraredEmittingandPhotoconductingColloidalSilverChalcogenideNanocrystalQuantumDotsfromaSilylamide-PromotedSynthesis[J].ACSNano,2011,5(5):3203758−3765.[24]ZhuC.N.,JiangP.,ZhangZ.L.,etal.Ag2SeQuantumDotswithTunableEmissionintheSecondNear-InfraredWindow[J].Appl.Mater.Interfaces,2013,5:1186−1189.[25]LiC.Y.,ZhangY.J.,WangM.,etal.Invivoreal-timevisualizationoftissuebloodflowandangiogenesisusingAg2SquantumdotsintheNIR-IIwindow[J].Biomaterials,2014,35:393-400.325[26]TanL.J.,HuangR.,LiX.Q.,etal.Chitosan-basedcore-shellnanomaterialsforpH-triggeredreleaseofanticancerdrugandnear-infraredbioimaging[J].CarbohydratePolymers,2017,157:325-334.[27]ZhangY.,ZhangY.J.,HongG.S.,etal.Biodistribution,pharmacokineticsandtoxicologyofAg2Snear-infraredquantumdotsinmice[J].Biomaterials,2013,34:3639-3646.[28]YangM.,GuiR.J.,JinH.,etal.Ag2Tequantumdotswithcompactsurfacecoatingsof330multivalentpolymers:Ambientone-potaqueoussynthesisandthesecondnear-infraredbioimaging[J].ColloidsandSurfacesB:Biointerfaces,2015,126:115-120.[29]RaoA.M.,E.Richter,S.Bandow,etal.,Diameter-selectiveRamanscatteringfromvibrationalmodesincarbonnanotubes[J].Science,1997,275:187-191.[30]SaunabG.,SergeiM.,Bachilo,etal.Advancedsortingofsingle-walledcarbonnanotubesbynonlinear335density-gradientultracentrifugation[J].NatureNanotechnology,2010,5:443-450.[31]AchimH.,HermeneglidoN.P.,LukasN.,etal.SimultaneousfluorescenceandRamanscatteringfromsinglecarbonnanotubes[J].Science2003,301:1354-1356.[32]WelsherK.,LiuZ.,SarahP.S.,etal.Aroutetobrightlyfluorescentcarbonnanotubesfornear-infraredimaginginmice[J].NatureNanotechnology,2009,4:773-780.340[33]KimJ.H.,HellerD.A.,JinH.,etal.Therationaldesignofnitricoxideselectivityinsingle-walledcarbonnanotubenear-infraredfluorescencesensorsforbiologicaldetection[J].NatureChemistry,2009,1:473-481.[34]JoshuaT.R.,KevinW.,ScottM.T.,etal.HighPerformanceInVivoNear-IR(>1μm)ImagingandPhotothermalCancerTherapywithCarbonNanotubes[J].NanoResearch,2010,3(11):779-793.[35]KimC.,FavazzaC.andWangL.V.Invivophotoacoustictomographyofchemicals:High-resolution345functionalandmolecularopticalimagingatnewdepths[J].ChemicalReviews,2010,110(5):2756-2782.[36]HongG.S.,JerryC.L.,ArshiJ.,etal.Near-InfraredIIFluorescenceforImagingHindlimbVesselRegenerationWithDynamicTissuePerfusionMeasurement[J].Circ.Cardiovasc.Imaging,2014,7:517-525.[37]HongG.S.,DiaoS.,ChangJ.L.,etal.Through-skullfluorescenceimagingofthebraininanewnearinfraredwindow[J].NaturePhotonics,2014,8(9):723-730.350[38]TanZ.M.,HongG.S.,ChihiroS.,etal.Biologicalimagingusingnanoparticlesofsmallorganicmoleculeswithfluorescenceemissionatwavelengthslongerthan1000nm[J].AngewandteChemie,2013,125:13240-13244.[39]D"Aléo,AdrienB.,SophieB.,etal.Ytterbium-Basedbioprobesfornear-infraredtwo-photonscanninglasermicroscopyimaging[J].AngewandteChemieInternationalEdition,2012,51:6622-6625.355[40]ChenH.,AlexanderL.A.,ChengK.,etal.Asmall-moleculedyeforNIR-IIimaging[J].NatureMaterials,2016,15:235-242.[41]ZhangX.D.,WangH.S.,AlexanderL.A.,etal.Traumaticbraininjuryimaginginthesecondnear-infraredwindowwithamolecularfluorophore[J].AdvancedMaterials,2016,28:6872-6879.[42]SunY.,QuC.R.,ChenH.,etal.Novelbenzo-bis(1,2,5-thiadiazole)fluorophoresforinvivoNIR-IIimagingof360cancer[J].ChemicalScience,2016,7:6203-6207.[43]YangQ.L.,MaZ.R.,WangH.S.,etal.RationaldesignofmolecularfluorophoresforbiologicalimagingintheNIR-IIwindow[J].AdvancedMaterials,2017,DOI:10.1002/adma.201605497.[44]SunY.,DingM.M.,ZengX.D.,etal.Novelbright-emissionsmall-moleculeNIR-IIfluorophoresforinvivo-10-
中国科技论文在线http://www.paper.edu.cntumorimagingandimage-guidedsurgery[J].ChemicalScience,2017,DOI:10.1039/c7sc00251c.365[45]OldenburgS.J.,AverittR.D.,WestcottS.L.,etal.Nanoengineeringofopticalresonances[J].ChemicalPhysicsLetters,1998,288:243-247.[46]BigioniT.P.andWhettenR.L.,Near-Infraredluminescencefromsmallgoldnanocrystals[J].JournalofPhysicalChemistryB,2000,104(30):6983-6986.[47]LiuW.Y.,AngelaY.C.,RichardD.S.,etal.ColloidalInSbnanocrystals[j].JournaloftheAmericanChemical370Society,2012,134:20258−20261.[48]CanhamL.T.,Siliconquantumwirearrayfabricationbyelectrochemicalandchemicaldissolutionofwafers[j].AppliedPhysicsLetters,1990,57(10):1046-1048.[49]DohC.L.,JeffreyM.P.,IstvanR.,etal.Colloidalsynthesisofinfrared-emittinggermaniumnanocrystals[J].JournaloftheAmericanChemicalSociety,2009,131:3436-3437.375[50]DanielA.R.,JustinC.J.,NathanR.N.,etal.Sizeandbandgapcontrolinthesolution-phasesynthesisofnear-infrared-emittinggermaniumnanocrystals[J].ACSNANO,2010,4(12):7459-7466.[51]SouravB.,ManiP.S.,TonyaM.A.,etal.Cytotoxicityofsurface-functionalizedsiliconandgermaniumnanoparticles:thedominantroleofsurfacecharges[J].Nanoscale,2013,5:4870-4833.[52]KaratutluA.,SongM.Y.,WheelerA.P.,etal.Synthesisandstructureoffree-standinggermaniumquantum380dotsandtheirapplicationinlivecellimaging[J].RSCAdvances,2015,5:20566-20573.[53]HongG.S.,ZouY.P.,AlexanderL.A.,etal.Ultrafastfluorescenceimaginginvivowithconjugatedpolymerfluorophoresinthesecondnear-infraredwindow[J].NatureCommunications,2014,5,4206.[54]MengZ.Q.,WeiF.,MaW.j.,etal.Designandsynthesisof-11-'
您可能关注的文档
- 蚀变岩型金矿尾矿火山灰性能的活化及应用研究.pdf
- 蛋白质NEDD化修饰的研究进展及展望.pdf
- 血管内支架植入后的内皮损伤及其修复策略.pdf
- 调节性B细胞对1,3-β-葡聚糖所致过敏性肺炎的调控作用.pdf
- 调速型磁力耦合器气隙特性研究.pdf
- 超临界二氧化碳、氮气和水的射流应力特性研究.pdf
- 超导磁浮危险物质输运系统屏蔽层性能研究.pdf
- 转移机构设计及其运动规律研究.pdf
- 近百年全球平均海平面变化重构研究进展与分析.pdf
- 适应于SiC BJT的双电源驱动电路的优化设计.pdf
- 针铁矿-细菌-腐殖酸复合体对Pb的吸附行为研究.pdf
- 锁掷酵母油对血脂异常小鼠脂代谢影响的研究.pdf
- 锂离子电池热特性实验与仿真分析.pdf
- 锰胁迫对茶树锰含量和生理变化的影响.pdf
- 长链菊粉对小鼠急性胰腺炎及相关肠道损伤的保护作用研究.pdf
- 长鬣蜥(Physignathus cocincinus)线粒体基因组全序列分析.pdf
- 预混层流本生灯顶端局部Karlovitz数.pdf
- 香烟烟雾致BEAS-2B细胞恶性转化过程中基因组与PTPRM的DNA甲基化改变.pdf
相关文档
- 施工规范CECS140-2002给水排水工程埋地管芯缠丝预应力混凝土管和预应力钢筒混凝土管管道结构设计规程
- 施工规范CECS141-2002给水排水工程埋地钢管管道结构设计规程
- 施工规范CECS142-2002给水排水工程埋地铸铁管管道结构设计规程
- 施工规范CECS143-2002给水排水工程埋地预制混凝土圆形管管道结构设计规程
- 施工规范CECS145-2002给水排水工程埋地矩形管管道结构设计规程
- 施工规范CECS190-2005给水排水工程埋地玻璃纤维增强塑料夹砂管管道结构设计规程
- cecs 140:2002 给水排水工程埋地管芯缠丝预应力混凝土管和预应力钢筒混凝土管管道结构设计规程(含条文说明)
- cecs 141:2002 给水排水工程埋地钢管管道结构设计规程 条文说明
- cecs 140:2002 给水排水工程埋地管芯缠丝预应力混凝土管和预应力钢筒混凝土管管道结构设计规程 条文说明
- cecs 142:2002 给水排水工程埋地铸铁管管道结构设计规程 条文说明