- 673.24 KB
- 2022-04-22 13:45:29 发布
- 1、本文档共5页,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报电话:19940600175。
'中国科技论文在线http://www.paper.edu.cn血管内支架植入后的内皮损伤及其修复策#略**席亚东,黄玉华,杜若林,尹铁英,王亚洲,王贵学5(重庆大学生物工程学院,重庆400044)摘要:冠状动脉粥样硬化性心脏病是严重危害人类生命健康的心血管疾病。近年来其主要的治疗手段是将血管支架植入到病变部位,支撑血管和重建血运。然而,大量研究表明,支架植入后的机械损伤、非特异性涂层药物等会对血管内皮造成极大的损伤,增加了支架内再狭10窄和晚期血栓的风险。因此,维持内皮的完整和正常功能可显著降低支架植入带来的一系列风险。研究表明,干细胞动员、归巢、分化、增殖是血管支架植入后内皮修复的主要机制,多种血管内因子、植入部位力学微环境变化等对这一过程均有一定的影响,进而影响植入部位的再内皮化。本文对支架植入造成内皮损伤的过程、损伤后的修复机制及其影响因素等进行详细阐述,并对其修复策略进行分析总结。15关键词:生物医学材料;血管支架植入;血管内皮修复;机制;策略中图分类号:R318.08Mechanismsofendothelialinjuryandrepairstrategiesaftervascularstentimplantation20XIYadong,HUANGYuhua,DURuolin,YINTieying,WANGYazhou,WANGGuixue(BiologicalEngineeringCollege,ChongqingUnivesity,Chongqing400044)Abstract:Coronaryatheroscleroticheartdiseaseisaseriousthreattohumanlifeandhealth.Inrecentyears,themaintreatmentistoimplanttheintravascularstentintothelesion,tosupportbloodvessels25andreconstructbloodsupply.However,alargenumberofexperimentalresultsshowthatmechanical,anti-proliferativedrugscausedgreatdamageafterstentimplantation,andincreasedin-stentrestenosisandlatethrombosisrisk.Thus,maintainingtheintegrityandnormalfunctioningoftheendotheliumcansignificantlyreducetherateofthrombosisandrestenosis.Stemcellmobilization,homing,differentiationandproliferationarethemainmechanismsofendothelialrepairaftervascularstent30implantation.Vascularfactorandmechanicalmicroenvironmentalchangesinimplantedsiteshaveacertaineffectonre-endothelialization.Inthispaper,theprocessofinjurycausedafterstentimplantation,therepairmechanismafterinjuryanditsinfluencingfactorsareexpoundedindetail.Andrepairingstrategiesareanalyzedandsummarized.Keywords:Biomedicalmaterials;Vascularstentimplantation;Vascularendothelialrepair;Mechanism;35Strategy.0引言[1]目前,全国有心血管病患者2.9亿,其死亡率在农村和城市均居各种疾病之首。血管基金项目:国家自然科学基金重点项目(11332003);国家重点研发计划项目(2016YFC1102305);重庆市科委领军人才项目(cstc2013kjrc-ljrccj10003);中央高校基本科研业务费资助项目(2015CDJZR);重庆大学作者简介:席亚东(1993-),男,硕士研究生,主要研究方向:生物大分子及生物材料通信联系人:尹铁英(1979-),女,副教授,硕导,主要研究方向:生物材料的功能化改性及其在心血管领域的应用.E-mail:ilyyty28@126.com-1-
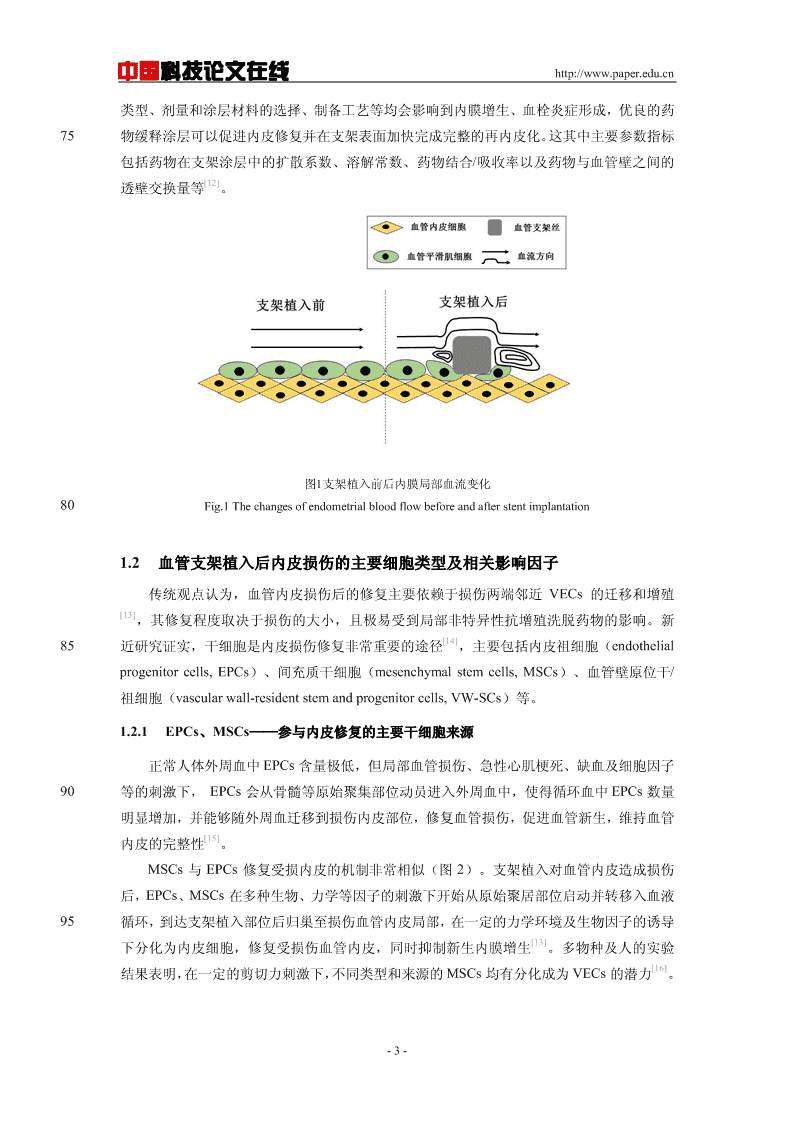
中国科技论文在线http://www.paper.edu.cn40内支架植入等介入治疗(percutaneouscoronaryintervention,PCI)能快速重建血运,恢复缺血心肌的血供,并以高效、微创的优势成为目前最重要、最有效的心血管疾病诊疗技术,已广泛[2]应用于临床治疗。血管内皮细胞(vascularendothelialcells,VECs)是血管内膜最重要的组成部分,具有物质交换、分泌和屏障的功能,因此VECs不仅在抗炎、抗血栓形成、调节血管张力等方面45具有重要生物学意义,还与心血管疾病的发生、发展具有密切联系。血管支架植入等介入操作对血管内壁的挤压和擦伤、装载药物的非特异性抑制、金属支架丝的持续刺激等都会造成内膜的损伤,进而引发血栓形成、平滑肌细胞(vascularsmoothmusclecells,SMCs)增殖,最终导致支架内再狭窄(intraventricularrestenosis,ISR)和晚期[3]血栓。可以说,支架植入后对内皮的损伤是诸多风险发生的始动环节。因此,在血管支架50植入后,如何尽快恢复VECs的完整与功能成为治疗ISR和晚期血栓的重要方式。本文对支架植入造成内皮损伤的过程、修复机制及其影响因素进行详细阐述,并对其修复策略进行分析总结。1血管支架植入后的内皮损伤及其修复机制1.1血管支架植入后内皮损伤的过程及影响因素55支架植入即刻,支架穿刺植入和球囊扩张过程不可避免的会产生摩擦、张应力、压迫等力学刺激,使血管内膜的完整性受到损坏。中膜弹力板等暴露在血液中黏附并激活血小板等血液成分,继而形成血栓。同时,该过程还会激活炎症反应,产生一系列生长因子和细胞因子,导致SMCs增殖。在这个过程中,SMCs发生表型转换,分泌大量胞外基质,增加内膜[4,5]厚度,从而引起支架内再狭窄。此外,支架扩张不足、聚合物断裂、金属支架等也会引[6]60起炎症反应,延迟内皮化的发生,引起一系列术后风险。植入血管内的支架本身作为一种异物,会极大的影响植入部位的血流动力学微环境,也会影响内皮损伤的修复进程。除对血管内壁形成压迫外,支架丝贴合血管壁后在局部形成的凸起会深刻影响内膜表面形貌,血液流经支架植入部位会在支架丝附近形成涡流或紊流等低剪切力区域,而支架丝的厚度、间距、走向等都会通过产生局部震荡流、涡流影响血管内皮65细胞调控基因的表达,进而影响内皮细胞的结构、功能、增殖和迁移,导致内皮功能障碍,[7–9]抑制支架损伤后再内皮化。力学环境影响如图1所示。此外,目前广泛应用的,可实现支架植入局部药物释放的药物洗脱支架(drugelutingstents,DES)所装载的药物以及载药涂层等可能会对内皮造成化学和炎症损伤。DES植入后,植入部位的病理变化可大致分为三个阶段。第一阶段(1个月内),药物大量集中释放,即70爆释效应,在短时间内局部浓度过高的药物会对血管内膜造成损伤,有产生急性和亚急性血栓的危险。第二阶段是受损血管部位组织修复的重要阶段。支架表面开始覆盖新生组织,但延迟的或不完全的内皮化有可能会导致血栓的形成和ISR的发生。第三阶段,3个月以后,[10,11]植入的支架通常嵌入在血管组织中,可能会导致晚期血栓和再狭窄。因此,装载药物的-2-
中国科技论文在线http://www.paper.edu.cn类型、剂量和涂层材料的选择、制备工艺等均会影响到内膜增生、血栓炎症形成,优良的药75物缓释涂层可以促进内皮修复并在支架表面加快完成完整的再内皮化。这其中主要参数指标包括药物在支架涂层中的扩散系数、溶解常数、药物结合/吸收率以及药物与血管壁之间的[12]透壁交换量等。图1支架植入前后内膜局部血流变化80Fig.1Thechangesofendometrialbloodflowbeforeandafterstentimplantation1.2血管支架植入后内皮损伤的主要细胞类型及相关影响因子传统观点认为,血管内皮损伤后的修复主要依赖于损伤两端邻近VECs的迁移和增殖[13],其修复程度取决于损伤的大小,且极易受到局部非特异性抗增殖洗脱药物的影响。新[14]85近研究证实,干细胞是内皮损伤修复非常重要的途径,主要包括内皮祖细胞(endothelialprogenitorcells,EPCs)、间充质干细胞(mesenchymalstemcells,MSCs)、血管壁原位干/祖细胞(vascularwall-residentstemandprogenitorcells,VW-SCs)等。1.2.1EPCs、MSCs——参与内皮修复的主要干细胞来源正常人体外周血中EPCs含量极低,但局部血管损伤、急性心肌梗死、缺血及细胞因子90等的刺激下,EPCs会从骨髓等原始聚集部位动员进入外周血中,使得循环血中EPCs数量明显增加,并能够随外周血迁移到损伤内皮部位,修复血管损伤,促进血管新生,维持血管[15]内皮的完整性。MSCs与EPCs修复受损内皮的机制非常相似(图2)。支架植入对血管内皮造成损伤后,EPCs、MSCs在多种生物、力学等因子的刺激下开始从原始聚居部位启动并转移入血液95循环,到达支架植入部位后归巢至损伤血管内皮局部,在一定的力学环境及生物因子的诱导[13]下分化为内皮细胞,修复受损伤血管内皮,同时抑制新生内膜增生。多物种及人的实验[16]结果表明,在一定的剪切力刺激下,不同类型和来源的MSCs均有分化成为VECs的潜力。-3-
中国科技论文在线http://www.paper.edu.cn图2内皮损伤后EPCs参与的修复机制100Fig.2RepairmechanismofEPCsinvolvedafterendothelialinjury1.2.2血管壁原位干/祖细胞——骨髓外细胞修复的主要来源血管外膜可能通过参与细胞表型转化、迁移、增殖、凋亡等,在血管生长、血管稳态、[17]功能调节以及血管重构、钙化和纤维化等过程中发挥重要作用。有研究显示,血管壁原[18]105位干/祖细胞在特定条件下能转移、分化为平滑肌细胞。Yu等对CCL2-/-小鼠血管内壁进行导丝损伤处理后发现,sca-1+干细胞无法从外膜转移至内膜促进内膜增生。他们认为,内膜损伤后SMCs可能通过CCR2/Rac1/p38和CXCR2/Rac1/p38两条信号通路诱导血管壁原位干/祖细胞由外膜转入内膜并分化为SMCs,导致内膜增生。但有研究认为血管壁原位干细胞也具有分化为血管内皮细胞的能力,可能是支架植入后110修复内皮损伤的重要细胞来源,对于血管病变或损伤部位的修复及血管再生具有重要的作[19]用。Campagnolo等研究结果显示,白藜芦醇可以通过MiR-21/Akt/β-catenin信号通路作用于血管壁原位干/祖细胞,并诱导诸如CD31、VE-cadherin和eNOS等内皮标志物的表达,其小鼠实验中白藜芦醇减少病变的结果也印证了这一点。1.2.3内皮修复细胞的主要影响因子115支架植入后局部因机械应力、炎症反应等对内膜造成损伤,受损血管局部产生响应机制,分泌血管内皮生长因子(vascularendothelialgrowthfactor,VEGF)、粒细胞集落刺激因子(granulocytecolonystimulatingfactor,G-CSF)等重要的生物活性因子,动员、分化EPCs、MSCs为VECs或促进周围VECs分裂增殖,修复局部内皮损伤,促进再内皮化。VEGF是一种促血管内皮生长因子,它能特异性促进VECs的分裂与增殖,并且是重要120的EPCs动员的调节因子。成纤维细胞生长因子(fibroblastgrowthfactor,FGF)能促进VECs[13]的增殖、迁移,并且促进管腔的形成。G-CSF作为一种血液生长因子,可以动员更多外周血中的EPCs,提升循环中的EPCs数量和功能,提升EPCs的增殖分化潜力,加速受损心[20,21]肌和血管修复。雌激素是一类有广泛生物活性的具有一定心血管保护作用的类固醇化合-4-
中国科技论文在线http://www.paper.edu.cn物,主要有雌二醇、雌三醇、雌酚等。支架植入对内皮造成损伤后,雌激素也可以促进EPCs[22]125的归巢、分化,修复受损部位,促进再内皮化,达到保护心血管的目的。除了上述生物活性因子外,生物力学刺激也是影响干细胞分化的重要因素。研究发现高剪切力有助于MSCs的内皮标志成分如VEGF的水平显著提高,而诸如平滑肌α-肌动蛋白[16](smoothmuscleα-actin,SMA)、钙结合蛋白等平滑肌标志表达水平显著降低。2血管支架植入后内皮损伤的修复策略1302.1药物与支架改进2.1.1促内皮修复药物及其药物支架现在应用较多的治疗内皮损伤的生物因子、药物包括VEGF、FGF、G-CSF、过氧化物酶体增殖物激活受体激动剂、他汀类等。生物活性因子类药物中以VEGF研究最多,其在促进内皮修复当中使用也最为广泛。135VEGF不仅能够促进VECs的分裂、增殖和功能恢复,还能够作用于干细胞。用VEGF修饰的血管支架生物涂层,VECs在不仅可以在其上附着,活力和增殖能力均明显增强,而且能[23]够诱导外周血中动员的MSCs向VECs方向分化,具有很好的促进内皮修复的效果,证明[24]了VEGF涂层支架的有效性。Song等首先将多巴胺(dopamine,DA)与肝素(heparin,Hep)共混交联,在316L不锈钢表面制备了DA-Hep涂层,而后通过浸泡的方法制备了兼140有VEGF和CD34的新型涂层。该涂层能进一步加快内皮细胞修复,减少支架在血液中的暴露时间,抑制急性、亚急性及晚期血栓形成。这为促再内皮化药物洗脱支架的研发提供了一个新的思路与平台。非生物因子类药物以他汀类最具代表性。他汀类药物可以促进EPCs的数量,因此具有[25]增强修复内皮损伤的功能。在支架植入后,可以采取口服、支架载药等方式实现他汀类145药物对受损部位内皮修复的功能。2.1.2支架载药系统的改进DES植入后的几个小时内,往往会发生药物暴释,急剧升高的局部药物浓度会对血管内膜造成损伤,同时抑制内皮细胞的生长,延迟血管受损部位再内皮化进程,导致急性血栓和亚急性血栓形成,最终导致晚期血栓和ISR。此外,DES药物涂层的刺激还会引起血管内150壁的炎症,抑制内皮的恢复。针对DES出现的上述诸多问题,国内外研究者对支架的结构、载药系统等进行设计与[26]优化,包括涂层材料优选、制备工艺、涂层及支架本体设计等。Noboru等设计出了一种不均匀涂层—外腔梯度变化涂层(abluminal-gradientCoating,AGC)。实验结果表明,相对于传统均匀满载的药物洗脱支架,该涂层结合西罗莫司支架植入兔子髂骨动脉2周后,内[27]155腔表面就已经完全被VECs覆盖,且其抗血栓效果也远优于传统药物洗脱支架。Zhu等-5-
中国科技论文在线http://www.paper.edu.cn设计了一种新颖的腔外充填生物可降解聚合物西罗莫司洗脱支架(AGF-BP-SES),虽然西罗莫司含量仅为传统DES的三分之一,但其在保有传统DES优异的机械性能之外,能较好的控制药物释放,维持安全和有效的局部药物浓度,并未出现局部或系统风险。此外,国内还设计出了一种无聚合物紫杉醇微盲孔载药支架(YINYI),其对支架本体进行了凹槽设计,160即以支架丝表面布有的微米级蜂窝状小坑携带药物,因此可有效避免聚合物引发的血管壁炎症及超敏反应,减弱了支架聚合物涂层对内皮的持续刺激,减少内皮损伤,降低晚期血栓和[28]ISR发生的风险。2.1.3生物可降解支架传统不可降解金属DES由于其不可降解性会带来一系列后遗病症及风险。生物可降解165支架在完成早期力学支撑后开始降解,既减少了支架持续支撑所导致内皮损伤,同时也解决远期支架残留对再内皮化的障碍,且降解产物可完全被人体吸收或排出体外,是一种内皮友好型血管支架。常见的可降解支架主要有可降解聚合物支架和可降解金属支架两类。目前,可降解聚合物支架使用的聚合物材料种类繁多,有聚乳酸(polylacticacid,PLA)、聚左乳酸(poly-l-lacticacid,PLLA)和聚羟基乙酸/聚乳酸共聚物(PGLA)等单一材料,也有170通过不同的配比与加工工艺融合而成的复合材料。其突出优点是生物相容性良好、降解速度[29]可调、机械性能可控、降解产物无毒且能被吸收或排出体外。可降解金属支架材料主要包括镁合金和锌合金。可降解镁合金支架具有理想的机械支撑[30]力、良好的生物相容性、新生内皮化迅速、易于降解(2-3月)等诸多优点。陈等将新型镁合金支架—MPM植入兔子腹主动脉后,支架于180d左右完全降解,该支架能为血管重175塑期管壁提供一定的支撑作用,没有造成再内皮化的延迟,能防止晚期血栓和ISR。锌合金[31]支架是近些年可降解金属支架的研究热点。Kubasek等通过配比不同锌镁含量筛选出一种Zn-0.8Mg的锌合金,其在具有优异的机械性能、合适的降解速率的同时,对L-929和人骨[32]肉瘤细胞并未显示细胞毒性,有望成为理想的血管植入材料。Bowen等采用锌丝穿刺大鼠腹主动脉的方法建立模型,进行锌合金的体内研究。实验结果显示,锌丝的植入并未产生180慢性毒性等副作用,且在植入部位其能够较好的抑制周围的平滑肌细胞活性,抑制内膜增生,具有广阔的应用前景。2.2细胞治疗以细胞种植、细胞捕获支架等为主要构想的细胞治疗法是在受损部位或支架表面种植干细胞、VECs,或是包被EPCs、MSCs的特异性捕获抗体,在SMCs增生之前先行快速修复185受损的内皮组织,促进EPCs、VECs向损伤部位动员、迁移;并释放活性因子抑制SMCs过度增生和血栓的形成。2.2.1细胞种植支架根据支架上种植细胞的种类不同,可将细胞种植支架分为VECs种植支架和干细胞种植支架两类。-6-
中国科技论文在线http://www.paper.edu.cn190VECs种植支架是将血管支架在体外培养、包覆VECs后植入体内,使得具有活性的内[33]皮细胞于受损部位促进再内皮化。Wu等构建了VEGF121过表达慢病毒载体并转染VECs,将采用超声雾化工艺喷涂明胶(0.4%)的316L不锈钢与该转染VECs旋转共培养,得到VECs种植支架,该支架可以促进血管支架植入受损部位的再内皮化过程,并且能够明显的减少新生内膜面积,具有很大的应用潜力。195干细胞种植支架将EPCs等干细胞种植或包覆起在支架表面,通过在局部分化、增殖,[34]迅速促进内皮再生来预防PCI术后的并发症。Shirota等设计了一种覆盖于微孔聚氨酯薄膜之上的固化明胶涂层支架,将其与EPCs共培养后置入人造血管组织。7d的培养结果显示,EPCs不仅覆盖于血管腔面,而且覆盖于支架腔内侧面,表明EPCs成功从支架中迁移、增[35]殖,并在支架丝和邻近血管处形成新生内皮覆盖。Hwang等设计出了一种纳米纤维支架200套管,该支架具有半透性,可以将MSCs包覆其内,通过MSCs分泌的旁分泌因子(paracrinefactors,PFs)以增强植入局部自我修复能力。动物实验结果显示,该种支架没有出现栓塞和免疫排斥反应。这无疑为干细胞种植支架提供了一个崭新的思路。2.2.2细胞捕获支架由于外周血中的EPCs、MSCs等干细胞数量非常少,自然状态下的修复十分缓慢,可205自动识别并特异性“捕捉”EPCs等干细胞的细胞捕获支架应运而生。该类血管支架包覆抗体于支架表面,可以有效捕捉外周血中的干细胞,覆盖在植入部位表面并迅速分化为内皮细[36][37]胞用于再内皮化。Wu等对CD133、CD34抗体捕获支架进行了深入研究,实验结果表明,无论在静态环境中,还是在流动剪切力加载条件下,CD133抗体涂层支架捕获EPCs的[38]能力均显著高于对照。杨等制备的雷帕霉素联合CD34抗体复合支架在体外可以有效的捕210捉内皮祖细胞;在支架植入动物体内48h后支架表面被完全覆盖,表现出了较高的捕获效率和促内皮增长的能力,具有极大的应用潜力。3展望血管内皮在冠状动脉粥样硬化性心脏病的发生、心血管支架植入后的治疗中发挥重要作用。但血管内支架植入后再内皮化进程的迟滞是导致后期一系列风险的始动环节,因此,在215支架植入后迅速再内皮化是解决血管内支架植入后血栓形成和ISR的根本方法。干细胞能在内皮损伤后的动员、归巢、迁移和分化,对修复损伤的内皮具有积极的意义,是支架植入后内皮损伤修复重要的机制。针对当下支架植入后的问题,通过构建新型促进内皮修复支架涂层、载药系统、可降解支架、细胞种植、捕获支架等方式,是促进植入部位再内皮化的有效策略(如图3)。其中生物可降解支架因其全降解性、内皮友好性,显示出巨大的优势。大220量体外、动物和临床实验已经证明了生物全降解支架的长期安全性和可靠性,相信不久的将[39]来必将取代现有不可降解药物支架成为冠状动脉介入治疗的主要手段,其无与伦比的优势必然有广大的发展空间。-7-
中国科技论文在线http://www.paper.edu.cn图3血管内支架植入后的内皮损伤及其修复策略225Fig.3Mechanismsandstrategiesofendothelialinjuryandrepairaftervascularstentimplantation[参考文献](References)[1]陈伟伟,高润霖,刘力生等.《中国心血管病报告2014》概要[J].中国循环杂志,2015(07):617-622.[2]张曌彤,李若松,胡亚娟等.浅谈国产血管支架的发展历程[J].中国医疗设备,2016(06):178-181.230[3]KAZEMIANMR,SOLOUKA,TANA,etal.Preventingin-stentrestenosisusinglipoprotein(a),lipidandcholesteroladsorbentmaterials[J].MedicalHypotheses,2015,85(6):986-988.[4]PAPAFAKLISMI,CHATZIZISISYS,NAKAKK,etal.Drug-elutingstentrestenosis:Effectofdrugtype,releasekinetics,hemodynamicsandcoatingstrategy[J].Pharmacology&Therapeutics,2012,134(1):43-53.[5]孙文博,王贺,司春婴等.内皮祖细胞对药物洗脱支架置入术后再狭窄及再内皮化影响的研究进展[J].235中国医药导报,2016(24):54-57.[6]LANH,WANGY,YINT,etal.Progressandprospectsofendothelialprogenitorcelltherapyincoronarystentimplantation[J].JournalofBiomedicalMaterialsResearchPartB-AppliedBiomaterials,2016,104(6):1237-1247.[7]SEOT,LAFONTA,CHOIS-Y,etal.Drug-ElutingStentDesignisaDeterminantofDrugConcentrationattheEndothelialCellSurface[J].AnnalsofBiomedicalEngineering,2016,44(2):302-314.240[8]VANDERHEIDENK,GIJSENFJH,NARRACOTTA,etal.Theeffectsofstentingonshearstress:relevancetoendothelialinjuryandrepair[J].CardiovascularResearch,2013,99(2):269-275.[9]WANGY-X,XIANGC,LIUB,etal.Amulti-componentparallel-plateflowchambersystemforstudyingtheeffectofexercise-inducedwallshearstressonendothelialcells.[J].Biomedicalengineeringonline,2016,15(Suppl2):154-154.245[10]HUT,YANGJ,CUIK,etal.ControlledSlow-ReleaseDrug-ElutingStentsforthePreventionofCoronaryRestenosis:RecentProgressandFutureProspects[J].AcsAppliedMaterials&Interfaces,2015,7(22):11695-11712.[11]LIUT,LIUY,CHENY,etal.Immobilizationofheparin/poly-L-lysinenanoparticlesondopamine-coatedsurfacetocreateaheparindensitygradientforselectivedirectionofplateletandvascularcellsbehavior[J].Acta250Biomaterialia,2014,10(5):1940-1954.[12]MCGINTYS,MCKEES,MCCORMICKC,etal.Releasemechanismandparameterestimationindrug-elutingstentsystems:analyticalsolutionsofdrugreleaseandtissuetransport[J].MathematicalMedicineandBiology-aJournaloftheIma,2015,32(2):163-186.[13]王亚莉,赖应龙,魏蜀亮等.心血管支架置入后血管内皮损伤的修复与再内皮化[J].中国组织工程研255究与临床康复,2009(09):1727-1730.[14]WILSONHK,CANFIELDSG,HJORTNESSMK,etal.Exploringtheeffectsofcellseedingdensityonthedifferentiationofhumanpluripotentstemcellstobrainmicrovascularendothelialcells.[J].FluidsandbarriersoftheCNS,2015,12:13-13.[15]李志海,梁亚洲,艾帅兵等.他汀类药物对药物涂层支架置入后再内皮化的影响[J].Women"sHealth260Research,2015(14):29-30.[16]DANP,VELOTE,DECOTV,etal.Theroleofmechanicalstimuliinthevasculardifferentiationofmesenchymalstemcells[J].JournalofCellScience,2015,128(14):2415-2422.[17]李军,丁文惠,唐朝枢.血管外膜与血管稳态和重构[J].中国循环杂志,2016(01):101-103.[18]YUB,WONGMM,POTTERCMF,etal.VascularStem/ProgenitorCellMigrationInducedbySmooth-8-
中国科技论文在线http://www.paper.edu.cn265MuscleCell-DerivedChemokine(C-CMotif)Ligand2andChemokine(C-X-Cmotif)Ligand1ContributestoNeointimaFormation[J].StemCells,2016,34(9):2368-2380.[19]CAMPAGNOLOP,HONGX,DIBERNARDINIE,etal.Resveratrol-InducedVascularProgenitorDifferentiationtowardsEndothelialLineageviaMiR-21/Akt/beta-CateninIsProtectiveinVesselGraftModels[J].PlosOne,2015,10(5):UNSPe0125122.270[20]白丽萍,赵志红,陈冲等.正常成人粒细胞集落刺激因子动员外周血内皮祖细胞的生物学特性[J].中国组织工程研究,2014(32):5190-5196.[21]JUNFENGL,ZHIC,ZHONGDONGD,etal.Granulocytecolony-stimulatingfactoramelioratescoronaryarteryelastinbreakdowninamousemodelofKawasakidisease[J].ChineseMedicalJournal,2014,127(21):3712-3717.275[22]安劲松.雌激素通过内皮祖细胞对冠心病保护作用的研究进展[J].内蒙古医学杂志,2015(03):318-320.[23]POHCK,SHIZ,LIMTY,etal.TheeffectofVEGFfunctionalizationoftitaniumonendothelialcellsinvitro[J].Biomaterials,2010,31(7):1578-1585.[24]SONGC-L,LIQ,YUY-P,etal.Studyofnovelcoatingstrategyforcoronarystents:simutaneouscoatingofVEGFandanti-CD34antibody[J].RevistaBrasileiraDeCirurgiaCardiovascular,2015,30(2):159-163.280[25]沈根,张顺,叶红华.他汀类药物对内皮祖细胞作用的研究进展[J].新医学,2015(12):789-793.[26]SAITON,MORIY,UCHIYAMAS.Drugdiffusionandbiologicalresponsesofarteriesusingadrug-elutingstentwithnonuniformcoating[J].MedicalDevices-EvidenceandResearch,2016,9:33-43.[27]ZHUJ,LIUH,CUIH等.Safetyandefficacyofanovelabluminalgroove-filledbiodegradablepolymersirolimus-elutingstent.[J].Journalofmaterialsscience.Materialsinmedicine,2017,28(3):54-54.285[28]张旭军.药物洗脱支架在冠状动脉介入治疗中的新进展[J].中国临床研究,2014(09):1144-1146.[29]潘兴纳,李亚雄,蒋立虹.组织工程血管支架材料的研究与进展[J].中国组织工程研究,2016(34):5149-5154.[30]陈亮,丁健,王永利等.镁合金支架植入兔腹主动脉后降解时间观察[J].介入放射学杂志,2015(11):984-987.290[31]KUBASEKJ,VOJTECHD,JABLONSKAE,etal.Structure,mechanicalcharacteristicsandinvitrodegradation,cytotoxicity,genotoxicityandmutagenicityofnovelbiodegradableZn-Mgalloys[J].MaterialsScience&EngineeringC-MaterialsforBiologicalApplications,2016,58:24-35.[32]BOWENPK,GUILLORYRJ,SHEARIERER,etal.Metalliczincexhibitsoptimalbiocompatibilityforbioabsorbableendovascularstents[J].MaterialsScience&EngineeringC-MaterialsforBiologicalApplications,2952015,56:467-472.[33]WUX,ZHAOY,TANGC,etal.Re-EndothelializationStudyonEndovascularStentsSeededbyEndothelialCellsthroughUp-orDownregulationofVEGF[J].AcsAppliedMaterials&Interfaces,2016,8(11):7578-7589.[34]SHIROTAT,YASUIH,SHIMOKAWAH,etal.Fabricationofendothelialprogenitorcell(EPC)-seededintravascularstentdevicesandinvitroendothelializationonhybridvasculartissue[J].Biomaterials,2003,24(13):3002295-2302.[35]HWANGC-W,JOHNSTONPV,GERSTENBLITHG,etal.Stemcellimpregnatednanofiberstentsleeveforon-stentproductionandintravasculardeliveryofparacrinefactors[J].Biomaterials,2015,52:318-326.[36]WOUDSTRAP,DEWINTERRJ,BEIJKMA.Next-generationDES:theCOMBOdualtherapystentwithGenousendothelialprogenitorcapturingtechnologyandanabluminalsirolimusmatrix[J].ExpertReviewof305MedicalDevices,2014,11(2):121-135.[37]WUX,YINT,TIANJ,etal.DistinctiveeffectsofCD34-andCD133-specificantibody-coatedstentsonre-endothelializationandin-stentrestenosisattheearlyphaseofvascularinjury.[J].Regenerativebiomaterials,2015,2(2):87-96.[38]杨峰,赵骞,张世轩等.雷帕霉素联合CD34抗体复合支架快速捕获外周血中内皮祖细胞[J].中国组织310工程研究,2015(41):6694-6698.[39]李禄丰,刘焕云,赵晓辉.可降解冠状动脉支架的应用现状[J].中国组织工程研究,2014(08):1270–1276.-9-'
您可能关注的文档
- 肉桂酸小檗红碱酯的合成及抗炎活性.pdf
- 肉瘤样癌转化:一种少见的肺腺癌EGFR靶向治疗耐药表现.pdf
- 胶粘剂对异种镁合金激光胶焊热作用过程的影响机制.pdf
- 脑心通胶囊干预局灶性脑缺血大鼠基因表达谱研究.pdf
- 苯并芘(BaP)对栉孔扇贝生殖毒性效应的研究.pdf
- 茶条槭果酚酸含量、种类及体外生物活性的测定.pdf
- 药物纳米结晶的固体化方法以及产品性质的影响因素.pdf
- 蚀变岩型金矿尾矿火山灰性能的活化及应用研究.pdf
- 蛋白质NEDD化修饰的研究进展及展望.pdf
- 调节性B细胞对1,3-β-葡聚糖所致过敏性肺炎的调控作用.pdf
- 调速型磁力耦合器气隙特性研究.pdf
- 超临界二氧化碳、氮气和水的射流应力特性研究.pdf
- 超导磁浮危险物质输运系统屏蔽层性能研究.pdf
- 转移机构设计及其运动规律研究.pdf
- 近百年全球平均海平面变化重构研究进展与分析.pdf
- 近红外二区生物成像材料研究进展.pdf
- 适应于SiC BJT的双电源驱动电路的优化设计.pdf
- 针铁矿-细菌-腐殖酸复合体对Pb的吸附行为研究.pdf
相关文档
- 施工规范CECS140-2002给水排水工程埋地管芯缠丝预应力混凝土管和预应力钢筒混凝土管管道结构设计规程
- 施工规范CECS141-2002给水排水工程埋地钢管管道结构设计规程
- 施工规范CECS142-2002给水排水工程埋地铸铁管管道结构设计规程
- 施工规范CECS143-2002给水排水工程埋地预制混凝土圆形管管道结构设计规程
- 施工规范CECS145-2002给水排水工程埋地矩形管管道结构设计规程
- 施工规范CECS190-2005给水排水工程埋地玻璃纤维增强塑料夹砂管管道结构设计规程
- cecs 140:2002 给水排水工程埋地管芯缠丝预应力混凝土管和预应力钢筒混凝土管管道结构设计规程(含条文说明)
- cecs 141:2002 给水排水工程埋地钢管管道结构设计规程 条文说明
- cecs 140:2002 给水排水工程埋地管芯缠丝预应力混凝土管和预应力钢筒混凝土管管道结构设计规程 条文说明
- cecs 142:2002 给水排水工程埋地铸铁管管道结构设计规程 条文说明