- 614.63 KB
- 2022-04-22 13:45:30 发布
- 1、本文档共5页,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报电话:19940600175。
'中国科技论文在线http://www.paper.edu.cn调节性B细胞对1,3-β-葡聚糖所致过敏性#肺炎的调控作用*刘芳炜,陆晓微5(中国医科大学公共卫生学院,沈阳110122)摘要:【目的】研究调节性B细胞对1,3-β-葡聚糖所致过敏性肺炎的调控作用。【方法】成年C57BL/6小鼠,按体重随机分配至对照组,葡聚糖组和Breg消除组。葡聚糖组和Breg消除组小鼠行非暴露式气管灌注1,3-β-葡聚糖溶液。Breg消除组小鼠腹腔注射anti-CD22单10克隆抗体以消除小鼠体内Breg。灌注后1、7、21天,处死小鼠,收集肺组织及肺泡灌洗液,制作肺组织病理切片并镜下观察,应用CBA及realtimePCR检测IL-2的蛋白及基因水平。【结果】Breg消除组小鼠肺组织炎症病理改变加重;Breg消除组小鼠IL-2的表达及分泌水平显著高于葡聚糖组小鼠。【结论】调节性B细胞通过影响IL-2的水平调控小鼠过敏性肺炎的病理进程。15关键词:调节性B细胞;1,3-β-葡聚糖;过敏性肺炎中图分类号:R135.2ThemodulationofregulatoryBcellon1,3-β-glucaninducedlunginflammation20LIUFangwei,LUXiaowei(SchoolofPublicHealth,ChinaMedicalUniversity,Shenyang110122)Abstract:[Objective]ToobservetheeffectofregulatoryBcells(Breg)on1,3-β-glucaninducedhypersensitivitypneumonitis.[Methods]AdultfemaleC57BL/6miceweredividedinto3groups:controlgroup,glucangroupandBregdepletiongroup.MiceinglucangroupandBregdepletiongroup25received1,3-β-glucansuspensionintratracheally.TodepleteBreg,miceinBregdepletiongroupwereinjectedintraperitoneallywith300μganti-CD22Abonedaybeforetheglucanexposure.Miceweresacrificedat1,7or21daysafter1,3-β-glucanexposure.Bronchoalveolarlavagefluidandlungtissueswereobtained.ThepathologicalchangewasobservedinmicelungsandthesecretionandexpressionofcytokinesIL-2wereexamined.[Results]MiceinBregdepletiongroupdemonstratedseverer30inflammatorychangescomparedwithglucangroup.ThesecretionandexpressionofIL-2inBregdepletionmiceincreasedsignificantlycomparedwiththatincontrolgroupandglucangroup(p<0.05).[Conclusion]BregregulatedthepathologicalchangesinmicelungthroughinhibitingthelevelofIL-2.Keywords:regulatoryBcells1;1,3-β-glucan2;hypersensitivitypneumonitis3350引言在职业环境中吸入被污染的有机粉尘而引起的以肺组织间质细胞浸润和肉芽肿形成为基本病理改变特征的疾病,称为职业性过敏性肺炎。随着现代工农业的不断发展,劳动环境[1-6]中有机粉尘的种类越来越复杂,常含有多种致病微生物,其中高浓度真菌污染较为常见。真菌细胞壁的主要结构成分中包含1,3-β-葡聚糖,是公认的职业环境中真菌暴露的生物标志40物。研究1,3-β-葡聚糖在过敏性肺炎中的作用及其免疫调控机制,对于治疗过敏性肺炎及预防肺组织肉芽肿样纤维化的发生具有重要的现实意义。1,3-β-葡聚糖进入机体后被巨噬细胞识别,促进巨噬细胞活化,并通过抗原提呈作用活基金项目:教育部博士学科点专项科研基金(新教师基金)(20132104120011)作者简介:刘芳炜(1983年-),女,副教授,主要研究方向:职业性肺疾病.E-mail:fwliu@cmu.edu.cn-1-
中国科技论文在线http://www.paper.edu.cn[7-10]化初始T淋巴细胞分化为效应T淋巴细胞,表达包括特异性的细胞因子。实验研究证实,1,3-β-葡聚糖暴露早期肺组织炎性细胞因子IL-12p35、IL-2、IFN-γ和IL-6含量明显增加,[11,12]45Th1型细胞免疫应答增强。我们前期的研究结果表明,在过敏性肺炎的发展过程中Th1型免疫应答发挥了重要作用,以IL-2为代表的Th1型细胞因子的水平可显著影响过敏性肺炎的病理进程。调节性B细胞(regulatoryBcells,Breg)是一类新近发现对T细胞免疫应答发挥调控作[13][14,15]用的功能性B细胞亚群。Breg主要通过分泌IL-10发挥免疫调节作用。静息状态下50的B细胞并不能组成性的分泌IL-10,需要一定的活化刺激信号后分化发育为产生IL-10的[13]效应性B10细胞。IL-10可以抑制巨噬细胞和树突状细胞活化及分泌促炎细胞因子,抑制[16]CD4+T细胞增殖及分泌IFN-γ、TNF-α,进而抑制Th1和Th17细胞分化。目前,在自身免疫性疾病,移植耐受、肿瘤免疫及感染免疫的研究中都发现Breg的数量和功能都有不同[17]程度的变化,而Breg对于疾病的发生发展和结局影响的程度尚需进一步研究。55我们拟利用小鼠1,3-β-葡聚糖所致肺部炎症模型,通过建立Breg消除小鼠,研究Breg对1,3-β-葡聚糖所致肺部炎症病理过程动态发展的影响,分析Breg对肺部炎症免疫应答的调控作用。旨在为职业性免疫性肺疾病的预防和控制提供新的理论依据。1材料与方法1.1实验动物及分组60C57BL/6小鼠,健康雌性,体重16±2g,6-8周龄,购自上海斯莱克实验动物有限公司。动物喂饲采用自由饮水摄食,相对湿度为45%~55%,环境温度为18~25℃,灭菌营养饲料由中国医科大学实验动物中心提供。将实验小鼠按体重排序后随机分为3组:对照组、葡聚糖组、Breg消除组。葡聚糖组和Breg消除组小鼠行非暴露式气管灌注1,3-β-葡聚糖(ZymosanA,Sigma)悬液(0.3mg/0.05ml,pH7.3),对照组给予等体积生理盐水。Breg消除65组小鼠于灌注前1天腹腔注射300μganti-CD22mAb,隔周复打,消除小鼠体内Breg。各组小鼠于1、7、21天处死,取小鼠仰卧位,暴露胸腔,称重肺组织。使用14号钝性注射针头插入气管内,并用缝线结扎固定,用1ml规格注射器将1ml4℃生理盐水经针头缓慢注入肺内,30s后将灌洗液抽回,收集到1.5mlEP管内,4℃1500rpm离心8min。收集肺泡灌洗液上清(bronchoalveolarlavagefluid,BALF)用于细胞因子的测定。切取肺组织,70液氮速冻于1.5mlEP管,-80℃保存用于测定肺组织细胞因子基因表达含量。1.2Masson染色病理学检测病理切片染色动态观察1,3-β-葡聚糖所致肺部炎症病理过程及特征:将不同时间点各组动物左肺固定、石蜡包埋后制成6μm石蜡切片,采用Masson染色,镜下观察肺组织病理改变的动态病理过程。751.3CBA检测蛋白表达水平微量样本蛋白定量技术CBA(cytometricbeadarray),分别将等比稀释后的标准品与待-2-
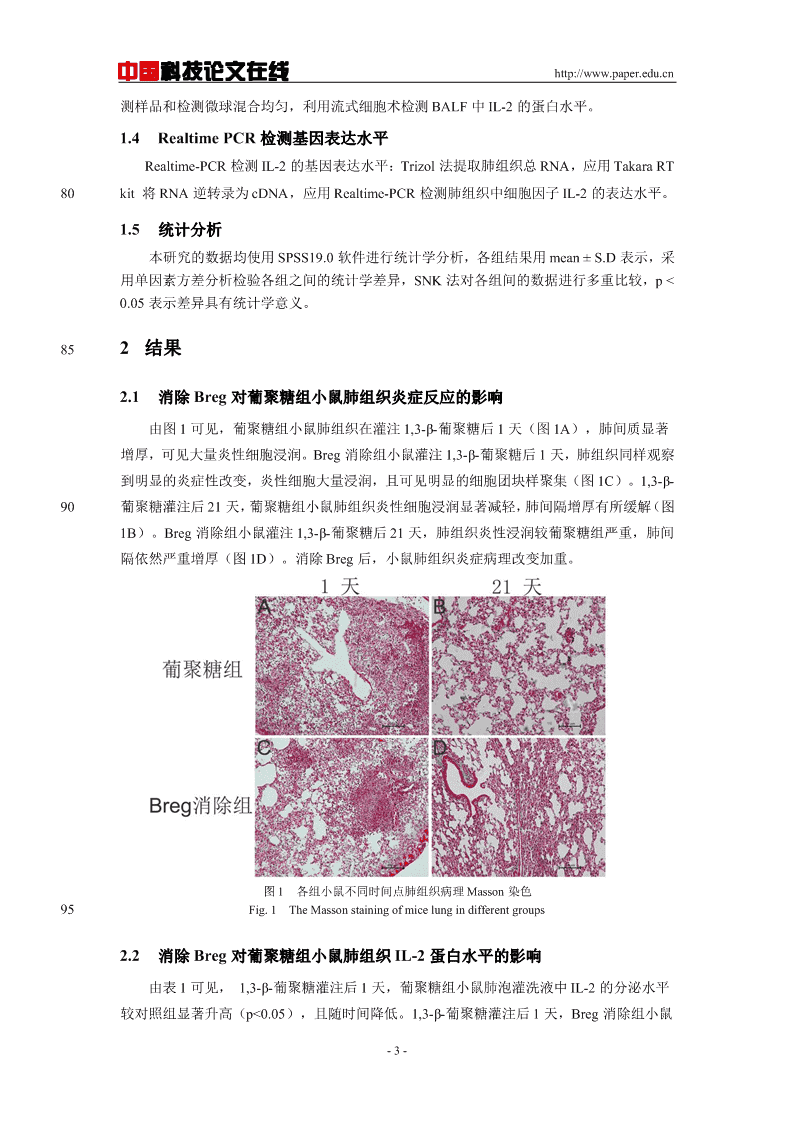
中国科技论文在线http://www.paper.edu.cn测样品和检测微球混合均匀,利用流式细胞术检测BALF中IL-2的蛋白水平。1.4RealtimePCR检测基因表达水平Realtime-PCR检测IL-2的基因表达水平:Trizol法提取肺组织总RNA,应用TakaraRT80kit将RNA逆转录为cDNA,应用Realtime-PCR检测肺组织中细胞因子IL-2的表达水平。1.5统计分析本研究的数据均使用SPSS19.0软件进行统计学分析,各组结果用mean±S.D表示,采用单因素方差分析检验各组之间的统计学差异,SNK法对各组间的数据进行多重比较,p<0.05表示差异具有统计学意义。852结果2.1消除Breg对葡聚糖组小鼠肺组织炎症反应的影响由图1可见,葡聚糖组小鼠肺组织在灌注1,3-β-葡聚糖后1天(图1A),肺间质显著增厚,可见大量炎性细胞浸润。Breg消除组小鼠灌注1,3-β-葡聚糖后1天,肺组织同样观察到明显的炎症性改变,炎性细胞大量浸润,且可见明显的细胞团块样聚集(图1C)。1,3-β-90葡聚糖灌注后21天,葡聚糖组小鼠肺组织炎性细胞浸润显著减轻,肺间隔增厚有所缓解(图1B)。Breg消除组小鼠灌注1,3-β-葡聚糖后21天,肺组织炎性浸润较葡聚糖组严重,肺间隔依然严重增厚(图1D)。消除Breg后,小鼠肺组织炎症病理改变加重。图1各组小鼠不同时间点肺组织病理Masson染色95Fig.1TheMassonstainingofmicelungindifferentgroups2.2消除Breg对葡聚糖组小鼠肺组织IL-2蛋白水平的影响由表1可见,1,3-β-葡聚糖灌注后1天,葡聚糖组小鼠肺泡灌洗液中IL-2的分泌水平较对照组显著升高(p<0.05),且随时间降低。1,3-β-葡聚糖灌注后1天,Breg消除组小鼠-3-
中国科技论文在线http://www.paper.edu.cn100肺泡灌洗液中IL-2的分泌水平也显著升高(p<0.05)。1,3-β-葡聚糖灌注后7、21天,Breg消除组小鼠肺泡灌洗液中IL-2的表达水平较对照组和葡聚糖组均显著升高(p<0.05)。表1各组小鼠不同时间点IL-2蛋白分泌水平(皮克/毫克)Tab.1TheconcentrationsofIL-2inBALFofmice(pg/ml)1天7天28天对照组1.4667±0.17591.5300±0.17001.6467±0.1557葡聚糖组2.0967±0.1704*1.5300±0.03001.6367±0.2759,,Breg消除组2.1067±0.1629*2.0567±0.0924***2.2033±0.1286***注:*,与同时间点对照组比,p<0.05;**与同时间点葡聚糖组比,p<0.05。1052.3消除Breg对葡聚糖组小鼠肺组织IL-2基因水平的影响由表2可见,1,3-β-葡聚糖灌注后1、21天,葡聚糖组小鼠肺组织中IL-2的表达水平较对照组显著升高(p<0.05)。1,3-β-葡聚糖灌注后1、21天,Breg消除组小鼠肺组织中IL-2的表达水平也显著升高(p<0.05)。1,3-β-葡聚糖灌注后7天,Breg消除组小鼠肺组织中IL-2的表达水平较对照组和葡聚糖组均显著升高(p<0.05)。110表2各组小鼠不同时间点IL-2基因表达水平Tab.2TherelativeexpressionofIL-2inlungofmice)1天7天28天对照组0.000117±0.0000470.000232±0.0000560.000212±0.000043葡聚糖组0.000211±0.000031*0.000326±0.0000420.000519±0.000055*,Breg消除组0.000235±0.000032*0.000471±0.000097***0.000623±0.000166*注:*,与同时间点对照组比,p<0.05;**与同时间点葡聚糖组比,p<0.05。3讨论Breg约占B细胞的3%,在抑制抗原特异性炎症反应和自身免疫病的发生中有着极为重[18-20]115要的作用。动物实验证实anti-CD22mAb可以有效消除小鼠体内Breg,其机制是anti-CD22mAb阻断了CD22与配体的结合,由于CD22的激活对于Breg在淋巴组织的存活[21,22]至关重要,因此应用anti-CD22mAb可以通过诱导凋亡机制来达到消除Breg的目的。[23]Bregs在许多炎症性疾病中具有明显的抑制炎症作用。到目前为止,Breg细胞的调节功能在自身免疫、移植耐受、抗肿瘤免疫和炎症中都有描述。在自身免疫模型中,Breg细[24,25]120胞消除恶化疾病,而B细胞输入能抑制这种疾病的有害表现。本研究利用anti-CD22消除小鼠Breg后,发现小鼠肺组织IL-2的基因和蛋白的表达水平较葡聚糖小鼠显著升高。且观察到小鼠肺组织炎性细胞浸润程度增加,炎性改变持续时间延长。体内研究显示,Breg对T淋巴细胞的调节是其抑制炎症最主要的途径。Breg通过分泌IL-10调控T细胞介导的[26][27]炎症反应,一方面可以抑制单核细胞和巨噬细胞分泌促炎性细胞因子;另一方面,通[28]125过抑制单核细胞和树突细胞的抗原提呈能力抑制抗原特异性CD4+T细胞的增殖。体外实验证明,Breg可以显著减少CD4+T细胞分泌细胞因子的能力;此外,Breg可以下调树突[29]细胞的抗原提呈能力,因此间接调节T细胞增殖。同时,Breg通过抑制树突细胞分泌促[30]炎性细胞因子来抑制Th1分化。在本研究中,消除Breg促进Th1特异性细胞因子IL-2的分泌。由此我们可以看出,Breg通过抑制Th1型细胞因子IL-2的表达及分泌,进而减轻130肺组织炎症性改变。-4-
中国科技论文在线http://www.paper.edu.cn4结论本文发现调节性B细胞通过影响IL-2的水平调控小鼠过敏性肺炎的病理进程。[参考文献](References)135[1]RylanderR.Organicdustsanddisease:acontinuousresearchchallenge.AmJIndMed,2004,46(4):323-326.[2]ChenJ,LiuZ,ShiJ,etal.Environmentalmycologicalstudyandrespiratorydiseaseinvestigationinfur-processingworkers.JOccupHealth,2003,45:238-241.[3]ChenJ,ShiJ,etal.Environmentalmycologicalstudyandrespiratorydiseaseinvestigationintussahsilkprocessingworkers.JOccupHealth,2004,46:418-422.140[4]ZhangYX,ChenJ,ChenY,etal.Environmentalmycologicalstudyandallergicrespiratorydiseaseamongtobaccoprocessingworkers.JOccupHealth,2005,47:181-187.[5]HeldalKK,HalstensenAS,ThornJ,etal.Upperairwayinflammationinwastehandlersexposedtobioaerosols.OccupEnvironMed,2003,60:444-450.[6]SigsgaardT,Bonefeld-JorgensenEC,HoffmannHJ,etal.Microbialcellwallagentsasanoccupationalhazard.145ToxicolApplPharmacol,2005,207(2Suppl):310-319.[7]LaurenM.Lilly,MelissaA.Gessner,ChadW.Dunaway,etal.Theb-Glucanreceptordectin-1promoteslungimmunopathologyduringfungalallergyviaIL-22.JournalofImmunology,2012Oct1,189(7):3653-60.[8]BrownGD.Innateantifungalimmunity:Thekeyroleofphagocytes.AnnuRevImmunol,2011,29:1-21.[9]DrummondRA,BrownGD.Theroleofdectin-1inthehostdefenceagainstfungalinfections.CurrentOpinion150Microbiology,2011Aug,14(4):392-9.[10]WernerJL,MetzAE,HornD,etal.Requisiteroleforthedectin-1beta-glucanreceptorinpulmonarydefenseagainstAspergillusfumigatus.JImmunol,2009,182:4938-4946.[11]YoungSH,JennyR,JamesMA.Pulmonaryexposureto1→3-β-glucanaltersadaptiveimmuneresponsesinrats.InhalationToxicology,2006,18:865-874.155[12]LiuFangwei,WengDong,ChenYing,etal.DepletionofCD4+CD25+Foxp3+regulatoryTcellswithanti-CD25antibodymayexacerbatethe1,3-b-glucaninducedlunginflammatoryresponseinmice.ArchToxicol,2011,85:1383-1394.[13]RiesS,HilgenbergE,LampropoulouV,eta1.B-typesuppression:aroleplayedbyregulatoryBcellsorregulatoryplasmacells?.EurJImmunol,2014,44(5):1251-1257.160[14]KalampokisI,YoshizakiA,TedderTF.IL-10-producingregulatoryBcells(B10cells)inautoimmunedisease.ArthritisResTher,2013,15Suppl1:S1.[15]BouasizJD,YanabaK,TedderTF.RegulatoryBcellsasinhibitorsofimmuneresponsesandinflammation.ImmunolRev,2008,224:201-214.[16]Flores-BorjaF,BosmaA,NgD,eta1.CDl9+CD24hiCD38hiBcellsmaintainregulatoryTcellswhile165limitingThlandThl7differentiation.SciTranslMed,2013,5:173ra23.[17]CoelhoV,SaitovitchD,KalilJ,etal.RethinkingthemultiplerolesofBcellsinorgantransplantation.CurrOpinOrganTransplant,2013,18(1):13-21.[18]MatsushitaT,YanabaK,BouazizJ-D,etal.RegulatoryBcellsinhibitEAEinitiationinmicewhileotherBcellspromotediseaseprogression[J].JClinInvest,2008,118(10):3420-3430.170[19]HaasKM,WatanabeR,MatsushitaT,etal.ProtectiveandpathogenicrolesforBcellsduringsystemicautoimmunityinNZB/WF1mice[J].JImmunol,2010,184(9):4789-4800.[20]WatanabeR,IshiuraN,NakashimaH,etal.RegulatoryBcells(B10cells)haveasuppressiveroleinmurinelupus:CD19andB10celldeficiencyexacerbatessystemicautoimmunity[J].JImmunol,2010,184(9):4801-4809.175[21]HaasKM,SenS,SanfordIG,etal.CD22ligandbindingregulatesnormalandmalignantBlymphocytesurvivalinvivo[J].JImmunol,2006,177(5):3063-3073.[22]PoeJC,FujimotoY,HasegawaM,etal.CD22regulatesBlymphocytefunctioninvivothroughbothligand-dependentandligand-independentmechanisms[J].NatImmunol,2004,5(10):1078-1087.[23]MauriC,EhrensteinMR.The"short"historyofregulatoryBcells[J].TrendsImmunol.2008,29(1):34-40.180[24]RenX,AkiyoshiK,DziennisS,etal.RegulatoryBcellslimitCNSinflammationandneurologicdeficitsinmurineexperimentalstroke.JNeurosci,2011Jun8,31(23):8556-63.[25]CarterNA,VasconcellosR,RosserEC,etal.MicelackingendogenousIL-10-producingregulatoryBcellsdevelopexacerbateddiseaseandpresentwithanincreasedfrequencyofTh1/Th17butadecreaseinregulatoryTcells[J].JImmunol,2011,186:5569-79.185[26]YanabaK,BouazizJ-D,HaasKM,etal.AregulatoryBcellsubsetwithauniqueCD1dhiCD5+phenotypecontrolsTcell-dependentinflammatoryresponses[J].Immunity,2008,28(5):639-650.[27]AsadullahK,SterryW,VolkH.Interleukin-10therapy-reviewofanewapproach[J].PharmacolRev,2003,55(2):241-269.[28]O"ConnorRA,MalpassKH,AndertonSM.Theinflamedcentralnervoussystemdrivestheactivationand-5-
中国科技论文在线http://www.paper.edu.cn190rapidproliferationofFoxp3+regulatoryTcells[J].JImmunol,2007,179(2):958-966.[29]MatsushitaT,HorikawaM,IwataY,etal.RegulatoryBcells(B10cells)andregulatoryTcellshaveindependentrolesincontrollingexperimentalautoimmuneencephalomyelitisinitiationandlate-phaseimmunopathogenesis[J].JImmunol,2010,185(4):2240-2252.[30]MatsumotoM,BabaA,YokotaT,etal.Interleukin-10-producingplasmablastsexertregulatoryfunctionin195autoimmuneinflammation[J].Immunity,2014,41(6):1040-1051.-6-'
您可能关注的文档
- 肉瘤样癌转化:一种少见的肺腺癌EGFR靶向治疗耐药表现.pdf
- 胶粘剂对异种镁合金激光胶焊热作用过程的影响机制.pdf
- 脑心通胶囊干预局灶性脑缺血大鼠基因表达谱研究.pdf
- 苯并芘(BaP)对栉孔扇贝生殖毒性效应的研究.pdf
- 茶条槭果酚酸含量、种类及体外生物活性的测定.pdf
- 药物纳米结晶的固体化方法以及产品性质的影响因素.pdf
- 蚀变岩型金矿尾矿火山灰性能的活化及应用研究.pdf
- 蛋白质NEDD化修饰的研究进展及展望.pdf
- 血管内支架植入后的内皮损伤及其修复策略.pdf
- 调速型磁力耦合器气隙特性研究.pdf
- 超临界二氧化碳、氮气和水的射流应力特性研究.pdf
- 超导磁浮危险物质输运系统屏蔽层性能研究.pdf
- 转移机构设计及其运动规律研究.pdf
- 近百年全球平均海平面变化重构研究进展与分析.pdf
- 近红外二区生物成像材料研究进展.pdf
- 适应于SiC BJT的双电源驱动电路的优化设计.pdf
- 针铁矿-细菌-腐殖酸复合体对Pb的吸附行为研究.pdf
- 锁掷酵母油对血脂异常小鼠脂代谢影响的研究.pdf
相关文档
- 施工规范CECS140-2002给水排水工程埋地管芯缠丝预应力混凝土管和预应力钢筒混凝土管管道结构设计规程
- 施工规范CECS141-2002给水排水工程埋地钢管管道结构设计规程
- 施工规范CECS142-2002给水排水工程埋地铸铁管管道结构设计规程
- 施工规范CECS143-2002给水排水工程埋地预制混凝土圆形管管道结构设计规程
- 施工规范CECS145-2002给水排水工程埋地矩形管管道结构设计规程
- 施工规范CECS190-2005给水排水工程埋地玻璃纤维增强塑料夹砂管管道结构设计规程
- cecs 140:2002 给水排水工程埋地管芯缠丝预应力混凝土管和预应力钢筒混凝土管管道结构设计规程(含条文说明)
- cecs 141:2002 给水排水工程埋地钢管管道结构设计规程 条文说明
- cecs 140:2002 给水排水工程埋地管芯缠丝预应力混凝土管和预应力钢筒混凝土管管道结构设计规程 条文说明
- cecs 142:2002 给水排水工程埋地铸铁管管道结构设计规程 条文说明