- 655.28 KB
- 2022-04-22 13:44:37 发布
- 1、本文档共5页,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报电话:19940600175。
'中国科技论文在线http://www.paper.edu.cn拟南芥丝裂原活化蛋白激酶MPK3/MPK6#参与调控ProPEPs基因的表达**李森,徐娟5(浙江大学生命科学学院,杭州310058)摘要:机械性损伤是植物生存面临的重要威胁之一。在拟南芥中,植物激发子多肽Peps是植物受损部位产生的一类防御性物质,它们能增强植物的防御反应。目前,关于这些植物多肽的调控仍是未知。这里,我们阐明了丝裂原活化的蛋白激酶MPK3/MPK6参与调控Peps前10体ProPEPs的基因表达。在条件诱导性过表达激活MPK3/MPK6时,ProPEPs基因的表达明显上调,但MPK3或MPK6的功能缺失会不同程度地降低ProPEPs基因的表达。位于MPK3/MPK6下游的转录因子WRKY33参与调控ProPEPs基因的表达。WRK33的突变能降低葡萄孢菌诱导的ProPEPs基因表达。然而,Peps处理诱导的乙烯生成,则独立于MAPK级联途径。关键词:丝裂原活化的蛋白激酶;植物激发子多肽;转录因子15中图分类号:Q945Mitogen-activatedproteinkinasesMPK3andMPK6areinvolvedintheregulationofProPEPsgenesexpressioninArabidopsis20LiSen,XuJuan(CollegeofLifeSciences,ZhejiangUniversity,Hangzhou310058)Abstract:Mechnicalinjuryarechallengingthreatsofplantsurvival.InArabidopsis,plantelicitorpeptides(Peps)areonekindofdefensepeptidesproducedinthewoundedplanttissues.Thesepeptidescanenhancetheplantdefenseresponses.However,theregulatorymechanismsofthese25peptidesremainunclear.Inthispaper,werevealedthatmitogen-activatedproteinkinasesMPK3/MPK6areinvolvedintheregulationofPepsprecursorsProPEPsgenesexpression.IntheconditionalinducedactivationofMPK3/MPK6system,theexpressionofProPEPsgenesarehighlyinduced.ThemutationofMPK3orMPK6reducestheexpressionofProPEPsgenes.WRKY33,atranscriptionfactordownstreamofMPK3/MPK6isalsoinvolvedintheexpression30ofProPEPsgenes.MutationofWRKY33cancompromisetheinducedexpressionofProPEPstriggeredbyBotrytiscinerea.Furthermore,wefoundthatPeps-inducedethyleneproductionisindependentofMPK3/MPK6cascade.Keywords:mitogen-activatedproteinkinase;plantelicitorpeptides;transcriptionfactor350引言丝裂原活化的蛋白激酶(MAPK)是真核生物中高度保守的信号通路之一,在细胞的生长、分化和应对胁迫反应中发挥重要作用。植物在受到外界环境刺激时,细胞内的MAPK信号通路被迅速激活,并将细胞表面感受到的信号传导到下游,从而启动一系列的生理反应,1-4来应对外界环境的变化。一个典型的MAPK级联途径通常包括三级激酶,即丝裂原活化40的蛋白激酶激酶激酶(MAPKKK)、丝裂原活化的蛋白激酶激酶(MAPKK)和丝裂原活化的蛋白激酶(MAPK)。最上游的MAPKKK通常在细胞感受到外界刺激后被激活,然后通过磷酸化下游的MAPKK保守结构域上的丝氨酸和苏氨酸来激活MAPKK。激活后的基金项目:教育部博士点专项科研基金新教师类项目(20130101120191)作者简介:李森,(1988年),男,博士研究生,植物细胞信号转导通信联系人:徐娟,(1984),女,副研究员,植物细胞信号转导.E-mail:xujuan@zju.edu.cn-1-
中国科技论文在线http://www.paper.edu.cn5MAPKK进一步通过磷酸化MAPK上的苏氨酸和酪氨酸来激活MAPK。受激活的MAPK,在不同的外界刺激下,能够磷酸化不同的底物。目前已知的MAPK下游底物包括转录因子6-945WRKY33、WRKY34、ERF6和SPEECHLESS等。这些转录因子进而起始相关基因的表达,从而对外界刺激作出响应。植物,作为固着生物,常受到食草动物的咀嚼或外界的机械性损伤。已知在植物受损伤10-11的部位,产生一类被称作伤害相关的分子模式(DAMPs)的植物激发子多肽(Peps)。这类多肽能被位于细胞膜表面的模式识别受体(PatternRecognitionReceptors)PEPR1和12-1350PEPR2所识别。在拟南芥中,这类多肽有八个家族成员。其中Pep1、Pep2和Pep3参14-16与放大植物的免疫反应,能够增强植物的抗病性。在玉米中也发现了Pep1的同源基因,17并且同样以增强植物免疫反应,说明了这类多肽在物种间的功能保守性。然而,关于这18-19些多肽的调控,鲜有报道。此外,Peps的处理能够诱导植物激素乙烯的合成,但关于其调控则并不清楚。而MAPK级联途径在转录和翻译后修饰双重水平上调控病原菌葡萄孢菌20-2255诱导的乙烯生成。本研究以拟南芥(Arabidopsisthaliana)为对象,利用功能缺失性和功能获得性材料,通过定量PCR发现丝裂原活化的蛋白激酶MPK3/MPK6参与调控Peps前体基因ProPEPs的表达。WRKY33,位于MPK3/MPK6下游的转录因子,也参与调控葡萄孢菌侵染诱导的ProPEPs基因表达。但Peps处理诱导的乙烯生成,则独立于MAPK级联途径,说明MAPK级联并不参与Peps处理诱导的乙烯合成。601材料与方法1.1实验材料拟南芥(Arabidopsisthaliana)所有植株背景均为Col-0,突变体从美国拟南芥生物资源o中心(ABRC)订购,并鉴定出纯合株系。种子经表面灭菌后,在4C春化3-4天,然后播种在含有50mL1/2MurashigeSkoog液体培养基的培养皿中,放在Percival光照培养箱生长。o-2-165培养条件:温度23C;光照24小时连续光照;光照强度为70µmolS。培养6天后,将小苗转移到20-mL的透明气相色谱瓶中,每瓶6mL液体培养基,10颗小苗,继续培养6天。1.2实验方法葡萄孢菌的培养及处理:葡萄孢菌(Botrytiscinerea)的孢子悬浊液在PDA(Potato70DextroseAgar)培养基上培养12天后,用无菌水将孢子收集起来。通过血球计数板计算出5孢子浓度,然后每瓶样品中加入4.0×10个孢子。在不同的时间点取样,在液氮中速冻,然o后将样品贮藏在-80C冰箱。DDDD地塞米松的处理:在液体培养基中生长12天的拟南芥幼苗NtMEK2,NtMEK2/mpk3DD和NtMEK2/mpk6,加入地塞米松(Dex)处理,终浓度为1µM。然后在各时间点取样,o75在液氮中速冻,然后贮藏于-80C。RNA的提取,反转录和定量PCR:根据TRIzol生产商Invitrogen的产品说明指导,提取样品的总RNA。然后,1µg的总RNA用于反转录。反转录后的cDNA稀释20倍,然后-ΔΔCt用作定量PCR的模板。定量PCR结果用2进行分析。乙烯的测定:在液体培养基生长12-天的拟南芥幼苗,用30nM(终浓度)的Pep1、Pep280和Pep3处理,相同浓度的flg22用作对照。然后换上带上硅胶垫的帽子,放置在相同条件下生长。分别在3h,6h,12h和24h时,用气相色谱(岛津GC-2014)测定乙烯含量。-2-
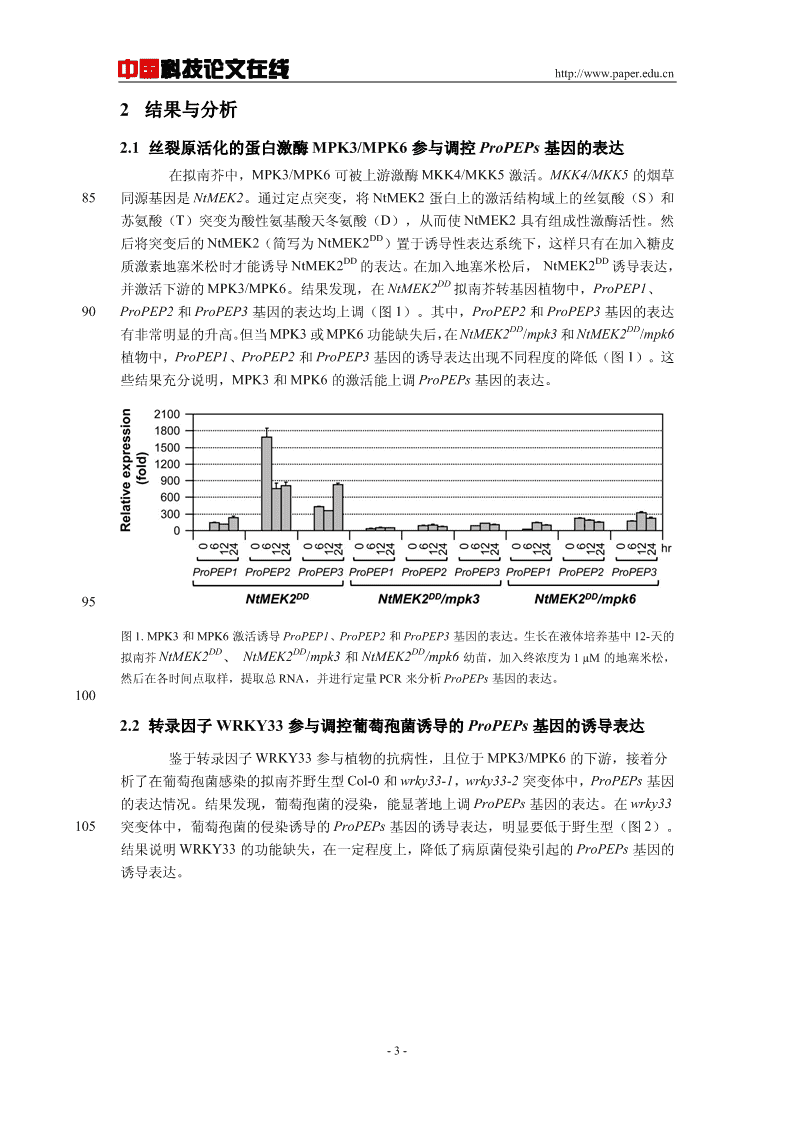
中国科技论文在线http://www.paper.edu.cn2结果与分析2.1丝裂原活化的蛋白激酶MPK3/MPK6参与调控ProPEPs基因的表达在拟南芥中,MPK3/MPK6可被上游激酶MKK4/MKK5激活。MKK4/MKK5的烟草85同源基因是NtMEK2。通过定点突变,将NtMEK2蛋白上的激活结构域上的丝氨酸(S)和苏氨酸(T)突变为酸性氨基酸天冬氨酸(D),从而使NtMEK2具有组成性激酶活性。然DD后将突变后的NtMEK2(简写为NtMEK2)置于诱导性表达系统下,这样只有在加入糖皮DDDD质激素地塞米松时才能诱导NtMEK2的表达。在加入地塞米松后,NtMEK2诱导表达,DD并激活下游的MPK3/MPK6。结果发现,在NtMEK2拟南芥转基因植物中,ProPEP1、90ProPEP2和ProPEP3基因的表达均上调(图1)。其中,ProPEP2和ProPEP3基因的表达DDDD有非常明显的升高。但当MPK3或MPK6功能缺失后,在NtMEK2/mpk3和NtMEK2/mpk6植物中,ProPEP1、ProPEP2和ProPEP3基因的诱导表达出现不同程度的降低(图1)。这些结果充分说明,MPK3和MPK6的激活能上调ProPEPs基因的表达。95图1.MPK3和MPK6激活诱导ProPEP1、ProPEP2和ProPEP3基因的表达。生长在液体培养基中12-天的DDDDDD拟南芥NtMEK2、NtMEK2/mpk3和NtMEK2/mpk6幼苗,加入终浓度为1µM的地塞米松,然后在各时间点取样,提取总RNA,并进行定量PCR来分析ProPEPs基因的表达。1002.2转录因子WRKY33参与调控葡萄孢菌诱导的ProPEPs基因的诱导表达鉴于转录因子WRKY33参与植物的抗病性,且位于MPK3/MPK6的下游,接着分析了在葡萄孢菌感染的拟南芥野生型Col-0和wrky33-1,wrky33-2突变体中,ProPEPs基因的表达情况。结果发现,葡萄孢菌的浸染,能显著地上调ProPEPs基因的表达。在wrky33105突变体中,葡萄孢菌的侵染诱导的ProPEPs基因的诱导表达,明显要低于野生型(图2)。结果说明WRKY33的功能缺失,在一定程度上,降低了病原菌侵染引起的ProPEPs基因的诱导表达。-3-
中国科技论文在线http://www.paper.edu.cn110图2.WRKY33的功能缺失降低了葡萄孢菌诱导的ProPEPs基因的诱导表达。生长在液体培养基中的125天的拟南芥Col-0、wrky33-1和wrky33-2幼苗,每瓶样品中加入4.0×10个葡萄孢菌孢子,来侵染幼苗。然后在各个时间点取样,提取样品的总RNA,并进行定量PCR来分析ProPEPs基因的表达。1152.3Peps处理诱导的乙烯生成,独立于MAPK级联途径。Peps处理可诱导植物产生乙烯,MPK3/MPK6激活也可以诱导乙烯合成。MPK3/MPK6激活同时可诱导ProPEPs基因的表达。那么Peps处理诱导的乙烯合成是否依赖MPK3/MPK6信号途径呢?我们发现在mpk3和mpk6单突变体中,Peps处理诱导的乙烯合成,与野生型相比,并无明显差异(图3)。MPK3和MPK6具有高度功能冗余,但是mpk3mpk6双突变120体是胚胎致死的。我们实验室利用化学遗传学方法设计了双突材料MPK6SR(基因型为mpk3YG23mpk6PMPK6MPK6)。当用激酶抑制剂NA-PP1处理时,该材料即相当于双突变体。我们加入激酶抑制剂NA-PP1或对照DMSO预处理30分钟后,再用Peps处理。结果,mpk3mpk6双突材料MPK6SR中乙烯的生成量与对照组DMSO相比,并无明显差异(图4)。相同处理的MPK6SR材料与野生型相比,乙烯合成量也无明显差异。说明MPK3/MPK6并不参与125Peps处理诱导的乙烯生成。-4-
中国科技论文在线http://www.paper.edu.cn130图3.Pep1、Pep2、Pep3和flg22处理诱导的乙烯生成在mpk3和mpk6单突变体中没有减少。生长在液体培养基中的12天的拟南芥Col-0,mpk3和mpk6幼苗,分别加入终浓度为30nM的Pep1,Pep2,Pep3和flg22。然后换上有硅胶垫的帽子,并旋紧帽子。在各个时间点,用岛津气相色谱GC-2014测定乙烯的生成量。135图4Pep1、Pep2、Pep3和flg22处理诱导的乙烯,但独立于MPK3/MPK6级联途径。在12天的拟南芥幼苗的生长培养基中加入等体积的DMSO和NA-PP1(终浓度为1µM),预处理30分钟后,分别加入终浓度为30nM的Peps和flg22来诱导乙烯的生成,然后在各个时间点测定乙烯的生成量。在野生型Col-0和mpk3140mpk6双突材料MPK6SR中,诱导的乙烯生成量并无明显差异。3结论拟南芥中的Peps在植物的抗病反应中,发挥着重要的作用。我们利用MAPK的功能获得性和功能缺失性材料,阐明了MPK3/MPK6信号途径参与调控ProPEPs基因的表达。145MPK3/MPK6的激活,能显著诱导ProPEPs基因的表达。MPK3/MPK6下游的转录因子-5-
中国科技论文在线http://www.paper.edu.cnWRKY33,参与葡萄孢菌侵染诱导的ProPEPs基因表达。该结果对进一步了解Peps的表达调控具有重要意义。[参考文献](References)150[1]WidmannC,GibsonS,JarpeMB,JohnsonGL.Mitogen-activatedproteinkinaseconservationofathreekinasemodulefromyeasttohuman[J].PhysiologicalReviews,1999,79:143-180.[2]ChangL,KarinM.MammalianMAPkinasesignallingcascades[J].Nature,2001,410:37-40.[3]NakagamiH,PitzschkeA,HirtH.EmergingMAPkinasepathwaysinplantstresssignalling[J].TrendsinPlantScience,2005,10:339-346.155[4]XuJ,ZhangS.Mitogen-activatedproteinkinasecascadesinsignalingplantgrowthanddevelopment[J].TrendsinPlantScience,2015,20:56-64.[5]RodriguezMC,PetersenM,MundyJ.Mitogen-activatedproteinkinasesignalinginplants[J].AnnualReviewofPlantBiology,2010,61:621-649.[6]MaoG,MengX,LiuY,ZhengZ,ChenZ,ZhangS.PhosphorylationofaWRKYtranscriptionfactorbytwo160pathogen-responsiveMAPKdrivesphytoalexinbiosynthesisinArabidopsis[J].ThePlantCell,2011,23:1639-1653.[7]GuanY,MengX,KhannaR,LaMontagneE,LiuY,ZhangS.PhosphorylationofaWRKYtranscriptionfactorbyMAPKisrequiredforpollendevelopmentandfunctioninArabidopsis[J].PLoSGenetics,2014,10:e1004384.[8]MengX,XuJ,HeY,YangKY,MordorskiB,LiuY,ZhangS.PhosphorylationofanERFtranscriptionfactor165byArabidopsisMPK3/MPK6regulatesplantdefensegeneinductionandfungalresistance[J].ThePlantCell,2013,25:1126-1142.[9]LampardGR,MacAlisterCA,BergmannDC.ArabidopsisstomatalinitiationiscontrolledbyMAPKmediatedregulationofthebHLHSPEECHLESS[J].Science,2008,322:1113-1116.[10]YamaguchiY,HuffakerA.Endogenouspeptideelicitorsinhigherplants[J].CurrentOpinioninPlant170Biology,2011,14:351-357.[11]HuffakerA,PearceG,RyanCA.AnendogenouspeptidesignalinArabidopsisactivatescomponentsoftheinnateimmuneresponse[J].ProceedingsofNationalAcademyofSciencesoftheUnitedStatesofAmerica,2006,106:8067-8072.[12]YamaguchiY,PearceG,RyanCA.Thecellsurfaceleucine-richrepeatreceptorforAtPep1,anendogenous175peptideelicitorinArabidopsis,isfunctionalintransgenictobaccocells[J].ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica,2006,103:10104-10109.[13]YamaguchiY,HuffakerA,BryanAC,TaxFE,RyanCA.PEPR2isasecondreceptorforthePep1andPep2peptidesandcontributestodefenseresponsesinArabidopsis[J].ThePlantCell,2010,22:508-522.[14]HuffakerA,PearceG,RyanCA.AnendogenouspeptidesignalinArabidopsisactivatescomponentsofthe180innateimmuneresponse[J].ProceedingsofNationalAcademyofSciencesoftheUnitedStatesofAmerica,2006,103:10098-10103.[15]HuffakerA,PearceG,VeyratN,ErbM,TurlingsTCJ,SartorR,ShenZ,BriggsSP,VaughanMM,AlbornHT,TealPEA,SchmelzEA.Plantelicitorpeptidesareconservedsignalsregulatingdirectandindirectantiherbivoredefense[J].ProceedingsofNationalAcademyofSciencesoftheUnitedStatesofAmerica,2013,185110:5707-5712.[16]HuffakerA,RyanCA.EndogenouspeptidedefnsesignalsinArabidopsisdifferentiallyamplifysignalingfortheinnateimmuneresponse[J].ProceedingsofNationalAcademyofSciencesoftheUnitedStatesofAmerica,2007,104:10732-10736.[17]HuffekerA,DafoeNJ,SchmelzEA.ZmPep1,anorthologofArabidopsiselicitorpeptide1,regulatesmaize190innateimmunityandenhancesdiseaseresistance[J].PlantPhysiology,2011,155:1325-1338.[18]BartelsS,LoriM,MbengueM,vanVerkM,KlauserD,HanderT,BoniR,RobatzekS,BollerT.ThefamilyofPepsandtheirprecursorsinArabidopsisdifferentialexpressionandlocalizationbutsimilarinductionofpattern-triggeredimmuneresponse[J].JournalofExperimentalBotany,2013,64:5309-5321.[19]FluryP,KlauserD,SchulzeB,BollerTandBartelsS.Theanticipationofdanger:Microbe-associated195molecularpatternperceptionenhancesAtPep-triggeredoxidativeburst[J].PlantPhysiology,2013,161:2023-2035.[20]LiuY,ZhangS.Phosphorylationof1-aminocyclopropane-1-carboxylicacidsynthasebyMPK6,astress-responsivemitogen-activatedproteinkinase,inducesethylenebiosynthesisinArabidopsis[J].ThePlantCell,2004,16:3386-3399.200[21]HanL,LiG,YangKY,MaoG,WangR,LiuY,ZhangS.Mitogen-activatedproteinkinase3and6regulateBotrytiscinerea-inducedethyleneproductioninArabidopsis[J].PlantJournal,2010,64:114-127.[22]LiG,MengX,WangR,MaoG,HanL,LiuY,ZhangS.Dual-levelregulationofACCsynthaseactivitybyMPK3/MPK6cascadeanditsdownstreamWRKYtranscriptionfactorduringethyleneinductioninArabidopsis[J].PLoSGenetics,2012,8(6):e1002767.205[23]XuJ,XieJ,YanC,ZouX,RenD,ZhangS.AchemicalgeneticapproachdemonstratesthatMPK3/MPK6activationandNADPHoxidase-mediatedoxidativeburstaretwoindependentsignalingeventsinplantimmunity[J].ThePlantJournal,2014,77:222-234.-6-'
您可能关注的文档
- 基于逆向技术的采煤机导向滑靴设计优化.pdf
- 多功能高强度水凝胶的构建及其生物医学应用.pdf
- 多小区协作上行链路系统中一种以用户为中心的动态分簇算法.pdf
- 大豆花叶病毒抗性鉴定及抗病种质筛选.pdf
- 富氢盐水对东莨菪碱诱导大鼠干眼模型眼表保护作用.pdf
- 小麦抗赤霉病研究进展.pdf
- 康复下肢外骨骼运动控制研究.pdf
- 慢性阻塞性肺疾病患者CAT评分与心功能相关性研究.pdf
- 抗肿瘤纳米药物的传递障碍及改进策略.pdf
- 斜齿轮载荷分布计算.pdf
- 新型多靶点化和物EMB的抗肿瘤作用研究.pdf
- 无线传感网中高效可视化算法.pdf
- 日本血吸虫成虫可溶性抗原(SWAP)及虫卵可溶性抗原(SEA)对LX2细胞影响的比较研究.pdf
- 术后认知功能障碍生物标志物的研究进展.pdf
- 板栗壳状CuCo2O4的制备及其电化学催化性能研究.pdf
- 林地土壤对毛红椿种子萌发及幼苗建成的模拟实验.pdf
- 果糖诱导高尿酸血症嘌呤代谢及尿酸排泄改变.pdf
- 柴芪汤对非酒精性脂肪肝大鼠肝脏组织氧化应激的影响及意义.pdf
相关文档
- 施工规范CECS140-2002给水排水工程埋地管芯缠丝预应力混凝土管和预应力钢筒混凝土管管道结构设计规程
- 施工规范CECS141-2002给水排水工程埋地钢管管道结构设计规程
- 施工规范CECS142-2002给水排水工程埋地铸铁管管道结构设计规程
- 施工规范CECS143-2002给水排水工程埋地预制混凝土圆形管管道结构设计规程
- 施工规范CECS145-2002给水排水工程埋地矩形管管道结构设计规程
- 施工规范CECS190-2005给水排水工程埋地玻璃纤维增强塑料夹砂管管道结构设计规程
- cecs 140:2002 给水排水工程埋地管芯缠丝预应力混凝土管和预应力钢筒混凝土管管道结构设计规程(含条文说明)
- cecs 141:2002 给水排水工程埋地钢管管道结构设计规程 条文说明
- cecs 140:2002 给水排水工程埋地管芯缠丝预应力混凝土管和预应力钢筒混凝土管管道结构设计规程 条文说明
- cecs 142:2002 给水排水工程埋地铸铁管管道结构设计规程 条文说明