- 425.64 KB
- 2022-04-22 13:45:48 发布
- 1、本文档共5页,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报电话:19940600175。
'中国科技论文在线http://www.paper.edu.cn高分子水凝胶在口服胰岛素中的应用**曾志英,冯旭利(重庆大学药学院,重庆401331)5摘要:过去的几十年内,科学家一直致力于寻找一种可靠,有效的口服胰岛素传递系统。尽管许多的载药系统能够防止胰岛素被胃肠道蛋白酶的降解,以此来提高胰岛素渗透性和生物利用度,但是这些载药系统在临床应用上并不能完全适用。为了使口服胰岛素更好的应用于人体临床实验,我们需要设计出更加有效、安全的载药系统,其中高分子水凝胶材料在胰岛10素传递性能和保护性能上有独特优势,水凝胶通过感应体内外环境的变化来特异性的释放包载的胰岛素。制备生物相容性的微球以及纳米颗粒的水凝胶材料一直是研究的热点,但是这些新型高分子水凝胶在人的糖尿病治疗上并没取得显著的效果。这篇综述主要总结了最近几年基于高分子水凝胶所制备的载药系统对口服胰岛素所做的探究。关键词:载药系统;口服胰岛素;高分子水凝胶15中图分类号:R9PolymerichydrogelsfororalinsulindeliveryZENGZhiying,FENGXuli(SchoolofPharmaceuticalSciences,ChongqingUniversity,Chongqing401331)20Abstract:Overthepastfewdecades,scientistshavebeenworkingtofindareliableandeffectiveoralinsulindeliverysystem.Althoughmanydrugdeliverysystemsareabletopreventinsulinfromdegradinggastrointestinalproteasesinordertoimproveinsulinpermeabilityandbioavailability,thesedrugdeliverysystemsarenotfullyapplicableinclinicalpractice.Inordertomakeoralinsulinbetterappliedtohumanclinicaltrials,weneedtodesignamoreeffectiveandsafedrugdeliverysystem,in25whichthepolymerhydrogelmaterialintheinsulintransferperformanceandprotectionperformancehasauniqueadvantage,hydrogelthroughinductionInvitroandinvivochangesintheenvironmenttothespecificreleaseofinsulin.Preparationofbiocompatiblemicrospheresandnanoparticlehydrogelmaterialshasbeenahottopic,butthesenewpolymerhydrogelsdidnotachievesignificantresultsinthetreatmentofhumandiabetes.Thisreviewsummarizestherecentyearsofresearchonoralinsulin30basedondrugdeliverysystemspreparedbypolymerhydrogels.Keywords:carriersystems;oralinsulin;polymerichydrogel0引言35胰岛素是由脊椎动物胰脏B细胞分泌的一种多肽激素,1921年由加拿大人Banting首[1]次在狗的胰脏中发现,并于1926年用化学方法纯化并进一步用于糖尿病的治疗。过去的几十年内随着生物技术的不断发展,胰岛素的不同给药途径被科研人员应用于糖尿病的研究中,其中胰岛素在给药途径上可分为皮下注射,鼻腔,口服等。但是胰岛素最广泛的传递方式还是通过注射进入体内发挥药效,但是注射给药的胰岛素无法模拟体内正常内源性胰岛素40的释放模式,从而无法长期维持糖尿病人的正常血糖水平。胰岛素通过口服给药的方式也存[2]在许多的弊端,例如肠道内蛋白酶的水解、小肠上皮细胞低渗透性、影响胰高血糖素的浓[3]度、免疫反应以及病人的依从性等缺陷。这些给药途径都无法长期维持糖尿病人的正常血糖水平。想要克服胰岛素口服的弊端,研究口服给药的传递途径来提高胰岛素的生物活性在作者简介:曾志英(1992-),男,硕士,蛋白运输通信联系人:冯旭利(1983-),博导,基因蛋白运输.E-mail:fengxuli@cqu.edu.cn-1-
中国科技论文在线http://www.paper.edu.cn治疗糖尿病显得尤为重要。45许多科研人员设计了多种不同策略来克服胰岛素在口服上的缺陷,主要包括与吸收增强[4][5]剂共用,酶抑制剂,化学修饰,高分子微球或纳米粒子,脂质体等。至今为止,尚未有口服胰岛素的制剂产品商业化应用于人体糖尿病的治疗,但是这些科学研究成果为胰岛素的口服制剂提供了可能。这些研究成果尽管存在许多的副作用,例如刺激肠道,损伤肠粘膜等。但是也包括许多高分子共聚水凝胶例如聚丙烯酸接枝在聚乙二醇形成P(MAA-g-EG)纳米颗50粒在动物实验上能增加胰岛素4.2%的生物活性,并且能有效防止胰岛素被胃蛋白酶降解,[6-7]以及增强肠粘膜的吸附来提高胰岛素的渗透性。这篇综述主要总结最近几年国内外基于高分子水凝胶制备出的胰岛素制剂在糖尿病治疗上的进展研究。1胰岛素口服传递中的障碍[3]口服胰岛素在传递过程中会被胃肠道蛋白酶降解以及胃酸水解,和肠上皮细胞降解。55由于肠道内与胃内的PH环境差异巨大,运输至肠道内的胰岛素会被氧化,水解以及脱酰胺基作用,从而导致失活。引起蛋白降解的酶主要有胃蛋白酶,胰蛋白酶,α-糜蛋白酶,羧肽[8]酶等。有研究表明α-糜蛋白酶的降解活性是胰蛋白酶的10倍。与此同时胰岛素的降解速率跟其所处溶液环境息息相关,当胰岛素所处溶液PH为4-8时,胰岛素浓度较低,胰岛素主要以单体的形式存在。当胰岛素处于碱性环境,胰岛素以二聚体的方式存在,从而导致胰60岛素降解速度明显增加。当胰岛素置于胆汁中,胰岛素的降解速度是单体的6倍。此外胰岛素也参与细胞色素P40-3A4的代谢。胰岛素在肠道内吸收也存在许多的障碍,其中组成肠道上皮层的紧连接(tj)使细胞之间紧密连接,使得大分子药物无法利用旁路转运来通过细胞进入体循环。由于大分子的肽分子质量大和亲水性强,导致其无法进行跨细胞转运和旁路转运,从而影响胰岛素的生物利用度。胰岛素也可以通过受体介导的胞吞作用进入血液循环[9][10]65,Ziv等人的研究表明胰岛素与顶端质膜上的特异性受体的结合,然后通过内在化腔质膜和囊泡结构进入肠细胞,最后转移到肠细胞的基底外侧膜释放,进入体循环。跨细胞吸收涉及肠上皮细胞和淋巴集结的M细胞的被动或主动吸收,而细胞旁吸收通过肠上皮细胞之间的间隙来吸收。受体介导的胞吞作用比细胞旁路途径更有效,通过与转铁蛋白(Tf),凝集素,维生素B12等配体作用使得纳米粒子能与肠上皮细胞的顶端质膜结合,提升转运效[11]70率。这种方法已经广泛用于多种靶向纳米粒子制剂的研发。2高分子在口服胰岛素传递中的应用随着高分子科学领域的不断发展,基于生物聚合物为骨架结构,并对其进行进一步的修饰,所形成的共聚物,接枝共聚物,互穿聚合物网络(IPN)水凝胶,聚合物微粒或纳米粒子材料等,这些都可用于口服胰岛素递送。通过不同的载药系统递送胰岛素至肠道,往往这些75系统应能承受胃肠道内PH值变化而造成的副作用。此外,胰岛素也作为生长激素,长期口服使用高剂量胰岛素可以诱导肠上皮细胞在有丝分裂GI期的改变。在任何情况下,我们应当优先关注胰岛素在胃肠道中的物理化学和生物的稳定性,从而延长胰岛素在肠道内的滞留时间。-2-
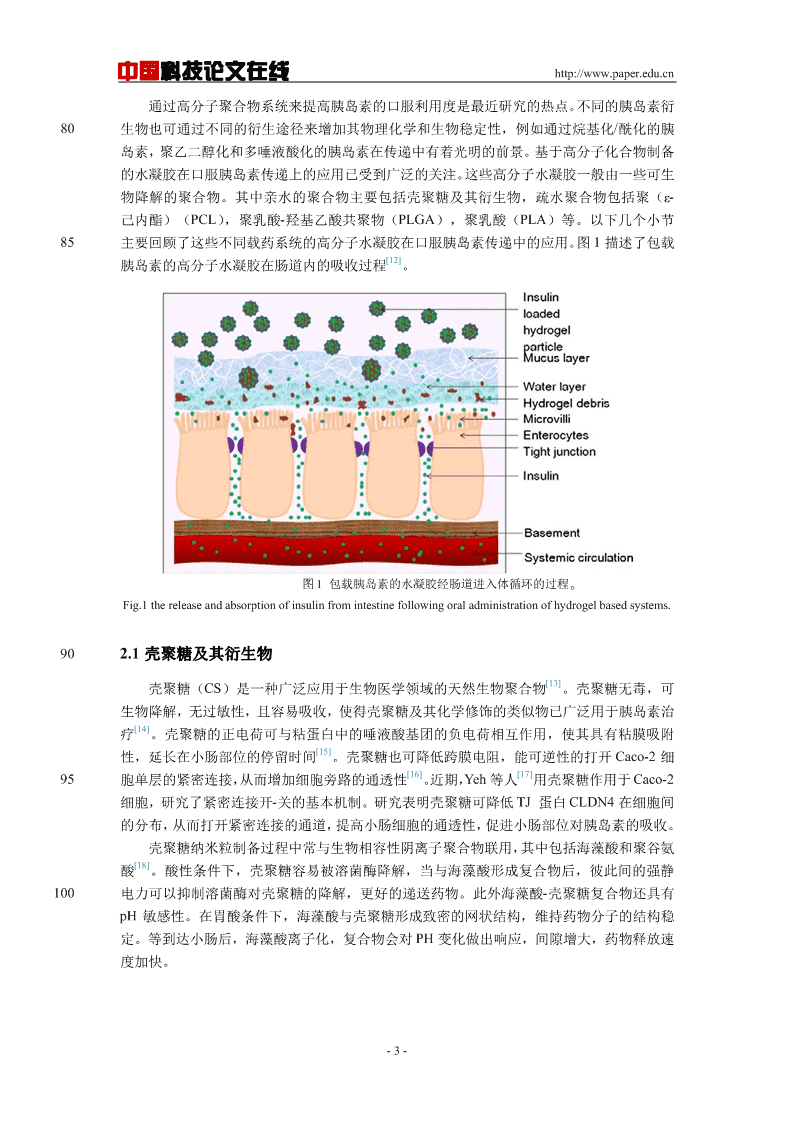
中国科技论文在线http://www.paper.edu.cn通过高分子聚合物系统来提高胰岛素的口服利用度是最近研究的热点。不同的胰岛素衍80生物也可通过不同的衍生途径来增加其物理化学和生物稳定性,例如通过烷基化/酰化的胰岛素,聚乙二醇化和多唾液酸化的胰岛素在传递中有着光明的前景。基于高分子化合物制备的水凝胶在口服胰岛素传递上的应用已受到广泛的关注。这些高分子水凝胶一般由一些可生物降解的聚合物。其中亲水的聚合物主要包括壳聚糖及其衍生物,疏水聚合物包括聚(ε-己内酯)(PCL),聚乳酸-羟基乙酸共聚物(PLGA),聚乳酸(PLA)等。以下几个小节85主要回顾了这些不同载药系统的高分子水凝胶在口服胰岛素传递中的应用。图1描述了包载[12]胰岛素的高分子水凝胶在肠道内的吸收过程。图1包载胰岛素的水凝胶经肠道进入体循环的过程。Fig.1thereleaseandabsorptionofinsulinfromintestinefollowingoraladministrationofhydrogelbasedsystems.902.1壳聚糖及其衍生物[13]壳聚糖(CS)是一种广泛应用于生物医学领域的天然生物聚合物。壳聚糖无毒,可生物降解,无过敏性,且容易吸收,使得壳聚糖及其化学修饰的类似物已广泛用于胰岛素治[14]疗。壳聚糖的正电荷可与粘蛋白中的唾液酸基团的负电荷相互作用,使其具有粘膜吸附[15]性,延长在小肠部位的停留时间。壳聚糖也可降低跨膜电阻,能可逆性的打开Caco-2细[16][17]95胞单层的紧密连接,从而增加细胞旁路的通透性。近期,Yeh等人用壳聚糖作用于Caco-2细胞,研究了紧密连接开-关的基本机制。研究表明壳聚糖可降低TJ蛋白CLDN4在细胞间的分布,从而打开紧密连接的通道,提高小肠细胞的通透性,促进小肠部位对胰岛素的吸收。壳聚糖纳米粒制备过程中常与生物相容性阴离子聚合物联用,其中包括海藻酸和聚谷氨[18]酸。酸性条件下,壳聚糖容易被溶菌酶降解,当与海藻酸形成复合物后,彼此间的强静100电力可以抑制溶菌酶对壳聚糖的降解,更好的递送药物。此外海藻酸-壳聚糖复合物还具有pH敏感性。在胃酸条件下,海藻酸与壳聚糖形成致密的网状结构,维持药物分子的结构稳定。等到达小肠后,海藻酸离子化,复合物会对PH变化做出响应,间隙增大,药物释放速度加快。-3-
中国科技论文在线http://www.paper.edu.cn[19]Y.Zhang等开发了独特的膜乳化法,按图二中的方法将胰岛素包封在CS-藻酸盐微球105中,实现高胰岛素负荷效率57%,2小时内在模拟胃液环境(SGF)中观察到5%胰岛素释放,而在SIF中4小时后释放32%胰岛素。大多数基于CS-海藻酸设计的纳米粒子释放胰岛素持续时间8-12h小时,但是这些微球可以维持胰岛素长达14天的释放。本研究证明了该体系显着的包载效果,主要由于这些微球(尺寸大约7.5μm)能粘附于肠壁,从而延长了胰岛素释放持续时间。110图二用膜乳化法制备CS-藻酸盐包载胰岛素过程Fig2PreparationofCS-alginate-loadedinsulinbymembraneemulsification另外基于g-谷氨酸(g-PGA)设计的阴离子聚合物与壳聚糖联用也可用于包载胰岛素,聚115g-PGA为水溶性的高分子材料,无副作用,生物可降解,能避免胃肠内的消化酶的降解。[20-21]Sung等人制备pH敏感的壳聚糖-聚谷氨酸(g-PGA)纳米粒子在磁力搅拌下自组装包载胰岛素,包载胰岛素效率达到了71.8±1.1%。通过静脉注射链脲霉素来构造小鼠糖尿病模型,通过口服和皮下注射该纳米粒子,结果显示CS/g-PGANPs能显著增加肠道对胰岛素的吸收,血糖浓度明显降低。将该纳米粒子冷冻干燥后装入至肠溶衣的胶囊,口服胰岛素纳[22]120米粒子30iu/kg后,有着20%的生物利用度。2.2丙烯酸聚合物丙烯酸类聚合物能抑制蛋白酶水解活性,增强对粘膜的粘附能力,改变细胞紧密连接,从而改善肠道对胰岛素的吸收。于此同时丙烯酸类聚合物及衍生物制备出的纳米颗粒,可以[23]显著提高胰岛素生物利用度。Deute等人将聚丙烯酸与半胱氨酸合成出的纳米颗粒向糖尿125病大鼠口服递送胰岛素,这种组合显示了良好的蛋白保护性能,增强了粘膜的吸附能力,提高了胰岛素在肠道内的渗透性。给药后,血糖浓度降低,血清中胰岛素浓度的显着增加。其中半胱氨酸中含有的巯醇能显著增强纳米粒子在肠道内的粘附作用,其中半胱氨酸-PAA纳[24]米颗粒比未改性的PAA纳米颗粒胰岛素释放量高2.3倍。在另一项研究中,Perera等人研究了类似的载体,用来保护胰岛素免受肠道中蛋白酶的降解。文章中体外实验表明,将胰130岛素溶液分别通过胰蛋白酶,α-胰凝乳蛋白酶和胰肽酶,纳米颗粒能避免约44%,21%和45%的胰岛素降解。丙烯酸树脂(Eudragit)是丙烯酸乙酯和甲基丙烯酸甲酯以及和含有季铵基团的甲基丙-4-
中国科技论文在线http://www.paper.edu.cn烯酸共聚而成,常常在药物产品中用作赋形剂。这种共聚物的肠溶性和控释性能使其应用于[25]口服胰岛素的传递。Jelvehgari等人将丙烯酸树脂和壳聚糖形成的高分子聚合物用于口服135胰岛素的传递,实验显示了约31%的负载效率,而且平均粒度约为200nm,CD研究显示胰岛素传递过程中结构没有明显变化,同时其释放具有PH依赖性,低PH下释放缓慢,高[26]PH值释放速率加快。Tyagi等将明胶和丙烯酸树脂L-100制备出的pH敏感纳米颗粒,这些纳米颗粒在PH2.5的条件下,90分钟内仅释放20%的胰岛素。在pH7.4下条件下,30分钟内释放了40%的胰岛素,这个pH敏感性释放模式使胰岛素免于被胃部蛋白酶的降解。同[27]140样Damgé等人设计出的一种聚阳离子的丙烯酸树脂-RS,其胰岛素的相对生物利用度超过13%。这种载体对胰岛素口服传递效率上的增强归因于丙烯酸树脂-RS的生物粘附特性。2.3聚乳酸-羟基乙酸共聚物(PLGA)PLGA由羟基乙酸和乳酸随机共聚而成,是一种可降解的功能化的高分子有机聚合物,具有良好的生物相容性、无毒、良好的成囊和成膜的性能。实际上,基于PLGA能制备出145多功能纳米颗粒,可以与其它聚合物组合运用,纳米颗粒可以增强肠道对负载药物的摄取。[28]Araújo等人,将负载胰岛素的PLGA纳米颗粒跨越Caco-2细胞单层模型,展现了良好的渗透能力,通过双重乳液溶剂蒸发技术制备的纳米颗粒,实现高于80%的包载效率。Reix[29]等人观察到网格蛋白介导的胰岛素吸收呈时间相关性。将纳米颗粒给药糖尿病大鼠,纳米颗粒在十二指肠中能稳定存在一段时间,使胰岛素能被肠道吸收和渗透进入血流。在另一[30]150项研究中,Yang等人也使用双重乳液溶剂蒸发技术,将胰岛素包封到PLGA纳米颗粒中。并且发现胰岛素在pH1.0的条件下以较低的速率释放,11天内释放90%胰岛素。然而在pH7.8释放速率快,90%的胰岛素在3天内被释放。在进一步研究中,将纳米颗粒口服给糖尿病大鼠,观察到血糖浓度下降,血液中的胰岛素水平明显增加。这些结果清楚地表明了PLGA纳米颗粒能持续释放胰岛素,增强胰岛素的吸收从而降低血糖浓度。确实包载胰岛素PLGA[31]155纳米颗粒初始释放速度很快,但是Fonte等人可通过和β-环糊精组合制备出的纳米颗粒能延缓胰岛素的释放速率,从而延长了胰岛素的作用时间。2.4ε-己内酯聚合物(PCL)PCL是一种可生物降解和生物相容性好的聚酯,PCL相比于PLGA来说,在体内的降[27]解速度更慢,能延长药物的控释时间。Damgé等人将PCL和丙烯酸树脂制备出的纳米颗160粒包载胰岛素,实现了约96%的胰岛素包载(AE)。将负载胰岛素的纳米颗粒分别按(25,50和100IU/kg)的不同剂量给药糖尿病大鼠,结果显示小鼠的血糖水平随剂量的增加而相应减少,在100IU/kg下达到了最低血糖浓度。此外,将包载异硫氰酸荧光素标记的胰岛素的纳米颗粒给药后,发现其粘附到肠粘膜,并且由派伊尔淋巴集结吸收,这主要是由于丙烯酸[32]树脂的粘膜粘附性。另一个工作中Socha等人,基于PCL设计的纳米颗粒用于包封Actrapid165和Novorapid胰岛素,包封率分别可达到96%和35%。载有Novorapid的纳米颗粒与空的纳米颗粒体外胰岛素释放实验显示:服用纳米颗粒的糖尿病大鼠血糖浓度明显降低。在另一个[33]研究中,Damgé等人使用相同的纳米载体包封胰岛素天冬氨酸(短效胰岛素类似物)并且获得约98%AE包载率。体外胰岛素释放研究中显示纳米颗粒能够在24小时后释放约70%的胰岛素。给予患糖尿病的大鼠口服纳米颗粒,血糖水平并未快速下降,胰岛素的作用时间170明显延长。经纳米颗粒包载的胰岛素与正常胰岛素相比能抑制餐后血糖峰值超过24小时,-5-
中国科技论文在线http://www.paper.edu.cn常规胰岛素仅能作用6-8小时。3总结胰岛素的口服制剂相比较传统的皮下注射有着独特的优势,能减轻患者注射给药的痛苦,提高患者对治疗的依从性。然而口服胰岛素在运输中主要的缺点在于它的低效率,只有175一小部分的胰岛素能通过胃肠道,吸收进入体循环。胃肠的降解,胰岛素的分子量大和强亲水性等大大限制了其运输效率,使其无法通过肠屏障。研究结果显示口服给药的胰岛素只有0.5%能到达体循环,发挥药效。本文所总结出载药系统对胰岛素有着较高的包载效率和保护作用,避免了胃肠道酶的降解,提升了胰岛素在肠道内的滞留时间,在体内外实验都表现出良好的降血糖效果。然而想要进一步应用于人体糖尿病的治疗还有很长的路要走,目前基180于口服胰岛素设计的载药系统,尽管在临床前动物实验中能有效提高胰岛素的生物利用度,但普遍没有在糖尿病人身上做临床实验,水凝胶载药系统的生物相容性,胰岛素在人体的生物利用度,以及水凝胶分子释放胰岛素后载体的代谢途径等都需要具体了解,因此我们一方面考虑水凝胶的载药性能,也要考虑载体对人体的不良反应。最近对口服胰岛素递送研究整体集中在一下几个方面:(1)具有粘膜吸附性或增强吸收效率的生物相容性高分子聚合物的185开发(2)递药系统与配体联用增强运输的靶向性(3)更高的胰岛素包载效率,更低生物毒性的载体研究。这些负载胰岛素的水凝胶载体系统能否在未来市场上推出仍有很长的路要走,在这其中要综合运用医学,高分子化学,药学,分子生物学等不同学科领域内的知识,来持续不断的探究和优化口服胰岛素的载药系统用于减轻糖尿病患者的痛苦。190[参考文献](References)[1]FGBanting,CHBest,Theinternalsecretionofthepancreas,jlabClinMed,1922,7,251-266.[2]Y.Aoki,M.morishita,K.Asai,etal,Regionaldependentroleofthemucous/glycocalyxlayersininsulinpermeationsacrossratsmallintestnalmembrane,PharmRes,2005,22,1854-1862.[3]VAgrawal,MAKhan,Currentstatusoftheoraldeliveryofinsulin,PharmTechnaol,2001,25,76-90.195[4]MARadwant,HYAboual-Enein,Theeffectoforalabsorptionenhanersontheinvivoperformanceofinsulin-loadingpoly(ethylcyanoacrylate)nanospheresindiabeticrats,JMicroencapsul,2002,19,225-235.[5]C.Prego,M.Garcia,D.Torres,,transmucosalmacromoleculardrugdelivery,JControlRelease,2005,101,151-162.[6]MMorishita,AMLowman,KTakayama,etal,Elucidationofthemechanismofincorporationofinsulinincontrolledreleasesystemsbasedoncomplexationpolymers,JControlrelease,2002,91.25-32.200[7]ACFoss,NAPeppas,Investigationofthecytotoxicityandinsulintransportofacrylic-basedcopolymerproteindeliverysystemsincontactwithcaco-2cultures,EurJPharmBiopharm,2004,57,447-455.[8]RJSchilling,AKMitra,Degradationofinsulinbytrypsinandchymotrypsin,PharmRes,1991,8,721-727.[9]JYFan,JLCarpentier,PGorden,etal,Receptor-mediatedendocytosisofinsulin:roleofmicrovilli,coatedpits,andcoatedcesicles,ProcNatlAcadSci,1982,79,7788-7791.205[10]E.Ziv,M.Bendayan,Intestinalabsorptionofpeptidesthroughtheenterocytes,Microsc.Res.Tech.2000,49346-352.[11]K.B.Chalasani,G.J.Russell-Jones,A.K.Jainetal,EffectiveoraldeliveryofinsulininanimalmodelsusingvitaminB12-coateddextrannanoparticles,J.Control.Release2007,122,141-150.[12]K.Chaturvedietal./JournalofControlledRelease,2013,165,129-138210[13]S.A.Agnihotri,N.N.Mallikarjuna,T.M.Aminabhavi,Recentadvancesonchitosan-basedmicro-andnanoparticlesindrugdelivery,J.Control.Release2004,100,5-28.[14]K.Ganguly,T.M.Aminabhavi,A.R.Kulkarni,Colontargetingof5-fluorouracilusingpolyethyleneglycolcross-linkedchitosanmicrospheresentericcoatedwithcelluloseacetatephthalate,Ind.Eng.Chem.Res.2011,50,11797-1180215[15]I.Bravo-Osuna,C.Vauthier,A.Farabollini,etal,Mucoadhesionmechanismofchitosanandthiolatedchitosan-poly(isobutylcyanoacrylate)core-shellnanoparticles,Biomaterials2007,28,2233-2243.[16]P.Artursson,T.Lindmark,S.S.Davis,L.Illum,Effectofchitosanonthepermeabilityofmonolayersofintestinalepithelialcells(Caco-2),Pharm.Res.1994,11,1358-1361.[17]T.H.Yeh,L.W.Hsu,M.T.Tseng,P.L.Lee,K.Sonjae,Y.C.Ho,H.W.Sung,Mechanismandconsequenceof-6-
中国科技论文在线http://www.paper.edu.cn220chitosan-mediatedreversibleepithelialtightjunctionopening,Biomaterials2011,32,6164-6173.[18]LankalapalliS,KolapalliVR.Polyelectrolytecomplexes:Areviewoftheirapplicabilityindrugdeliverytechnology[J].IndianJPharmSci,2009,71,481-487.[19]Y.Jin,Y.Song,X.Zhu,D.Zhou,etal.Huang,Gobletcell-targetingnanoparticlesfororalinsulindeliveryandtheinfluenceofmucusoninsulintransport,Biomaterials,33,2015,1573-1582225[20]K.Sonaje,Y.J.Chen,H.L.Chen,.etal,Enteric-coatedcapsulesfilledwithfreeze-driedchitosan/poly(g-glutamicacid)nanoparticlesfororalinsulindelivery,Biomaterials,2010,313384-3394.[21]K.Sonaje,K.J.Lin,J.J.Wang,etal,Self-assembledpH-sensitivenanoparticles:aplatformfororaldeliveryofproteindrugs,Adv.Funct.Mater.2010,20,3695-3700.[22]K.Sonaje,Y.H.Lin,J.H.Juang,S.P.Wey,C.T.Chen,H.W.Sung,Invivoevaluationofsafetyandefficacyof230self-assemblednanoparticlesfororalinsulindelivery,Biomaterials2009,30,2329-2339.[23]DeutelB,GreindlM,ThaurerM,Bernkop-SchnurchA.Novelinsulinthiomernanoparticles:invivoevaluationofanoraldrugdeliverysystem.Biomacromolecules2008,9,278-285.[24]PereraG,GreindlM,PalmbergerTF,Bernkop-SchnürchA.Insulin-loadedpoly(acrylicacid)-cysteinenanoparticles:stabilitystudiestowardsdigestiveenzymesoftheintestine.DrugDeliv2009,16,254-260.235[25]JelvehgariM,Zakeri-MilaniP,Siahi-ShadbadMR,etal.DevelopmentofpH-sensitiveinsulinnanoparticlesusingEudragitL100-55andchitosanwithdifferentmolecularweights.AAPSPharmSciTech2010,11,1237-1242.[26]TyagiC,TomarL,KumarP,etal.pHresponsivepolymericnanoparticlesfororalinsulindelivery.IntJPharmPharmacolTech2012,,1.[27]DamgéC,SochaM,UbrichN,MaincentP.Poly(ε-caprolactone)/eudragitnanoparticlesfororaldeliveryof240aspart-insulininthetreatmentofdiabetes.JPharmSci2010,9,9879-889.[28]AraújoF,ShresthaN,ShahbaziM-A,FonteP,MäkiläEM,SalonenJJ,etal.TheimpactofnanoparticlesonthemucosaltranslocationandtransportofGLP-1acrosstheintestinalepithelium.Biomaterials2014b,35,9199-9207.[29]ReixN,ParatA,SeyfritzE,etal.InvitrouptakeevaluationinCaco-2cellsandinvivoresultsindiabeticrats245ofinsulin-loadedPLGAnanoparticles.IntJPharm2012,437,213-20.[30]YangJ,SunH,SongC.Preparation,characterizationandinvivoevaluationofpH-sensitiveoralinsulin-loadedpoly(lactic-co-glycolicacid)nanoparticles.DiabetesObesMetab2012,14,358-64.[31]FonteP,SoaresS,CostaA,etal.Effectofcryoprotectantsontheporosityandstabilityofinsulin-loadedPLGAnanoparticlesafterfreeze-drying.Biomatter2012,2,329-39.250[32]SochaM,SapinA,DamgéC,MaincentP.Influenceofpolymersratiooninsulin-loadednanoparticlesbasedonpoly-ε-caprolactoneandEudragit®RSfororaladministration.DrugDeliv2009,16,430-6.[33]DamgéC,MaincentP,UbrichN.Oraldeliveryofinsulinassociatedtopolymericnanoparticlesindiabeticrats.JControlRelease2007,117,163–70.-7-'
您可能关注的文档
- 适应于SiC BJT的双电源驱动电路的优化设计.pdf
- 针铁矿-细菌-腐殖酸复合体对Pb的吸附行为研究.pdf
- 锁掷酵母油对血脂异常小鼠脂代谢影响的研究.pdf
- 锂离子电池热特性实验与仿真分析.pdf
- 锰胁迫对茶树锰含量和生理变化的影响.pdf
- 长链菊粉对小鼠急性胰腺炎及相关肠道损伤的保护作用研究.pdf
- 长鬣蜥(Physignathus cocincinus)线粒体基因组全序列分析.pdf
- 预混层流本生灯顶端局部Karlovitz数.pdf
- 香烟烟雾致BEAS-2B细胞恶性转化过程中基因组与PTPRM的DNA甲基化改变.pdf
- AgTiO2纳米管阵列光电催化性能研究.pdf
- CFRP索在索桥结构中的应用和发展.pdf
- LMWOAs对溶解态菲和甲基菲生物降解过程影响的研究.pdf
- [AMIM][BF4]溶胶-凝胶固相微萃取涂层在水体中有机磷酸酯化合物测定中的应用.pdf
- 一个基于梯度提升决策树的商品推荐算法.pdf
- 一种初中数学知识本体的构建与评估.pdf
- 不同时程铅暴露对海马神经元AMPA受体表达的影响.pdf
- 不同面筋蛋白组分对面包品质的影响.pdf
- 两种硫氧化细菌CO2同化潜能解析及其影响因素.pdf
相关文档
- 施工规范CECS140-2002给水排水工程埋地管芯缠丝预应力混凝土管和预应力钢筒混凝土管管道结构设计规程
- 施工规范CECS141-2002给水排水工程埋地钢管管道结构设计规程
- 施工规范CECS142-2002给水排水工程埋地铸铁管管道结构设计规程
- 施工规范CECS143-2002给水排水工程埋地预制混凝土圆形管管道结构设计规程
- 施工规范CECS145-2002给水排水工程埋地矩形管管道结构设计规程
- 施工规范CECS190-2005给水排水工程埋地玻璃纤维增强塑料夹砂管管道结构设计规程
- cecs 140:2002 给水排水工程埋地管芯缠丝预应力混凝土管和预应力钢筒混凝土管管道结构设计规程(含条文说明)
- cecs 141:2002 给水排水工程埋地钢管管道结构设计规程 条文说明
- cecs 140:2002 给水排水工程埋地管芯缠丝预应力混凝土管和预应力钢筒混凝土管管道结构设计规程 条文说明
- cecs 142:2002 给水排水工程埋地铸铁管管道结构设计规程 条文说明