- 422.06 KB
- 2022-04-22 13:45:52 发布
- 1、本文档共5页,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报电话:19940600175。
'中国科技论文在线http://www.paper.edu.cnLMWOAs对溶解态菲和甲基菲生物降解#过程影响的研究121**杜兰,朱亚先,张勇5(1.近海海洋环境科学国家重点实验室(厦门大学),厦门大学环境与生态学院,厦门361102;2.厦门大学化学化工学院,厦门361005)摘要:利用同步荧光法研究了小分子量有机酸(LMWOAs)草酸、柠檬酸和酒石酸对新鞘氨醇10杆菌US6-1降解溶解态单组份菲(Phe)、3-甲基菲(3-MPhe)和9-甲基菲(9-MPhe)的影响。结果表明,上述LMWOAs浓度为0.2mmol/L时,均促进US6-1对Phe的降解,但草酸抑制了3-MPhe及9-MPhe的降解,柠檬酸和酒石酸则表现为促进作用。2.0mmol/L的草酸促进了Phe、3-MPhe及9-MPhe的降解,而2.0mmol/L酒石酸抑制了上述PAHs的降解。两种浓度条件下LMWOAs中,草酸均使得US6-1表面疏水性提高。双因素方差分析结果表明,15LMWOAs种类、浓度及二者的交互作用在Phe及3-MPhe的降解过程中起主要作用(p<0.05),而对于9-MPhe,此三因素并非降解过程的关键因子(p>0.05)。关键词:生物降解;LMWOAs;Phe;MPhe;疏水性InfluenceofLMWOAsonthebiodegradationofdissolved20phenanthreneandmethylphenanthrene121DULan,ZHUYaxian,ZHANGYong(1.StateKeyLaboratoryofMarineEnvironmentalScienceofChina(XiamenUniversity),CollegeoftheEnvironmentandEcology,XiamenUniversity,Xiamen361102;2.CollegeofChemistryandChemicalEngineering,XiamenUniversity,Xiamen361005)25Abstract:Influenceoflowmolecularweightorganicacids(LMWOAs):Oxalicacid,CitricacidandTartaricacidonthebiodegradationofdissolvedphenanthrene(Phe),3-methylPhe(3-MPhe)and9-methylPhe(9-MPhe)bybacteriumNovosphingpentaromativoransUS6-1wereindividuallystudiedusingsynchronousfluorescence.Resultsshowedthat0.2mmol/LLMWOAspromotedthebiodegradationofPhe.0.2mmol/LOxalicacidinhibitiedthebiodegradationof3-MPheand9-MPhe,30while0.2mmol/LTartaricacidorCitricacidpromotedtheseprocesses.Thepresenceof2.0mmol/LOxalicacidpromotedthedegradationofthethreePAHs,but2.0mmol/LTartaricacidinhibitedtheseprocesses.Oxalicacidattwoconcentrations,i.e.0.2mmol/Land2.0mmol/LimprovedthecellsurfacehydrophobicityofUS6-1.ForPheand3-MPhe,theresultsoftwo-factorvarianceanalysisshowedthatthetypes,concentrationsofLMWOAs,andtheinteractionofthesetwofactorsplayedmainroleduring35thebiodegradationprocessofPheand3-MPhe(p<0.05);For9-MPhe,thesethreefactorswerenotthekeyfactorsinfluencingthebiodegradationof9-MPhe(p>0.05).Keywords:biodegradation;LMWOAs;Phe;MPhe0引言烷基取代多环芳烃(Alkylpolycyclicaromatichydrocarbons,A-PAHs)作为PAHs的重要组[1]40成部分,因其毒性效应强、种类繁多,已逐步成为研究热点。生物降解是去除PAHs的重[2]要途径之一,环境中其他有机物对其降解过程产生重要影响。小分子量有机酸(LMWOAs)[3]广泛分布于环境中,且具有较高的反应活性。研究指出LMWOAs可增强土壤中吸附态基金项目:高等学校博士学科点专项科研基金(20130121130005);国家自然科学基金(21177102,21577110);国家海洋局海洋溢油鉴别与损害评估技术重点实验室开放基金(201405)作者简介:杜兰(1991-),女,硕士研究生,主要研究方向:环境化学通信联系人:张勇(1962-),博导,主要研究方向:环境化学.E-mail:yzhang@xmu.edu.cn-1-
中国科技论文在线http://www.paper.edu.cn[4-6]PAHs的解析,使得其生物有效性提高;也可促进土壤微生物生长及相关酶活性增强,使[7-9]得PAHs的降解效率提高。然而,目前关于LMWOAs对溶解态A-PAHs生物降解过程的45研究鲜见报道。本文选取NovosphingobiumpentaromativoransUS6-1为降解菌,以草酸(Oxalicacid)、柠檬酸(Citricacid)和酒石酸(Tartaricacid)为典型LMWOAs,研究其对Phe及3-甲基菲(3-MPhe)和9-甲基菲(9-MPhe)生物降解过程的影响。1材料与方法501.1试剂与仪器试剂:Phe、3-MPhe和9-MPhe(纯度>98%,美国Sigma-Aldrich公司);Oxalicacid、Citricacid、Tartaricacid(纯度>99%,北京百灵威科技有限公司);(NH4)2SO4、Na2HPO4、K2HPO4、MgSO4·7H2O、CaCl2·2H2O、FeCl3·6H2O、(NH4)6Mo7O24·4H2O、NaOH、尿素(A.R.,国药化学试剂有限公司);无水乙醇(A.R.,西陇化工股份有限公司);2216E富营养培养基(青岛海55博生物技术有限公司);正十六烷(纯度≥98%,国药集团化学试剂有限公司);实验用水均为[10][11]Milli-Q水。MSM液体培养基的配制参照文献,PUM缓冲液的配制参照文献。仪器:FLS920型纳秒时间分辨荧光光谱仪(EdinburghInstrument公司,英国);752紫外可见分光光度计(上海光谱仪器有限公司);HV-50全自动电子灭菌器(Hiragama公司,日本);Universal320R高速冷冻离心机(Hettich公司,德国);VS-840K-U洁净工作台(苏州安60泰空气技术有限公司);Sky2102C恒温振荡器(上海苏坤实业有限公司)。实验菌株:US6-1由韩国海洋研究与发展院提供,筛选自Ulsan海湾(韩国)沉积物的革[12]兰氏染色阴性菌,可降解Phe、蒽和芘等二环至五环PAHs。1.2实验方法1.2.1LMWOAs对PAHs生物降解的影响65从-80℃冰箱中取出US6-1,活化几分钟后取100L于2216E培养液中培养(25℃,150rpm),经28-34h待其进入对数增长期后,取50mL培养液于离心管中离心10min(4℃,6000rpm)。舍去清液,加入MSM溶液重悬后继续离心,重复三次得到降解菌。取适量Phe、3-MPhe和9-MPhe标准品溶于乙醇;Oxalicacid、Citricacid和Tartaricacid-2标准品溶于水;均分别配制成1.0×10mol/L的储备液,置于4℃冰箱避光保存。取适量上-370述PAHs储备液于10mL比色管,用乙醇分别稀释至1.0×10mol/L,取该稀释液80L于125mL锥形瓶中,氮吹至近干后加入100mLMSM溶液。实验分为三组,每组分别包含单-7组份Phe、3-MPhe和9-MPhe,其浓度均为8×10mol/L;取适量LMWOAs储备液分别加入于含有PAHs的锥形瓶中,第一组LMWOAs浓度为0.2mmol/L,第二组LMWOAs浓度为2.0mmol/L,第三组不含LMWOAs。溶液pH均用NaOH溶液调节至7.0。实验结果表明,75LMWOAs对三种PAHs荧光信号无显著影响,其存在不影响三种PAHs的测定,同步荧光[13]法可用于本研究。LMWOAs不易挥发和分解,可直接灭菌。接种菌后于摇床中避光震荡培养(25℃,150r/min)。适当时间后直接测定降解体系中PAHs荧光强度。实验设三组平行。US6-1初始生物量OD600=0.0005。实验所用容器及培养液均121℃高压灭菌20min。-2-
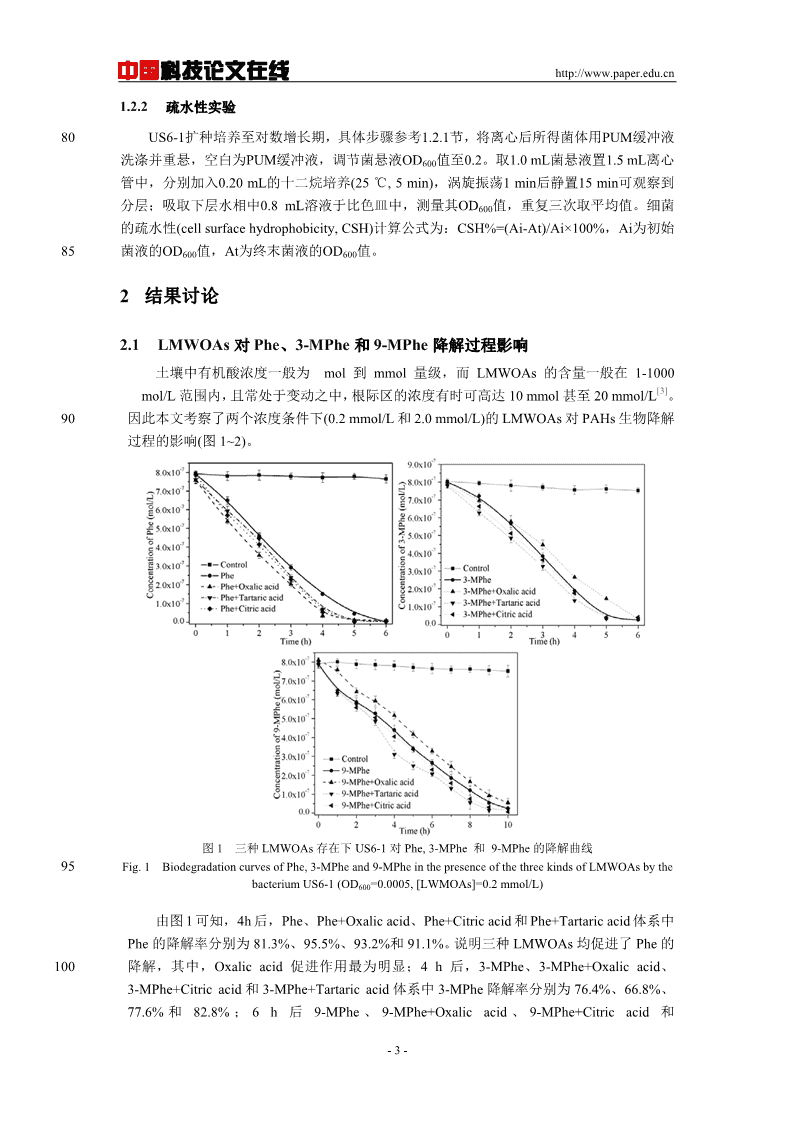
中国科技论文在线http://www.paper.edu.cn1.2.2疏水性实验80US6-1扩种培养至对数增长期,具体步骤参考1.2.1节,将离心后所得菌体用PUM缓冲液洗涤并重悬,空白为PUM缓冲液,调节菌悬液OD600值至0.2。取1.0mL菌悬液置1.5mL离心管中,分别加入0.20mL的十二烷培养(25℃,5min),涡旋振荡1min后静置15min可观察到分层;吸取下层水相中0.8mL溶液于比色皿中,测量其OD600值,重复三次取平均值。细菌的疏水性(cellsurfacehydrophobicity,CSH)计算公式为:CSH%=(Ai-At)/Ai×100%,Ai为初始85菌液的OD600值,At为终末菌液的OD600值。2结果讨论2.1LMWOAs对Phe、3-MPhe和9-MPhe降解过程影响土壤中有机酸浓度一般为mol到mmol量级,而LMWOAs的含量一般在1-1000[3]mol/L范围内,且常处于变动之中,根际区的浓度有时可高达10mmol甚至20mmol/L。90因此本文考察了两个浓度条件下(0.2mmol/L和2.0mmol/L)的LMWOAs对PAHs生物降解过程的影响(图1~2)。图1三种LMWOAs存在下US6-1对Phe,3-MPhe和9-MPhe的降解曲线95Fig.1BiodegradationcurvesofPhe,3-MPheand9-MPheinthepresenceofthethreekindsofLMWOAsbythebacteriumUS6-1(OD600=0.0005,[LWMOAs]=0.2mmol/L)由图1可知,4h后,Phe、Phe+Oxalicacid、Phe+Citricacid和Phe+Tartaricacid体系中Phe的降解率分别为81.3%、95.5%、93.2%和91.1%。说明三种LMWOAs均促进了Phe的100降解,其中,Oxalicacid促进作用最为明显;4h后,3-MPhe、3-MPhe+Oxalicacid、3-MPhe+Citricacid和3-MPhe+Tartaricacid体系中3-MPhe降解率分别为76.4%、66.8%、77.6%和82.8%;6h后9-MPhe、9-MPhe+Oxalicacid、9-MPhe+Citricacid和-3-
中国科技论文在线http://www.paper.edu.cn9-MPhe+Tartaricacid体系中9-MPhe降解率分别为66.3%、59.5%、70.9%和73.6%。说明此时Oxalicacid对3-MPhe和9-MPhe的降解起抑制作用,而Citricacid和Tartaricacid仍105起促进作用。图2三种LMWOAs存在下US6-1对Phe,3-MPhe和9-MPhe的降解曲线Fig.2BiodegradationcurvesofPhe,3-MPheand9-MPheinthepresenceofthethreekindsofLMWOAsbythe110bacteriumUS6-1(OD600=0.0005,[LWMOAs]=2.0mmol/L)如图2,4h后Phe、Phe+Oxalicacid、Phe+Citricacid和Phe+Tartaricacid体系中Phe的降解率分别为81.0%、97.6%、77.3%和66.2%;4h后3-MPhe、3-MPhe+Oxalicacid、3-MPhe+Citricacid和3-MPhe+Tartaricacid体系中3-MPhe降解率分别为76.4%、78.8%、11578.7%和51.0%;6h后9-MPhe、9-MPhe+Oxalicacid、9-MPhe+Citricacid和9-MPhe+Tartaricacid体系中9-MPhe降解率分别为66.3%、81.1%、76.4%和54.0%。说明该条件下Oxalicacid促进Phe、3-MPhe和9MPhe的降解,而Citricacid和Tartaricacid抑制了上述三种PAHs的降解,其中Tartaricacid抑制作用最强。2.2US6-1细胞表面疏水性120细胞表面疏水性是决定细菌非特异性黏附到生物和非生物表面及界面的最重要因素之[14][15]一,也是影响细菌吸收和降解疏水性有机物主要因素之一。Kaczorek研究表明,微生物降解石油等有机污染物的过程中,细胞表面疏水性能影响细菌对有机污染物的黏附,促进细菌对石油的降解。已有研究指出LMWOAs可通过极性作用影响细菌对溶解态菲(Phe)、芴和[16]芘的降解过程。图3为三种LMWOAs存在下US6-1细菌表面疏水性变化的测定结果。125-4-
中国科技论文在线http://www.paper.edu.cnAB图3US6-1细胞表面疏水性Fig.3MicrobialadhesiontohydrocarbonforthebacteriumUS6-1(A:[LWMOAs]=0.2mmol/L;B:[LWMOAs]=2.0mmol/L)130由图3A,未加LMWOAs时,Phe、3-MPhe和9-MPhe疏水性分别为35.8%、44.2%和64.2%。当LMWOAs浓度0.2mmol/L时,对于Phe、3-MPhe和9-MPhe在Oxalicacid存在下,US6-1的细胞表面疏水性最强,分别为55.6%、60.2%和73.3%。但Oxalicacid促进了Phe的降解,抑制了3-MPhe和9-MPhe的降解。研究结果显示,高疏水性使有机物易在细[3,17,18]135胞膜中滞留,不利于向胞内传输。本文中MPhe跨膜过程中,较于Phe,高极性Oxalicacid使得MPhe更不易向胞内传送,更多的MPhe滞留在细胞膜中间层疏水性区域,抑制了其降解。相反,Citricacid和Tartaricacid则促进了MPhe的降解。由图3B,当LMWOAs浓度为2.0mmol/L时,对于Phe、3-MPhe和9-MPhe,Oxalicacid存在时,US6-1细胞表面疏水性最强,分别为74.2%、77.4%和79.0%。结合该条件下降解140过程,Oxalicacid促进了所研究PAHs降解,Tartaricacid则为抑制作用,说明此时细胞表面疏水性不是LMWOAs影响PAHs降解的关键因素。有研究报道LMWOAs可显著提高土壤[9]中脱氢酶活性,继而促进PAHs的降解。相关研究有待进一步开展。2.3双因素方差分析表1US6-1对PAHs降解速率双因素方差分析145Tab.1AnalysisofvariancesummaryforthedegradationrateconstantofthebacteriumUS6-1aPAHsSourceSumofsquaresD.F.F-valuep-value-15-12PheLMWOAs2.1×10295.13.9×10-15-12Concentrations2.6×10380.91.1×10-15-12Interaction5.9×10693.51.9×10-15-133-MPheLMWOAs1.5×102118.63.6×10-15-14Concentrations2.2×103114.52.4×10-15-15Interaction3.1×10681.19.7×10-149-MPheLMWOAs6.3×1020.20.8-13Concentrations4.8×1030.90.4-13Interaction2.8×1060.30.9本实验过程,存在多种因素影响所述PAHs的降解过程,包括LMWOA种类及浓度,-5-
中国科技论文在线http://www.paper.edu.cn因此通过双因素方差分析以确定主要影响因素(见表1)。结果表明LMWOAs种类与浓度及其交互作用对Phe及3-MPhe生物降解过程产生重要影响(Phe:F=93.5,p<0.001;3-MPhe:150F=81.1,p<0.001),而对于9-MPhe,相应的F=0.3,p>0.05,说明这三种因素不是影响9-MPhe降解的关键因素。3结论(1)0.2mmol/L的LMWOAs对US6-1降解Phe的影响不同于其对MPhe的影响。上述三种LMWOAs均促进了US6-1对Phe的降解,但Oxalicacid抑制了3-MPhe及9-MPhe的155降解,Citricacid和Tartaricacid则对其降解起促进作用。(2)2.0mmol/L的LMWOAs对US6-1降解的影响受其种类影响,Oxalicacid同时促进了Phe、3-MPhe及9-MPhe的降解,而Tartaricacid抑制了上述PAHs的降解。(3)本文通过考察US6-1细胞表面疏水变化对上述降解过程进行初步探讨。要深入探究其影响机制,需进一步借助其他方法研究降解过程中LMWOAs的浓度变化,及蛋白组学等160研究相关酶的活性变化。[参考文献](References)[1]MalmquistLMV,SelckH,JørgensenKB,etal.Polycyclicaromaticacidsareprimarymetabolitesofalkyl-PAHs,acasestudywithNereisdiversicolor[J].EnvironmentalScience&Technology,2015,49(9):1655713-5721.[2]KuppusamyS,ThavamaniP,VenkateswarluK,etal.Remediationapproachesforpolycyclicaromatichydrocarbons(PAHs)contaminatedsoils:technologicalconstraints,emergingtrendsandfuturedirections[J].Chemosphere,2017,168:944-968.[3]魏星媛.水溶液中溶解态多组分多环芳烃(PAHs)的生物降解[D].厦门大学,2014.170[4]GaoY,RenL,LingW,etal.Desorptionofphenanthreneandpyreneinsoilsbyrootexudates[J].BioresourceTechnology,2010,101(4):1159-1165.[5]GaoY,YuanX,LinX,etal.Low-molecular-weightorganicacidsenhancethereleaseofboundPAHresiduesinsoils[J].SoilandTillageResearch,2015,145:103-110.[6]ZhuYH,ZhangS,HuangH,etal.Effectsofmaizerootexudatesandorganicacidsonthedesorptionof175phenanthrenefromsoils[J].JournalofEnvironmentalSciences,2009,21(7):920-926.[7]JonesDL.Organicacidsintherhizosphere-acriticalreview[J].Plantandsoil,1998,205(1):25-44.[8]XiaoM,WuF.Areviewofenvironmentalcharacteristicsandeffectsoflow-molecularweightorganicacidsinthesurfaceecosystem[J].JournalofEnvironmentalSciences,2014,26(5):935-954.[9]WangY,FangL,LinL,etal.Effectsoflowmolecular-weightorganicacidsanddehydrogenaseactivityin180rhizospheresedimentsofmangroveplantsonphytoremediationofpolycyclicaromatichydrocarbons[J].Chemosphere,2014,99:152-159.[10]吴芳,张振轩,何欣欣,等.利用发光细菌测试方法评价菲和芘生物降解过程的毒性变化[J].生态毒理学报,2014,9(3):445-452.[11]孙晓莹,施汉昌,全向春,等.细菌细胞表面疏水性及在活性污泥中粘附率影响因素研究[J].环境科学,1852008,29(10):2809-2814.[12]SohnJH,KwonKK,KangJH,etal.Novosphingobiumpentaromativoranssp.nov.,ahigh-molecular-masspolycyclicaromatichydrocarbon-degradingbacteriumisolatedfromestuarinesediment[J].InternationalJournalofSystematicandEvolutionaryMicrobiology,2004,54(5):1483-1487.[13]ZhangZX,ZhuYX,ZhangY.Simultaneousdeterminationof9-ethylphenanthrene,pyreneand1901-hydroxypyreneinanaqueoussolutionbysynchronousfluorimetryusingthedoublescansmethodandhydroxyl-propylbeta-cyclodextrinasasensitizer[J].Talanta,2015,144:836-843.[14]KallimanisA,FrillingosS,DrainasC,etal.Taxonomicidentification,phenanthreneuptakeactivity,andmembranelipidalterationsofthePAHdegradingArthrobactersp.strainSphe3[J].AppliedMicrobiologyandBiotechnology,2007,76(3):709-717.195[15]KaczorekE,SałekK,GuzikU,etal.CellsurfacepropertiesandfattyacidscompositionofStenotrophomonasmaltophiliaundertheinfluenceofhydrophobiccompoundsandsurfactants[J].NewBiotechnology,2013,30(2):-6-
中国科技论文在线http://www.paper.edu.cn173-182.[16]WeiXY,SangLZ,ChenJN,etal.TheeffectsofLMWOAsonbiodegradationofmulti-componentPAHsinaqueoussolutionusingdual-wavelengthfluorimetry[J].EnvironmentalPollution,2009,157(11):3150-3157.200[17]GórnaH,ŁawniczakŁ,Zgoła-GrześkowiakA,etal.DifferencesanddynamicchangesinthecellsurfacepropertiesofthreePseudomonasaeruginosastrainsisolatedfrompetroleum-pollutedsoilasaresponsetovariouscarbonsourcesandtheexternaladditionofrhamnolipids[J].BioresourceTechnology,2011,102(3):3028-3033.[18]ZhangY,MillerRM.EffectofaPseudomonasrhamnolipidbiosurfactantoncellhydrophobicityandbiodegradationofoctadecane[J].AppliedandEnvironmentalMicrobiology,1994,60(6):2101-2106.205-7-'
您可能关注的文档
- 锂离子电池热特性实验与仿真分析.pdf
- 锰胁迫对茶树锰含量和生理变化的影响.pdf
- 长链菊粉对小鼠急性胰腺炎及相关肠道损伤的保护作用研究.pdf
- 长鬣蜥(Physignathus cocincinus)线粒体基因组全序列分析.pdf
- 预混层流本生灯顶端局部Karlovitz数.pdf
- 香烟烟雾致BEAS-2B细胞恶性转化过程中基因组与PTPRM的DNA甲基化改变.pdf
- 高分子水凝胶在口服胰岛素中的应用.pdf
- AgTiO2纳米管阵列光电催化性能研究.pdf
- CFRP索在索桥结构中的应用和发展.pdf
- [AMIM][BF4]溶胶-凝胶固相微萃取涂层在水体中有机磷酸酯化合物测定中的应用.pdf
- 一个基于梯度提升决策树的商品推荐算法.pdf
- 一种初中数学知识本体的构建与评估.pdf
- 不同时程铅暴露对海马神经元AMPA受体表达的影响.pdf
- 不同面筋蛋白组分对面包品质的影响.pdf
- 两种硫氧化细菌CO2同化潜能解析及其影响因素.pdf
- 中国在亚太地区股票市场的影响力研究:来自溢出效应和市场一体化的证据.pdf
- 中韩贸易自由化的贸易效应评估.pdf
- 主导企业突破性技术与市场的共生演化--以格力电器为例.pdf
相关文档
- 施工规范CECS140-2002给水排水工程埋地管芯缠丝预应力混凝土管和预应力钢筒混凝土管管道结构设计规程
- 施工规范CECS141-2002给水排水工程埋地钢管管道结构设计规程
- 施工规范CECS142-2002给水排水工程埋地铸铁管管道结构设计规程
- 施工规范CECS143-2002给水排水工程埋地预制混凝土圆形管管道结构设计规程
- 施工规范CECS145-2002给水排水工程埋地矩形管管道结构设计规程
- 施工规范CECS190-2005给水排水工程埋地玻璃纤维增强塑料夹砂管管道结构设计规程
- cecs 140:2002 给水排水工程埋地管芯缠丝预应力混凝土管和预应力钢筒混凝土管管道结构设计规程(含条文说明)
- cecs 141:2002 给水排水工程埋地钢管管道结构设计规程 条文说明
- cecs 140:2002 给水排水工程埋地管芯缠丝预应力混凝土管和预应力钢筒混凝土管管道结构设计规程 条文说明
- cecs 142:2002 给水排水工程埋地铸铁管管道结构设计规程 条文说明