- 1.02 MB
- 2022-04-22 13:43:40 发布
- 1、本文档共5页,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报电话:19940600175。
'中国科技论文在线http://www.paper.edu.cn微囊藻毒素合成酶McyG的N端结构域的结构研究**崔宁,谭啸峰,江永亮,周丛照5(中国科学技术大学生命科学学院,合肥230026)摘要:【目的】微囊藻毒素具有肝毒性,长期饮用微囊藻毒素污染的水增加罹患肝癌等疾病的风险。McyG是微囊藻毒素合成起始反应的多功能酶,其N端包含腺苷化功能结构域(A)与肽基载体蛋白功能结构域(PCP)组成的双功能结构域。目前McyGA-PCP的催化机制尚不10明确,McyGA-PCP结构的解析将有助于功能的阐释。【方法】通过分子克隆的方法将McyGA-PCP构建至pET28a载体,通过大肠杆菌表达系统异源表达了McyGA-PCP,然后通过镍亲和层析和分子筛纯化得到了均一的蛋白,最后通过晶体筛选和优化得到了晶体。【结果】通过X-ray衍射方法解析了McyGA-PCP结构。【结论】通过结构分析得到底物的催化中间态L-Phe-AMP的结合位点,分析了A和PCP的相互作用界面,推断出A-PCP反应循环机制,为15阐明微囊藻毒素合成的分子机制奠定了基础。关键词:微囊藻毒素;McyG;晶体结构;催化机制中图分类号:Q518.3StructureoftheN-terminaldidomainoftheMicrocystis20aeruginosamicrocystinsynthetaseMcyGCUINing,TANXiao-Feng,JiangYong-Liang,ZHOUCong-Zhao(SchoolofLifeSciences,UniversityofScienceandTechnologyofChina,HeFei,230026)Abstract:Microcystinshavehepatotoxicity,whichmayresultinthedevelopmentoflivercancerandotherdiseases.McyGisamultifunctionalenzymefortheinitiationofmicrocystinsynthesis.The25N-terminusofMcyGconsistsoftheadenylationdomain(A)andthepeptidylcarrierproteinfunctionaldomain(PCP).Todate,thecatalyticmechanismofMcyGA-PCPremainsunclear.Here,wereportthecrystalstructureofMcyGA-PCPcomplexedwithcatalyticintermediateL-Phe-AMP.FurtherstructuralanalysesidentifiedtwodifferentinterfacesdisplayingvariedcommunicationbetweenthePCPdomainandtheAdomain.Weproposeacatalyticcycleforadenylationandpeptidetransferofthe30A-PCPdidomain.Keywords:Microcystins;McyG;crystalstructure;catalyticmechanism0引言35由于工业化进程加剧、环保意识不足,污水乱排导致大量的江河湖泊甚至部分海洋区域水体污染及富营养化,其中大量的磷、钾元素促使蓝细菌大量繁殖,形成水华。水华爆发导致其他好氧水生动植物死亡,同时蓝藻分泌的毒素导致该片水域不能饮用。铜绿微囊藻是目前武汉东湖、安徽巢湖等地爆发的水华中主要的蓝细菌,也是微囊藻毒素合成的来源。饮用[1]水中含有微囊藻毒素是引起中国东南地区肝癌高发的一个重要因素。微囊藻毒素是一种极40作者简介:崔宁(1990-),女,生物化学与分子生物学通信联系人:周丛照(1968-),男,博导,生物化学与分子生物学.E-mail:zcz@ustc.edu.cn-1-
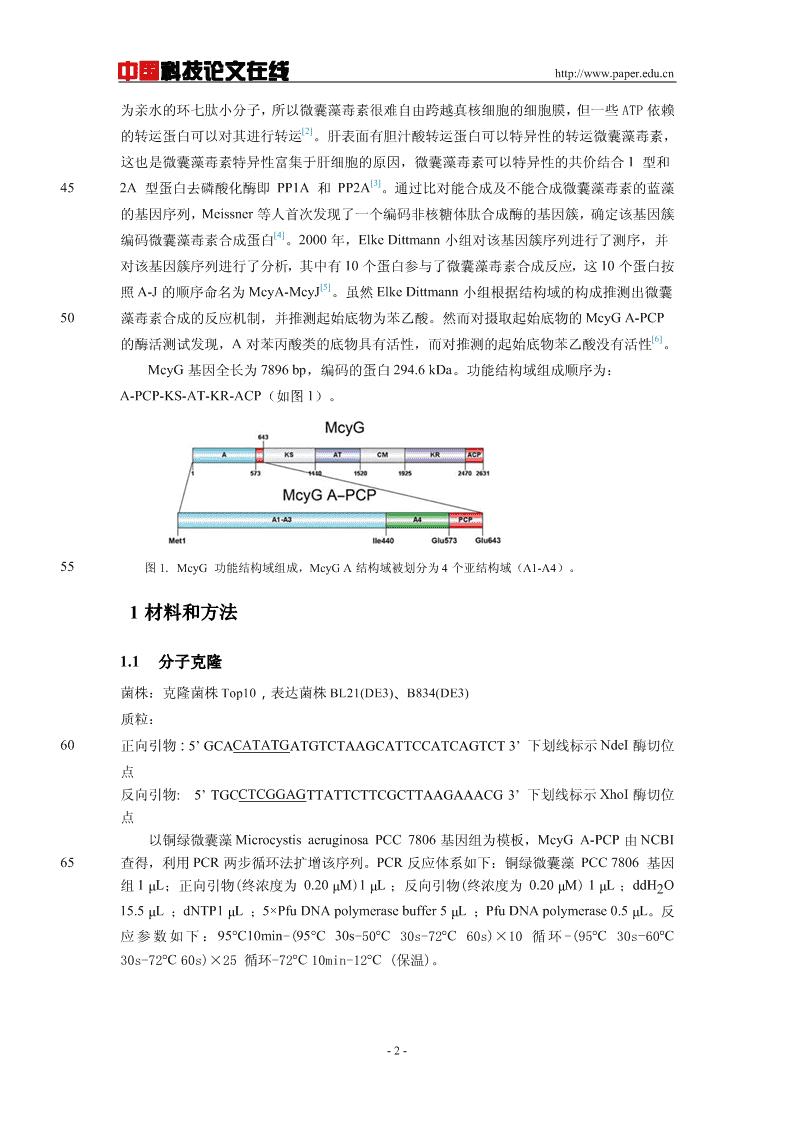
中国科技论文在线http://www.paper.edu.cn为亲水的环七肽小分子,所以微囊藻毒素很难自由跨越真核细胞的细胞膜,但一些ATP依赖[2]的转运蛋白可以对其进行转运。肝表面有胆汁酸转运蛋白可以特异性的转运微囊藻毒素,这也是微囊藻毒素特异性富集于肝细胞的原因,微囊藻毒素可以特异性的共价结合1型和[3]452A型蛋白去磷酸化酶即PP1A和PP2A。通过比对能合成及不能合成微囊藻毒素的蓝藻的基因序列,Meissner等人首次发现了一个编码非核糖体肽合成酶的基因簇,确定该基因簇[4]编码微囊藻毒素合成蛋白。2000年,ElkeDittmann小组对该基因簇序列进行了测序,并对该基因簇序列进行了分析,其中有10个蛋白参与了微囊藻毒素合成反应,这10个蛋白按[5]照A-J的顺序命名为McyA-McyJ。虽然ElkeDittmann小组根据结构域的构成推测出微囊50藻毒素合成的反应机制,并推测起始底物为苯乙酸。然而对摄取起始底物的McyGA-PCP[6]的酶活测试发现,A对苯丙酸类的底物具有活性,而对推测的起始底物苯乙酸没有活性。McyG基因全长为7896bp,编码的蛋白294.6kDa。功能结构域组成顺序为:A-PCP-KS-AT-KR-ACP(如图1)。55图1.McyG功能结构域组成,McyGA结构域被划分为4个亚结构域(A1-A4)。1材料和方法1.1分子克隆菌株:克隆菌株Top10,表达菌株BL21(DE3)、B834(DE3)质粒:60正向引物:5’GCACATATGATGTCTAAGCATTCCATCAGTCT3’下划线标示NdeI酶切位点反向引物:5’TGCCTCGGAGTTATTCTTCGCTTAAGAAACG3’下划线标示XhoI酶切位点以铜绿微囊藻MicrocystisaeruginosaPCC7806基因组为模板,McyGA-PCP由NCBI65查得,利用PCR两步循环法扩增该序列。PCR反应体系如下:铜绿微囊藻PCC7806基因组1μL;正向引物(终浓度为0.20μM)1μL;反向引物(终浓度为0.20μM)1μL;ddH2O15.5μL;dNTP1μL;5×PfuDNApolymerasebuffer5μL;PfuDNApolymerase0.5μL。反应参数如下:95°C10min-(95°C30s-50°C30s-72°C60s)×10循环-(95°C30s-60°C30s-72°C60s)×25循环-72°C10min-12°C(保温)。-2-
中国科技论文在线http://www.paper.edu.cn701.2重组质粒构建用PCR清洁回收试剂盒对PCR产物进行回收,并进行核酸电泳确定回收后片段的纯度及含量。利用限制性内切酶NdeI、XhoI分别对目的片段和质粒双酶切,体系如下:片段或载体43μL10×双酶切Hbuffer5μL;NdeI1μL;XhoI1μL。反应条件:37℃水浴过夜,双酶切后,分别对目的片段及载体进行回收,回收后再次利用琼脂糖凝胶电泳对片段、载体进75行纯度、浓度鉴定。根据目的片段及载体的摩尔浓度比5:1的原则计算连接体系。反应条件:16℃2小时。将连接产物转化至Top10感受态,涂布含有卡那霉素(30mg/mL)的固体培养基,37℃恒温培养过夜后,挑取单克隆至3mL含有相应抗生素的液体培养基,37℃振荡培养4小时后,进行菌液PCR鉴定。反应条件与目的片段扩增时相同。之后进行核酸电泳鉴定,对于阳性克隆提取500μL送往上海生工公司进行测序。测序正确后将剩余菌液进行80质粒抽提用来后续实验。1.3蛋白质大量表达与纯化将质粒转入BL21(DE3)感受态细胞后转至3mL含有卡那霉素的液体培养基培养过夜后转接至400mL液体培养基,37℃振荡培养至OD600=0.6-0.8。加入终浓度为0.2mMIPTG诱导表达4小时后,收集细胞后用20mL缓冲液A(100mMNaCl,20mMTris-ClpH8.0)85重悬,超声破碎细胞后高速离心,收集包含有目的蛋白的上清,加入镍柱进行亲和层析。同时向缓冲液A中加入终浓度为20mM咪唑(缓冲液B)配置20mL用以洗脱杂蛋白,最后用终浓度为300mM咪唑的洗脱液6mL洗脱目的蛋白。随后对含有目的蛋白的洗脱液进行分子筛凝胶层析进一步除杂,最终获得纯度大于95%的目的蛋白进行晶体初筛。为了确定相位,需制备硒代甲硫氨酸修饰的蛋白,过程如下。将质粒转入B834(DE3)90感受态细胞后转至3mL含有卡那霉素的液体培养基培养过夜后转接至400mL液体培养基,37℃振荡培养至OD600=0.2。离心去除上清,用M9培养基清洗两次后重悬菌体,转移至含有30μg/mL卡那霉素、Se-Met及其他必要氨基酸的培养基中。加入终浓度为0.2mMIPTG诱导表达4小时后,收集细胞后用20mL缓冲液A(100mMNaCl,20mMTris-ClpH8.0)重悬,破碎、纯化方法与普通蛋白一致。951.4晶体初筛与优化文献报道McyGA-PCP在表达过程中会结合底物——由大肠杆菌提供ATP形成腺苷化[6]的苯丙酸。在初筛前向蛋白质溶液中加入终浓度为5mML-Phe、5mMATP和1mMMgCl2,并在25℃水浴下反应30分钟。利用Mosquito晶体初筛机器人,使用悬滴气象扩散法,筛选了Kit、Index、Complex、ComplexpH、GridI、GridII、Salt等7个试剂盒。晶体100生长条件为16℃冷库,2个星期后逐渐出现晶体,对出晶条件进行统计,并重复优化,利用学院RigakuMM007X-ray衍射仪进行衍射,确定其中的盐晶、蛋白晶,以及衍射质量高的晶体。最终确定出晶条件为1.8M(NH4)2SO4,0.1MNaKHPO4pH6.5。1.5X-射线衍射数据的收集与处理以及结构的解析和精修晶体的防冻剂是使用含有终浓度30%甘油+该晶体在板上出所下槽液。用适当大小的105loop捞出晶体,在防冻液涮洗下放入氮中冷起来。利用学院的RigakuMM007X-ray衍射仪(日本Rigaku公司)进行衍射选择分辨率高的晶体冻入液氮中,以备带到上海同步辐射光源(SSRF)进行衍射收集数据。在上海同步辐射光源的BL17U线站进行晶体数据收集(收集-3-
中国科技论文在线http://www.paper.edu.cn条件:温度100K,探测器是QuantumQ315rCCD由ADSC公司生产)。总共收集了两套数据,分别是Native-McyGA-PCP和Se-McyGA-PCP的数据各一套。Native-McyGA-PCP110使用单波长衍射,波长为1.04435Å,每1s旋转1°,共旋转180°,收集了180张。Se-McyGA-PCP利用单波长反常散射法进行收集,波长为0.97923Å,每1s旋转1°,共旋转360°,收集了360张。数据用HKL2000进行的指标化、积分和归一最终处理的数据分辨率为2.8Å。利用PHENIX中AUTOLSOL确定重原子的位置,并利用OASIS确定相位并进行了初步的模型搭建。之后精修主要使用WINCOOT以及CCP4i中的REFMAC5。之后将精修的115Se-McyGA-PCP的结构和处理的Native-McyGA-PCP数据利用CP4i中MOLREP进行分子置换得到NativeMcyGA-PCP的结构。并利用WINCOOT以及CCP4i中的REFMAC5进行精修。由于2.8Å的数据有部分的细节看不清楚。因此江永亮师兄利用iMOSFLM重新对数据进行了处理,分辨率达到2.45Å。利用之前精修的Se-McyGA-PCP结构和新处理的数据在MOLREP程序进行分子置换,并重新了精修。1202实验结果2.1McyG的整体结构利用Se-McyGA-PCP数据获得结构后,通过分子置换找到Native-McyGA-PCP的解并125进行了精修。相关数据结构在表格1中列出。分辨率为2.45Å,晶体结构的空间群为P3221,一个不对称单位中含有两个分子,其中一个分子包含有完整的A-PCP双功能结构域的结构(将其命名为A分子),包含的氨基酸残基为Ser5-Ser641,另一个分子中只包含有A的结构(将其命名为B分子),包含氨基酸残基为Ser7-Lys561,之后的电子云看不清。McyGA结构域包含两个结构域分别命名为大型结构域、小型结构域。大型结构域从130Ser5到Gly434,又可以分为3个亚结构域命名为亚结构域A1、亚结构域A2和亚结构域A3,小型结构域则包含Ile440-Lys566,又被命名为亚结构域A4,如图2所示。大型、小型结构域通过一段柔性的环连接(Arg435-Glu439),并且小型结构域可通过这一柔性区域相对大型结构域发生运动,以适应不同阶段的反应。亚结构域A1由9个β片(β1,β2,β9-β15)和11个α螺旋组成,其中α螺旋环绕在β片的周围,形成一个扭曲的β桶;亚结构域A2135包含6个β片(β3-β8),在6个β片的两侧分布着5个α螺旋(α3-α7);亚结构域A3包含了5个扭曲的β片(β16-β20)外加一个α螺旋(α17)。这三个亚结构域形成的β桶状结构和两个β片堆积在一起形成五层的αβαβα的折叠结构。亚结构域A4起始端含有2个反向平行的短β折叠(β21-β22),连着3个核心的β片四周环绕着5股α螺旋(α18-α22)。功能结构域A的口袋中结合腺苷化的L型苯丙氨酸。功能结构域A的整体结构与腺苷化构象140下功能结构域A的结构相同,因此McyGA处于第一步反应氨基酸腺苷化反应完成而第二步硫醇化反应未开始的中间态。分子A中的PCP包含4股α螺旋命名为αI-αIV,活性残基Ser604位于在αII的N端。PCP通过一段柔性的环(Glu567-Ser572)与功能结构域A相连。这段柔性的环和PCP的4股α螺旋在电子云上清晰可见,但Ser604侧链羟基附近并没有看到符合4-磷酸泛酰巯基乙145胺部分的电子云,这与文献报道的大肠杆菌中PPTaseEntD不会将4-磷酸泛酰巯基乙胺部分-4-
中国科技论文在线http://www.paper.edu.cn连接到McyGPCP的活性残基丝氨酸上进行翻译后修饰的实验结果相符。因此PCP处于apoform,然而此PCP的整体结构构象与已报道的PCP结构中的中间态构象相同。150图2McyGA-PCP整体结构。a,b展示的是一个非对称单位中的两个分子。c图为两个分子的比较。d图为分子A的拓扑结构。2.2L-Phe-AMP的结合位点每个McyGA结合一分子L-Phe-AMP,L-Phe-AMP位于功能结构域A的两个结构域形成155的相互作用界面之间,参与小分子L-Phe-AMP的结合残基来自大型结构域,这些残基形成一个底物口袋,而小型结构域就像一个盖子盖在底物口袋的上方。大型结构域的两段柔性区域304308333337AGEQV和AFGMT如同三明治的两片面包将L-Phe-AMP夹在中间。其中的AMP与结合口袋的残基形成氢键而被固定:腺嘌呤碱基的N6位氨基与形成底物口袋中的Ala333的α羰基形成氢键,N7位的氨基与Gly305的α羰基形成氢键;核糖上的2’和3’的羟基与Asp421和160Arg435分别形成氢键,核糖上4’和5’的氧原子与来自小型结构域的Lys533的侧链形成氢键;AMP部分的A磷酸上的氧与Thr337的侧链形成氢键;AMP与L-Phe相连接的氧与His226形成氢键;L-Phe的α氨基与Gly335的α羰基形成氢键,从而固定α氨基。L-Phe的苯环通过疏水相互作用被固定,参与疏水相互作用的残基包括Trp272的侧链以及Ala333、Gly335和Ser341的-5-
中国科技论文在线http://www.paper.edu.cn主链,如图3。165图3McyGA底物结合口袋(a)及与PheA的底物结合口袋对比(b)1702.3McyGA-PCP中A与PCP的相互作用界面在一个不对称单位中的两分子,只有a具有完整的A-PCP结构,而分子b只有A的结构,这说明PCP在功能结构域A处腺苷化构象的时候,具有很强的运动性,PCP的固定单靠A与PCP的连接区域是不能实现。另外,溶液中apo-PCP仍然具有三级结构,如Astate或者A/Hstate下的PCP构象。因此想观察分子b的PCP的运动范围。通过对称操作,发175现PCP与功能结构域A形成了两个相互作用界面(图4a)。其中一个相互作用界面是由分子a自身的功能结构域A与自身的PCP的相互作用形成的界面,这个相互作用包括了A与PCP连接区域与PCP相互作用产生的界面,以及PCP的L1柔性环(αI与αII之间的柔性环)、αIII螺旋与A的α19和α22之间的相互作用界面,除去连接区域与PCP产生的相互作用界2面后,相互作用面积约641Å,我们把这个相互作用界面命名为作用界面1。第二个相互作180用界面是由分子a的PCP与相邻的不对称单位中分子b"的亚结构域A4相互作用形成,相互-6-
中国科技论文在线http://www.paper.edu.cn2作用界面面积约为952Å,这个相互作用界面命名为作用界面2。在作用界面1中(图4b),从整体观察,PCP参与到下游功能结构域识别的L柔性环和αIII螺旋均被包裹在相互作用界面里。特别值得注意L1柔性环上的Glu599的侧链分别与来自α19螺旋上的Arg501和Arg504位以及α22螺旋上Arg563的侧链形成氢键被固定,185另外Phe598的侧链苯环朝向α19螺旋。同时,αIII螺旋上的Phe628的侧链苯环与α19螺旋上的Thr508的侧链上甲基和Gly512的主链碳原子形成疏水相互作用从而被固定。在短肽杆[7]菌素合成酶TycCPCP(S45A)与PPTaseSfp形成的复合物中,PCPP的L1柔性区域上Gln40参与Sfp的残基Y36的特异性识别并形成氢键,在PCP(S45A)与Sfp(Y36A)在5℃下的解离常数为54.3μM,而在25℃条件下,解离常数远大于100μM。而野生型的Sfp190与PCP(S45A)的解离常数在5℃和25℃分别为0.74μM和0.92μM。而TycCPCP上的Gln40对应于McyGPCP的Glu599;肠菌素合成酶EntF的双功能结构域的核磁结构PCP上[8]的Phe42对应于McyGPCP上的Phe598,而Phe42参与PCP对下游功能结构域TE的识别,而Phe42的点突变将导致PCP不能与TE形成相互作用;另外,肠菌素合成酶EntBPCP[9]的αIII螺旋上的Ala268是识别下游功能结构域Ent功能结构域C的必要残基,而EntBPCP195上的Ala268对应于McyGPCP的αIII螺旋上的Phe628。在苦霉素合成酶pentaketide-ACP4-PikAIII(C209A/ΔACP5)的电镜结构中(功能域组成顺序为:ACP4-KS5(C209A)-AT5-KR5且ACP4上结合中间产物pentaketide),ACP4将中间产物呈递给下游功能结构域KS5,而ACP4参与相互作用界面形成的部分包括了L1柔性区域。这些说明分子a的PCP上参与和下游功能结构域或者PPTase特异识别的残基以及区域被A与200PCP之间的相互作用界面所包裹。另外PCP的活性残基Ser604也处于被A包围的环境,从[10]而阻止了PCP与下游功能结构域或PPTase的识别、呈递中间产物或者被修饰活化的可能。分子a中呈现了这样的一种构象:PCP的活性残基Ser604及参与下游功能结能结构域识别的残基被包裹在A与PCP形成的相互作用界面里,从而阻止PCP与下游功能结构域的接触。在最近由冷冻电镜得到的苦霉素合成蛋白PikAIII的结构中,第一次揭示了多聚乙酰205合成酶顺序反应的机理。PikAIII包含的功能结构域按照一定顺序组成苦霉素合成酶中的第五个标准模块即KS5-AT5-KR5-ACP5。反应顺序为(1)KS5将上游的ACP4呈递的pentaketide连接到活性残基半胱氨酸的侧链上;(2)AT5摄取甲基化的丙二酰辅酶A,并将甲基化的丙二酰基连接在holo-ACP5上形成MM-ACP5;(3)MM-ACP5将二碳单位呈递给KS5,KS5催化pentaketide与二碳单位反应,从而延伸烃链得到β-ketohexaketide并将其连接在ACP5210上,形成β-ketohexaketide-ACP5;(4)β-ketohexaketide-ACP5将β-ketohexaketide呈递给KR5,KR5利用NADPH完成还原反应生成β-hydroxyhexaketide-ACP5。(6)β-hydroxyhexaketide-ACP5将β-hydroxyhexaketide呈递给下游的功能结构域。第一步反应完成,形成的pentaketide-KS5-PikAIII中AT5向KS5移动,封闭KS5接受上游ACP4呈递中间产物的外侧通道避免上游ACP4的干扰,同时holo-ACP5移动向AT5接受二碳单位;在进行2153至6步反应的时候,得到中间态β-ketohexaketide-PikAIII、β-hydroxyhexaketide-PikAIIIP中的AT5一直封闭KS5的外侧通道。在这些结构中可以总结出:当KS5连接有上游呈递的中间产物时,会促使整个蛋白按顺序启动2至6的反应,为了避免4‒6反应未结束而受到KS5结合上游中间产物生的干扰,AT5封闭外侧通道;ACP的运动受到其连接中间产物的影响,即当连接有二碳单位时会促使ACP向KS移动,当连接有β-ketohexaketide的时候会220向KR移动。因此,可以做出一个推测,McyGA-PCP采取分子a中的构象是为了反应顺序进行。McyG的组成为A-PCP-KS-AT-CM-KR-ACP,与苦霉素合成酶均属于I型多聚乙酰-7-
中国科技论文在线http://www.paper.edu.cn酶,因此McyG为了保持反应的顺利进行,当KS完成催化反应后,KS也会被AT封闭PCP呈递中间产物的通道。同样McyGA为了保证PCP不受连接了中间产物的影响而试图接触下游功能结构域,在腺苷化完成后,通过相互作用封闭PCP与下游功能结构域相互识别的225界面,维持反应顺利进行。在作用界面2中(图4c),该界面通过一系列的氢键和盐桥固定了作用界面。参与相互作用的残基来自分子b"的α19"螺旋、紧跟其后的柔性区域L19"和α22"螺旋;以及分子a的PCP上的αI、αII螺旋和柔性环LI。形成的氢键包括了:Glu573(αI)的主链上羰基与Gln509"(α19")的侧链氨基;Arg576(αI)的侧链氨基与Thr508"(α19")、Gln509"(α19")230的主链羰基;Ser583(αI)的侧链羟基与Arg504"(α19")的侧链氨基以及Pro515"(L19")的主链羰基;Gln587(LI)的侧链羰基与Tyr517"(L19")上的侧链羟基;Thr589(LI)的侧链羟基与Ala514"(L19")、Ala516"(L19")的主链羰基。另外;Arg609(αII)的两个侧链氨基与Asp556"(α22")的侧链羰基分别形成两对盐桥;Glu584(αI)和Glu613(αII)的侧链与Arg501"(α19")的侧链形成四对盐桥。235那么相互作用界面是否有生理意义呢?在这些相互作用残基中包含了功能结构域A上的核心区域A9core的部分残基(图4d)。而A9core的残基影响到功能结构域A的第二步反应硫醇化。针对短肽杆菌素合成酶TycA的功能结构域A的A9core的残基点突变,[11]发现Pro485和Try487的点突变将降低功能结构域A催化第二步反应的效率。而TycAA中的Pro485和Tyr487分别对应McyGA中的Pro515和Tyr517位的残基,且这些残基在240腺苷化功能结构域A中相对保守。另外,在肠菌素合成酶中相对保守。另外,在肠菌素合成酶EntE(功能结构域A)与EntB(PCP)形成的分子间A-PCP相互作用,其中功能结构域A的构象处于硫醇化构象,PCP将手臂伸入A的底物口袋中。在这个结构A与PCP形成的相互作用中,有三个残基影响到了A对PCP的特异识别并通过点突变后的PCP与A的结合实验以及酶活证明,它们分别是Arg494,Glu500,Arg506;其中从序列比较上,EntE245的Arg494,Arg506分别对应McyGA中的Arg504"和Ala516"。我们推测这个作用界面展示了A-PCP从腺苷化构象向硫醇构象转变过程中的一个中间构象或者这是A与PCP进行识别的一个过程中间态。-8-
中国科技论文在线http://www.paper.edu.cn图4McyGA与PCP的相互作用界面及序列对比250(a)相互作用界面在整体结构中显示;(b)interface1的相互作用残基;(c)interface2的相互作用残基(粉红色的棍棒显示残基来自PCP,深绿色来自分子a的A4亚结构域,银白色来自分子b’的A4亚结构域);(d)分子b’参与相互作用的部分残基与其它腺苷化结构域的序列对比。2.4A-PCP反应循环机制在A功能结构域的第一步反应完成后,ACP处于adenylatedconformation,A-PCP进入255第二步反应,需要下游的功能结构域提供信号。在McyG中,ACP完成了将中间产物传递给McyD中的KS功能结构域重新成为holo-ACP,或者ACP被连接了二碳单位丙二酰基,使得AT功能结构域远离McyGKS的外侧底物通道。得到信号后,A-PCP中的A4亚结构域旋转140°使loopA远离底物口袋,打开PCP的手臂进入底物口袋的通道,同时A4亚结-9-
中国科技论文在线http://www.paper.edu.cn构域的α22螺旋发生解旋和偏转,将PCP带到靠近底物口袋通道的位置,同时PCP自身也260发生偏转,将手臂送入到A的底物口袋,形成thiolatedconformation。当第二步反应完成,A4亚结构域发生运动,远离A1-A3亚结构域,打开底物进入通道。同时A4的α22螺旋发生解旋和偏转以方便PCP与上下游的功能结构域相互作用传递底物。这个过程中PCP发生相对A4的运动,暴露出与上游的功能结构域相互作用界面,形成openconformation。当PCP完成中间产物的传递,A功能结构域接受了底物,A4亚结构域向A1-A3亚结构域靠近,辅265助A功能结构域完成底物的腺苷化反应,同时PCP向A4靠近,从而进行下一个循环。图5A-PCP反应循环机制3结论270McyGA-PCP的结构展示了A将PCP与下游功能结构域相互识别的残基以及活性残基Ser604包裹在相互作用的界面中从而阻止了PCP与下游功能结构域识别、传递中间产物-10-
中国科技论文在线http://www.paper.edu.cn的可能。这可能是为了维持多聚乙酰合成酶/非核糖体肽合成酶这类大型多功能复合酶中各个功能结构域的顺序反应。根据A-PCP的结构构象以及比对PDB中的仅有的含有A-PCP双功能结构域的2个结[12][13]275构,我们发现McyGA-PCP展示的是一种全新的构象,这种构象捕捉到了功能结构域A完成了第一步反应且第二步反应没有开始的时候,A阻止PCP与下游功能结构域相互作用的构象,结合另外两个结构的构象,推测出A-PCP进行反应循环的机理。这一部分工作对于最终微囊藻毒素合酶结构解析、功能研究奠定了基础。致谢280感谢上海同步辐射光源的工作人员在数据收集给予的帮助。感谢国家自然基金委(基金号:31370757,31070652)以及教育部高等学校博士学科点专项科研基金课题(20133402110023)对于课题给予的资金支持。[参考文献](References)[1]YuSZ(1995)PrimaryPreventionofHepatocellular-Carcinoma[J].JGastroenHepatol10:674-682285[2]Eriksson,J.E.,etal.(1990).HepatocellularUptakeofH-3Dihydromicrocystin-Lr,aCyclicPeptideToxin[J].BiochimicaEtBiophysicaActa1025(1):60-66.[3]ToivolaDM,ErikssonJE,BrautiganDL(1994)IdentificationofProteinPhosphatase2aasthePrimaryTargetforMicrocystin-1rinRat-LiverHomogenates[J].FebsLett344:175-180[4]Meissner,K.,etal.(1996).Toxicandnon-toxicstrainsofthecyanobacteriumMicrocystisaeruginosacontain290sequenceshomologoustopeptidesynthetasegenes[J].FemsMicrobiologyLetters135(2-3):295-303.[5]TillettD,DittmannE,ErhardM,vonDohrenH,BornerT,NeilanBA(2000)StructuralorganizationofmicrocystinbiosynthesisinMicrocystisaeruginosaPCC7806:anintegratedpeptide-polyketidesynthetasesystem[J].Chemistry&Biology7:753-764[6]Hicks,L.M.,etal.(2006).Structuralcharacterizationofinvitroandinvivointermediatesontheloading295moduleofmicrocystinsynthetase[J].ACSChemBiol1(2):93-102[7]TufarP,RahighiS,KraasFI,KirchnerDK,LohrF,HenrichE,KopkeJ,DikicI,GuntertP,MarahielMA,DotschV(2014a)CrystalstructureofaPCP/Sfpcomplexrevealsthestructuralbasisforcarrierproteinposttranslationalmodification[J].Chemistry&Biologyiology21:552-562[8]FruehDP,ArthanariH,KoglinA,VosburgDA,BennettAE,WalshCT,Wagner(2008)Dynamic300thiolation-thioesterasestructureofanon-ribosomalpeptidesynthetase[J].Nature454:903-U962[9]LaiJR,FischbachMA,LiuDR,WalshCT(2006)Aproteininteractionsurfaceinnonribosomalpeptidesynthesismappedbycombinatorialmutagenesisandselection[J].ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesAmerica103:5314-5319[10][10]DuttaS,WhicherJR,HansenDA,HaleWA,ChemlerJA,CongdonGR,NarayanAR,HakanssonK,305ShermanDH,SmithJL,SkiniotisG(2014)Structureofamodularpolyketidesynthase[J].Nature510:512-517[11]Bucevic-PopovicV,SprungM,SoldoB,Pavela-VrancicM(2012)TheA9CoreSequencefromNRPSAdenylationDomainIsRelevantforThioesterFormation[J].Chembiochem13:1913-1920[12]TanovicA,SamelSA,EssenLO,MarahielMA(2008)Crystalstructureoftheterminationmoduleofanonribosomalpeptidesynthetase[J].Science321:659-663310[13]MitchellCA,ShiC,AldrichCC,GulickAM(2012)StructureofPA1221,anonribosomalpeptidesynthetasecontainingadenylationandpeptidylcarrierproteindomains[13].Biochemistry51:3252-3263-11-'
您可能关注的文档
- 基层扶贫资源分配的政府行为分析——以国家贫困县X县为例.pdf
- 多主元高熵合金MoNbTaVW中合金元素的占位行为.pdf
- 多取代四氢-β-咔啉类衍生物的合成研究.pdf
- 大鼠灌胃蒙药复方阿拉坦-5后诃子酚性成分的药代动力学研究.pdf
- 套利活动对香港离岸人民币存款市场的影响研究.pdf
- 安徽巢北地区栖霞组臭灰岩段黄铁矿研究--形态及分布特征.pdf
- 家蚕BmPDCD2基因功能研究.pdf
- 岩溶地表水生系统不同季节的水化学昼夜变化特征及碳汇效应的研究--以重庆丰都雪玉洞流域地下水补给的水池为例.pdf
- 广东省碳排放与经济增长脱钩关系实证分析.pdf
- 快充和超长稳定的高度互联Cu-Si合金纳米管锂离子电池阳极材料.pdf
- 提高环境质量的财政基础.pdf
- 星型网络下量子态的制备.pdf
- 棉花XTH基因家族全基因组鉴定及进化分析.pdf
- 欠驱动弹跳机器人着地相运动规划.pdf
- 武汉市腹泻婴幼儿隐孢子虫感染的分子流行病学调查.pdf
- 氧化石墨烯诱导再生丝素蛋白成胶.pdf
- 水通道蛋白的研究进展.pdf
- 活化方式对多孔活性生物炭材料的结构及电容性能的影响.pdf
相关文档
- 施工规范CECS140-2002给水排水工程埋地管芯缠丝预应力混凝土管和预应力钢筒混凝土管管道结构设计规程
- 施工规范CECS141-2002给水排水工程埋地钢管管道结构设计规程
- 施工规范CECS142-2002给水排水工程埋地铸铁管管道结构设计规程
- 施工规范CECS143-2002给水排水工程埋地预制混凝土圆形管管道结构设计规程
- 施工规范CECS145-2002给水排水工程埋地矩形管管道结构设计规程
- 施工规范CECS190-2005给水排水工程埋地玻璃纤维增强塑料夹砂管管道结构设计规程
- cecs 140:2002 给水排水工程埋地管芯缠丝预应力混凝土管和预应力钢筒混凝土管管道结构设计规程(含条文说明)
- cecs 141:2002 给水排水工程埋地钢管管道结构设计规程 条文说明
- cecs 140:2002 给水排水工程埋地管芯缠丝预应力混凝土管和预应力钢筒混凝土管管道结构设计规程 条文说明
- cecs 142:2002 给水排水工程埋地铸铁管管道结构设计规程 条文说明